Реализация системно-деятельностного подхода совместно с компьютерными технологиями в преподавании химии. презентация
Содержание
- 2. Системно-деятельностный подход Позиция учителя: к классу с вопросом. Позиция ученика: за познанием мира,(в специально организованных для
- 3. 1 этап. Организационный, целеполагание. Цель деятельности учителя: Создать условия для выхода учащихся на постановку учебной цели.
- 4. Постановка проблемы с помощью эксперимента: Опыт №1 Железо+ нитрат меди= Действие: Наблюдение Опыт №2 Цинк+ нитрат
- 5. Вставьте в текст пропущенные слова: 1 Элемент находится в 3 периоде, 7 группе, главной подгруппе. 2
- 6. Тема: КИСЛОТЫ.
- 7. Девиз урока: «Всё познаётся в сравнении» Тема урока: Кислоты
- 8. Цель: научиться отличать кислоты по формулам и по цвету индикатора.
- 9. План изучения темы: Классификация кислот Отличие кислот по цвету индикатора.
- 10. 2 этап. Изучение нового учебного материала. Цель деятельности учителя: Создать условия учащимися для определения классификации и
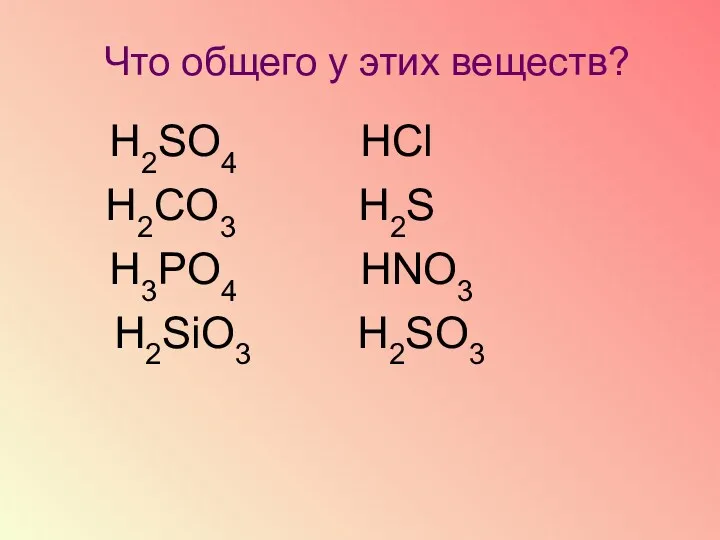
- 11. Что общего у этих веществ? Н2SO4 НСl Н2CO3 Н2S Н3РO4 НNO3 Н2SiO3 Н2SO3
- 12. Что такое кислоты? Сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка
- 13. Рассмотрите формулы кислот и найдите сходство между ними. Дайте определение кислот.
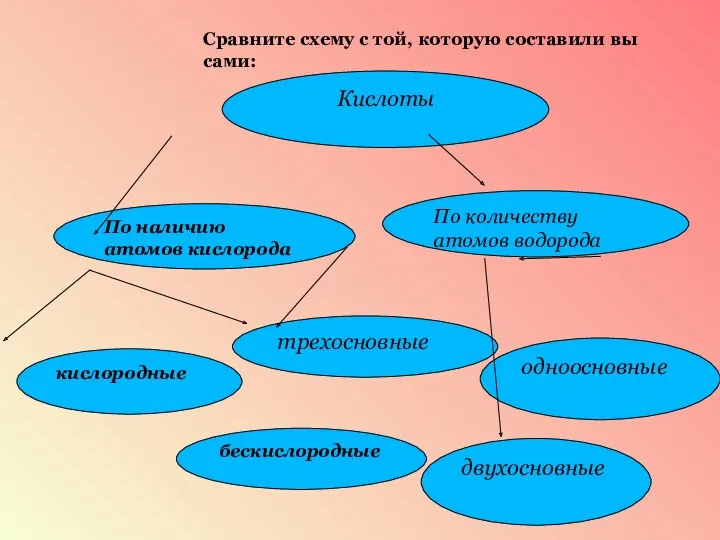
- 14. Сравните схему с той, которую составили вы сами: Кислоты По наличию атомов кислорода По количеству атомов
- 15. Как вы думаете, можно ли отличить кислоты от других веществ? Подумайте, в какой цвет будут изменять
- 16. Осторожно: Не забудь: Если на руку тебе кислота попала, Руку быстро промой водой из-под крана И,
- 17. Проведем небольшое исследование. Какова его цель? - Проверить, как изменяют окраску индикаторы в растворах кислот. Помни!
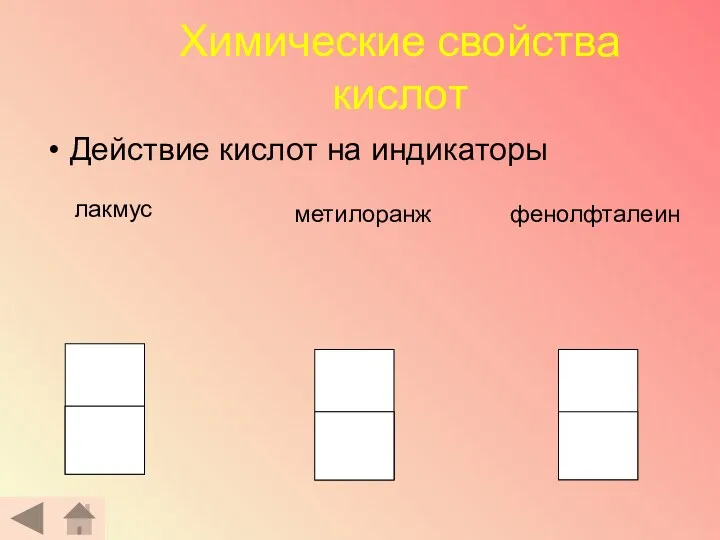
- 18. Химические свойства кислот Действие кислот на индикаторы лакмус метилоранж фенолфталеин
- 19. Заполните таблицу: Сделайте вывод: Независимо от вида кислоты, индикаторы изменяют свой цвет одинаково, а это означает,
- 20. Синквейн Например: 1 – водород; 2 – бесцветный, легкий. 3 – реагирует, восстанавливает, сгорает; 4 –
- 21. Решать задачи по алгоритму. Например, алгоритм нахождения массовой доли растворенного вещества: Последовательность действий: 1. Прочитайте текст
- 22. 3 этап. Закрепление знаний и умений. Цель деятельности учителя: Создать условия для закрепления изученной информации об
- 23. Задание №1 Используя таблицу растворимости кислот, оснований и солей в воде, составьте формулы разных кислот из
- 24. Рефлексия. Продолжить предложение: сегодня я узнал… было интересно… было трудно… я выполнял задания… я понял, что…
- 25. Д/З ! 1. П. 20, упр. 3, стр. 107 2. Задание по выбору: - Подготовить сообщение
- 26. Системно-деятельностный подход в преподавании химии. Формирования следующих видов деятельности: познавательной деятельности; информационно-коммуникативной деятельности; рефлексивной деятельности;
- 28. Скачать презентацию






















 Работа с неговорящими детьми, развитие речи у неговорящих детей, алалия
Работа с неговорящими детьми, развитие речи у неговорящих детей, алалия Виды информации
Виды информации Статья на тему: Использование личного информационного пространства для повышения эффективности воспитательной работы
Статья на тему: Использование личного информационного пространства для повышения эффективности воспитательной работы классный час День народного единства.
классный час День народного единства. Газовая турбина. Реактивные двигатели
Газовая турбина. Реактивные двигатели Виробництво лікерів
Виробництво лікерів Русский язык, как родной. Об изменении в ФЗ Об образовании в Российской Федерации
Русский язык, как родной. Об изменении в ФЗ Об образовании в Российской Федерации Презентация к уроку Электролитическая диссоциация химия 9 кл
Презентация к уроку Электролитическая диссоциация химия 9 кл Туберкулез
Туберкулез Основы Морского дела. Конструкция судна/корабля
Основы Морского дела. Конструкция судна/корабля Шаблон игры Учись различать звонкие и глухие согласные звуки
Шаблон игры Учись различать звонкие и глухие согласные звуки Жизнь по законам климата
Жизнь по законам климата Композиция с цветами и птицами
Композиция с цветами и птицами Представительство. Доверенность
Представительство. Доверенность Райх. Вегетотерапия и телесный анализ
Райх. Вегетотерапия и телесный анализ Областной конкурс творческих и исследовательских работ С малой родины начинается Россия
Областной конкурс творческих и исследовательских работ С малой родины начинается Россия Саркоидоз сердца. Клинический случай
Саркоидоз сердца. Клинический случай БАЗ-дың заманауи, ғылыми классификациясы. №3 лекция
БАЗ-дың заманауи, ғылыми классификациясы. №3 лекция Понятие графа. Простейшие свойства
Понятие графа. Простейшие свойства формулы корней квадратного уравнения
формулы корней квадратного уравнения Сложение и вычитание алгебраических дробей с разными знаменателями
Сложение и вычитание алгебраических дробей с разными знаменателями Сказка про степени сравнения прилагательных
Сказка про степени сравнения прилагательных Чесотка - заразное паразитарное заболевание кожи
Чесотка - заразное паразитарное заболевание кожи Основные типы установок высокой эффективности
Основные типы установок высокой эффективности Методы и устройства согласования трактов СВЧ. Лекция 2
Методы и устройства согласования трактов СВЧ. Лекция 2 Типы и основные характеристики станций
Типы и основные характеристики станций Презентация Среда обитания
Презентация Среда обитания Обособленные уточняющие члены предложения. Знаки препинания при них
Обособленные уточняющие члены предложения. Знаки препинания при них