Содержание
- 2. В реальных химических реакциях масса продукта всегда оказывается меньше расчетной. ПОЧЕМУ?
- 3. Многие химические реакции обратимы и не доходят до конца. При взаимодействии органических веществ часто образуются побочные
- 4. масса теоретическая всегда больше практической; объём теоретический всегда больше объёма практического. Теоретический выход составляет 100%, практический
- 5. Доля выхода продукта реакции (η - «этта») ηвых = Vпрактический Vтеоретический mпрактическая mтеоретическая - это отношение
- 6. Три типа задач с понятием «Выход продукта» 2. Даны массы исходного вещества и выход продукта реакции.
- 7. При сжигании железа в сосуде, содержащем 21,3г хлора, было получено 24,3г хлорида железа(III). Рассчитайте выход продукта
- 8. 21,3г хлора получено 24,3г хлорида железа(III) При сжигании железа в сосуде, содержащем 21,3г хлора, было получено
- 9. 1. Запишите уравнение химической реакции и расставьте коэффициенты. 2. Под формулами веществ напишите количество вещества согласно
- 10. Анализ условия задачи. Над 16 г серы пропустили водород при нагревании. Определите объем (н.у.)полученного сероводорода, если
- 11. Расчет массы продукта реакции, если известен выход продукта.
- 12. Анализ условия задачи. Какой объём оксида углерода (II) был взят для восстановления оксида железа (III), если
- 13. По известному практическому объёму или массе, найдите теоретический объём или массу (используя долю выхода продукта). m
- 14. Для окисления оксида серы (IV) взяли 112л(н.у.) кислорода и получили 760г оксида серы (VI). Чему равен
- 16. Скачать презентацию













 Советы родителям будущих первоклассников.
Советы родителям будущих первоклассников. Танкисты – добровольцы из Тувинской Народной Республики
Танкисты – добровольцы из Тувинской Народной Республики Презентация Пальчиковые игрушки
Презентация Пальчиковые игрушки Где вода-там жизнь
Где вода-там жизнь Основы программирования на языке Python
Основы программирования на языке Python Пристрій керування каналом (Заняття № 7.9)
Пристрій керування каналом (Заняття № 7.9) КузнецовВВ_Презентация
КузнецовВВ_Презентация Игрушки из прищепок. Технология. 2 урок
Игрушки из прищепок. Технология. 2 урок Использование метода проекта в образовательном процессе МБДОУ
Использование метода проекта в образовательном процессе МБДОУ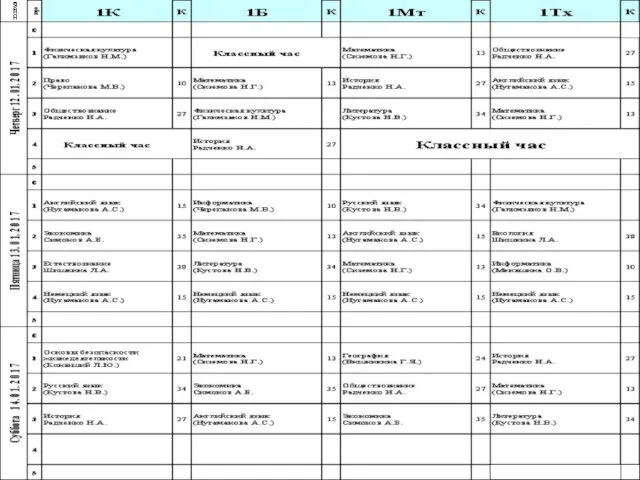 Расписание учебных занятий
Расписание учебных занятий Практика применения законодательства о контрактной системе. Подходы антимонопольного органа и арбитражных судов
Практика применения законодательства о контрактной системе. Подходы антимонопольного органа и арбитражных судов Скоростные поезда
Скоростные поезда Компетентностно-ориентированные задачи по химии для 8 класса
Компетентностно-ориентированные задачи по химии для 8 класса Беларусь в составе Российской империи в конце XVIII - середине XIX вв. (Занятие 7)
Беларусь в составе Российской империи в конце XVIII - середине XIX вв. (Занятие 7) Разработка мероприятий по снижению безработицы в Ставропольском крае
Разработка мероприятий по снижению безработицы в Ставропольском крае Ярмарки в России
Ярмарки в России Презентация к уроку географии на тему Изображение высот и глубин на картах.
Презентация к уроку географии на тему Изображение высот и глубин на картах. Личное и групповое снаряжение
Личное и групповое снаряжение Производство армированных изделий методом намотки
Производство армированных изделий методом намотки Фенилхромановые соединения. Флавоноиды
Фенилхромановые соединения. Флавоноиды Должностные положения бухгалтерского, финансового и экономического отделов
Должностные положения бухгалтерского, финансового и экономического отделов Творческая мастерская. Пасхальный дар
Творческая мастерская. Пасхальный дар Занимательная химия
Занимательная химия Патріотизм
Патріотизм Ниткопись - инновационный игровой метод работы с детьми дошкольного возраста
Ниткопись - инновационный игровой метод работы с детьми дошкольного возраста Страны Евразии. Обобщение. Задания
Страны Евразии. Обобщение. Задания Лабиринты 5-6 классы
Лабиринты 5-6 классы Лирика Пушкина
Лирика Пушкина