Содержание
- 2. Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью.
- 3. Щелочноземельные металлы
- 4. Цели урока: Изучить физические, химические свойства щелочноземельных металлов; Узнать о применении щелочноземельных металлов и их соединений.
- 5. Бериллий Магний Кальций Стронций Барий Радий
- 6. Положение в периодической таблице. В периодической системе находятся в главной подгруппе II группы. Являются сильными восстановителями,
- 7. Положение в периодической таблице Be Mg Ca Sr Ba Ra Восстановительные свойства усиливаются
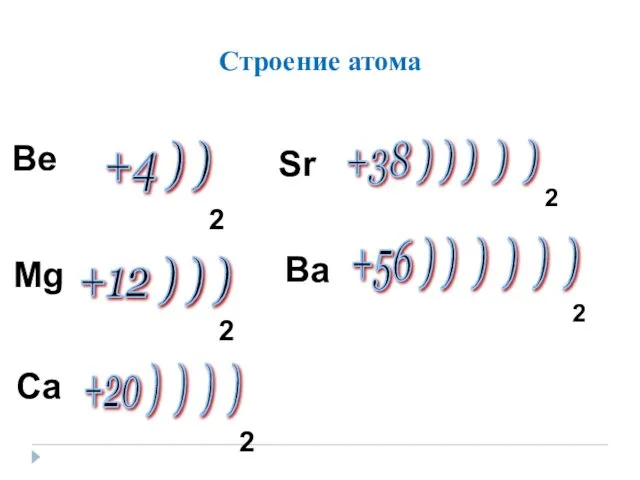
- 8. Строение атома +4 ) ) +12 ) ) ) +20 ) ) ) ) +38 )
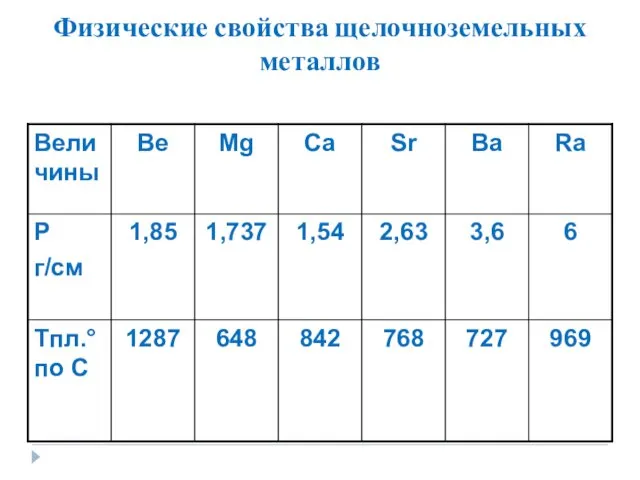
- 9. Физические свойства щелочноземельных металлов
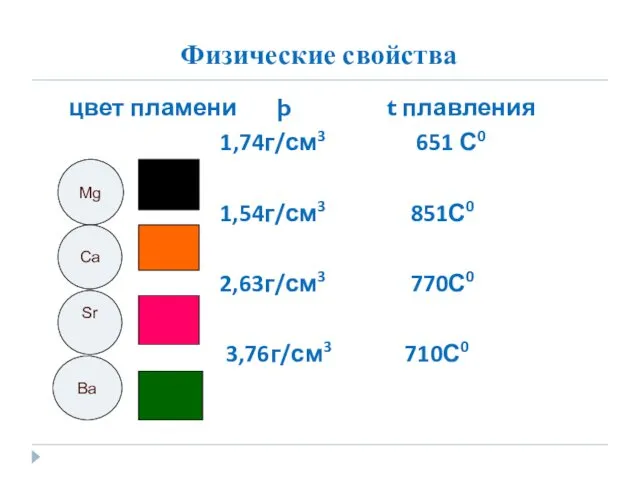
- 10. Физические свойства цвет пламени þ t плавления 1,74г/см3 651 С0 1,54г/см3 851С0 2,63г/см3 770С0 3,76г/см3 710С0
- 11. Нахождение в природе Бериллий: 3BeO • Al2O3 • 6SiO2 – берилл Магний: MgCO3 – магнезит Кальций:
- 12. Химические свойства С простыми веществами(неметаллами) 2Me0 +O2 → 2Me+2O-2 - оксид Me0 +H2 → Me+2H2 -
- 13. Соединения щелочноземельных металлов Оксиды щелочноземельных металлов –МеО, имеют основный характер, легко реагируют с оксидами неметаллов с
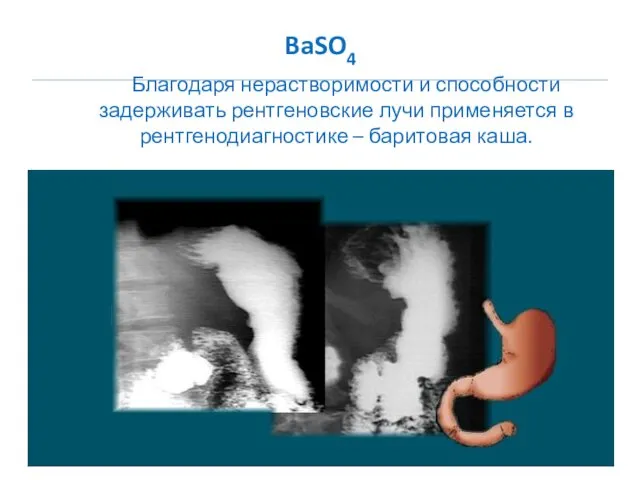
- 14. BaSO4 Благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике – баритовая каша.
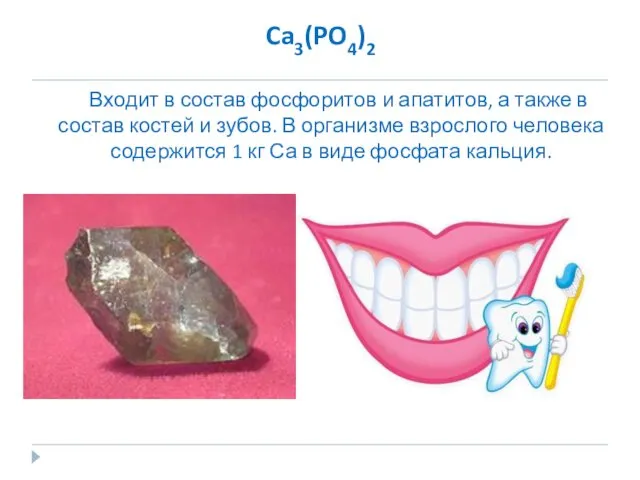
- 15. Ca3(PO4)2 Входит в состав фосфоритов и апатитов, а также в состав костей и зубов. В организме
- 16. CaCO3 Карбонат кальция – одно из самых распространённых на Земле соединений. Его содержат горные породы –
- 17. CaSO4∙ 2H2O Встречается в природе в виде минерала гипса, представляющего собой кристаллогидрат. Используется в строительстве, в
- 18. MgCO3 Широко применяется в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы
- 19. Са(ОН)2 Гидроксид кальция или гашёная известь с песком и водой называется известковым раствором и широко используется
- 22. Изучили физические свойства: все ЩЗ металлы имеют серебристый цвет, кроме Sr и Ba, и мягкие, кроме
- 23. Заполни пропуски! 1) Ca + … = 2CaO 2) … + … = Be3N2 3) Mg
- 25. Скачать презентацию

















 Цветные революции на постсоветском пространстве
Цветные революции на постсоветском пространстве Наша команда бизнес-класс!
Наша команда бизнес-класс! Разнообразие ракообразный и их роль в природе
Разнообразие ракообразный и их роль в природе Способы запоминания
Способы запоминания Внеклассное мероприятие Моя малая Родина
Внеклассное мероприятие Моя малая Родина Школьное самоуправление. Выборы
Школьное самоуправление. Выборы Чистая остановка - лицо села
Чистая остановка - лицо села Наш класс 6 Б 2012-13 уч.год
Наш класс 6 Б 2012-13 уч.год Массаж. Основные приемы массажа
Массаж. Основные приемы массажа Физкультминутка Диск
Физкультминутка Диск Активный и пассивный словарный запас русского языка: архаизмы, историзмы, неологизмы
Активный и пассивный словарный запас русского языка: архаизмы, историзмы, неологизмы Сенсоры. Классификация сенсоров. Миниатюрные электрорадиомеханические и оптоэлектромеханические компоненты
Сенсоры. Классификация сенсоров. Миниатюрные электрорадиомеханические и оптоэлектромеханические компоненты Арктическая пустыня
Арктическая пустыня Мирный Дагестан
Мирный Дагестан Древний Египет
Древний Египет Садово-парковые ландшафты
Садово-парковые ландшафты Роды и жанры литературы
Роды и жанры литературы Методичка вожатого
Методичка вожатого Игровое дидактическое пособие
Игровое дидактическое пособие Принципы, методы и средства обеспечения безопасности
Принципы, методы и средства обеспечения безопасности Кардиалгический синдром. Лечение больных ИБС в амбулаторных условиях
Кардиалгический синдром. Лечение больных ИБС в амбулаторных условиях виды театра
виды театра Техническое регулирование в Российской Федерации
Техническое регулирование в Российской Федерации Общение как взаимодействие
Общение как взаимодействие Магматические месторождения
Магматические месторождения Атом энергетикасы өндірісі мен радиологиялық нысандардағы апаттардың себебінен жіктелуі және олардың салдарының масштабы
Атом энергетикасы өндірісі мен радиологиялық нысандардағы апаттардың себебінен жіктелуі және олардың салдарының масштабы Основы материаловедения. Металлы и сплавы
Основы материаловедения. Металлы и сплавы Строение и значение опорно-двигательной системы человека
Строение и значение опорно-двигательной системы человека