Содержание
- 2. ЧТО ВЫ УЗНАЕТЕ? Открытие и название Положение щелочных металлов в ПС, строение атомов Содержание в природе
- 3. Великие законы мирозданья В сущности наивны и просты. И порой Вам не хватает знания Для разгадки
- 4. ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ Литий был открыт шведским химиком Й. Арфведсоном в 1817 г. По предложению Й.Берцелиуса
- 5. Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807г при электролизе
- 6. Й. Берцелиус предложил назвать один новый элемент натрием (от араб. натрун – сода), а второй элемент
- 7. Рубидий был открыт по характерным линиям в длинноволновой области спектра в 1861г. немецкими учёными Р. Бунзеном
- 8. Цезий был первым элементом, открытым с помощью метода спектрального анализа. В 1860 г Р. Бунзен и
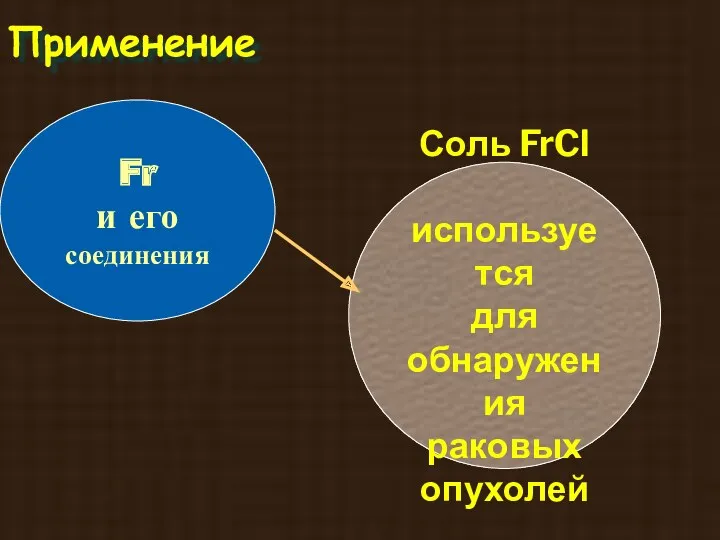
- 9. Франций был открыт в 1939г француженкой М. Пере. Она доказала, что этот элемент является продуктом распада
- 10. ❄Щелочные металлы находятся в ❄Строение внешнего энергетического уровня ❄ Максимальная степень окисления +1 ns1 IA-группе ПС
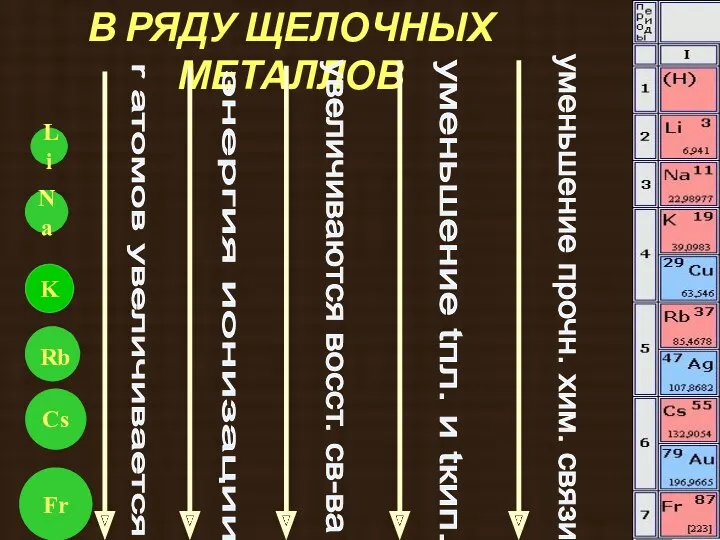
- 11. В РЯДУ ЩЕЛОЧНЫХ МЕТАЛЛОВ Na K Li Fr r атомов увеличивается увеличиваются восст. св-ва уменьшение tпл.
- 12. Содержание щелочных металлов в природе
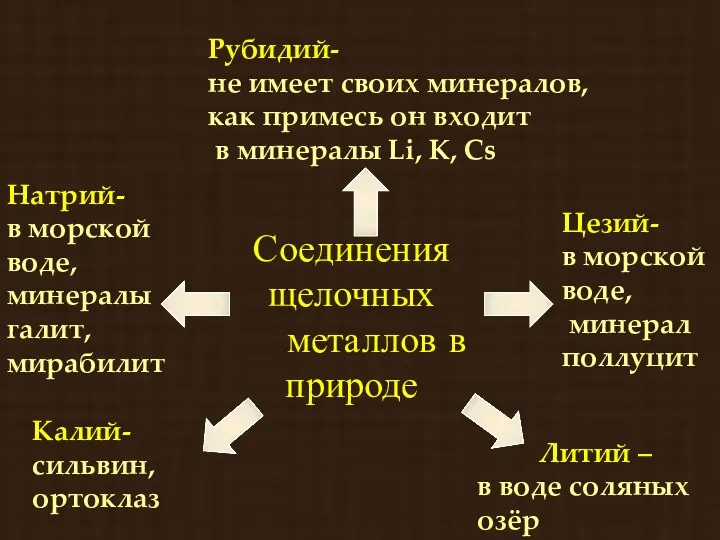
- 13. Соединения щелочных металлов в природе Литий – в воде соляных озёр Натрий- в морской воде, минералы
- 14. Н а х о ж д е н и е в п р и р о
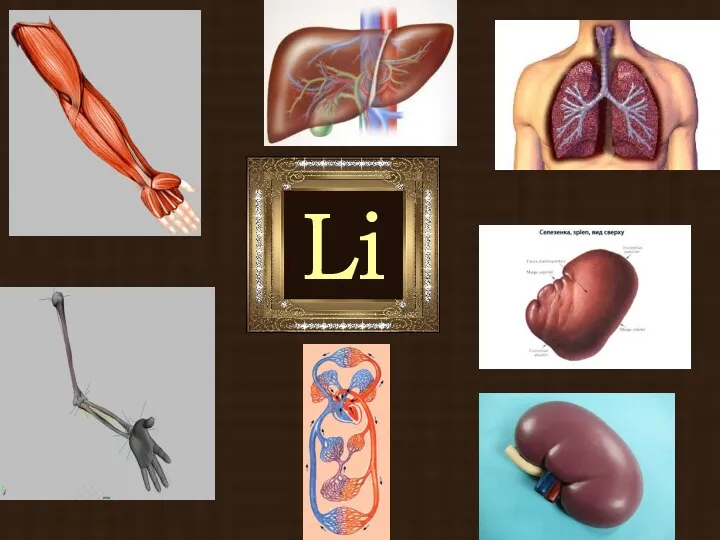
- 15. Б и о л о г и ч е с к а я р о л
- 16. Содержание ионов щелочных металлов в человеческом организме Na 0,08% K 0,23% Li 10 % Rb 10
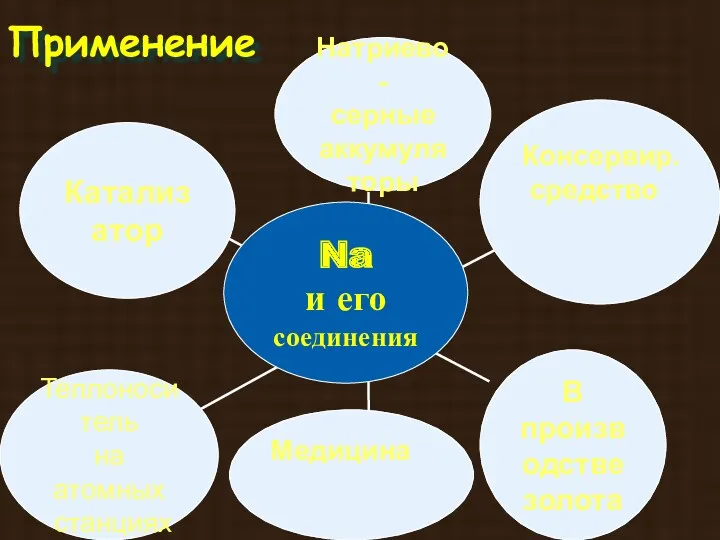
- 17. Na
- 18. К
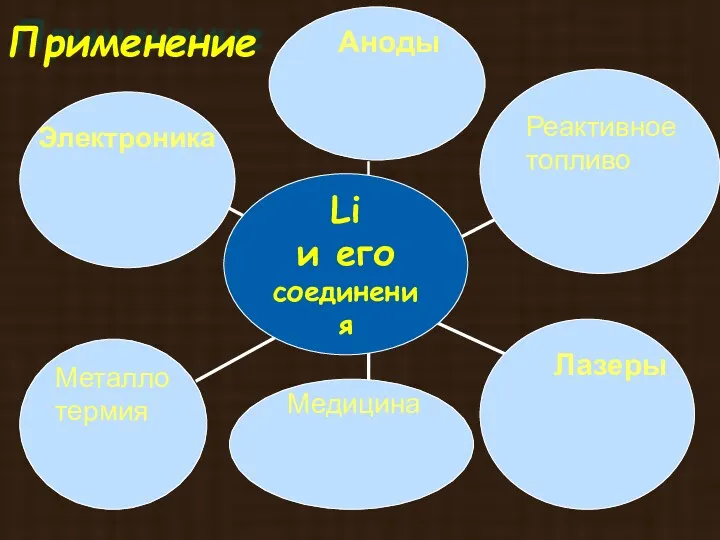
- 19. Li
- 20. ИНТЕРЕСНО Установлено, что некоторые соединения лития оказывают положительное влияние на больных с маниакальной депрессией. Всасываясь из
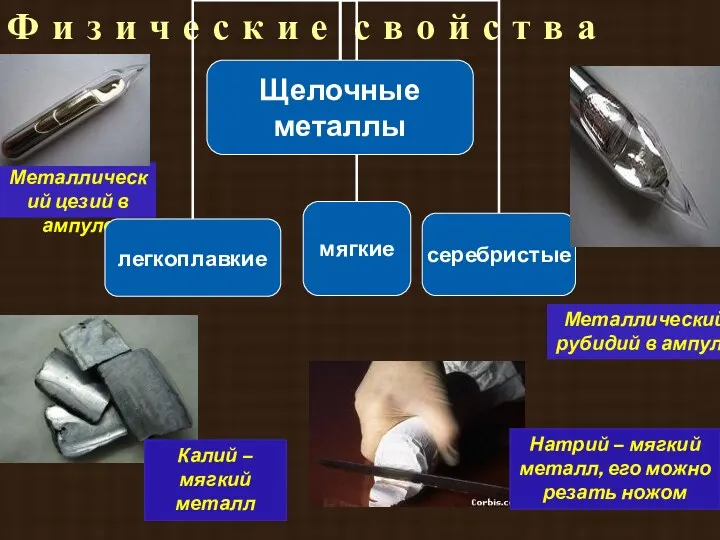
- 21. Металлический цезий в ампуле Металлический рубидий в ампуле Натрий – мягкий металл, его можно резать ножом
- 22. Х И М И Ч Е С К И Е С В О Й С Т
- 23. Все щелочные металлы активно реагируют с водой, образуя щелочи и восстанавливая воду до водорода: 2М0 +
- 24. Окраска пламени ионами щелочных металлов Li+ Rb+ Na+ Cs+ К+
- 25. Применение Аноды Реактивное топливо Лазеры Медицина Электроника Металло термия
- 26. Применение Консервир. средство Медицина
- 27. Применение Медицина
- 28. Применение
- 29. Применение
- 30. Применение Fr и его соединения Соль FrCl используется для обнаружения раковых опухолей
- 31. Домашнее задание §6.2; упр. 4, 5
- 32. http://ru.wikipedia.org/wiki/%D0%A4%D0%B0%D0%B9%D0%BB:Nametal.JPG.jpg http://www.aib.ru/~kam/biography/gemfri-devi.htm http://office.microsoft.com/ru-ru/images/results.aspx?qu=%D1%8F%D0%B1%D0%BB%D0%BE%D0%BA%D0%B8 http://www.physchem.chimfak.rsu.ru/Source/History/Persones/Arfwedson.html http://ru.wikipedia.org/wiki/%D0%A4%D0%B0%D0%B9%D0%BB:ElectrochemCell.png http://www.piplz.ru/page-id-490.html http://elementy.ru/trefil/21154 http://alexandr4784.narod.ru/7_5.htm http://forexaw.com/TERMs/Physics44554/image177928_1-2_%D0%A1%D1%82%D1%80%D1%83%D0%BA%D1%82%D1%83%D1%80%D0%B0_%D0%B0%D1%82%D0%BE%D0%BC%D0%B0 http://www.calc.ru/img/m.gif http://ru.wikipedia.org/w/index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:The_Earth_seen_from_Apollo_17.jpg&filetimestamp=20101017074211 http://science.nationalgeographic.com/science/photos/brain/ http://kuuni.livejournal.com/2686.html http://www.liveinternet.ru/users/v2r/rubric/1645065/ http://ru.eduys.com/photo/99a6602212e6f58e42b3995d5e15d272/Демонстрационная-модель-почки-в-разрезе-из-пластика.jpg http://adelanta.info/news/england4/index2009/01/27/4583.html
- 34. Скачать презентацию



















 Социальные иституты
Социальные иституты Гемолитические анемии. Клиника, диагностика, лечение
Гемолитические анемии. Клиника, диагностика, лечение Требования к оформлению исследовательской работы для научно-исследовательской конференции
Требования к оформлению исследовательской работы для научно-исследовательской конференции Презентация, классный час Новый год в разных странах
Презентация, классный час Новый год в разных странах презентация Виды сказок в работе с детьми дошкольного возраста
презентация Виды сказок в работе с детьми дошкольного возраста Влияние телевизора на здоровье младшего школьника
Влияние телевизора на здоровье младшего школьника Первоцветы 1 класс внеурочная деятельность Я и мой мир
Первоцветы 1 класс внеурочная деятельность Я и мой мир Воспитательный час Семья и Отечество
Воспитательный час Семья и Отечество Заболевания носа, придаточных пазух
Заболевания носа, придаточных пазух Медицинская деонтология и этика. Основные термины и понятия
Медицинская деонтология и этика. Основные термины и понятия Воспаление: определение, сущность, биологическое значение
Воспаление: определение, сущность, биологическое значение phpOdviwa_rozhdestvo
phpOdviwa_rozhdestvo Проект Сказки Г.Х.Андерсена
Проект Сказки Г.Х.Андерсена Перспективы развития агроэкотуризма в Витебской области в соответствии с международным экологическим стандартом качества ЕСЕАТ
Перспективы развития агроэкотуризма в Витебской области в соответствии с международным экологическим стандартом качества ЕСЕАТ Путешествие по островам природы
Путешествие по островам природы Разработка технологического процесса изготовления детали Крышка
Разработка технологического процесса изготовления детали Крышка Каспий маңы мұнай-газды бассейнінің оңтүстік-шығыс бөлігінің шоғырлар бойынша жіктемесі
Каспий маңы мұнай-газды бассейнінің оңтүстік-шығыс бөлігінің шоғырлар бойынша жіктемесі Про те, якими ми не є
Про те, якими ми не є История применения математических методов в экономике
История применения математических методов в экономике Таблица сложения. 1 класс
Таблица сложения. 1 класс каверин
каверин Вибрато. Виды
Вибрато. Виды Кинезиология. Развивающая программа
Кинезиология. Развивающая программа Экологический анализ предприятий
Экологический анализ предприятий Жизнь класса
Жизнь класса Герметизация фиссур
Герметизация фиссур Картотека игр на участке в летний период
Картотека игр на участке в летний период New York is the most populous city in US
New York is the most populous city in US