Содержание
- 2. Тип урока: урок- исследование. Цели урока: - расширить знания учащихся по теме: «Закономерности течения химических реакций»;
- 3. Задачи урока: -воспитывать культуру и совершенствовать навыки самостоятельной работы; -развивать наблюдательность; -развивать способность устанавливать причинно-следственные связи;
- 4. Оборудование и реактивы: \компьютер, мультимедийный проектор, экран, презентация, справочники по химии, учебник, мактолаборатории с лабораторным оборудованием
- 5. ПЛАН УРОКА: Постановка задач. Активизация опорных знаний (скорость , концентрация с помощью эвристической беседы). Формирование понятия
- 6. Определение зависимости скорости химической реакции о различных факторов (демонстрация фрагмента к/ф , демонстрации опытов, лабораторные опыты»)
- 7. Виды работы учащихся: Эвристическая беседа. Лабораторная работа. Работа с учебником и дополнительной литературой. Групповое сотрудничество в
- 8. Ход урока : Организационный момент Вступительное слово : тема, задачи, план урока. Деление класса на 4
- 9. Скорость – это величина, показывающая как изменяется какая либо характеристика в единицу времени.
- 10. Скорость химической реакции – это величина , показывающая как изменяются концентрации исходных веществ и продуктов реакции
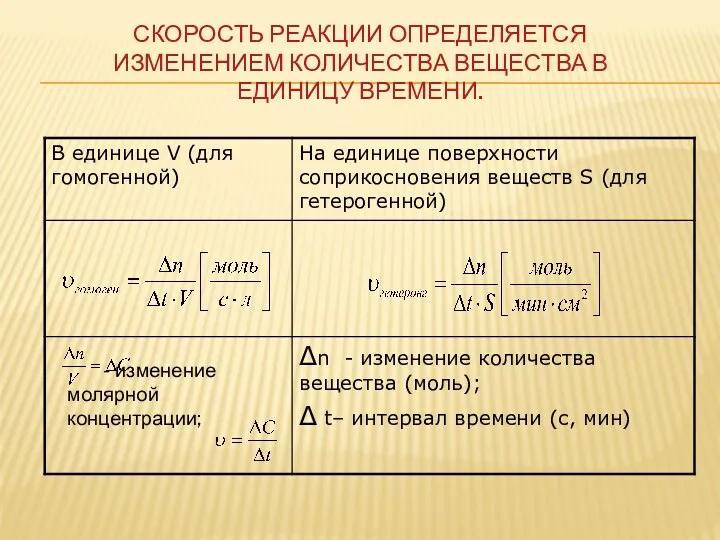
- 11. Скорость реакции определяется изменением количества вещества в единицу времени. - изменение молярной концентрации;
- 12. Работа в группах 1 Группа- зависимость скорости химической реакции от концентрации реагирующих веществ : Уксусная кислота
- 13. 2 группа зависимость скорости химической реакции от площади соприкосновения реагирующих веществ Беседа как быстрее разжечь костер?
- 14. 3 группа зависимость скорости химической реакции от природы реагирующих веществ, демонстрация опыта горения серы, железа в
- 15. 4 группа группа зависимость скорости химической реакции от температуры t H 2SO4(p)+ CuО → H 2SO4(k)+
- 16. Влияние температуры Правило Вант-Гоффа При нагревании системы на 10 ˚С скорость реакции возрастает в 2-4 раза
- 17. Обсуждение работы «научных лабораторий», составление схемы.
- 19. Скачать презентацию















 Основные организационные направления в работе с одаренными детьми на 2017-2018 учебный год
Основные организационные направления в работе с одаренными детьми на 2017-2018 учебный год delovaya_igra_dlya_pedagogov
delovaya_igra_dlya_pedagogov Классный час о дружбе
Классный час о дружбе История развития предмета экология человека
История развития предмета экология человека Психологическая готовность к школе
Психологическая готовность к школе Вокально-интонационные упражнения
Вокально-интонационные упражнения Лесная промышленность России
Лесная промышленность России Самопрезентация
Самопрезентация Развитие мелкой моторики и речи у детей старшего дошкольного возраста
Развитие мелкой моторики и речи у детей старшего дошкольного возраста Презентация к лексико-грамматическому занятию Домашние животные
Презентация к лексико-грамматическому занятию Домашние животные Презентация 8 марта - Международный женский день
Презентация 8 марта - Международный женский день Мировая энергетика. Источники энергии. Энергетический баланс в мире. (Тема 19)
Мировая энергетика. Источники энергии. Энергетический баланс в мире. (Тема 19) Адаптация пятиклассников к новым условиям обучения
Адаптация пятиклассников к новым условиям обучения Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии СССР во второй половине 1950 - начале 1980-х гг
СССР во второй половине 1950 - начале 1980-х гг родительское собрание в 5 классе или в конце 4 класса по адаптации
родительское собрание в 5 классе или в конце 4 класса по адаптации Педагогическое общение. Конфликты в педагогическом общении и их преодоление
Педагогическое общение. Конфликты в педагогическом общении и их преодоление Восточное направление внешней политики Ивана IV Грозного
Восточное направление внешней политики Ивана IV Грозного Постановка звука [Ц]
Постановка звука [Ц] Саморегулируемые организации кадастровых инженеров
Саморегулируемые организации кадастровых инженеров Мое рабочее место – лаборатория творчества
Мое рабочее место – лаборатория творчества 课件制作者 张莉
课件制作者 张莉 История Трои
История Трои Производство муки
Производство муки Буддизм – самая древняя мировая религия
Буддизм – самая древняя мировая религия Книги по английскому языку в помощь учебному процессу. База Юрайт
Книги по английскому языку в помощь учебному процессу. База Юрайт Василь Стефаник
Василь Стефаник Шаруашылық аумақтық ұйымдастырылуы. Ішкі айырмашылықтары
Шаруашылық аумақтық ұйымдастырылуы. Ішкі айырмашылықтары