Содержание
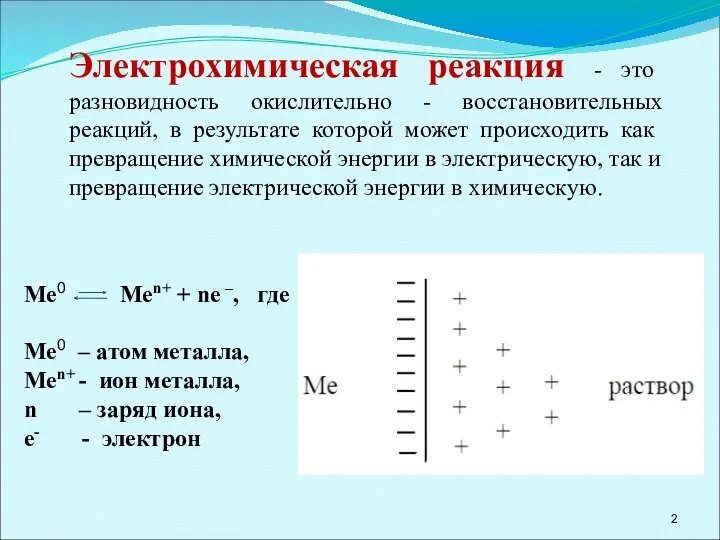
- 2. Электрохимическая реакция - это разновидность окислительно - восстановительных реакций, в результате которой может происходить как превращение
- 3. Луиджи Гальвани 1791 г. «Отцы – основатели» науки «электрохимия»
- 4. Алессандро Вольта «Вольтов столб» 1797-1800 г.г. «Отцы – основатели» науки «электрохимия»
- 5. Х. Дэви 1806 г., электролизом получены щелочные элементы Первые фундаментальные работы в области электрохимии
- 6. Первые фундаментальные работы в области электрохимии Ч. Холл П. Эру 1886 г., получение алюминия из криолит-глиноземного
- 7. Первые фундаментальные работы в области электрохимии Б.С. Якоби 1838 г., гальванопластика, гальваностегия
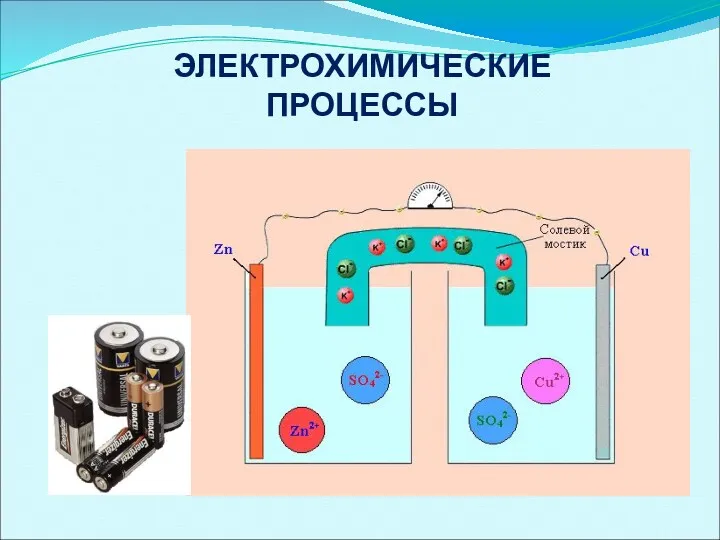
- 8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
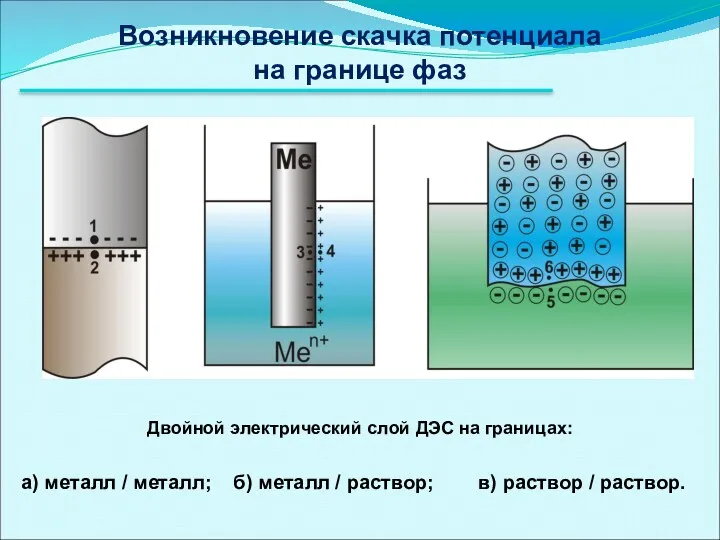
- 9. Возникновение скачка потенциала на границе фаз Двойной электрический слой ДЭС на границах: а) металл / металл;
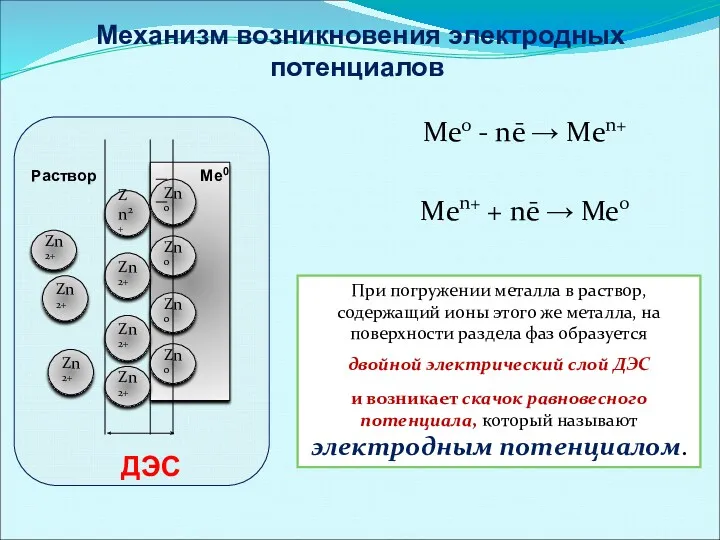
- 10. Механизм возникновения электродных потенциалов Ме0 - nē → Mеn+ Mеn+ + nē → Ме0 Zn0 Zn2+
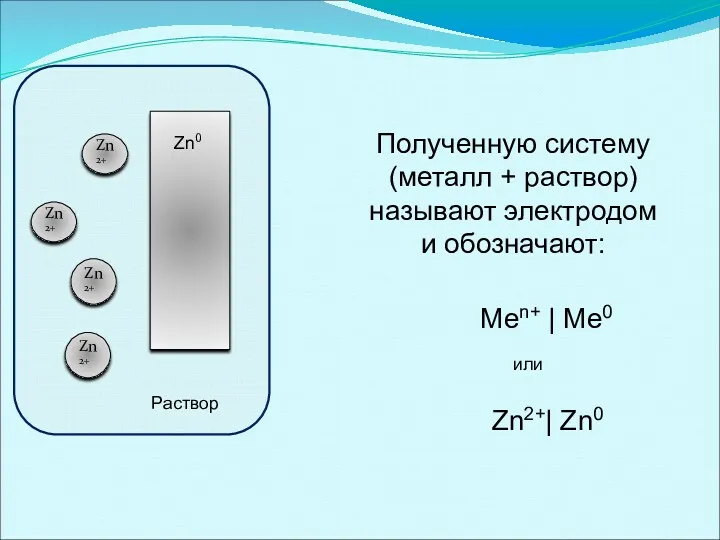
- 11. Zn2+ Zn2+ Zn2+ Zn2+ Полученную систему (металл + раствор) называют электродом и обозначают: Раствор Zn0 Меn+
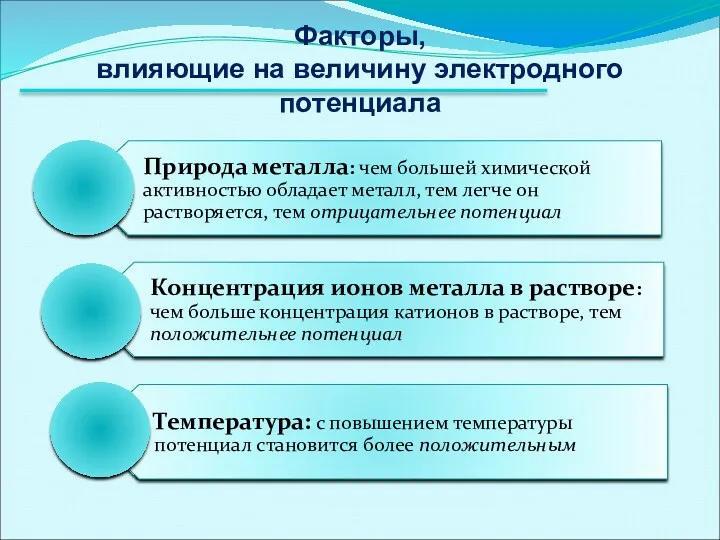
- 12. Факторы, влияющие на величину электродного потенциала
- 13. Уравнение НЕРНСТА Стандартный электродный потенциал φº - это потенциал электрода при стандартных условиях: Т = 298
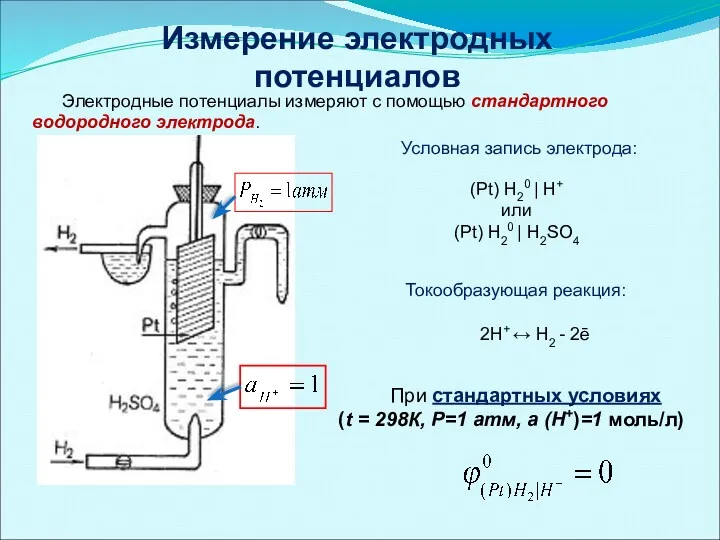
- 14. Измерение электродных потенциалов Электродные потенциалы измеряют с помощью стандартного водородного электрода. При стандартных условиях (t =
- 15. Уравнение Нернста для водородного электрода:
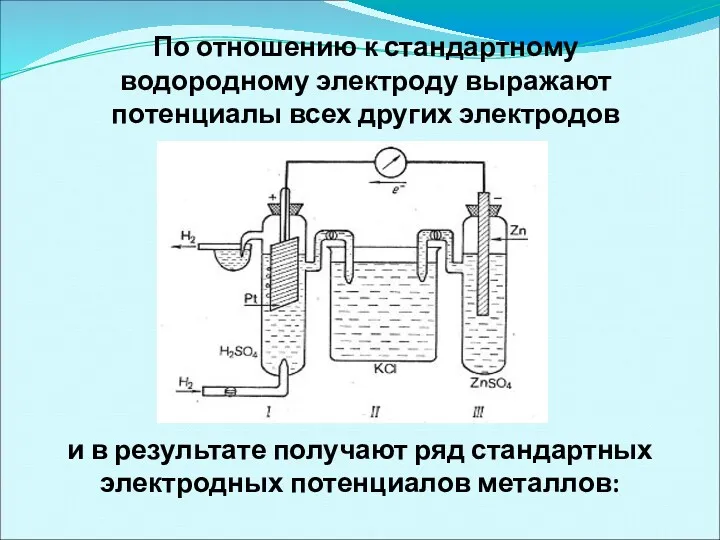
- 16. По отношению к стандартному водородному электроду выражают потенциалы всех других электродов и в результате получают ряд
- 17. Электрохимический ряд стандартных электродных потенциалов металлов Увеличение потенциала Усиление окислительных свойств Уменьшение химической активности металла Активные
- 18. Типы электродов Электроды I рода Электроды II рода Окислительно-восстановительные электроды
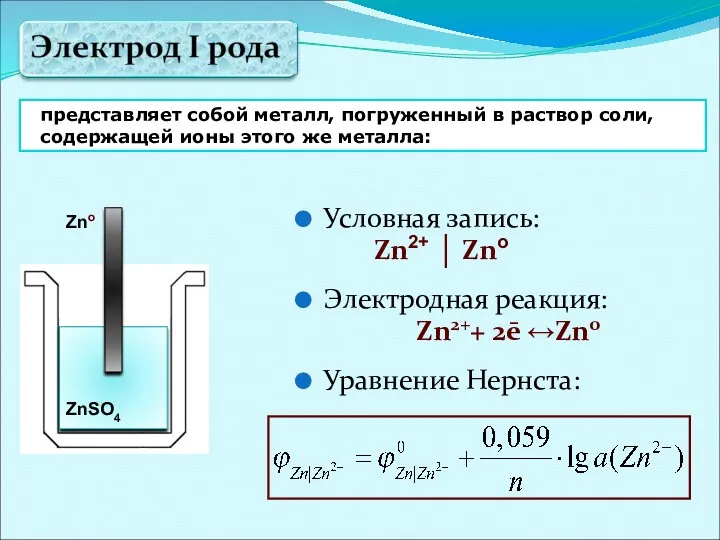
- 19. представляет собой металл, погруженный в раствор соли, содержащей ионы этого же металла: Zno ZnSO4 Условная запись:
- 20. система, в которой металл покрыт слоем труднорастворимой соли и погружен в раствор, содержащий анионы этой соли:
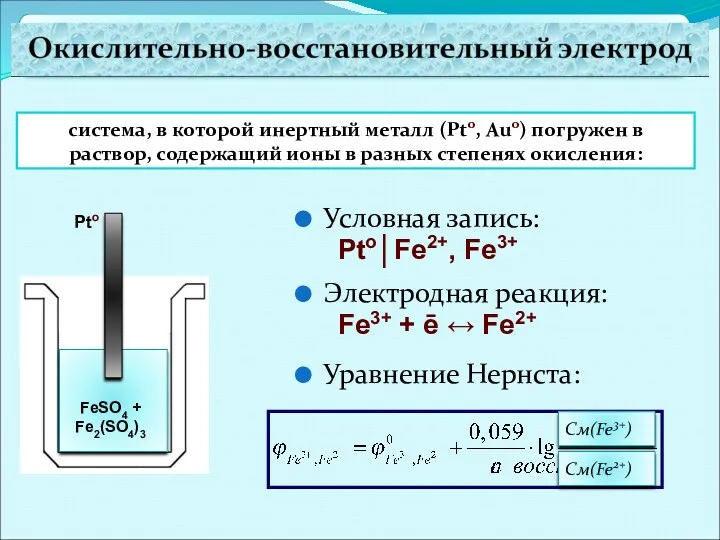
- 21. система, в которой инертный металл (Pto, Auo) погружен в раствор, содержащий ионы в разных степенях окисления:
- 22. Гальванический элемент Гальванический элемент - это электрохимическая система, состоящая из двух электродов любого типа и в
- 23. Гальванические элементы (ГЭ): электрохимические - источником электрической энергии является химическая реакция. концентрационные - источником электрической энергии
- 24. ПРАВИЛО ЗАПИСИ ГЭ: Слева всегда пишется электрод с меньшим стандартным потенциалом, этот электрод называется АНОДОМ (А)
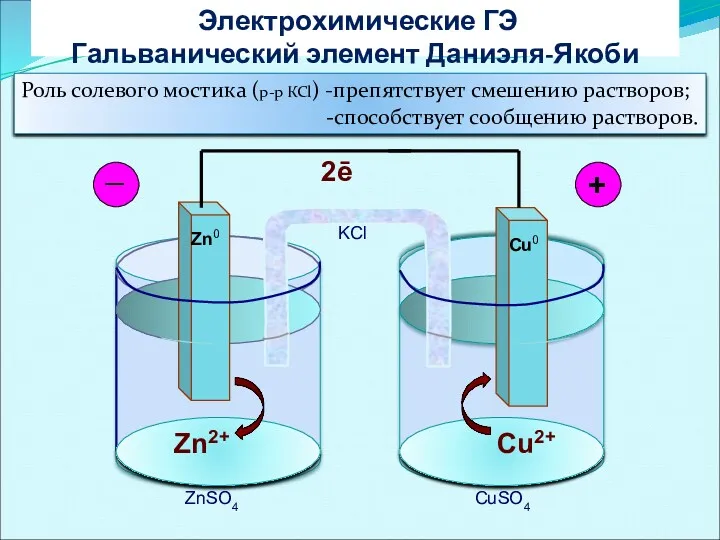
- 25. Электрохимические ГЭ Гальванический элемент Даниэля-Якоби Zn2+ Cu2+ 2ē Zn0 Cu0 _ + ZnSO4 CuSO4 KCl Роль
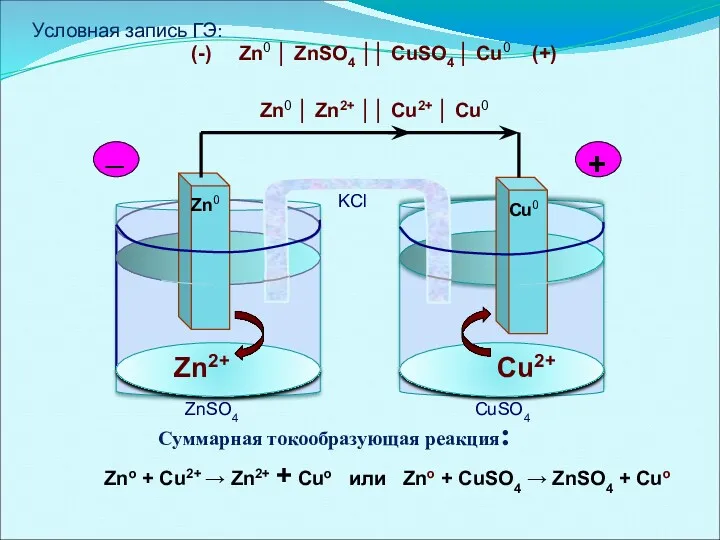
- 26. Условная запись ГЭ: (-) Zn0 │ ZnSO4 ││ CuSO4 │ Cu0 (+) Zn0 │ Zn2+ ││
- 27. Расчет ЭДС гальванического элемента Электродвижущая сила (ЭДС) – это разность электродных потенциалов катода и анода в
- 28. Расчет ЭДС гальванического элемента можно выполнить 2-мя путями: Рассчитать по уравнению Нернста электродные потенциалы каждого электрода,
- 29. Уравнение Нернста для расчета ЭДС гальванического элемента Пусть в ГЭ протекает токообразующая реакция: ν1А + ν2В
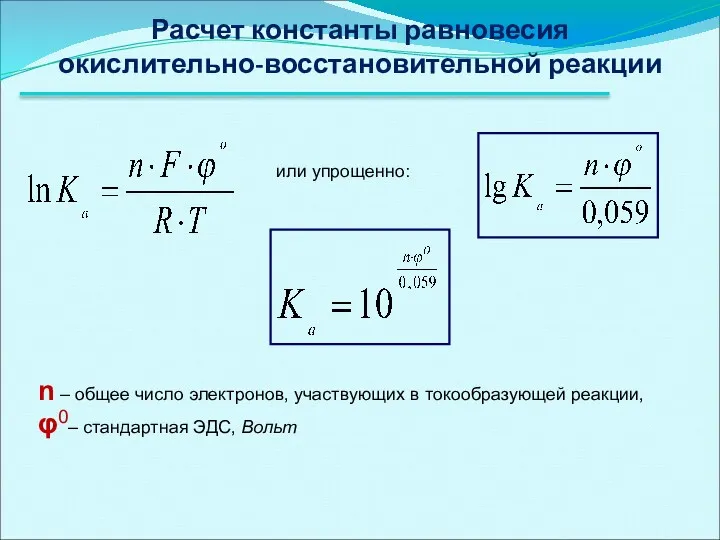
- 30. Расчет константы равновесия окислительно-восстановительной реакции или упрощенно: n – общее число электронов, участвующих в токообразующей реакции,
- 31. Концентрационные ГЭ ( – ) Ag0 ⏐AgNO3⏐⏐ AgNO3⏐ Ag0 ( + ) ɑ1 ɑ2 это система
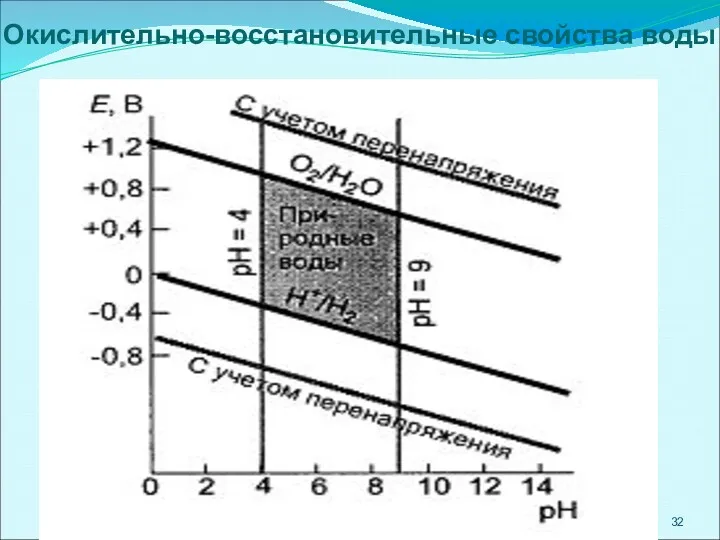
- 32. Окислительно-восстановительные свойства воды
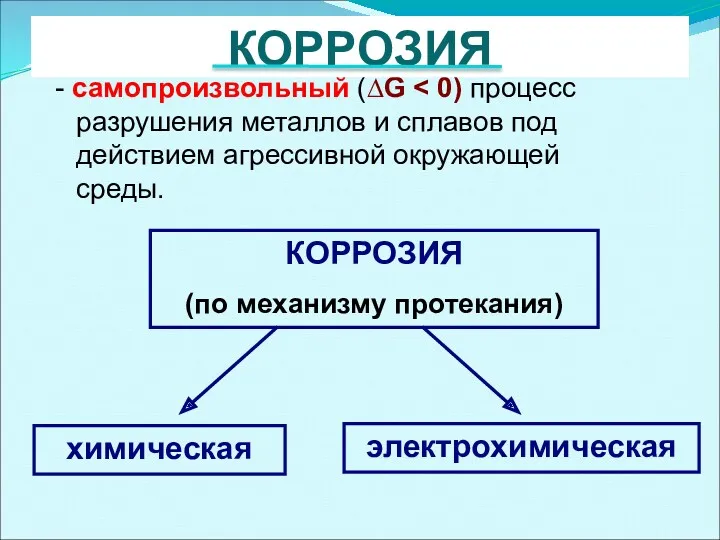
- 33. КОРРОЗИЯ (по механизму протекания) электрохимическая химическая - самопроизвольный (∆G КОРРОЗИЯ
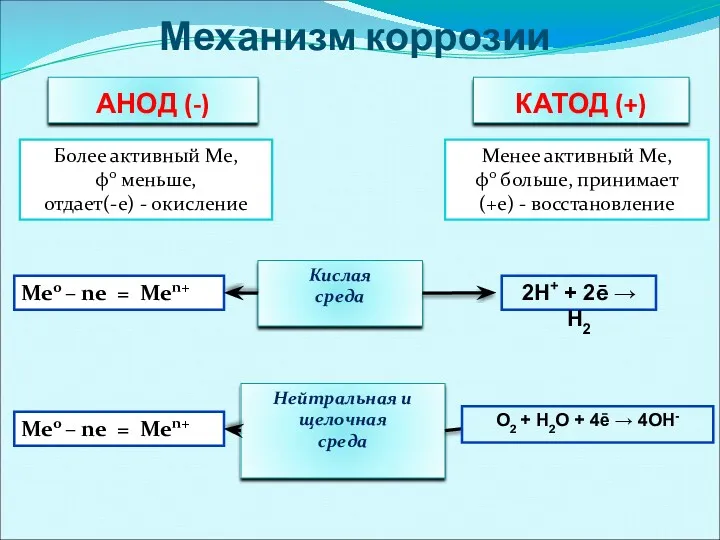
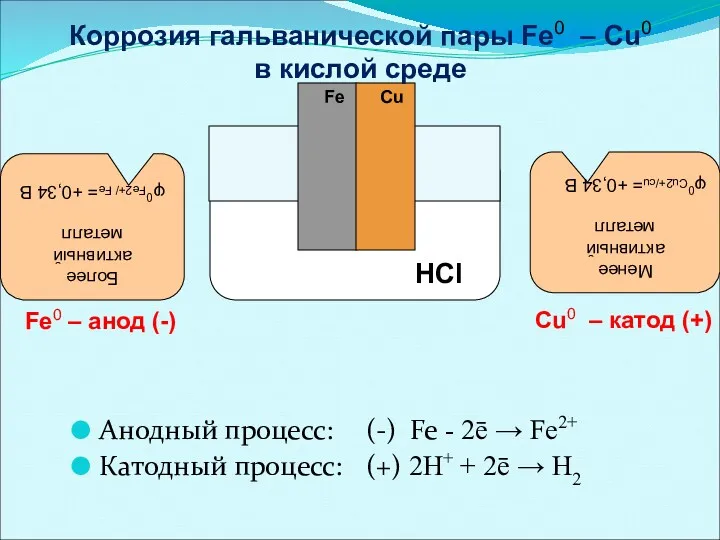
- 34. Механизм коррозии КАТОД (+) АНОД (-) Более активный Ме, φ0 меньше, отдает(-е) - окисление Менее активный
- 35. Анодный процесс: (-) Fe - 2ē → Fe2+ Катодный процесс: (+) 2H+ + 2ē → H2
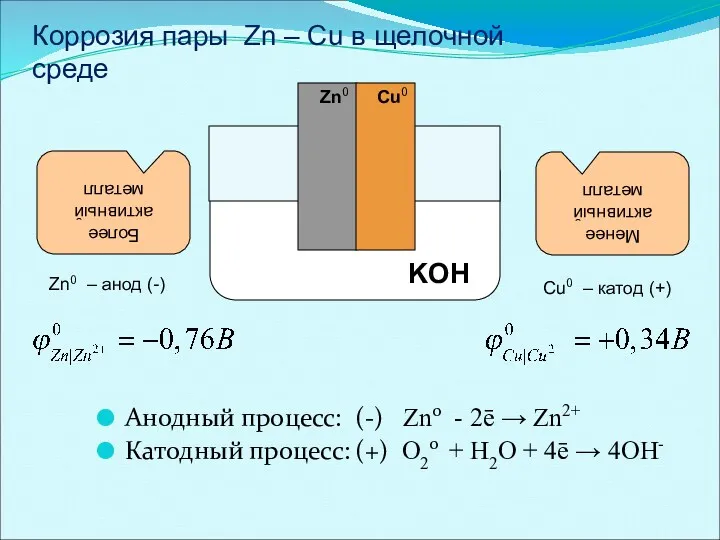
- 36. Анодный процесс: (-) Zn0 - 2ē → Zn2+ Катодный процесс: (+) O20 + H2О + 4ē
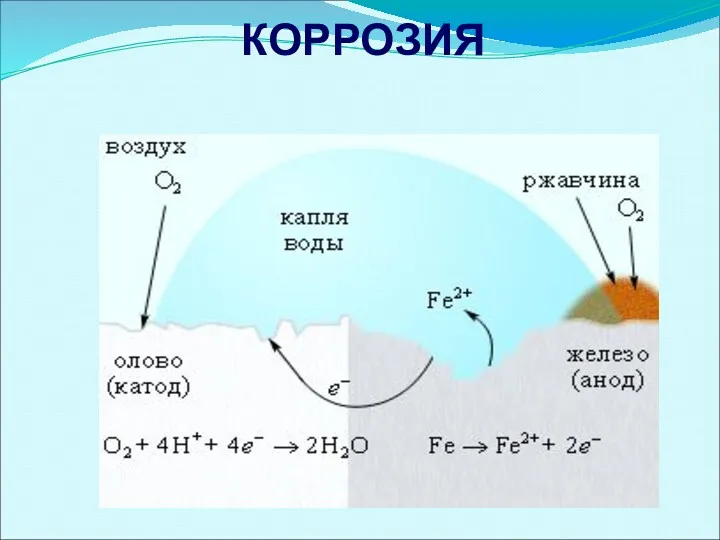
- 37. КОРРОЗИЯ
- 39. Методы защиты от коррозии Коррозия процесс нежелательный, приносящий большие убытки Окраска Оксидирование Нанесение металлических покрытий: -
- 40. Нанесение катодных покрытий Электрохимическая коррозия железа, покрытого оловом Катодные покрытия – это покрытия защищаемого металла менее
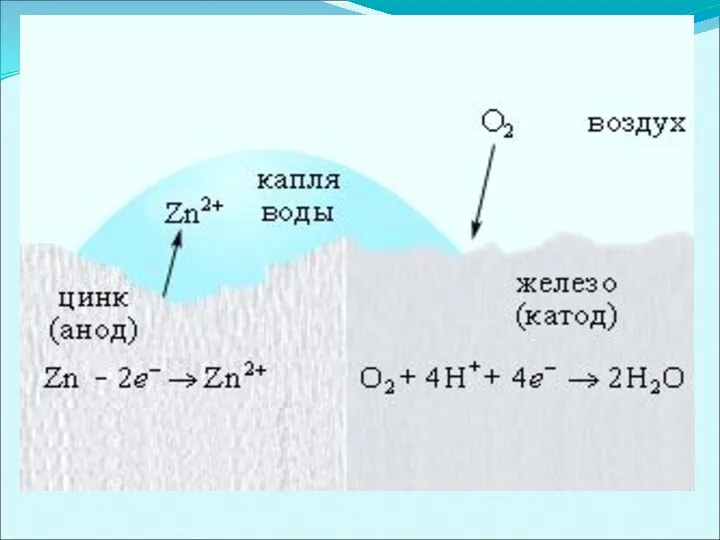
- 41. Нанесение анодных покрытий Электрохимическая коррозия железа, покрытого цинком Анодные покрытия – это покрытия защищаемого металла более
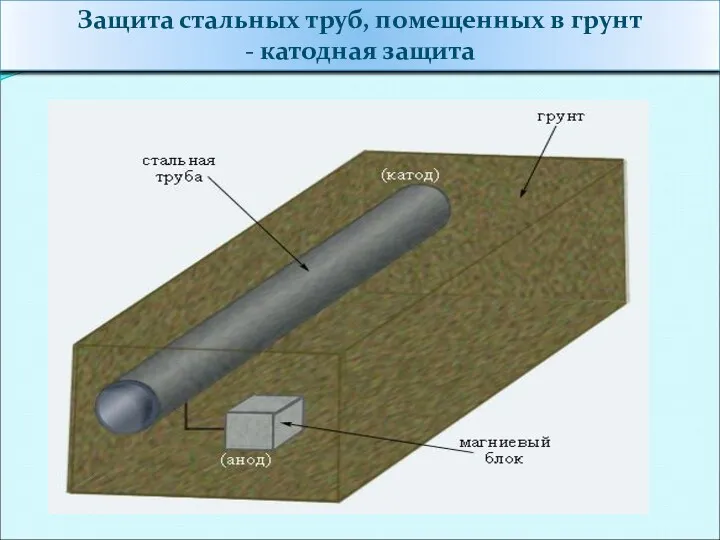
- 42. К защищаемому металлу крепится металл потенциал которого меньше. Этот металл называют протектором. Протекторная защита При этом:
- 43. Защита стальных труб, помещенных в грунт - катодная защита
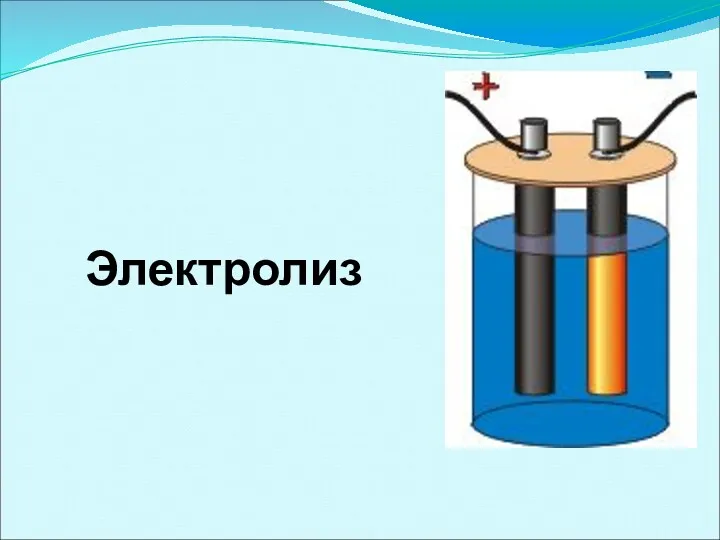
- 44. Электролиз
- 45. Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав
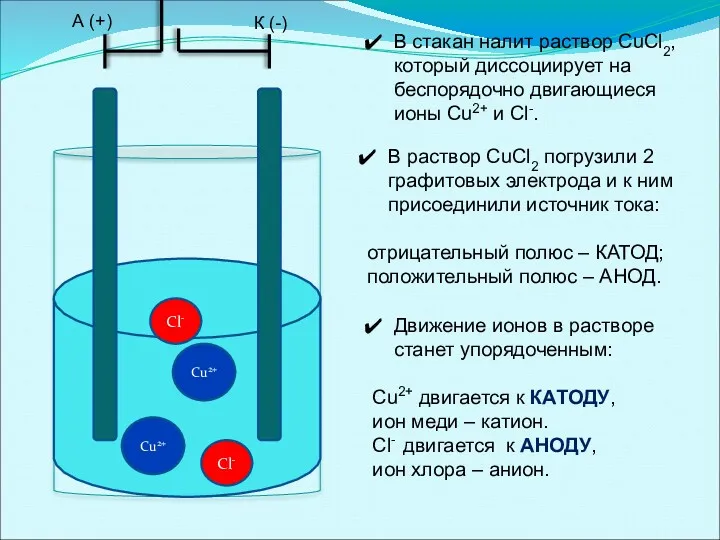
- 46. Сl- Сu2+ Сl- Сu2+ А (+) К (-) В раствор CuCl2 погрузили 2 графитовых электрода и
- 47. При электролизе: на отрицательном электроде (катоде) идет процесс восстановления, а на положительном электроде (аноде) идет процесс
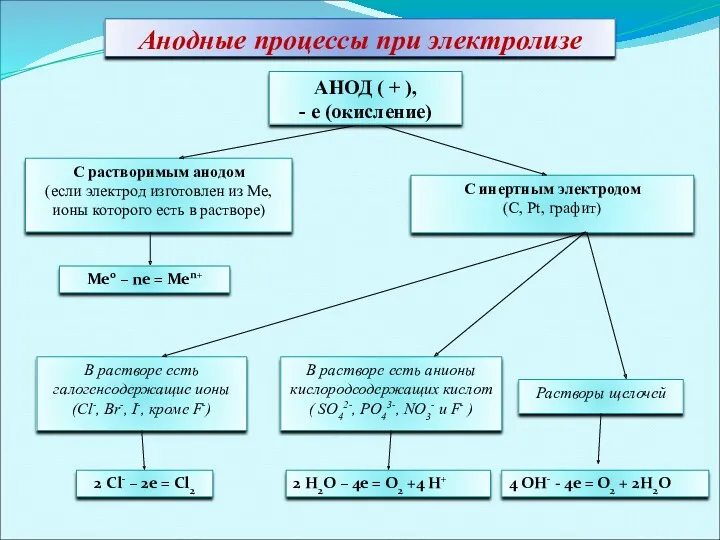
- 48. С растворимым анодом (если электрод изготовлен из Ме, ионы которого есть в растворе) С инертным электродом
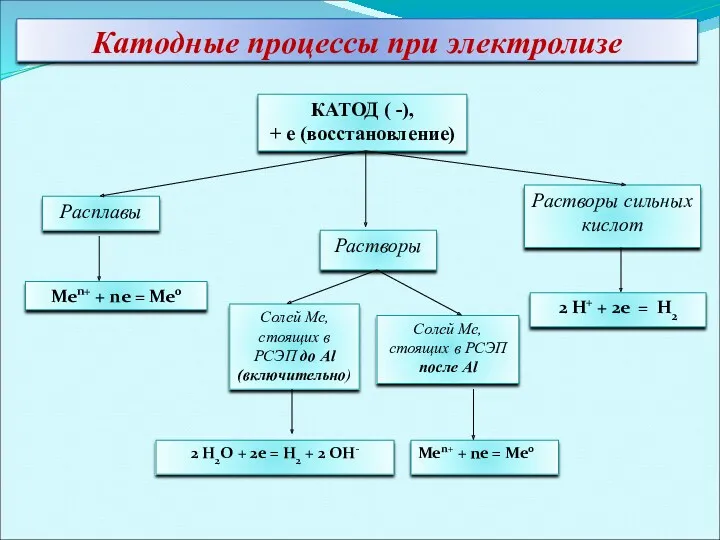
- 49. Катодные процессы при электролизе КАТОД ( -), + е (восстановление) Расплавы Растворы Солей Ме, стоящих в
- 50. Законы электролиза Первый закон Фарадея: Масса вещества, образующегося на электроде, пропорциональна количеству электричества, пропущенного через раствор.
- 51. Второй закон Фарадея: Для разряда одного моль ионов на электроде через раствор необходимо пропустить столько Фарадеев
- 52. Для выделения 1 моль вещества надо пропустить e⋅F (А∙час) электричества, т.е.: для выделения 1 моль Ag+
- 53. Выход по току – это отношение массы практически выделевшегося вещества к массе, рассчитанной по закону Фарадея:
- 54. Рассчитайте массу меди, которая выделится на катоде при пропускании через раствор CuSO4 постоянного электрического тока силой
- 55. 64 г меди _______ 2 F Х г меди _______ I · t Составляем пропорцию: (По
- 56. Е = φ(+) – φ(-)
- 58. Скачать презентацию






























 Буквы И – Ы после приставок
Буквы И – Ы после приставок Эффективность производственно-хозяйственной деятельности. Тема 9
Эффективность производственно-хозяйственной деятельности. Тема 9 Интеллектуальная карусель
Интеллектуальная карусель Профессиограмма: инженер (автомобильный транспорт)
Профессиограмма: инженер (автомобильный транспорт) Современный урок в соответствии с требованиями ФГОС
Современный урок в соответствии с требованиями ФГОС Introduction to electrodynamics
Introduction to electrodynamics Сталинградской битве посвящается. Классный час
Сталинградской битве посвящается. Классный час презентация проекта
презентация проекта Познавательная деятельность личности
Познавательная деятельность личности Викторина по сказкам А.С. Пушкина
Викторина по сказкам А.С. Пушкина Презентация для кружка В мире любознательных
Презентация для кружка В мире любознательных Матрёшка
Матрёшка Создать презентацию в программе, которую поддерживает панель МЭШ. Задание
Создать презентацию в программе, которую поддерживает панель МЭШ. Задание Мастер-класс на тему Модель и способ Тема урока: Модель и способ
Мастер-класс на тему Модель и способ Тема урока: Модель и способ Интерактивная ходилка Лестницы и змейки
Интерактивная ходилка Лестницы и змейки Миокардиодистрофия. Этиология и патогенез миокардиодистрофии
Миокардиодистрофия. Этиология и патогенез миокардиодистрофии Ethiopia.Freshly baked white brea
Ethiopia.Freshly baked white brea География материков и океанов. Природа Антарктиды
География материков и океанов. Природа Антарктиды Презентация Что такое хорошо и что такое плохо
Презентация Что такое хорошо и что такое плохо Презентация :Солнышко из бумажной тарелки
Презентация :Солнышко из бумажной тарелки Guess who
Guess who Практики применения медиативных технологий. Восстановительная медиация
Практики применения медиативных технологий. Восстановительная медиация Містобудівне проектування в системі управління розвитком міста
Містобудівне проектування в системі управління розвитком міста Введение. Особенности детей раннего и дошкольного возраста
Введение. Особенности детей раннего и дошкольного возраста Патріотичний символ Гордість нації. Впровадження патріотичної символіки
Патріотичний символ Гордість нації. Впровадження патріотичної символіки Взаимоотношения А.С. Пушкина с императором Александром I
Взаимоотношения А.С. Пушкина с императором Александром I Классификация химических элементов. Периодический закон
Классификация химических элементов. Периодический закон Интервизия и супервизия
Интервизия и супервизия