Содержание
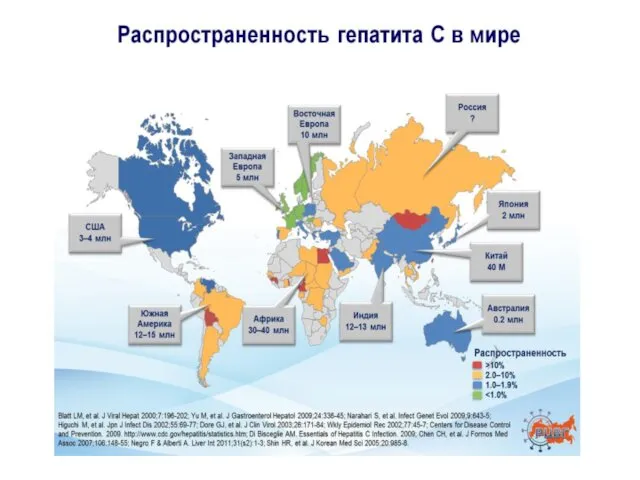
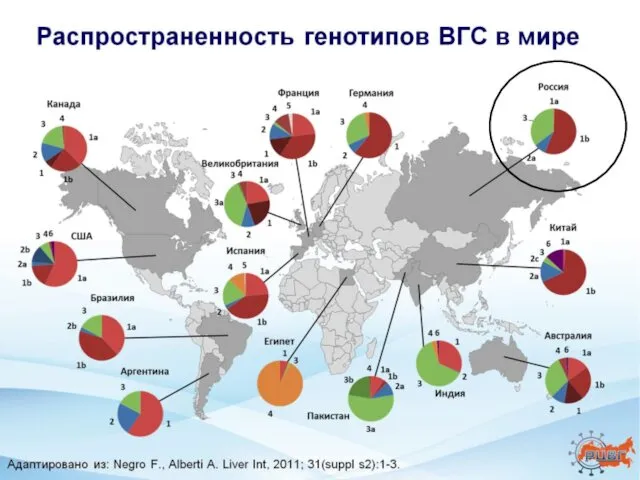
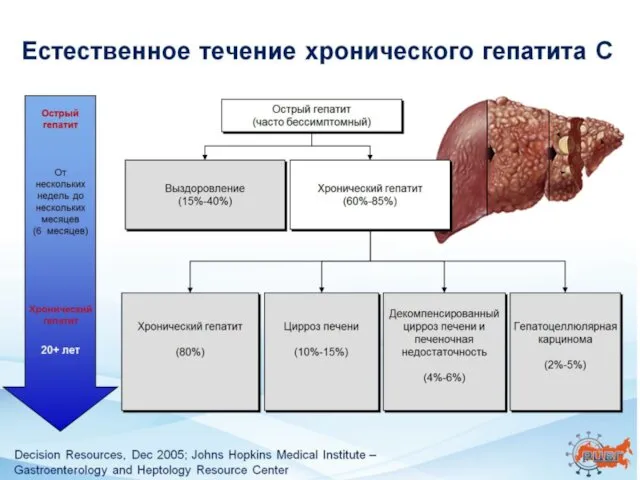
- 2. Хронический гепатит С
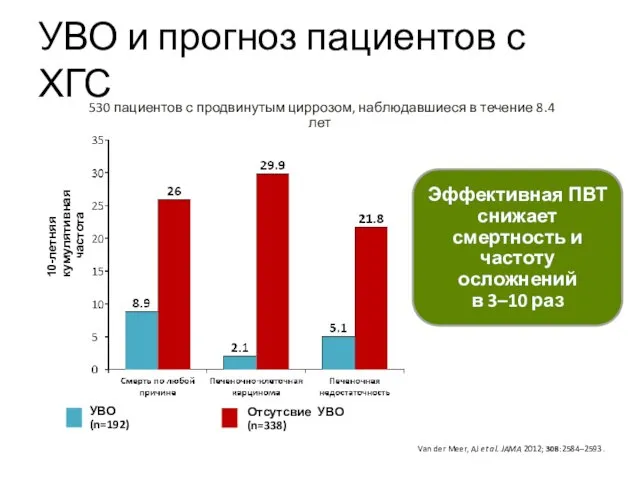
- 5. УВО и прогноз пациентов с ХГС Van der Meer, AJ et al. JAMA 2012; 308:2584–2593. Эффективная
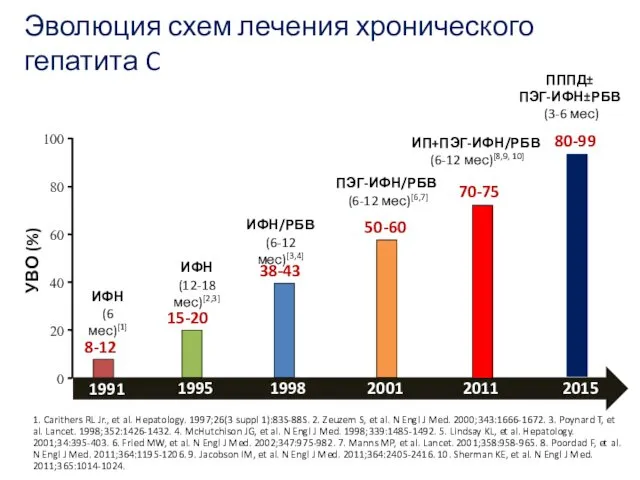
- 6. Эволюция схем лечения хронического гепатита C 0 20 40 60 80 100 8-12 УВО (%) 15-20
- 7. Лечение хронического гепатита С (генотип 1) – 2016 недели 0 12 24 48 Нет противопоказаний к
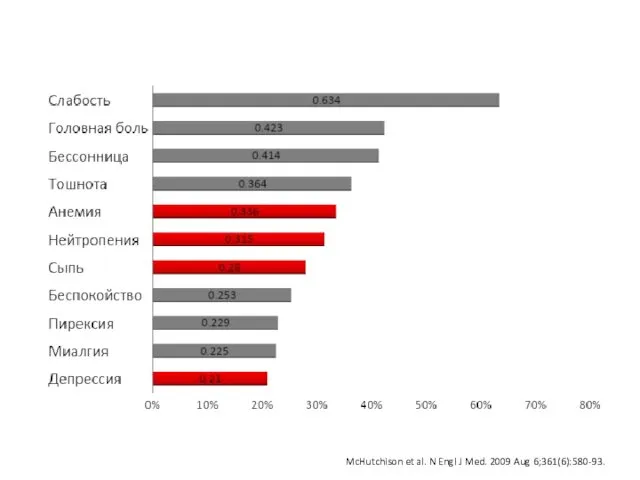
- 8. озникающие на фоне двойной терапии ПЭГ-ИФНa2a/РБВ (n=1019) McHutchison et al. N Engl J Med. 2009 Aug
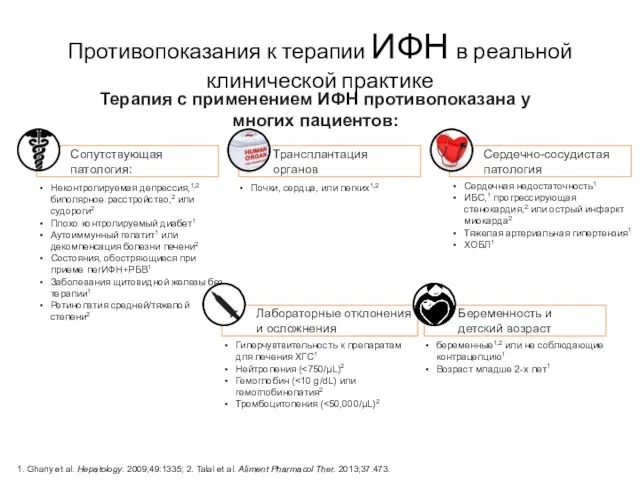
- 9. Беременность и детский возраст Противопоказания к терапии ИФН в реальной клинической практике Неконтролируемая депрессия,1,2 биполярное расстройство,2
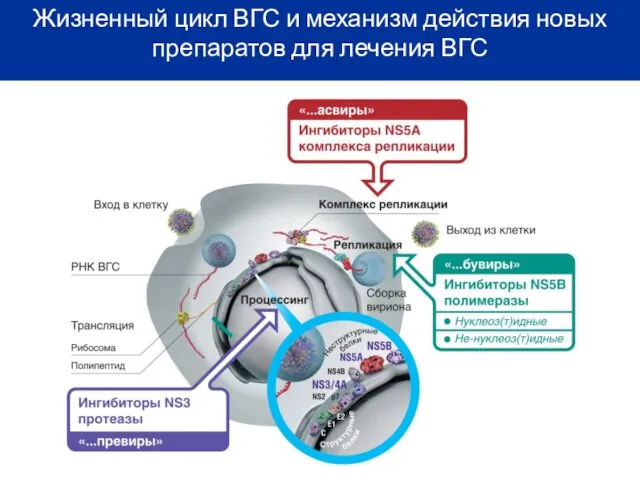
- 10. Жизненный цикл ВГС и механизм действия новых препаратов для лечения ВГС
- 11. Даклатасвир (DCV): ключевые свойства Высокоселективный ингибитор комплекса репликации NS5A ВГС Высокая активность (пикомолярная EC50) in vitro
- 12. Высокоселективный in vitro ингибитор протеазы NS3 ВГС Противовирусная активность против HCV генотипов 1, 4, 5 и
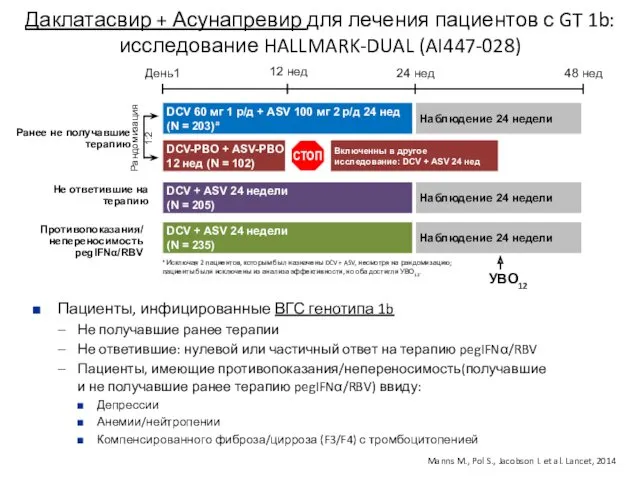
- 13. Даклатасвир + Асунапревир для лечения пациентов с GT 1b: исследование HALLMARK-DUAL (AI447-028) Рандомизация 1:2 DCV +
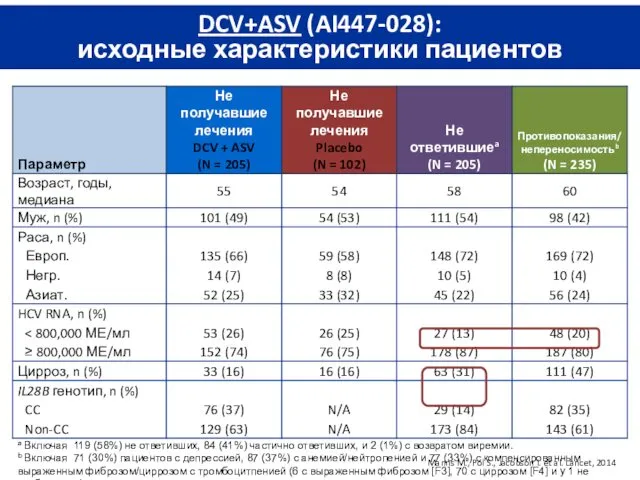
- 14. DCV+ASV (AI447-028): исходные характеристики пациентов Manns M., Pol S., Jacobson I. et al. Lancet, 2014
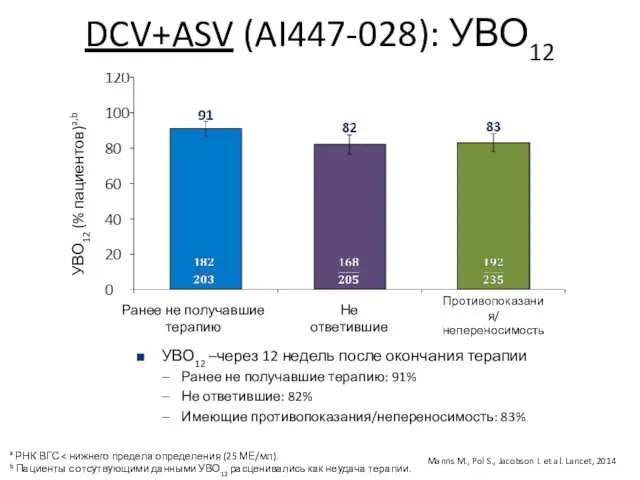
- 15. DCV+ASV (AI447-028): УВО12 Ранее не получавшие терапию Не ответившие Противопоказания/ непереносимость УВО12 (% пациентов)a,b a РНК
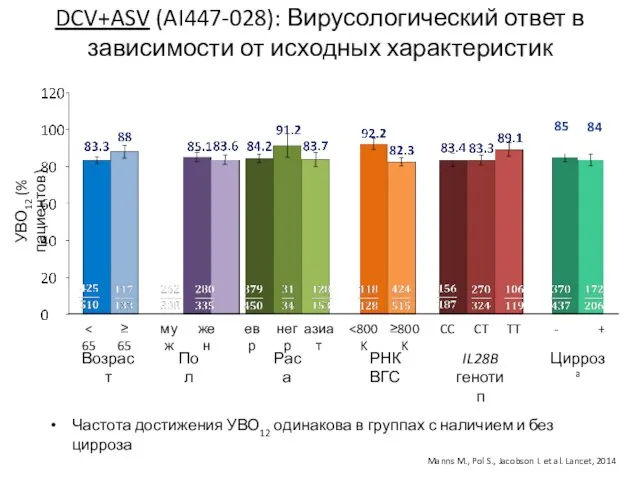
- 16. DCV+ASV (AI447-028): Вирусологический ответ в зависимости от исходных характеристик Возраст Пол Раса РНК ВГС IL28B генотип
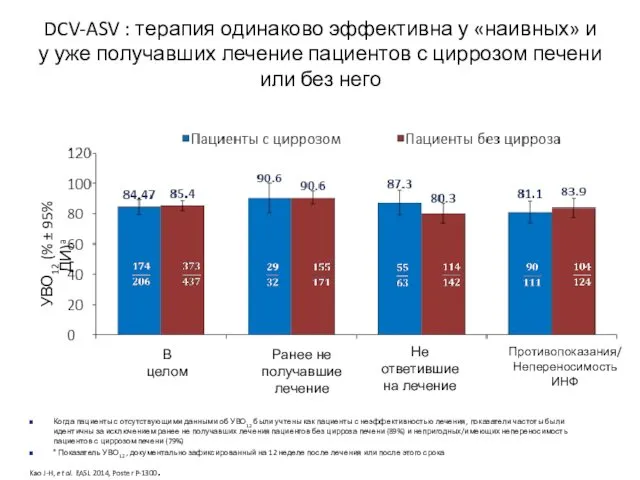
- 17. DCV-ASV : терапия одинаково эффективна у «наивных» и у уже получавших лечение пациентов с циррозом печени
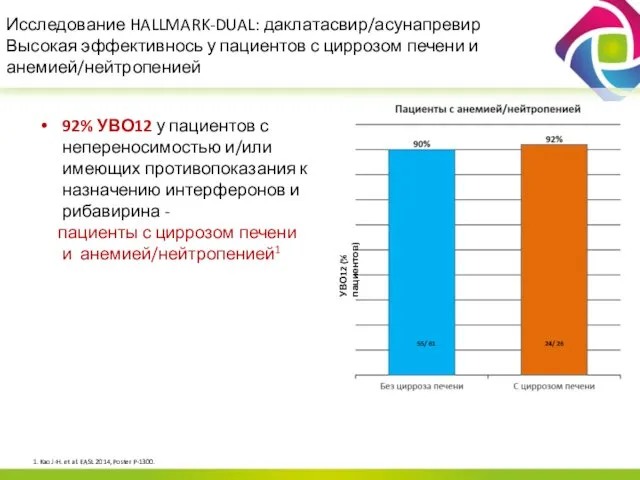
- 18. Исследование HALLMARK-DUAL: даклатасвир/асунапревир Высокая эффективнось у пациентов с циррозом печени и анемией/нейтропенией 92% УВО12 у пациентов
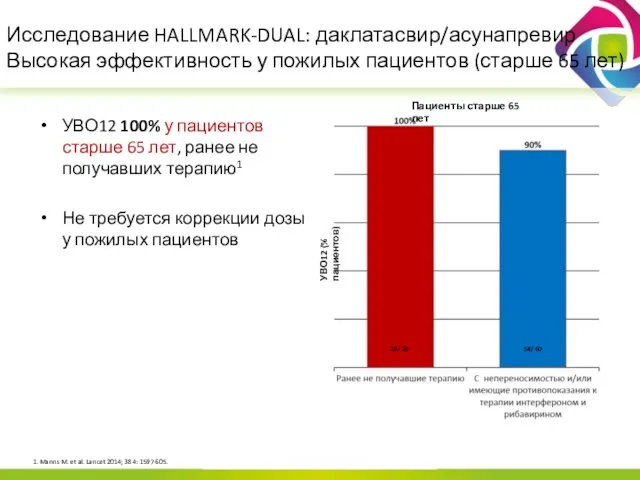
- 19. Исследование HALLMARK-DUAL: даклатасвир/асунапревир Высокая эффективность у пожилых пациентов (старше 65 лет) УВО12 100% у пациентов старше
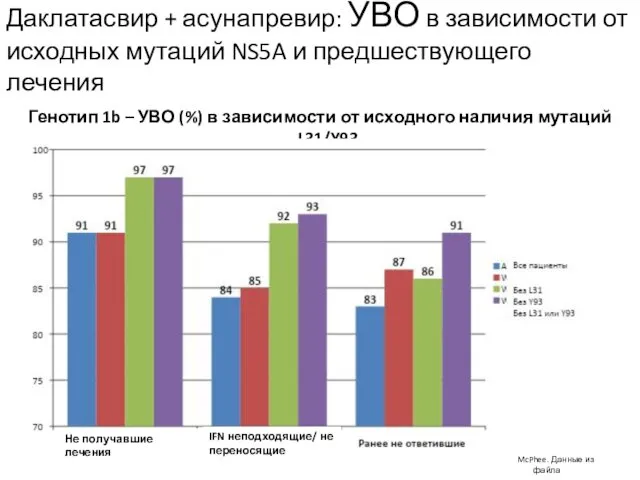
- 20. Даклатасвир + асунапревир: УВО в зависимости от исходных мутаций NS5A и предшествующего лечения McPhee. Данные из
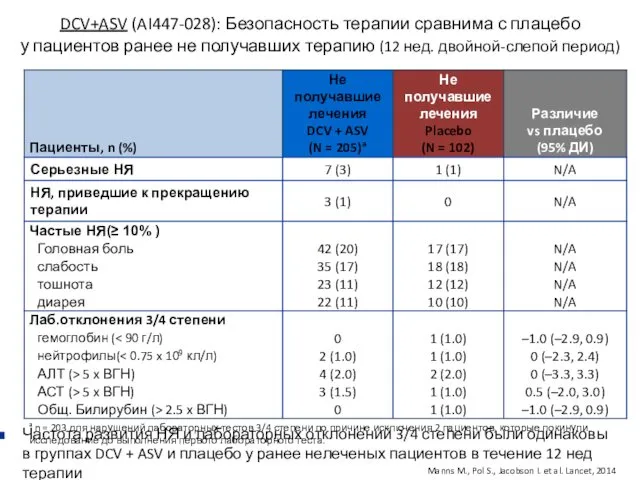
- 21. DCV+ASV (AI447-028): Безопасность терапии сравнима с плацебо у пациентов ранее не получавших терапию (12 нед. двойной-слепой
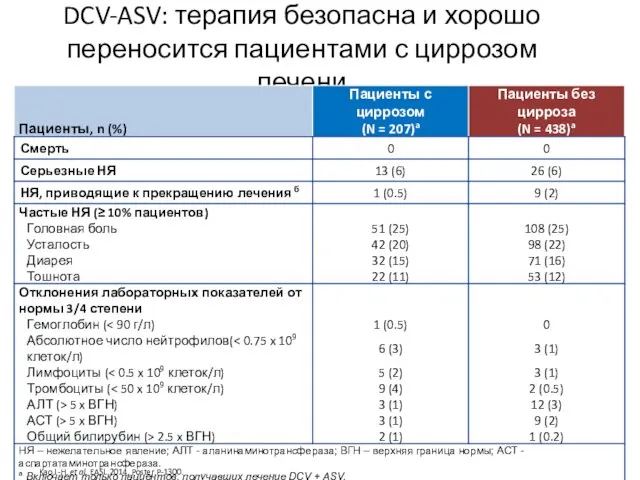
- 22. DCV-ASV: терапия безопасна и хорошо переносится пациентами с циррозом печени Kao J-H, et al. EASL 2014,
- 23. Терапия Даклатасвир+Асунапревир у «тяжелых» категорий пациентов Пациенты с циррозом печени, имеющие непереносимость, или противопоказания к терапии
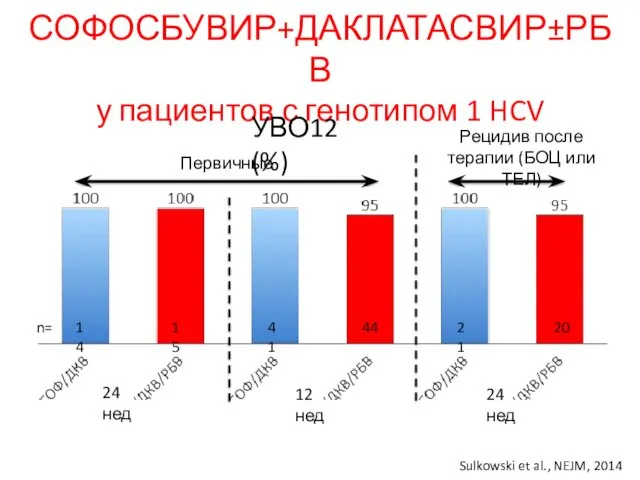
- 24. СОФОСБУВИР+ДАКЛАТАСВИР±РБВ у пациентов с генотипом 1 HCV Первичные Рецидив после терапии (БОЦ или ТЕЛ) 24 нед
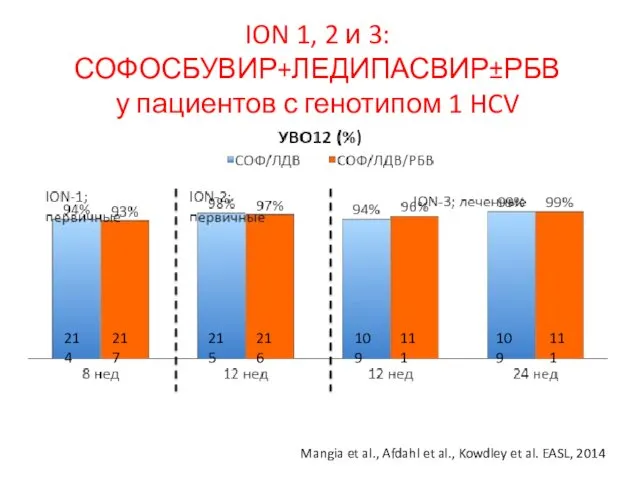
- 25. ION 1, 2 и 3: СОФОСБУВИР+ЛЕДИПАСВИР±РБВ у пациентов с генотипом 1 HCV 214 217 215 216
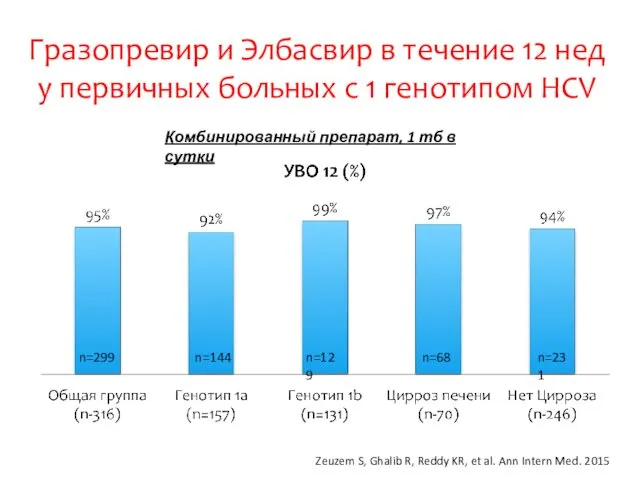
- 26. Гразопревир и Элбасвир в течение 12 нед у первичных больных с 1 генотипом HCV Zeuzem S,
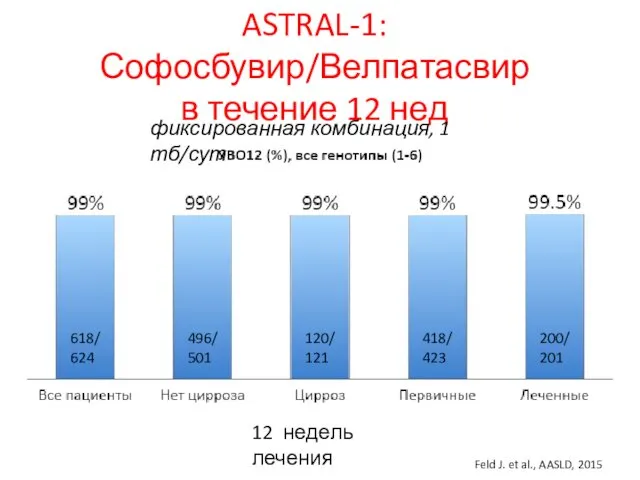
- 27. ASTRAL-1: Софосбувир/Велпатасвир в течение 12 нед 12 недель лечения Feld J. et al., AASLD, 2015 618/624
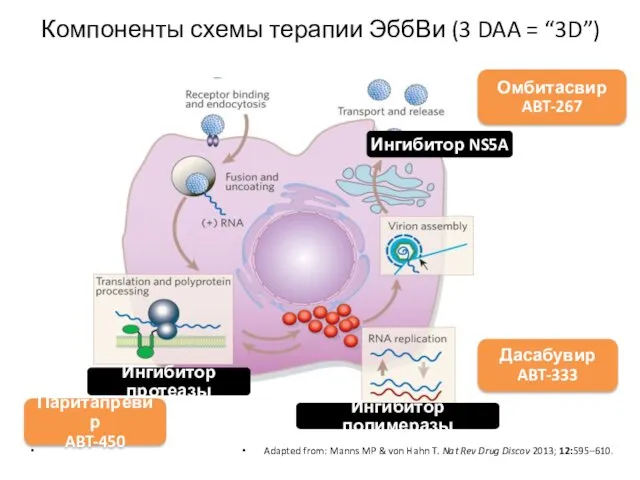
- 28. Компоненты схемы терапии ЭббВи (3 DAA = “3D”) Adapted from: Manns MP & von Hahn T.
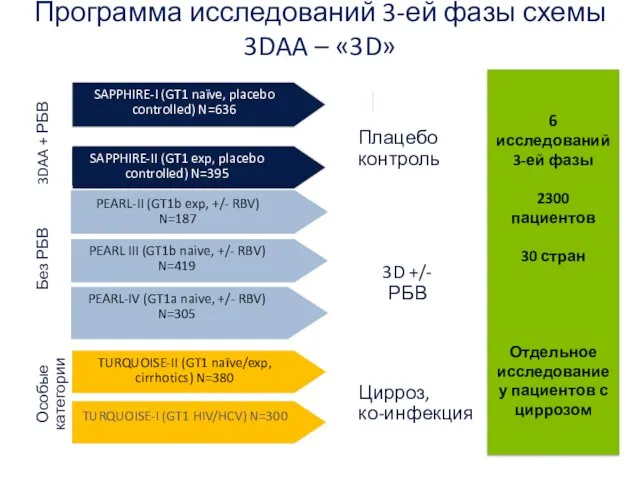
- 29. Программа исследований 3-ей фазы схемы 3DAA – «3D» PEARL-IV (GT1a naive, +/- RBV) N=305 PEARL III
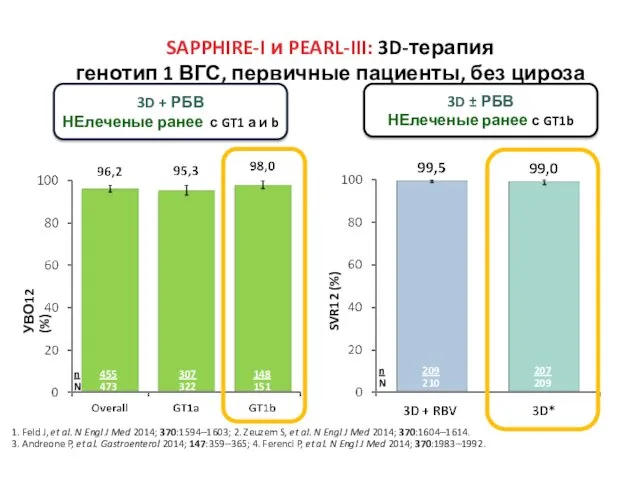
- 30. SAPPHIRE-I и PEARL-III: 3D-терапия генотип 1 ВГС, первичные пациенты, без цироза 3D + РБВ НЕлеченые ранее
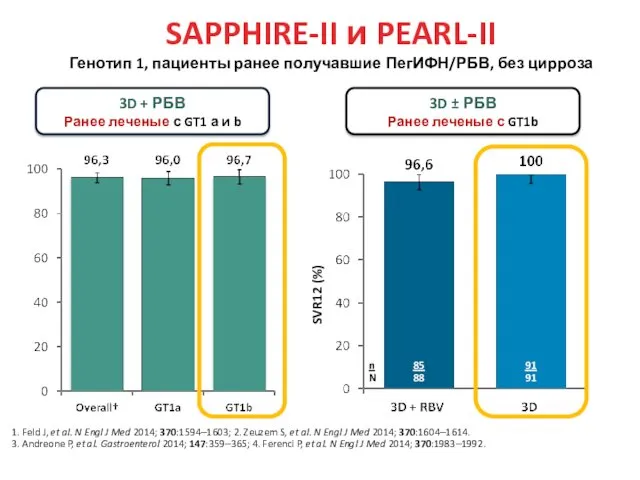
- 31. SAPPHIRE-II и PEARL-II Генотип 1, пациенты ранее получавшие ПегИФН/РБВ, без цирроза 3D + РБВ Ранее леченые
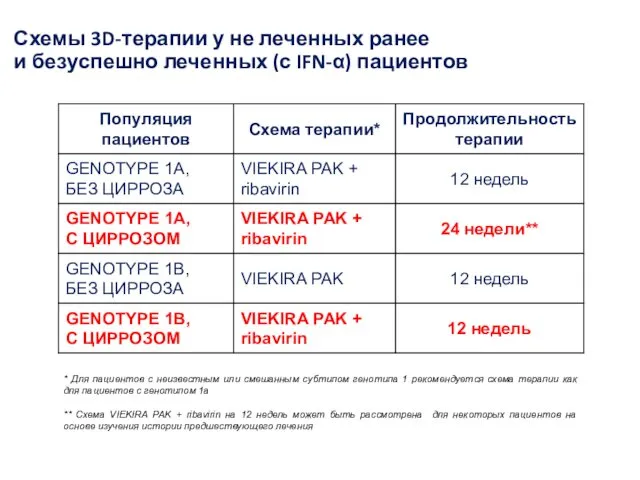
- 32. * Для пациентов с неизвестным или смешанным субтипом генотипа 1 рекомендуется схема терапии как для пациентов
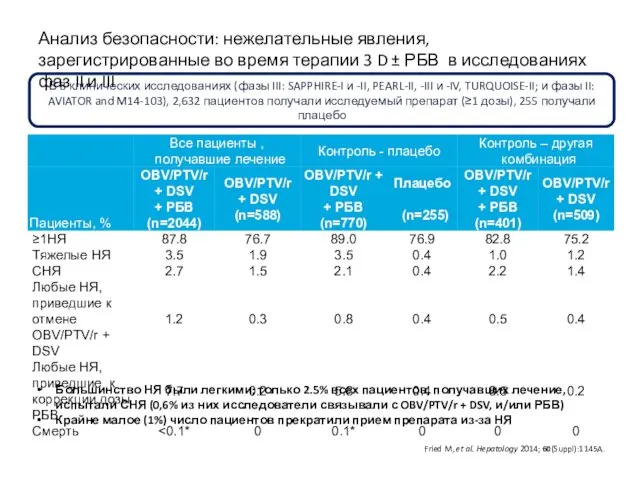
- 33. Анализ безопасности: нежелательные явления, зарегистрированные во время терапии 3 D ± РБВ в исследованиях фаз II
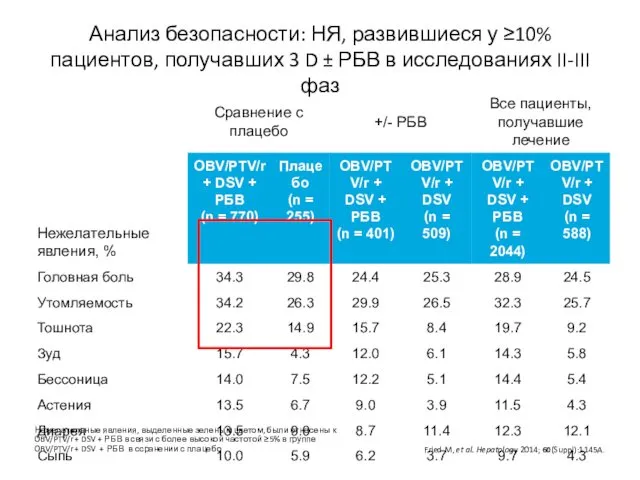
- 34. Анализ безопасности: НЯ, развившиеся у ≥10% пациентов, получавших 3 D ± РБВ в исследованиях II-III фаз
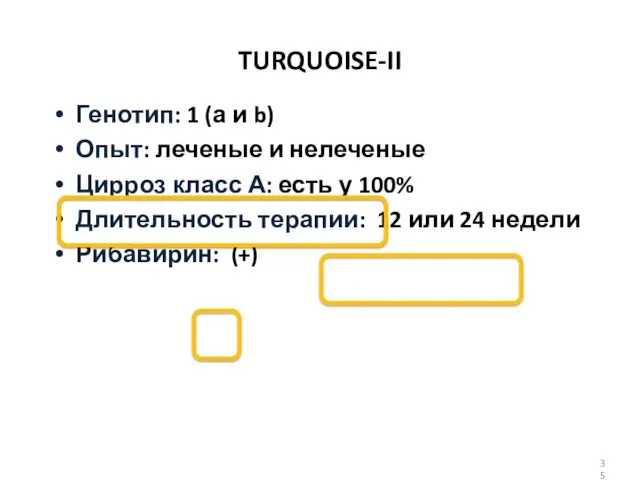
- 35. TURQUOISE-II Генотип: 1 (а и b) Опыт: леченые и нелеченые Цирроз класс А: есть у 100%
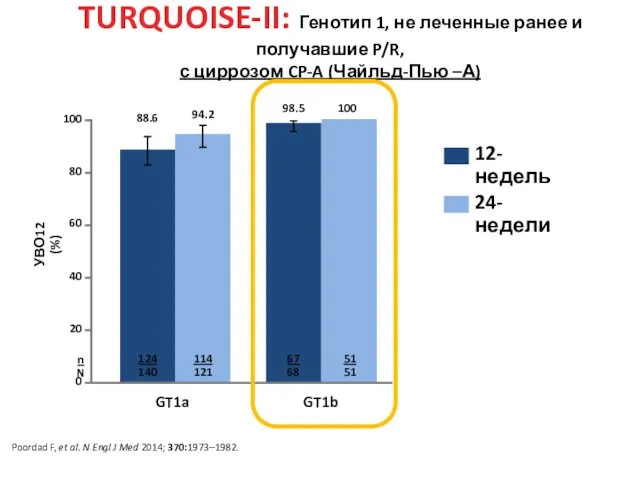
- 36. GT1a GT1b TURQUOISE-II: Генотип 1, не леченные ранее и получавшие P/R, с циррозом CP-A (Чайльд-Пью –А)
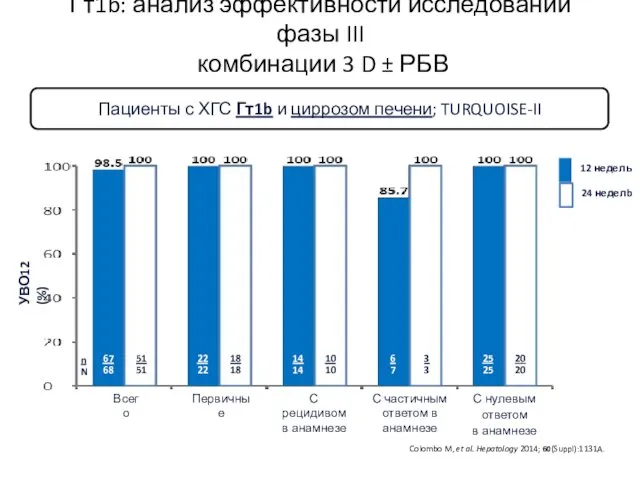
- 37. Гт1b: анализ эффективности исследований фазы III комбинации 3 D ± РБВ Colombo M, et al. Hepatology
- 38. * Для пациентов с неизвестным или смешанным субтипом генотипа 1 рекомендуется схема терапии как для пациентов
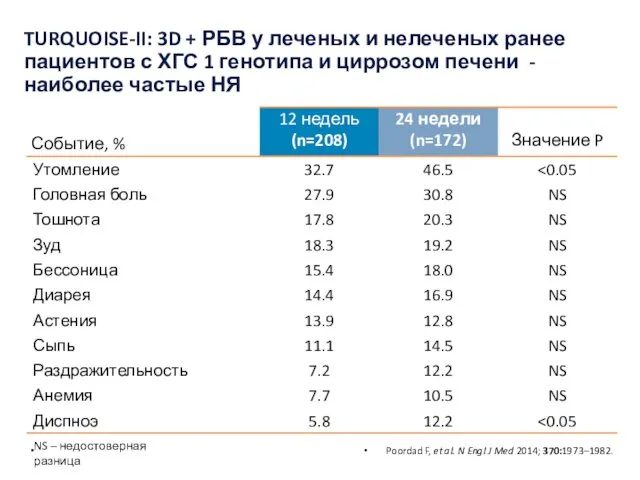
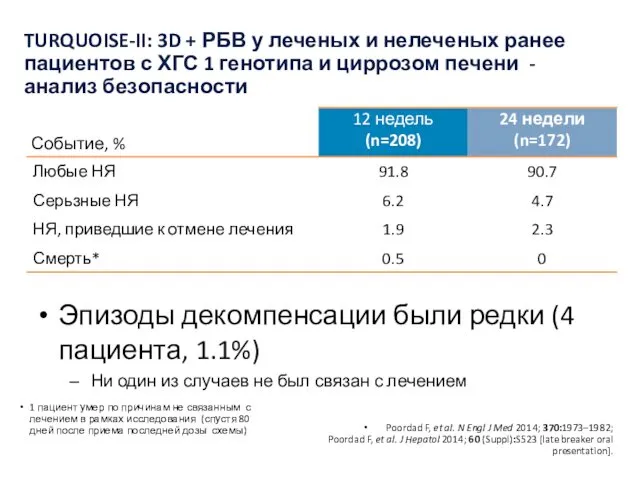
- 39. Poordad F, et al. N Engl J Med 2014; 370:1973–1982. TURQUOISE-II: 3D + РБВ у леченых
- 40. Эпизоды декомпенсации были редки (4 пациента, 1.1%) Ни один из случаев не был связан с лечением
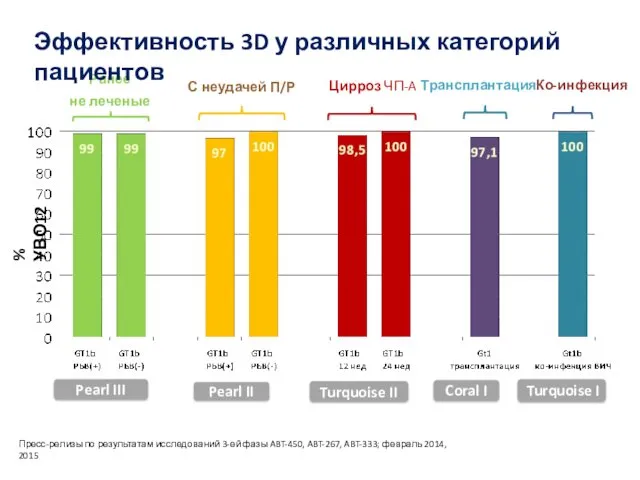
- 41. % УВО12 Ранее не леченые С неудачей П/Р Цирроз ЧП-A Пресс-релизы по результатам исследований 3-ей фазы
- 43. Скачать презентацию





 vyezdnaya_prezentatsia_AP
vyezdnaya_prezentatsia_AP Письмо
Письмо Фонетика
Фонетика Подорож містом Львів
Подорож містом Львів Презентация к внеклассному мероприятию Что значит быть хорошим сыном или дочерью.
Презентация к внеклассному мероприятию Что значит быть хорошим сыном или дочерью. Ассирийская держава
Ассирийская держава Хочу всё знать. Интеллектуальная игра для дошкольников
Хочу всё знать. Интеллектуальная игра для дошкольников Удельная теплота плавления
Удельная теплота плавления Выбор индивида. Основы теории потребления
Выбор индивида. Основы теории потребления Социокультурный потенциал развития учреждения дополнительного образования
Социокультурный потенциал развития учреждения дополнительного образования Арматурные изделия
Арматурные изделия Роль родителей в воспитании детей
Роль родителей в воспитании детей Физиология послеродового периода. Лактация. Грудное вскармливание. Контрацепция
Физиология послеродового периода. Лактация. Грудное вскармливание. Контрацепция Утилизация мусора
Утилизация мусора Педагогическая академия последипломного образования
Педагогическая академия последипломного образования Внедрение инновационных проектов – это реально (ТПП РФ)
Внедрение инновационных проектов – это реально (ТПП РФ) Презентация по теме Самый, самый ....
Презентация по теме Самый, самый .... Развитие зрительного восприятия
Развитие зрительного восприятия Клеточные и гуморальные механизмы иммунного ответа
Клеточные и гуморальные механизмы иммунного ответа Маркетинговые исследования
Маркетинговые исследования Прямая и обратная пропорциональные зависимости
Прямая и обратная пропорциональные зависимости Как происходило объединение Франции
Как происходило объединение Франции Компьютерные вирусы и антивирусные программы Типы компьютерных вирусов
Компьютерные вирусы и антивирусные программы Типы компьютерных вирусов Презентация Рождество
Презентация Рождество Особенности речевого развития у детей с перинатальным поражением ЦНС
Особенности речевого развития у детей с перинатальным поражением ЦНС Определение и понятия биографического метода
Определение и понятия биографического метода Энергетика – тарихи, әлеуметтік және экологиялык аспектілері. Казахстан республика энергетикасынын замануй тенденциялары
Энергетика – тарихи, әлеуметтік және экологиялык аспектілері. Казахстан республика энергетикасынын замануй тенденциялары Дидактическая игра Кто, где живет?
Дидактическая игра Кто, где живет?