Содержание
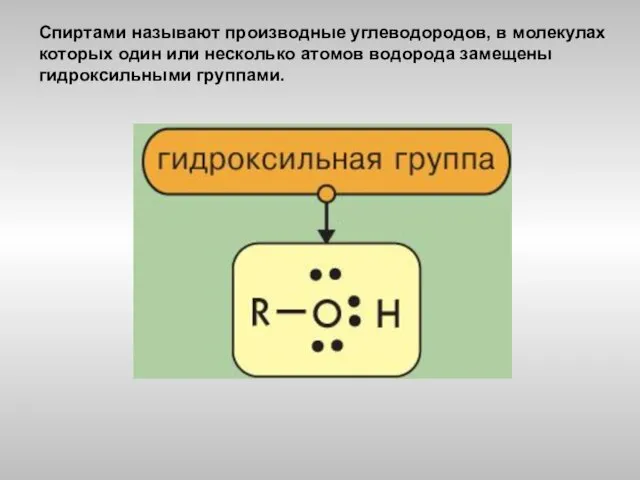
- 2. Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами.
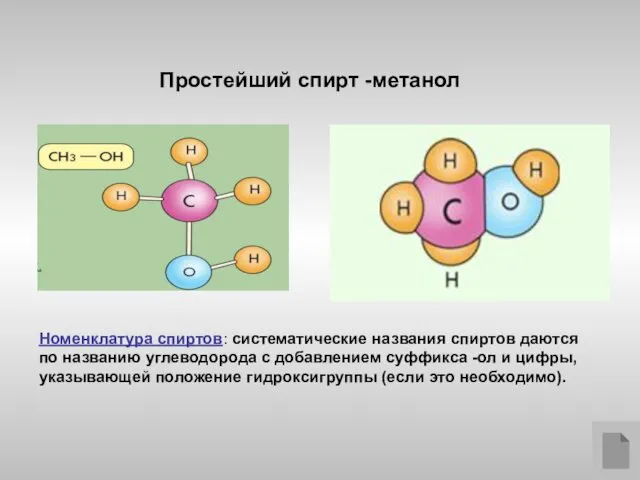
- 3. Простейший спирт -метанол Номенклатура спиртов: систематические названия спиртов даются по названию углеводорода с добавлением суффикса -ол
- 4. Классификация спиртов 1. По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа -ОН) и многоатомные
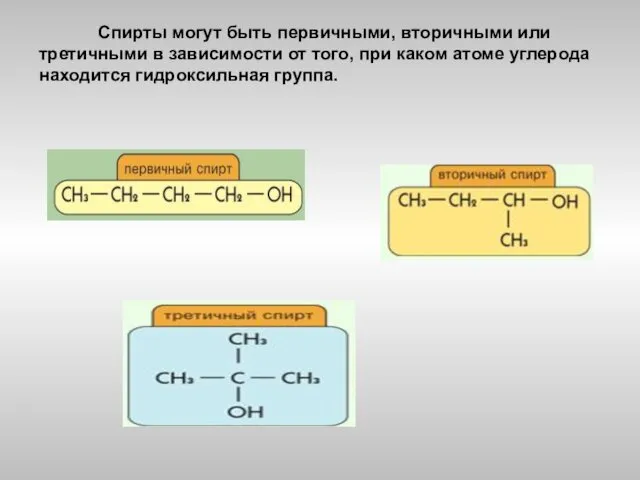
- 5. Спирты могут быть первичными, вторичными или третичными в зависимости от того, при каком атоме углерода находится
- 6. Изомерия изомерия положения ОН - группы, (начиная с С3) ; углеродного скелета, (начиная с С4 );
- 7. Физические свойства Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность
- 8. Одноатомные спирты Многоатомные спирты
- 9. Реакции замещения водорода функциональной группы Реакции замещения функциональной группы Реакции элиминирования Реакции окисления Реакции этерификации Химические
- 10. Реакции замещения Одноатомные спирты реагируют с активными металлами (Na, K, Mg, Al и др), образуя соли
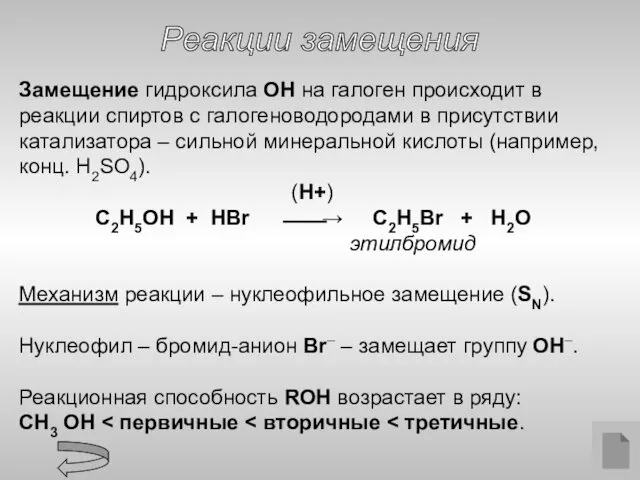
- 11. Реакции замещения Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора
- 12. Реакции дегидратации Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при нагревании
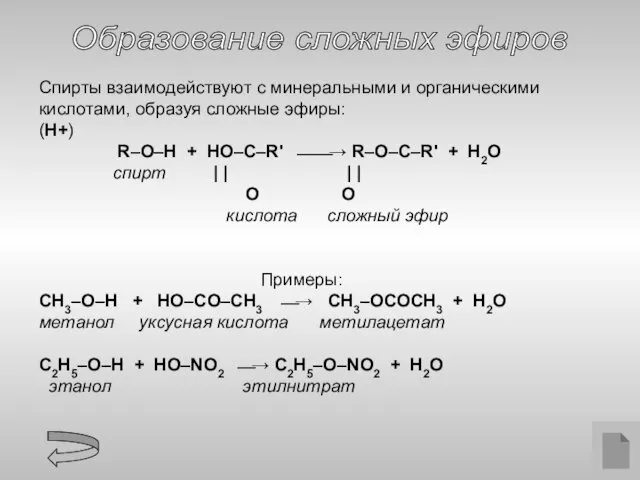
- 13. Образование сложных эфиров Спирты взаимодействуют с минеральными и органическими кислотами, образуя сложные эфиры: (H+) R–O–H +
- 14. Реакции окисления При действии окислителей (KMnO4, K2Cr2O7+H2SO4, O2+катализатор) группа >СH–О–Н превращается в карбонильную группу >С=О, а
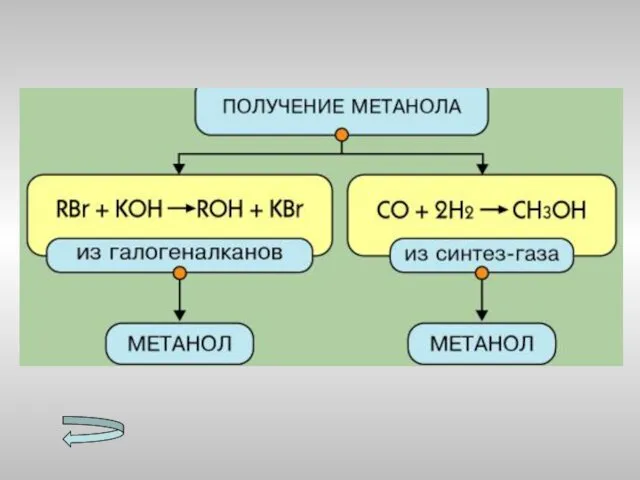
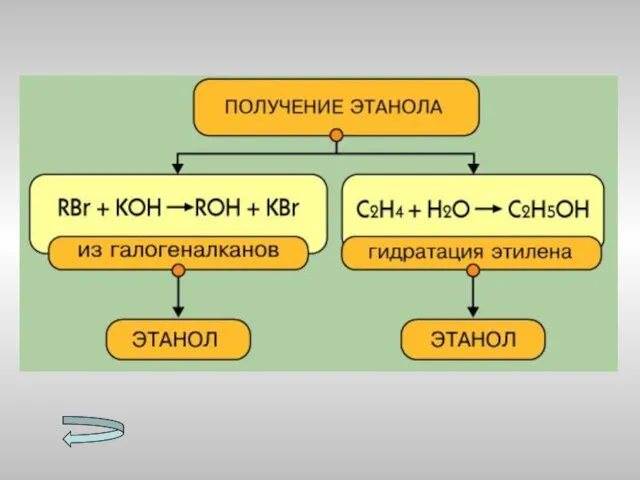
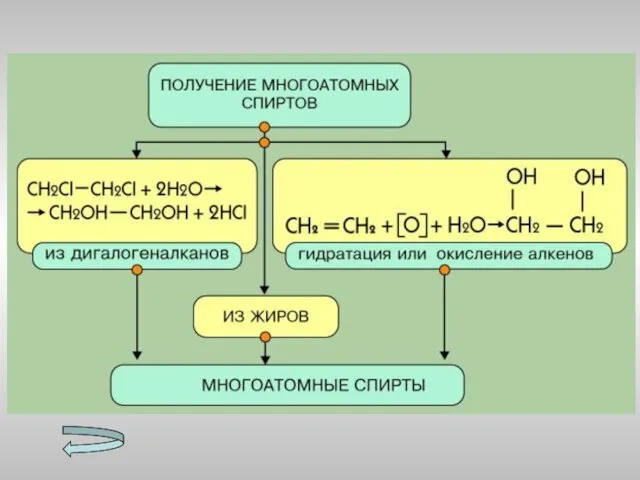
- 15. Получение спиртов Метанола Этанола Многоатомных спиртов
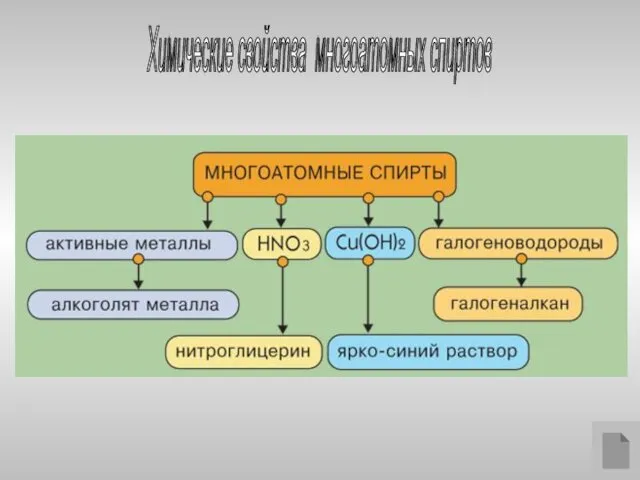
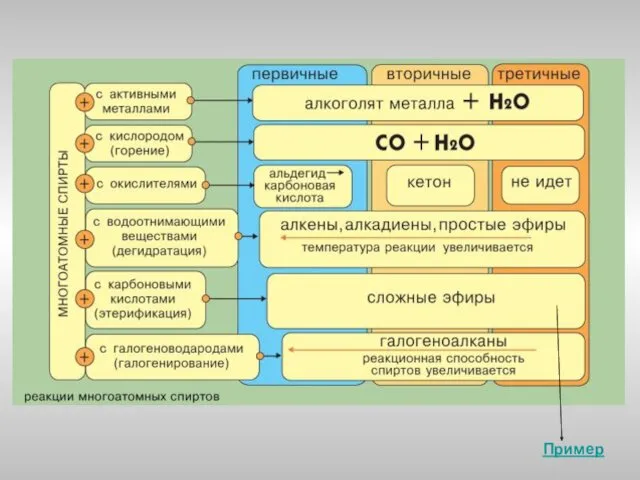
- 19. Химические свойства многоатомных спиртов
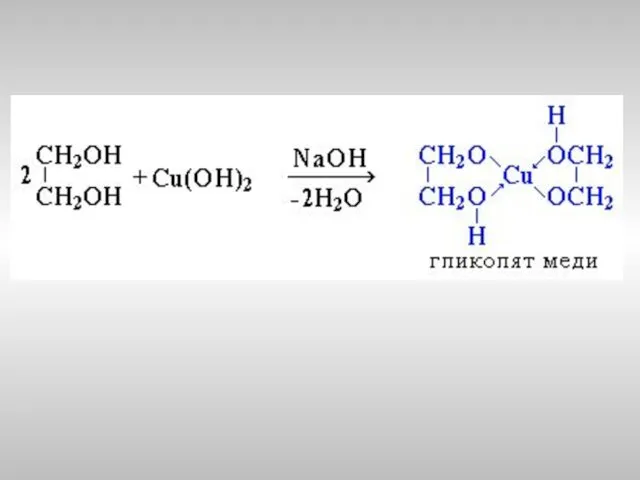
- 20. Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов
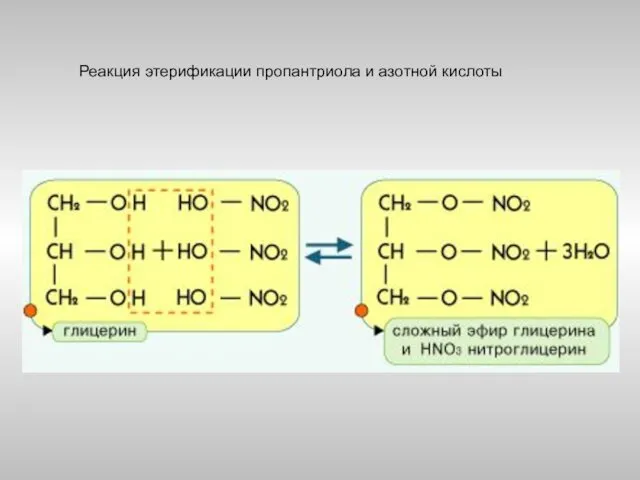
- 22. Пример
- 23. Реакция этерификации пропантриола и азотной кислоты
- 24. Применение спиртов Метанол CH3OH -производство формальдегида, муравьиной кислоты; - растворитель. Этанол С2Н5ОН (этиловый спирт) - производство
- 25. Применение спиртов Этиленгликоль HOCH2-CH2OH - производство пластмасс; - компонент антифризов; - сырье в органическом синтезе. Глицерин
- 26. Вопросы для контроля ТЕСТ Какие вещества относят к спиртам? На какие группы классифицируют спирты? Назовите виды
- 28. Скачать презентацию













 Правила технической эксплуатации железных дорог Российской Федерации
Правила технической эксплуатации железных дорог Российской Федерации Декупаж
Декупаж Классификация средств измерений
Классификация средств измерений Ценообразование. Предмет, метод и задачи курса
Ценообразование. Предмет, метод и задачи курса Мониторинг и оценка эффективности наставничества участниками проекта Формула жизни
Мониторинг и оценка эффективности наставничества участниками проекта Формула жизни Дерево целей и систем автомобильного транспорта и технической эксплуатации. Понятие о дереве целей. Тема 4
Дерево целей и систем автомобильного транспорта и технической эксплуатации. Понятие о дереве целей. Тема 4 Конструирование одежды
Конструирование одежды Гиганты прошлого
Гиганты прошлого Основная ткань
Основная ткань Теории и технологии обучения
Теории и технологии обучения Правила технической эксплуатации железных дорог Российской Федерации, часть 2
Правила технической эксплуатации железных дорог Российской Федерации, часть 2 Сказочный домик
Сказочный домик Календарные Христианские праздники
Календарные Христианские праздники Презентация к программе внеурочной деятельности Бурейские родники
Презентация к программе внеурочной деятельности Бурейские родники 63715
63715 Сущность, формы и условия развития внешнеэкономических связей (ВЭД)
Сущность, формы и условия развития внешнеэкономических связей (ВЭД) Детские игры - школа здоровья
Детские игры - школа здоровья Реконструкция подстанции 110/10 кВ с разработкой релейной защиты силового трансформатора
Реконструкция подстанции 110/10 кВ с разработкой релейной защиты силового трансформатора Анализ эффективности работы эксплуатационного фонда столбового месторождения
Анализ эффективности работы эксплуатационного фонда столбового месторождения Презентация Дети блокадного Ленинграда
Презентация Дети блокадного Ленинграда Средняя общеобразовательная школа на 450 ученических мест в г. Краснослободске
Средняя общеобразовательная школа на 450 ученических мест в г. Краснослободске Физика поверхностных явлений. Свойства растворов
Физика поверхностных явлений. Свойства растворов Рождественский венок
Рождественский венок Презентация Использование технологии дидактического синквейна в работе со старшими дошкольниками с ОНР
Презентация Использование технологии дидактического синквейна в работе со старшими дошкольниками с ОНР Нормативно-правовые акты, регулирующие материальную и нематериальную мотивацию государственных гражданских служащих России
Нормативно-правовые акты, регулирующие материальную и нематериальную мотивацию государственных гражданских служащих России Погода - условия обитания человека.
Погода - условия обитания человека. Использование информационных технологий
Использование информационных технологий Слайд-презентация проекта Детский сад наш хорош, лучше сада не найдешь!
Слайд-презентация проекта Детский сад наш хорош, лучше сада не найдешь!