Содержание
- 2. Эргодическая гипотеза: среднее по ансамблю равно среднему по времени. Рассмотрим систему, состоящую из n тел, движущихся
- 3. Распределение молекул по скоростям. (Распределение Максвелла) функция распределения – доля молекул, приходящаяся на единичный интервал скоростей
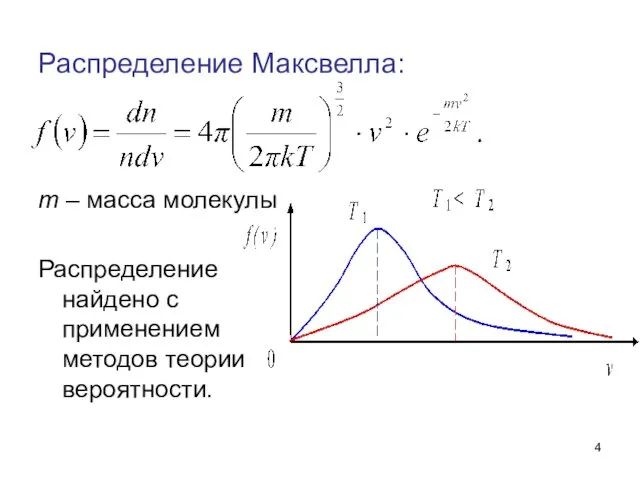
- 4. Распределение Максвелла: m – масса молекулы Распределение найдено с применением методов теории вероятности.
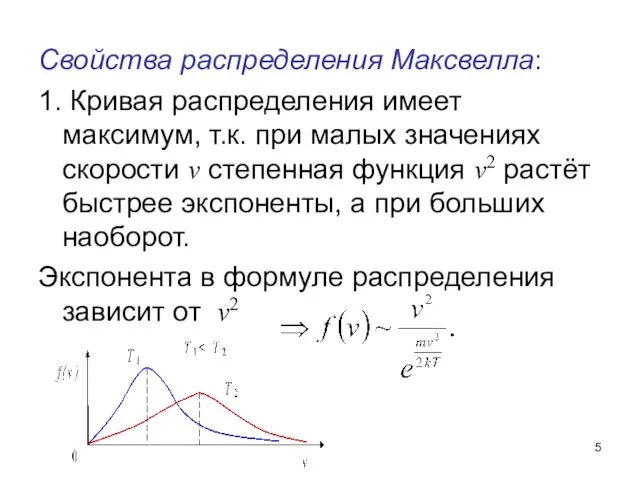
- 5. Свойства распределения Максвелла: 1. Кривая распределения имеет максимум, т.к. при малых значениях скорости v степенная функция
- 6. Свойства распределения Максвелла: 2. При увеличении температуры Т максимум распределения смещается в сторону более высоких скоростей
- 7. Свойства распределения Максвелла: 3. Доля молекул, приходящихся на единичный интервал скоростей вблизи v = 0 и
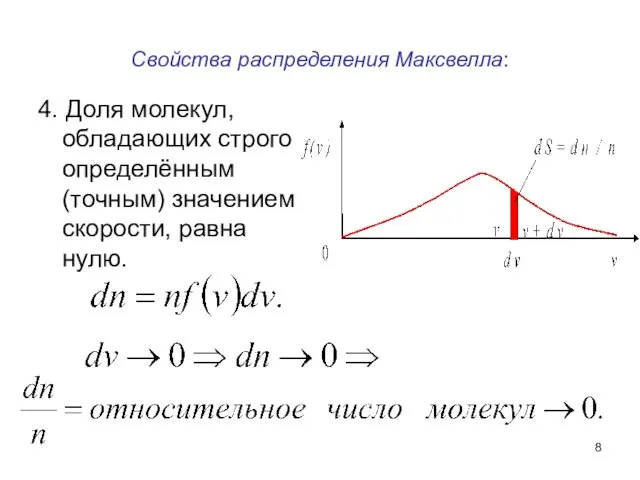
- 8. Свойства распределения Максвелла: 4. Доля молекул, обладающих строго определённым (точным) значением скорости, равна нулю.
- 9. Свойства распределения Максвелла: 5. Распределение Максвелла по скоростям справедливо для молекул не только идеального газа, но
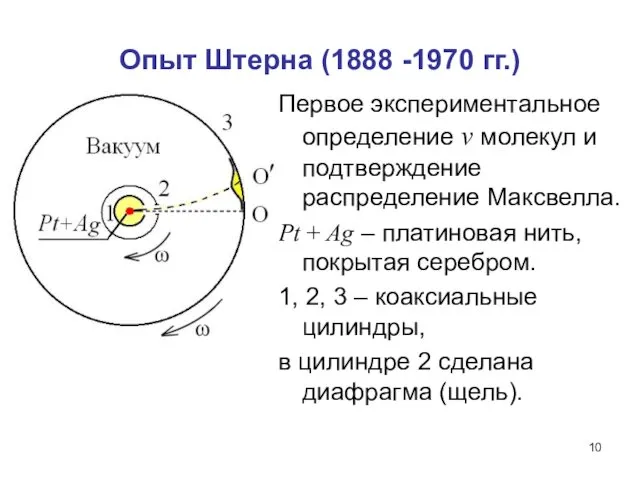
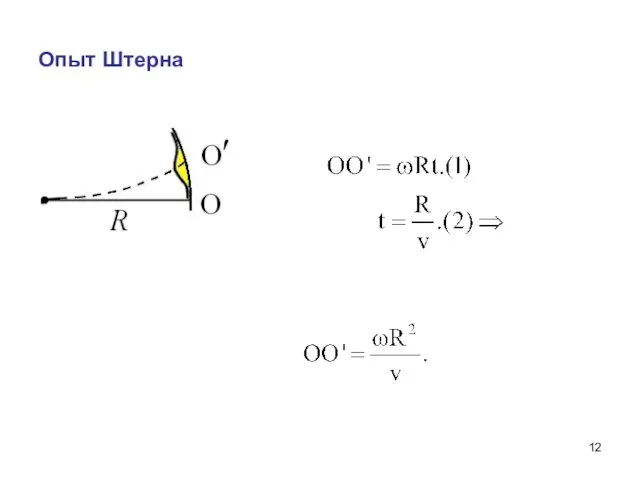
- 10. Опыт Штерна (1888 -1970 гг.) Первое экспериментальное определение v молекул и подтверждение распределение Максвелла. Pt +
- 11. Опыт Штерна Платиновая нить нагревается током до t ~ 12350 C, при этом атомы серебра испаряются
- 12. Опыт Штерна
- 13. Скорости газовых молекул Средняя скорость (средняя арифметическая скорость). в интервале от v до v + dv.
- 14. Скорости газовых молекул Средняя скорость:
- 15. Скорости газовых молекул 2. Средняя квадратичная скорость.
- 17. Средняя квадратичная скорость.
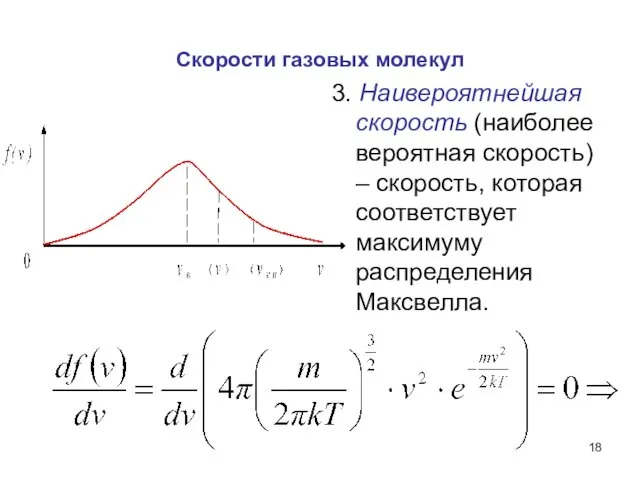
- 18. Скорости газовых молекул 3. Наивероятнейшая скорость (наиболее вероятная скорость) – скорость, которая соответствует максимуму распределения Максвелла.
- 19. 3. Наивероятнейшая скорость
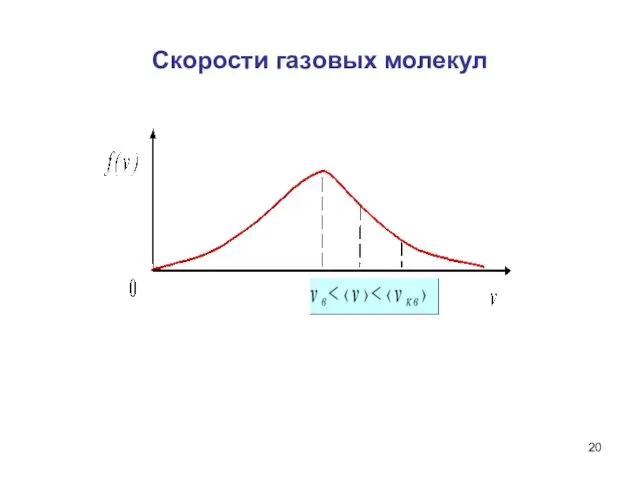
- 20. Скорости газовых молекул
- 21. Распределение молекул по импульсам и кинетическим энергиям
- 22. Распределение молекул по импульсам и кинетическим энергиям Делаем замену переменных:
- 24. Распределение молекул по импульсам и кинетическим энергиям
- 26. Распределение молекул по потенциальным энергиям (Распределение Больцмана)
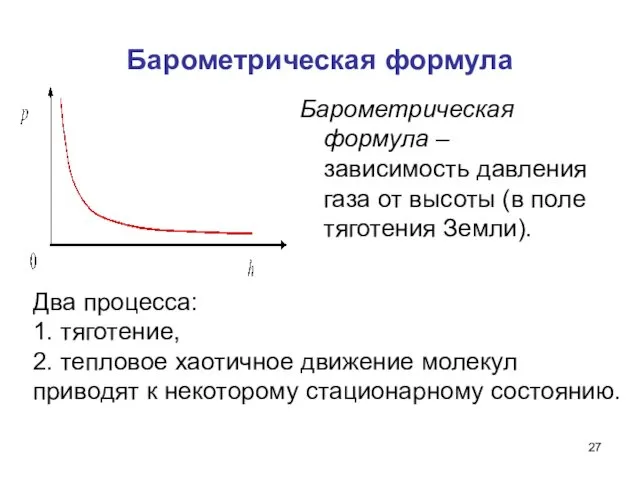
- 27. Барометрическая формула Барометрическая формула – зависимость давления газа от высоты (в поле тяготения Земли). Два процесса:
- 28. Барометрическая формула Предположим: 1) идеальный газ, m = const, 2) поле тяготения однородно, g = const,
- 29. Барометрическая формула Знак «–» отражает то, что с увеличением h давление p падает.
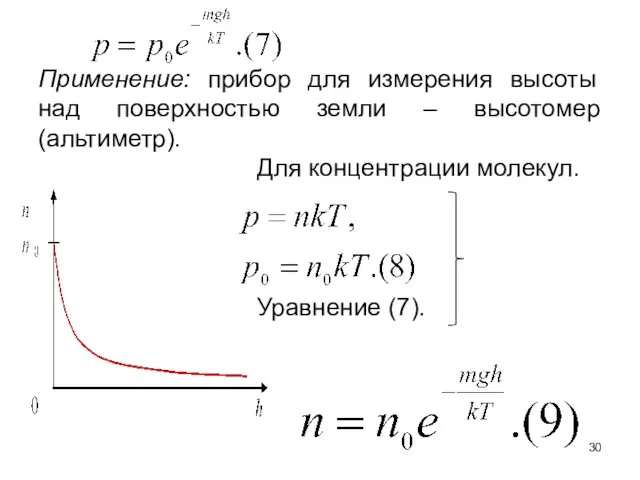
- 30. Применение: прибор для измерения высоты над поверхностью земли – высотомер (альтиметр). Для концентрации молекул. Уравнение (7).
- 31. Распределение молекул по потенциальным энергиям (Распределение Больцмана) потенциальная энергия в поле тяготения. распределение Больцмана. Больцман показал,
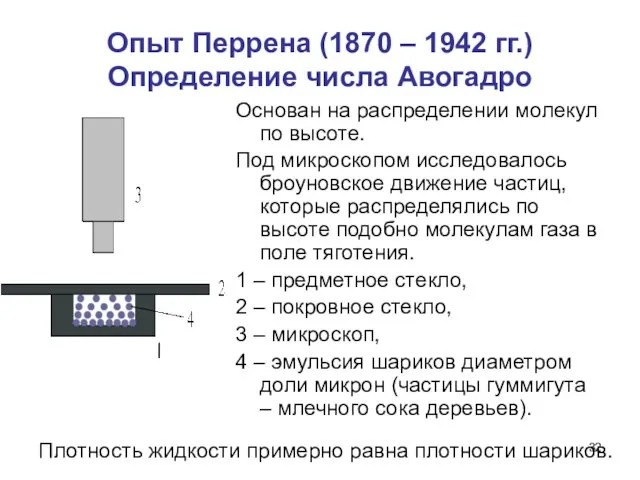
- 32. Опыт Перрена (1870 – 1942 гг.) Определение числа Авогадро Основан на распределении молекул по высоте. Под
- 33. Опыт Перрена m – масса шарика, mж – масса объёма жидкости, вытесненной шариком.
- 34. Опыт Перрена. Определение числа Авогадро Получил Точное значение:
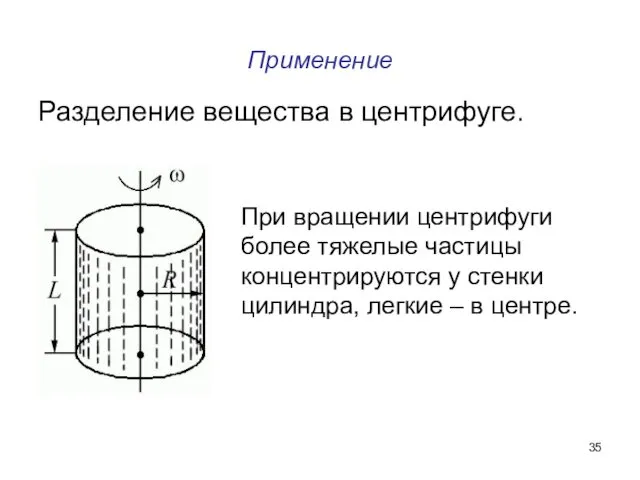
- 35. Применение Разделение вещества в центрифуге. При вращении центрифуги более тяжелые частицы концентрируются у стенки цилиндра, легкие
- 36. Закон равномерного распределения энергии по степеням свободы Степени свободы – число независимых координат, определяющих положение и
- 37. 1. Одноатомный газ имеет три степени свободы, т.к. может двигаться в 3-х направлениях. Следовательно, обладает 3
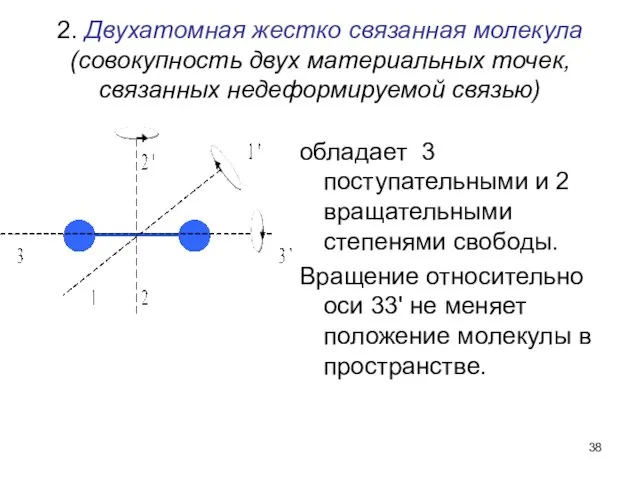
- 38. 2. Двухатомная жестко связанная молекула (совокупность двух материальных точек, связанных недеформируемой связью) обладает 3 поступательными и
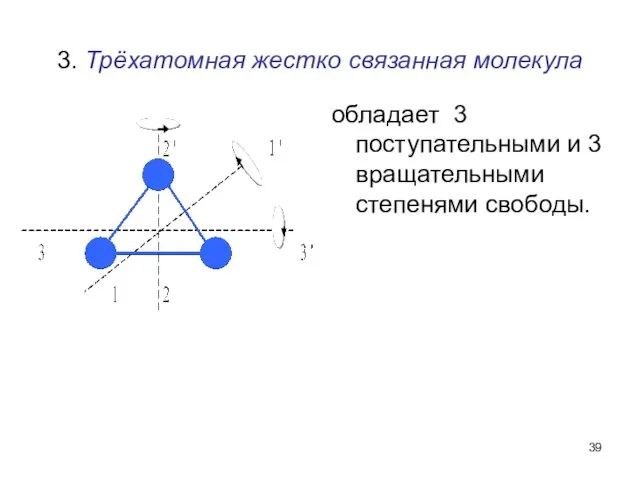
- 39. 3. Трёхатомная жестко связанная молекула обладает 3 поступательными и 3 вращательными степенями свободы.
- 40. Закон равномерного распределения энергии по степеням свободы (закон Больцмана): если система частиц находится в состоянии термодинамического
- 41. На колебательную степень свободы приходится не только кинетическая энергия, но и потенциальная, причём среднее значение кинетической
- 43. Скачать презентацию









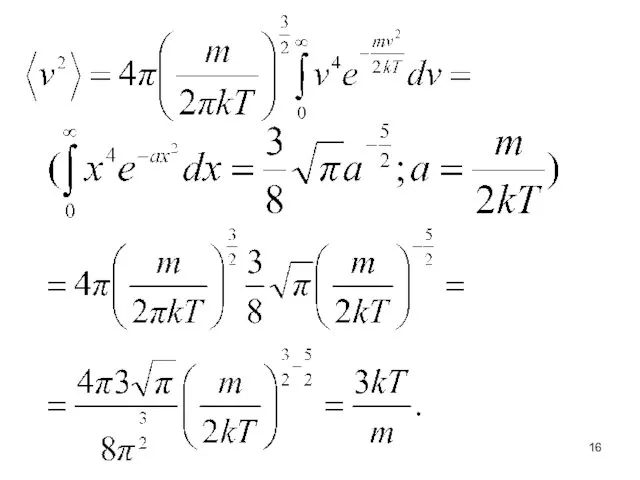






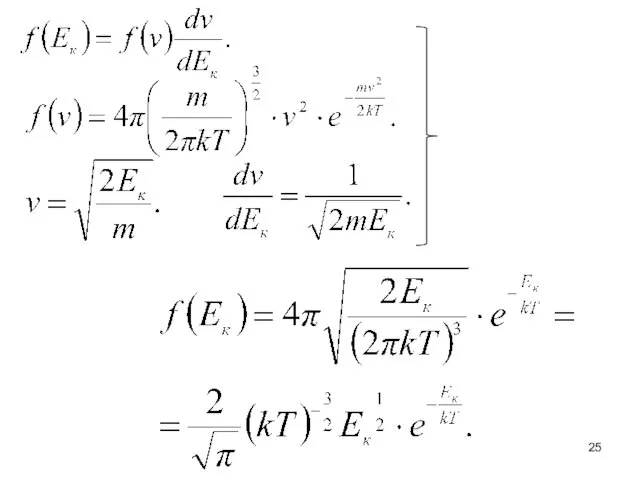










 Минем уңышлырым
Минем уңышлырым Пневмония. Атипичные пневмонии
Пневмония. Атипичные пневмонии Презентация к вводному занятию Волшебная страна бисера.
Презентация к вводному занятию Волшебная страна бисера. АКТ мен тұрақты дамудың мыңжылдық. Декларациясындағы мақсаттарға жету арасындағы байланыс
АКТ мен тұрақты дамудың мыңжылдық. Декларациясындағы мақсаттарға жету арасындағы байланыс Вентиляция. Организация воздухообмена в зданиях
Вентиляция. Организация воздухообмена в зданиях Марина Ивановна Цветаева 1892-1941
Марина Ивановна Цветаева 1892-1941 Зимние забавы на прогулке
Зимние забавы на прогулке Ауыз қуысының анатомиясы және физиологиясы. Ауыз қуысының кілегейлі қабығының құрамы және қызметтері. Сілікей
Ауыз қуысының анатомиясы және физиологиясы. Ауыз қуысының кілегейлі қабығының құрамы және қызметтері. Сілікей Основные определения, топологические параметры и методы расчета электрических цепей
Основные определения, топологические параметры и методы расчета электрических цепей ООО Городецкий судоремонтный завод
ООО Городецкий судоремонтный завод Правописание приставок ПРЕ- и ПРИ-
Правописание приставок ПРЕ- и ПРИ- Иван-дурак в волшебных сказках
Иван-дурак в волшебных сказках Экономические ресурсы и международное разделения труда
Экономические ресурсы и международное разделения труда Наречие как часть речи. Правописание наречий
Наречие как часть речи. Правописание наречий Онтогенез общения от 0 до 7 лет
Онтогенез общения от 0 до 7 лет The Presentation of Jesus Christ in the Temple
The Presentation of Jesus Christ in the Temple Психічний розвиток дитини від народження до вступу у школу
Психічний розвиток дитини від народження до вступу у школу Расчет суточной нормы кормления и обоснование цены
Расчет суточной нормы кормления и обоснование цены Функциональная организация фон-неймановской ВМ
Функциональная организация фон-неймановской ВМ Сүзгілер
Сүзгілер ПДД Причины несчастных случае на дорогах
ПДД Причины несчастных случае на дорогах Человек в системе экономических отношений
Человек в системе экономических отношений Как люди считали в старину и как писали цифры
Как люди считали в старину и как писали цифры Superheroes. Comparisons
Superheroes. Comparisons Общественный сектор современной России, масштабы и возможности
Общественный сектор современной России, масштабы и возможности презентация Наркотики-дорога в никуда
презентация Наркотики-дорога в никуда Сопротивление в цепи переменного тока
Сопротивление в цепи переменного тока В мире живой природы
В мире живой природы