Содержание
- 3. В конце XIX и начале XX веков появились экспериментальные доказательства сложной структуры атома: фотоэффект катодные лучи
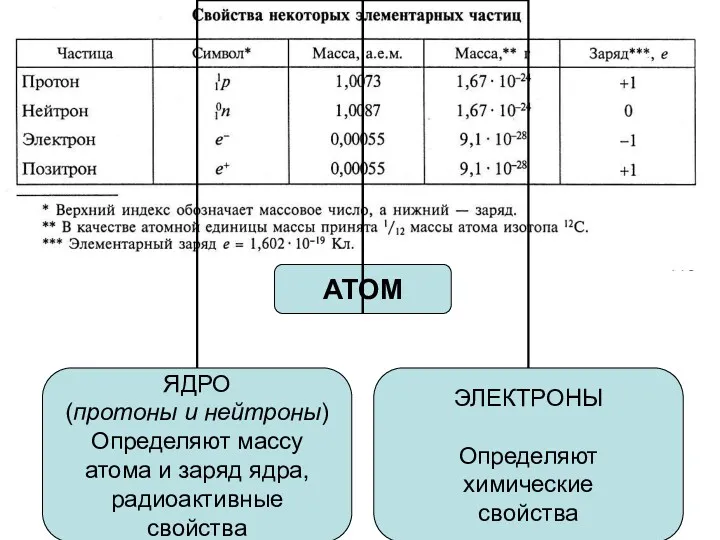
- 4. Итак, установлено, что атомы состоят из отрицательно и положительно заряженных частиц, сильно взаимодействующих между собой. Возник
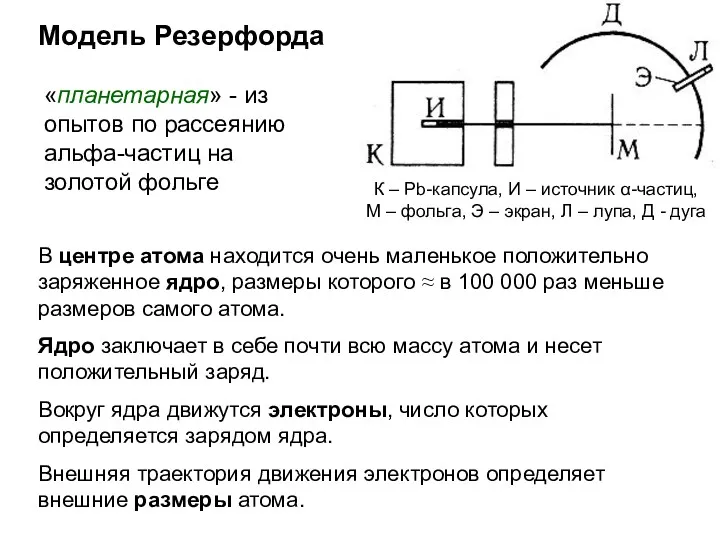
- 5. Модель Резерфорда В центре атома находится очень маленькое положительно заряженное ядро, размеры которого ≈ в 100
- 6. Опыты Резерфорда не только выявили существование атомного ядра, но и позволили определить его заряд. Порядковый номер
- 7. Линейчатый спектр атома водорода в видимой и близкой УФ-области спектра (серия Бальмера). (ν - частота, λ
- 8. где n1 и n2 - целые числа; R - постоянная Ридберга. При n1 = 1 и
- 9. линейчатый спектр испускания атомов водорода объединение линий спектра в серии почему притяжение между электроном и ядром
- 10. Наличие линейчатых спектров испускания и поглощения атомов и молекул указывают на то, что энергия испускается и
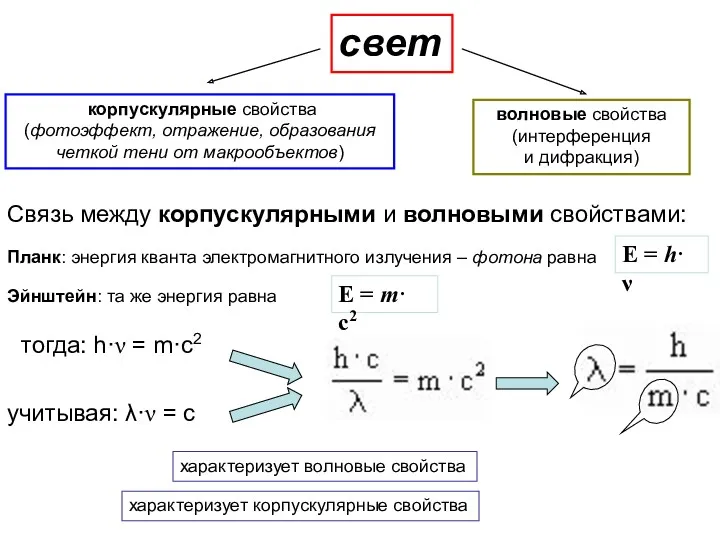
- 11. свет корпускулярные свойства (фотоэффект, отражение, образования четкой тени от макрообъектов) волновые свойства (интерференция и дифракция) Планк:
- 12. Оставаясь на позициях планетарной модели, и учитывая квантовую теорию света, Бор постулировал: В атоме, который не
- 13. Однако она имела и серьезные недостатки: Количественные расчеты многоэлектронных атомов оказались чрезвычайно сложными и практически не
- 14. Луи де Бройль (1924 г.): распространил двойственность природы света - на вещество (поток любых материальных частиц
- 16. Правильное описание движения электрона в атоме должно учитывать его двойственный характер. классическая механика Ньютона квантовая механика
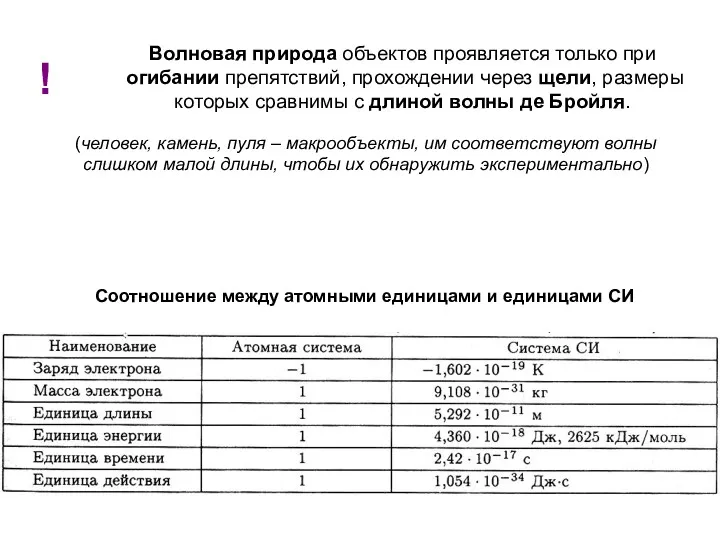
- 17. Например: для е (m = 9,11 ⋅10−31 кг): h /(2πm) ≈ 10−4 при Δx = 0,001
- 18. Как квантовая механика описывает движение е- в атоме? T + U = E , В квантовой
- 19. Принцип неопределенности → состояние микрочастицы полностью описывается не ее координатой и скоростью, а некоторой функцией ψ
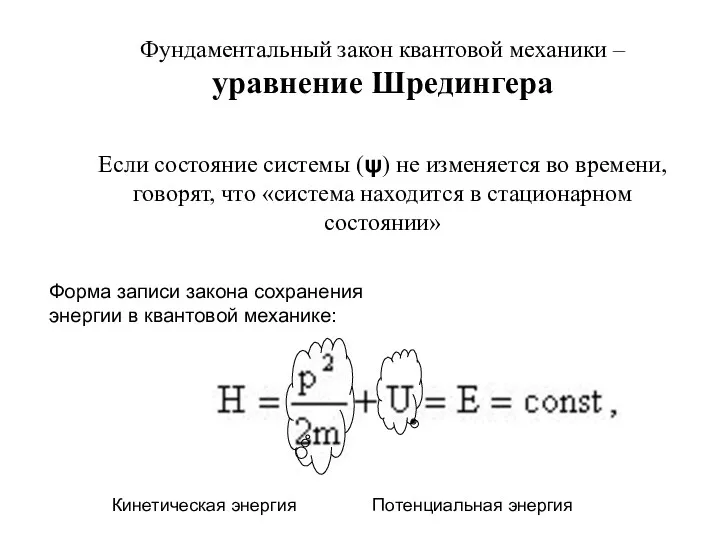
- 20. Фундаментальный закон квантовой механики – уравнение Шредингера Если состояние системы (ψ) не изменяется во времени, говорят,
- 21. Вместо физических величин (импульс, координата, энергия и т.д.) применяются операторы (определенные математические правила для вычисления этих
- 22. После подстановки квантовых аналогов классических величин получаем: или, окончательно: Уравнение Шредингера для стационарных состояний электрона в
- 23. Итак, чтобы изучить состояния микрочастиц, необходимо описать потенциальную энергию частицы в явном виде и затем решить
- 24. В атоме водорода потенциальная энергия электрона определяется его кулоновским притяжением к ядру: r – расстояние от
- 26. Уровни энергии электрона в атоме водорода Основному состоянию атома водорода соответствует n = 1 с Е1
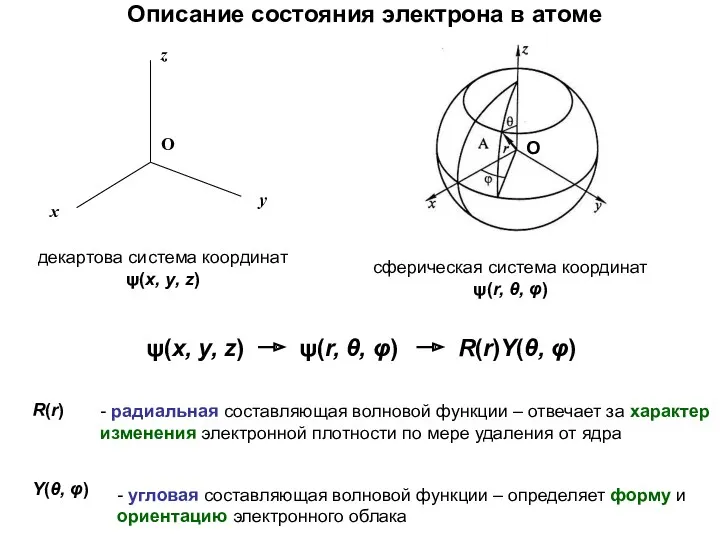
- 27. декартова система координат ψ(x, y, z) сферическая система координат ψ(r, θ, φ) R(r) Y(θ, φ) -
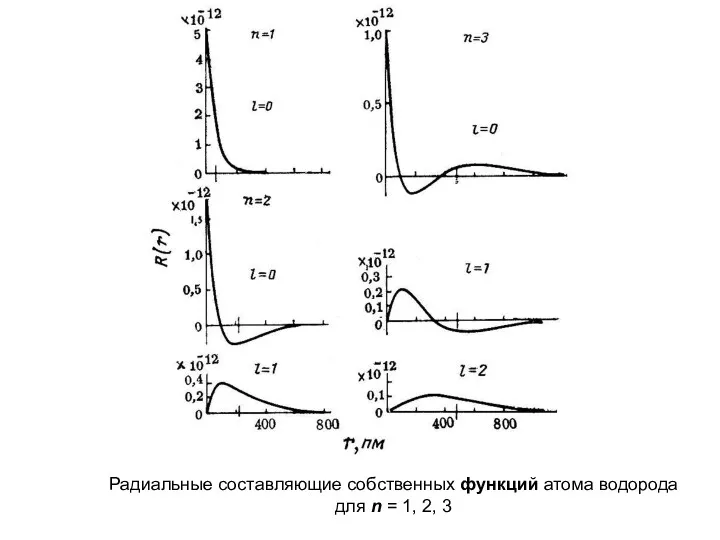
- 28. Радиальные составляющие собственных функций атома водорода для n = 1, 2, 3
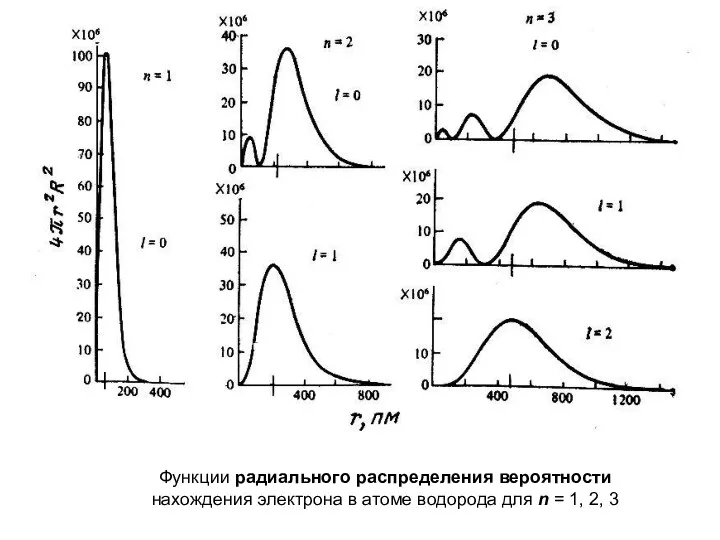
- 29. Атом – «матрешка» Как меняется вероятность нахождения электрона в различных точках объема атома? отдельные слои толщиной
- 30. Функции радиального распределения вероятности нахождения электрона в атоме водорода для n = 1, 2, 3
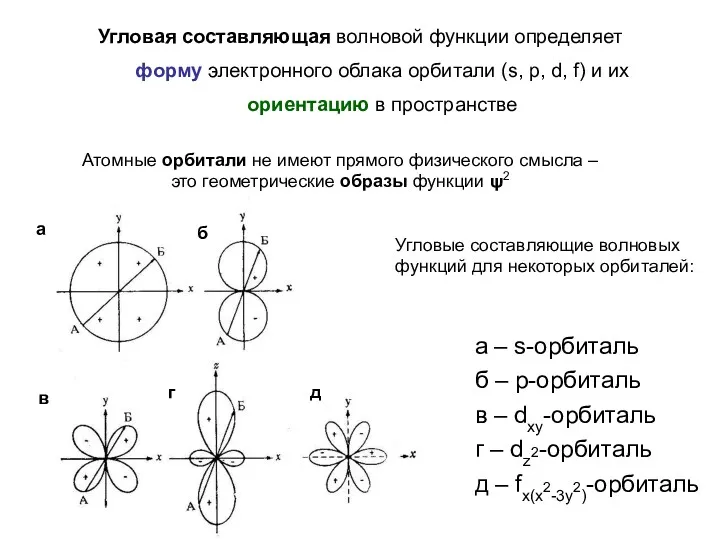
- 31. Угловая составляющая волновой функции определяет форму электронного облака орбитали (s, p, d, f) и их ориентацию
- 32. r = radius expressed in atomic units (1 Bohr radius = 52.9 pm) π = 3.14159
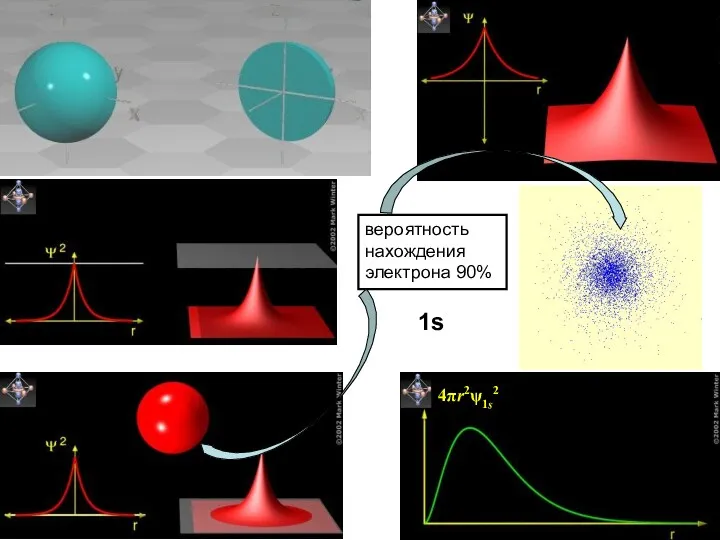
- 33. вероятность нахождения электрона 90% 1s
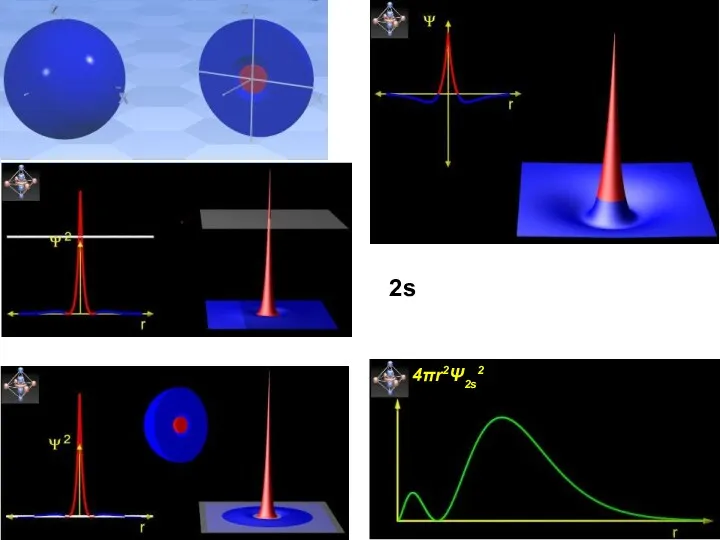
- 34. 4πr2Ψ2s2 2s
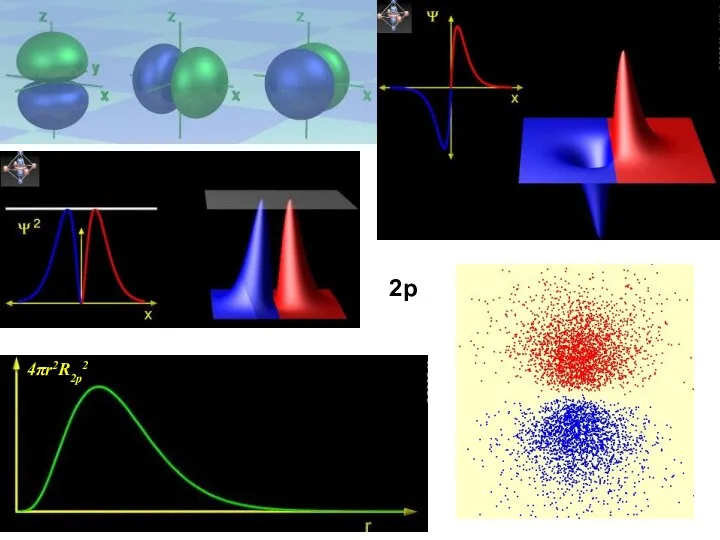
- 35. 2p
- 36. Состояние электрона в атоме полностью определяется четырьмя квантовыми числами
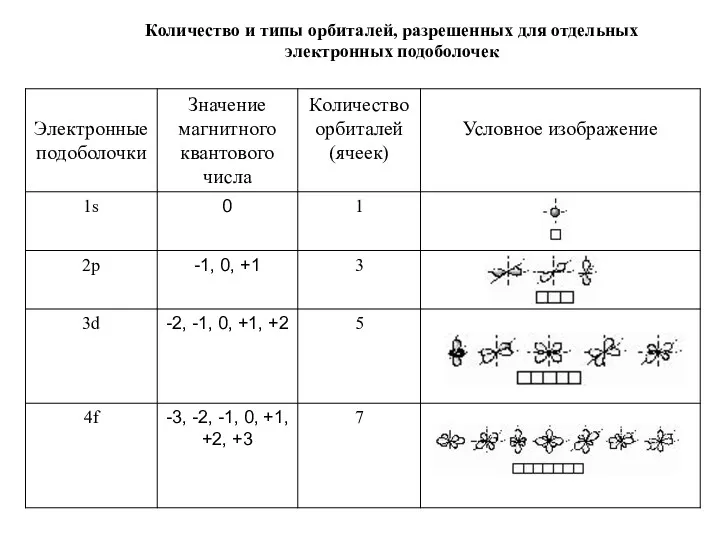
- 37. Количество и типы орбиталей, разрешенных для отдельных электронных подоболочек
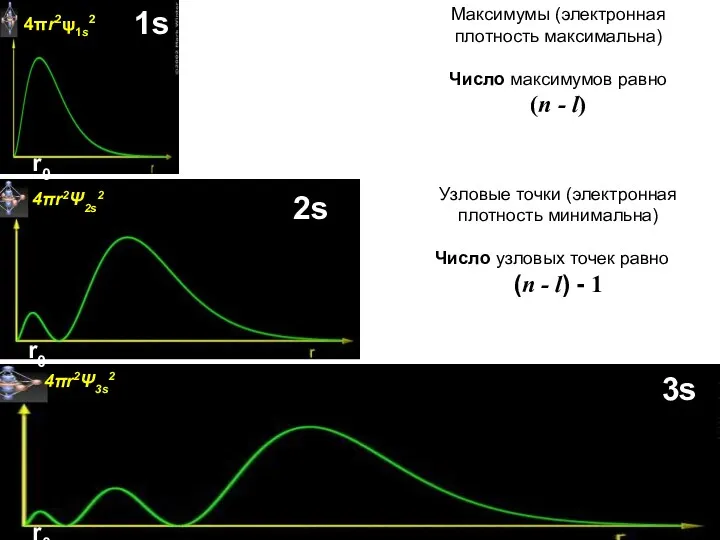
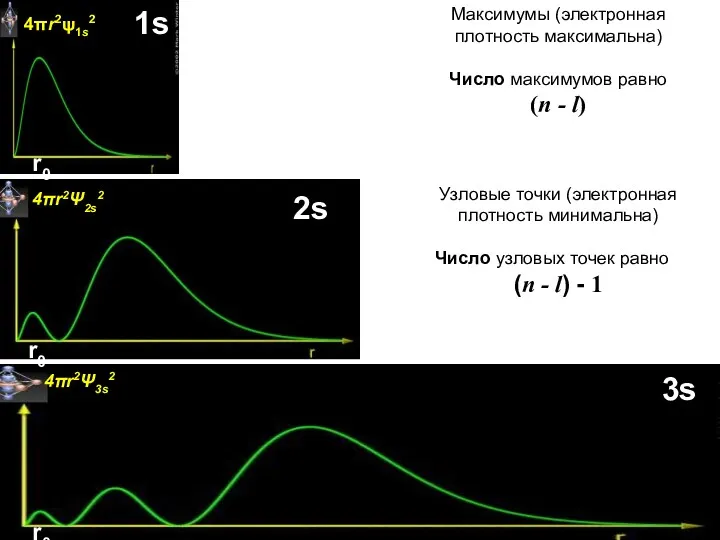
- 39. 4πr2Ψ2s2 4πr2Ψ3s2 4πr2ψ1s2 1s 2s 3s Узловые точки (электронная плотность минимальна) Число узловых точек равно (n
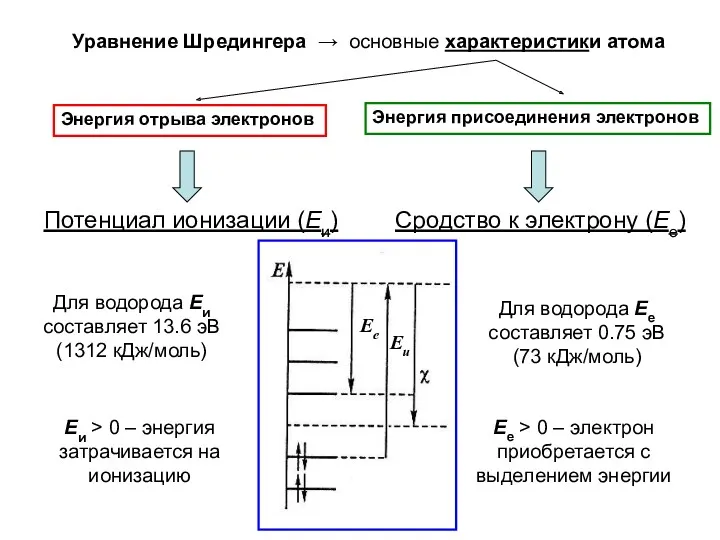
- 40. Уравнение Шредингера → основные характеристики атома Энергия отрыва электронов Энергия присоединения электронов Потенциал ионизации (Еи) Для
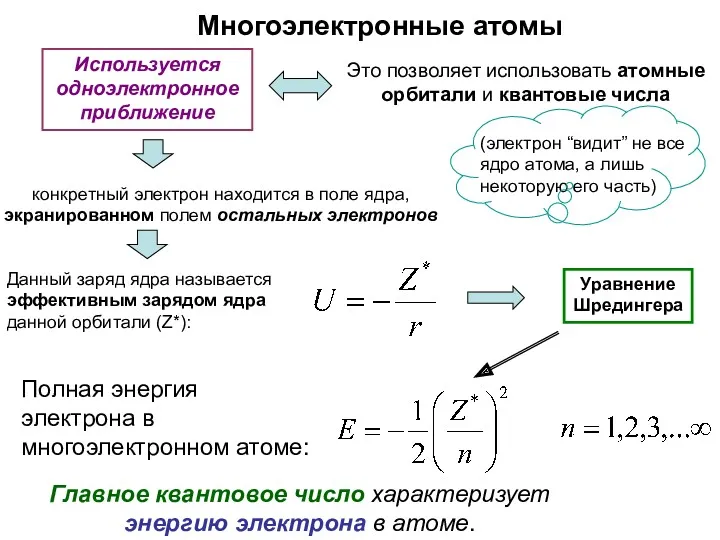
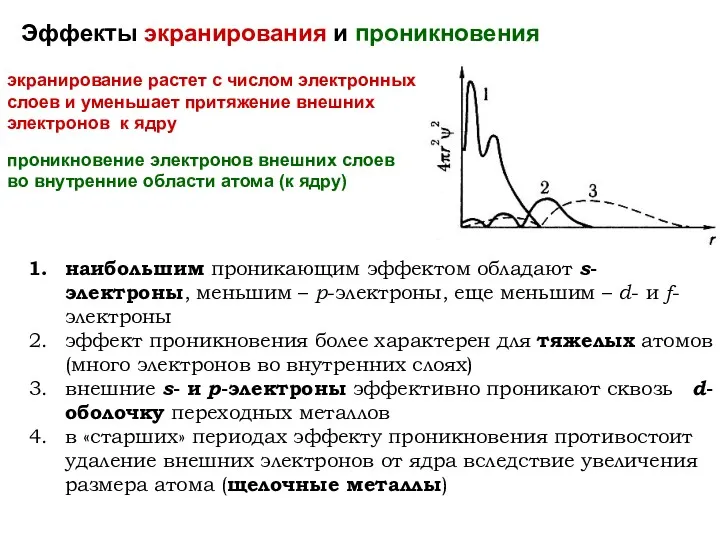
- 41. Это позволяет использовать атомные орбитали и квантовые числа конкретный электрон находится в поле ядра, экранированном полем
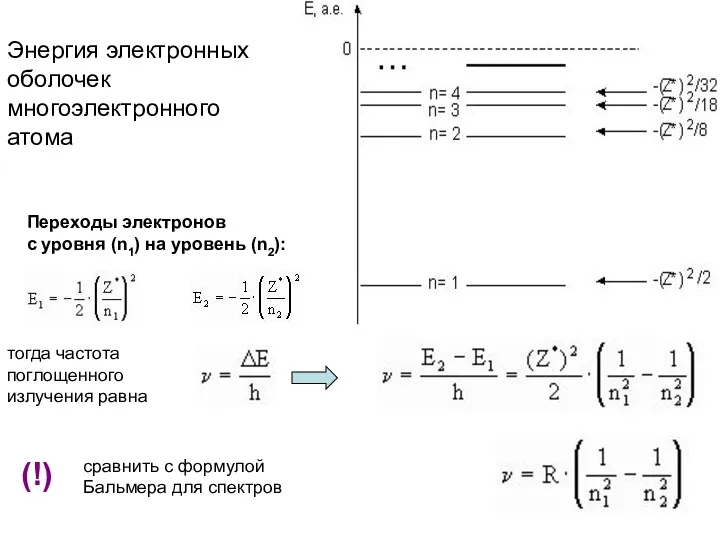
- 42. Переходы электронов с уровня (n1) на уровень (n2): Энергия электронных оболочек многоэлектронного атома тогда частота поглощенного
- 43. Приближенные методы расчета многоэлектронных атомов дают следующие принципиальные результаты: многоэлектронность сказывается только на радиальной части волновой
- 44. Квантовые числа и энергия орбиталей С ростом n повышается энергия электрона (Епред → 0). Чем меньше
- 45. РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ В МНОГОЭЛЕКТРОННЫХ АТОМАХ принцип наименьшей энергии Электрон в первую очередь распределяется в пределах электронной
- 46. Пояснения к правилам Клечковского Последовательность заполнения подуровней по правилам Клечковского 3s-облако – три максимума 3p-облако –
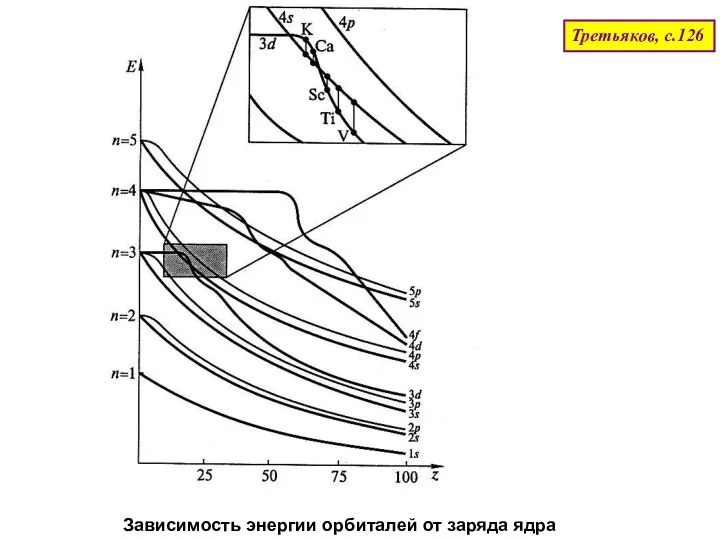
- 47. Зависимость энергии орбиталей от заряда ядра Третьяков, с.126
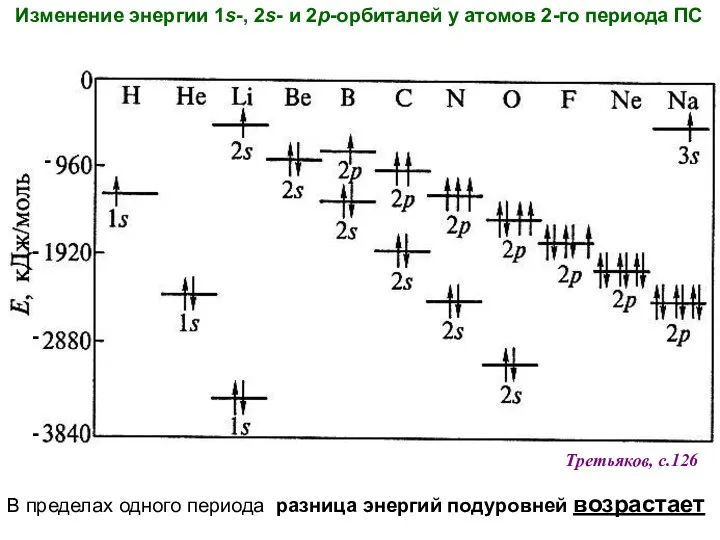
- 48. В пределах одного периода разница энергий подуровней возрастает Изменение энергии 1s-, 2s- и 2p-орбиталей у атомов
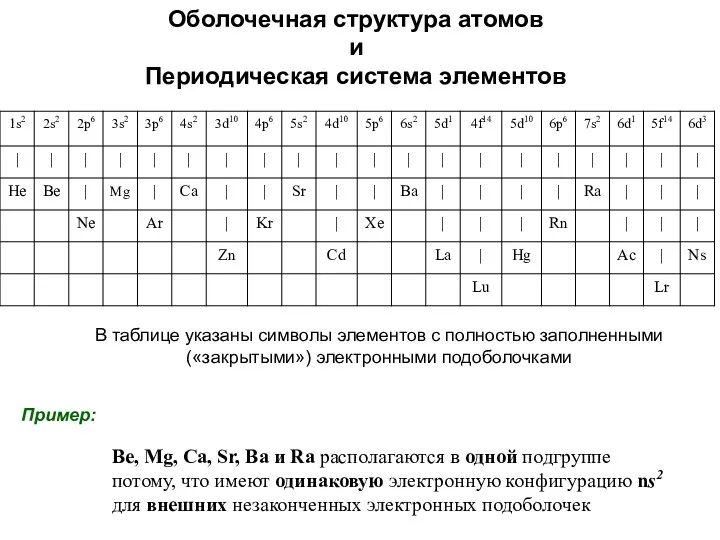
- 49. СПОСОБЫ ЗАПИСИ ЭЛЕКТРОННЫХ КОНФИГУРАЦИЙ АТОМОВ И ИОНОВ Наиболее часто используют запись по электронным оболочкам и подоболочкам:
- 50. Be, Mg, Ca, Sr, Ba и Ra располагаются в одной подгруппе потому, что имеют одинаковую электронную
- 51. 1. Номер периода совпадает с: количеством заполняющихся электронных оболочек атома; главным квантовым числом внешней (заполняющейся электронами)
- 52. 6 период → полная электронная конфигурация включает таковую предшествующего благородного элемента (54Xe) и плюс электронную конфигурацию
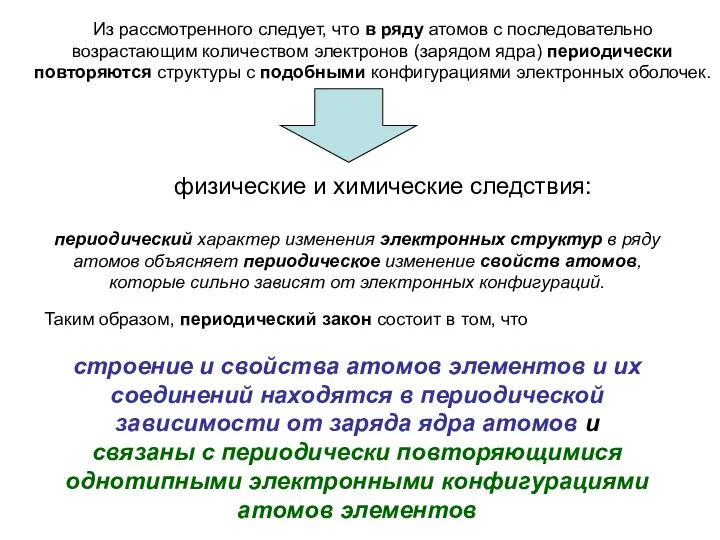
- 53. Таким образом, периодический закон состоит в том, что строение и свойства атомов элементов и их соединений
- 54. ПЕРИОДИЧЕСКИЕ СВОЙСТВА АТОМОВ И ИОНОВ ЭЛЕМЕНТОВ Сходство физико-химических и химических свойств атомов обусловлено сходством их электронных
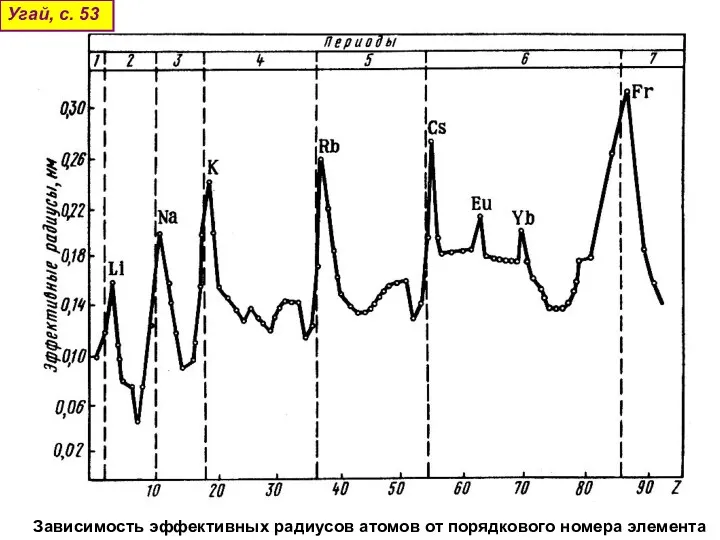
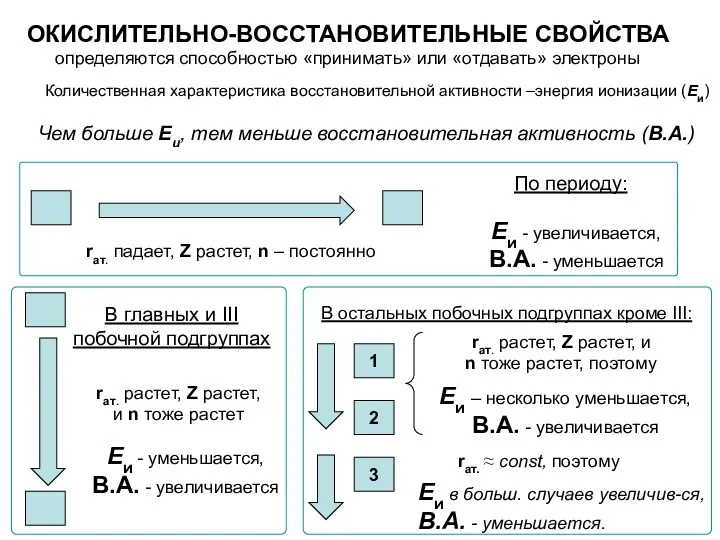
- 55. АТОМНЫЕ И ИОННЫЕ РАДИУСЫ По периоду: главное квантовое число электронов внешней оболочки n – постоянно, и
- 56. Зависимость эффективных радиусов атомов от порядкового номера элемента Угай, с. 53
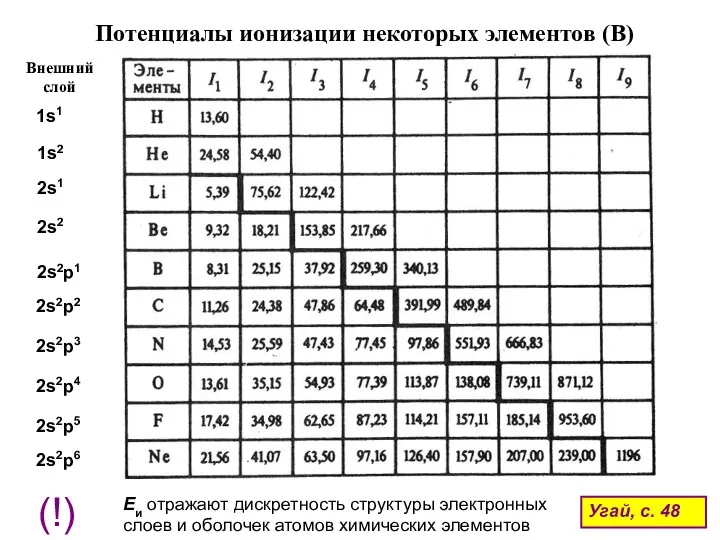
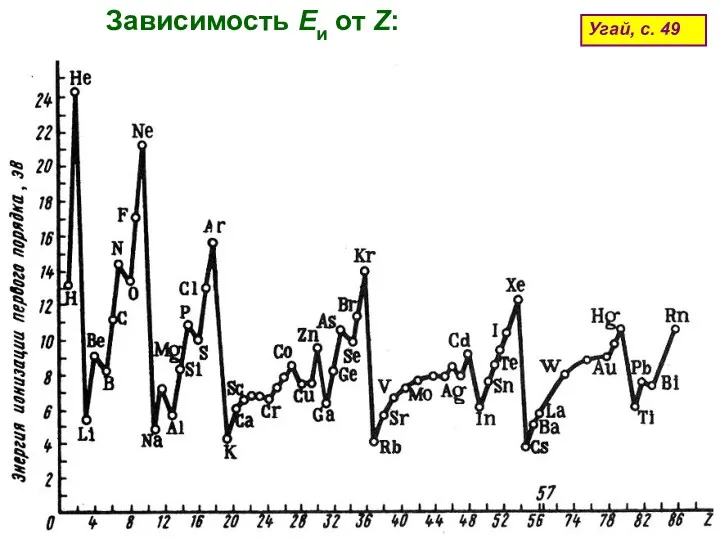
- 57. Еи отражают дискретность структуры электронных слоев и оболочек атомов химических элементов Угай, с. 48 Потенциалы ионизации
- 58. Зависимость Еи от Z: Угай, с. 49
- 59. Эффекты экранирования и проникновения экранирование растет с числом электронных слоев и уменьшает притяжение внешних электронов к
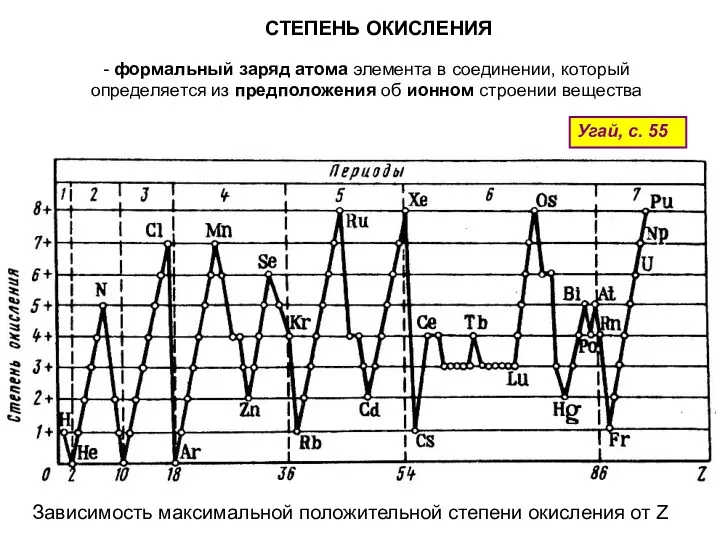
- 60. СТЕПЕНЬ ОКИСЛЕНИЯ - формальный заряд атома элемента в соединении, который определяется из предположения об ионном строении
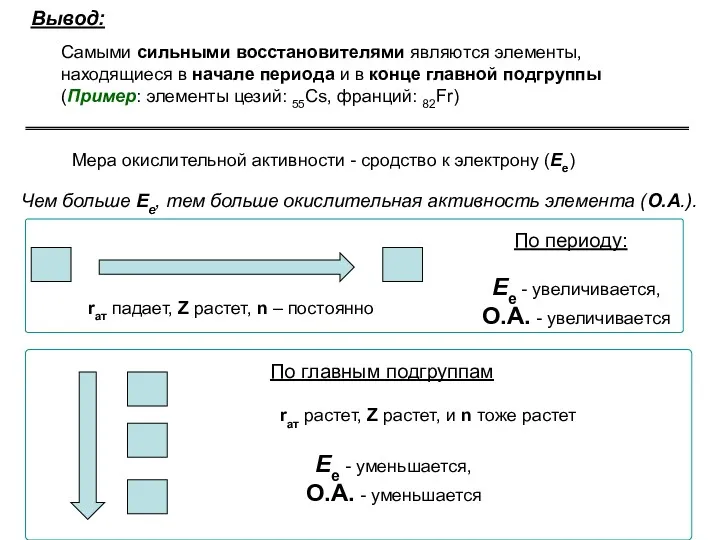
- 61. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА По периоду: rат. падает, Z растет, n – постоянно В главных и III побочной
- 62. Самыми сильными восстановителями являются элементы, находящиеся в начале периода и в конце главной подгруппы (Пример: элементы
- 63. Виды аналогий в Периодической системе 1. Групповая и типовая аналогия Групповая: в группы ПС объединяются элементы
- 64. 2. Электронная аналогия бывает полная и неполная в зависимости от структуры не только внешней оболочки, но
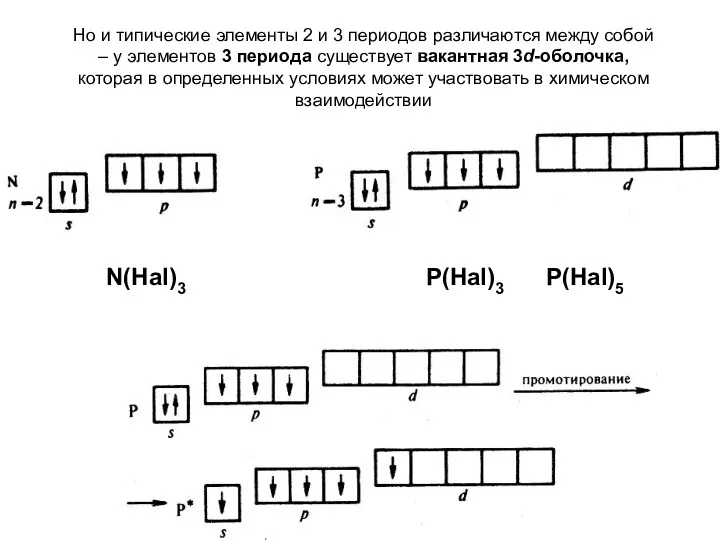
- 65. Но и типические элементы 2 и 3 периодов различаются между собой – у элементов 3 периода
- 66. Своеобразие первого ряда типических элементов заключается в том, что р-орбитали у них появляются впервые. «кайнос» (греч.)
- 67. 4πr2Ψ2s2 4πr2Ψ3s2 4πr2ψ1s2 1s 2s 3s Узловые точки (электронная плотность минимальна) Число узловых точек равно (n
- 68. 4. Контракционная аналогия Для атомов переходных металлов известны две тенденции: заполняющиеся d- или f-электронные оболочки экранируют
- 69. 5. Вторичная и внутренняя периодичность Внутренняя периодичность – немонотонное изменение в горизонтальных рядах p-, d- и
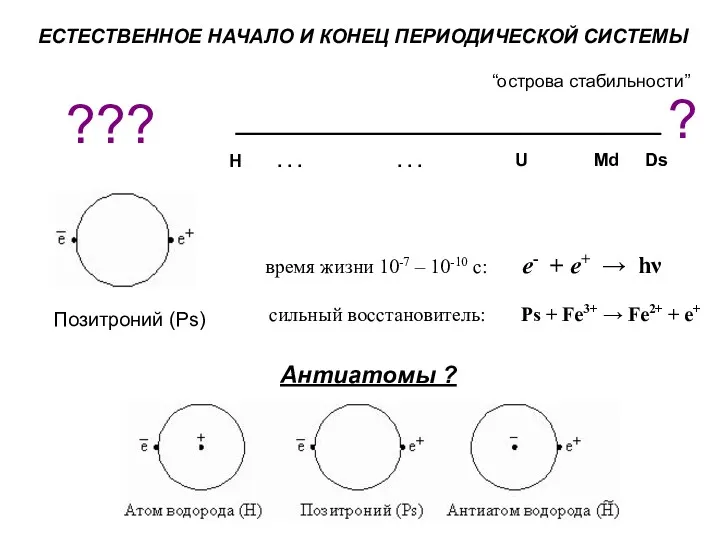
- 70. ЕСТЕСТВЕННОЕ НАЧАЛО И КОНЕЦ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ H . . . . . . U ? ???
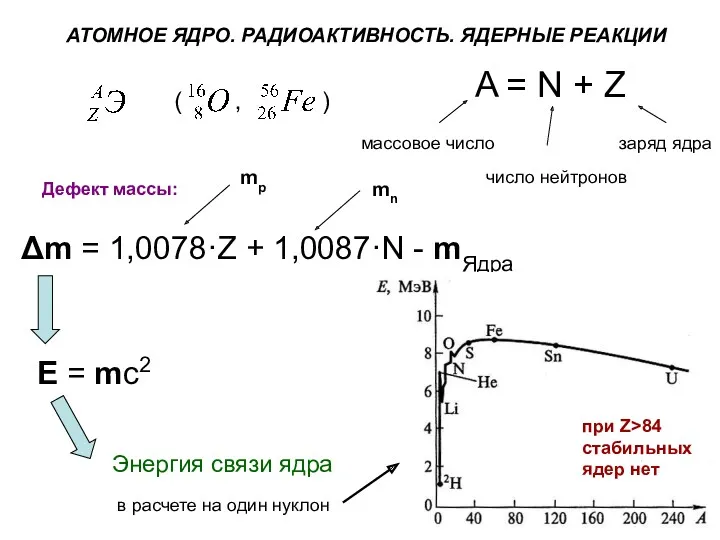
- 71. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ. ЯДЕРНЫЕ РЕАКЦИИ A = N + Z массовое число заряд ядра число нейтронов
- 72. изотопы - Z = const (например, 126C и 136C); изотоны - N = const (136C и
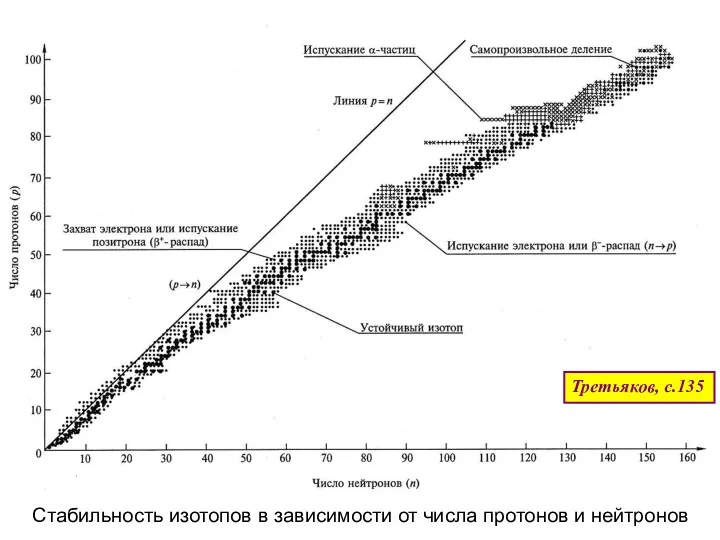
- 73. Стабильность изотопов в зависимости от числа протонов и нейтронов Третьяков, с.135
- 74. Радиоактивность При распаде ядер наблюдают: α - излучение - ядра гелия 42He (ион He2+); β -
- 75. При бомбардировке изотопов хим. элементов частицами с высокой энергией (n, p, α-частицами и более тяжелыми ядрами)
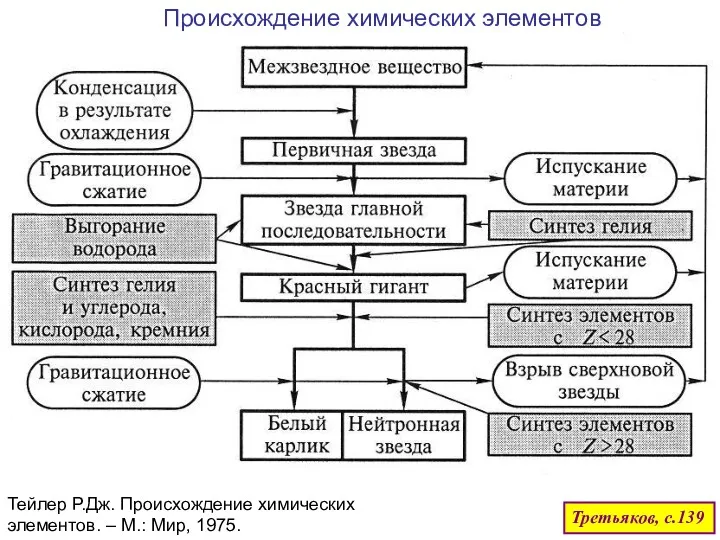
- 76. Происхождение химических элементов Тейлер Р.Дж. Происхождение химических элементов. – М.: Мир, 1975. Третьяков, с.139
- 78. Скачать презентацию








































 Illustrated drilling glossary
Illustrated drilling glossary Презентация Летопись нашего класса
Презентация Летопись нашего класса Федеративная Республика Германия (ФРГ)
Федеративная Республика Германия (ФРГ) les 19
les 19 Какие бывают растения
Какие бывают растения Обучение грамоте. Слог, ударение
Обучение грамоте. Слог, ударение Физическая культура
Физическая культура Гаметогенез, оплодотворение
Гаметогенез, оплодотворение ПрезентацияСпешите делать добро
ПрезентацияСпешите делать добро Технологія жирів і жирозамінників
Технологія жирів і жирозамінників Развитие учащихся 1 класса в процессе формирования универсальных учебных действий по программе ПНШ.
Развитие учащихся 1 класса в процессе формирования универсальных учебных действий по программе ПНШ. Хоровая литература. Оперно-хоровое творчество
Хоровая литература. Оперно-хоровое творчество Гражданская авиатехника
Гражданская авиатехника Расчёт загрузки и составление грузового плана судна с проработкой маршрута перехода судна по навигационным картам и пособиям
Расчёт загрузки и составление грузового плана судна с проработкой маршрута перехода судна по навигационным картам и пособиям Гендерный подход к воспитанию дошкольников
Гендерный подход к воспитанию дошкольников Любовь в изобразительном искусстве
Любовь в изобразительном искусстве Дерево целей и систем автомобильного транспорта и технической эксплуатации. Понятие о дереве целей. Тема 4
Дерево целей и систем автомобильного транспорта и технической эксплуатации. Понятие о дереве целей. Тема 4 Транссибирская железнодорожная магистраль
Транссибирская железнодорожная магистраль Родники саратовской поэзии. Конкурс чтецов, посвященный 80-летию Саратовской области
Родники саратовской поэзии. Конкурс чтецов, посвященный 80-летию Саратовской области Диабетическая микроангиопатия
Диабетическая микроангиопатия Перспектива в рисунке
Перспектива в рисунке Видеосъемка. Общие положения
Видеосъемка. Общие положения Організація роботи сортувальної станції
Організація роботи сортувальної станції Народное искусство и культурное наследие ( младшая группа)
Народное искусство и культурное наследие ( младшая группа) LeadER. Привлечем. Оцифруем. Удержим
LeadER. Привлечем. Оцифруем. Удержим Народные движения. История России. 7 класс
Народные движения. История России. 7 класс Базовая станция Шереметьево Карго
Базовая станция Шереметьево Карго Родительское собрание Упражнения для развития внимания
Родительское собрание Упражнения для развития внимания