Содержание
- 2. Маленькая точка, сделанная карандашом, состоит из огромного количества атомов, большего, чем количество жителей на Земле !
- 3. Демокрит В основе философии Демокрита лежит учение об атомах и пустоте как двух принципах, порождающих многообразие
- 4. М.В. Ломоносов (1711-1765 гг.) Материя состоит из мельчайших первичных частиц, или атомов. Атомы неделимы и не
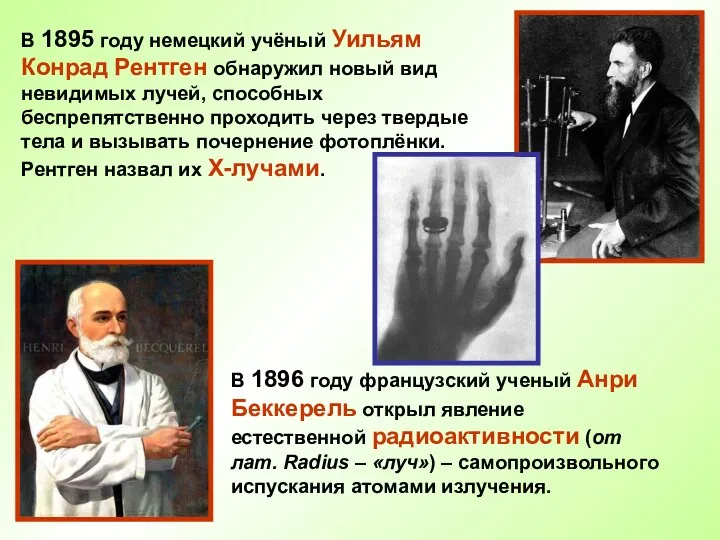
- 5. В 1895 году немецкий учёный Уильям Конрад Рентген обнаружил новый вид невидимых лучей, способных беспрепятственно проходить
- 6. В 1898 году Пьер Кюри и Мария Склодовская – Кюри, изучавшие явление радиоактивности, открыли новые элементы
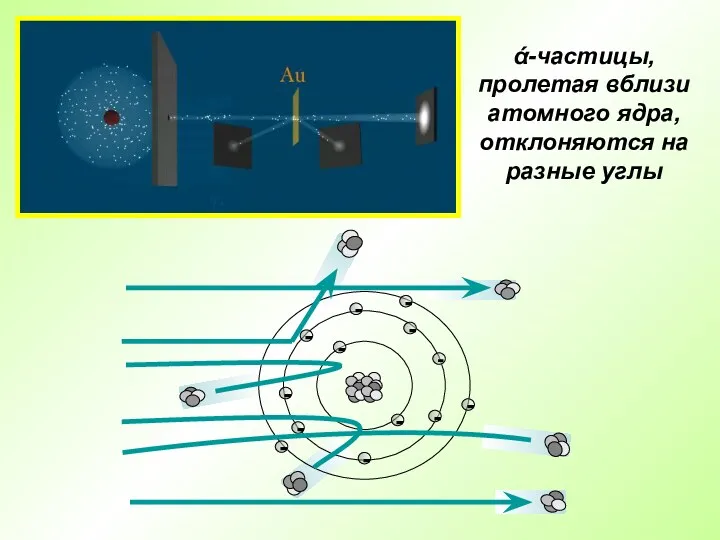
- 7. Английский физик Эрнест Резерфорд в 1909 г. открыл ядро атома Опыт Резерфорда: поток ά-частиц, излучаемый радиоактивным
- 8. ά-частицы, пролетая вблизи атомного ядра, отклоняются на разные углы
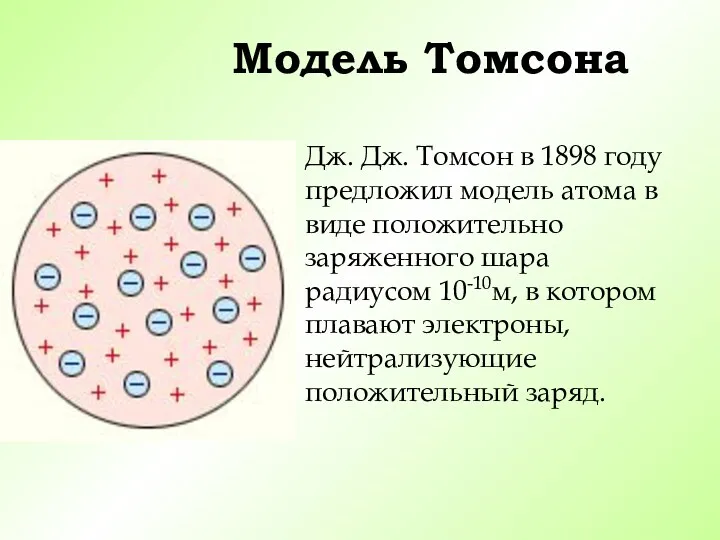
- 9. Модель Томсона Дж. Дж. Томсон в 1898 году предложил модель атома в виде положительно заряженного шара
- 10. Э. Резерфорд предложил планетарную модель атома: в центре находится положительно заряженное ядро, которое имеет достаточно малые
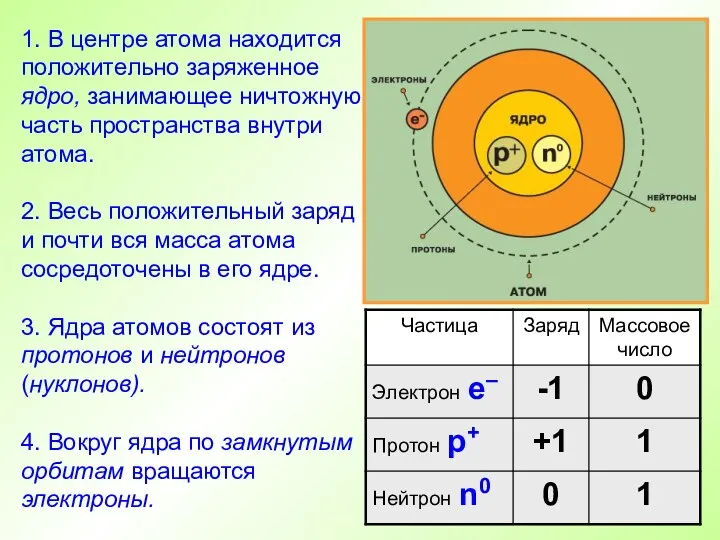
- 11. 1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома. 2. Весь
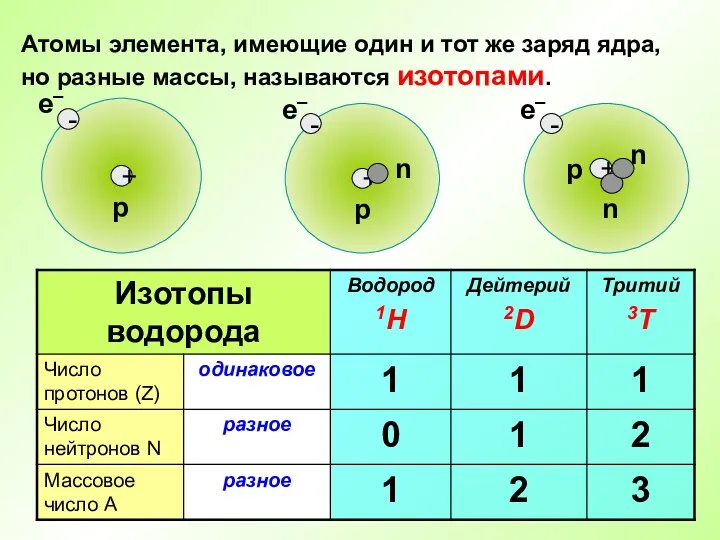
- 12. Атомы элемента, имеющие один и тот же заряд ядра, но разные массы, называются изотопами.
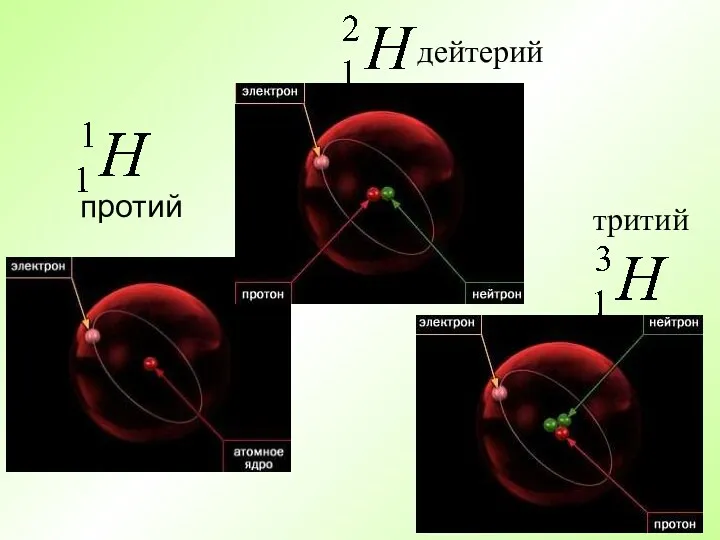
- 13. протий дейтерий тритий
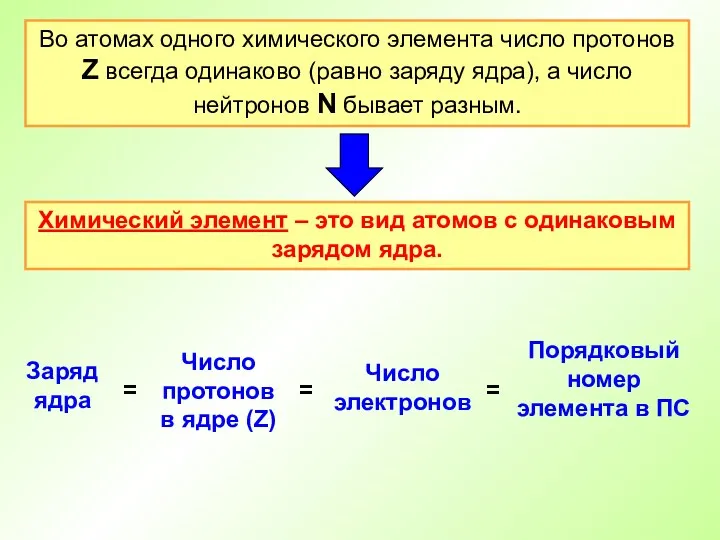
- 14. Во атомах одного химического элемента число протонов Z всегда одинаково (равно заряду ядра), а число нейтронов
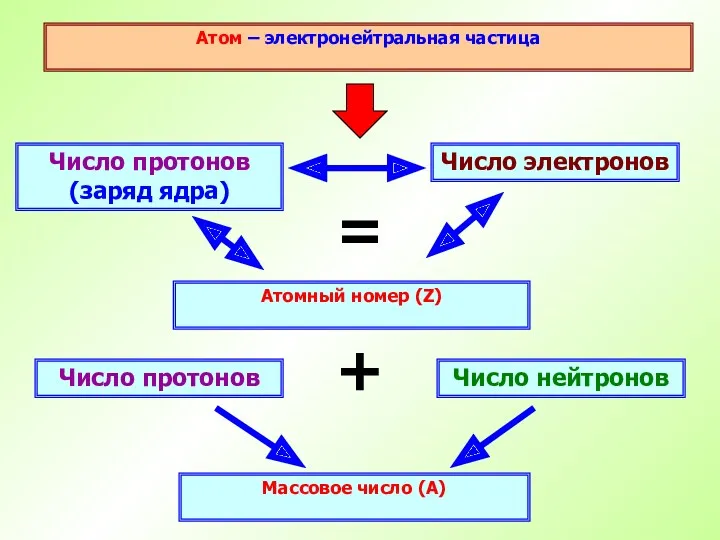
- 15. Атом – электронейтральная частица Число протонов (заряд ядра) Атомный номер (Z) Число электронов = Число нейтронов
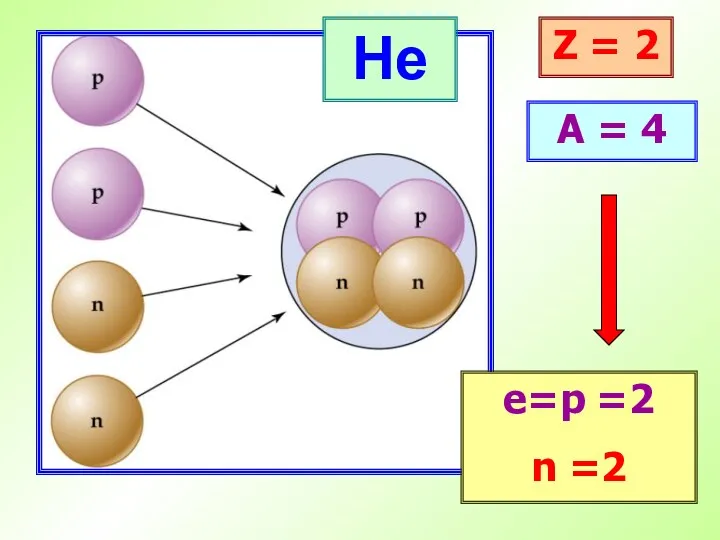
- 16. He Z = 2 A = 4 е=p =2 n =2
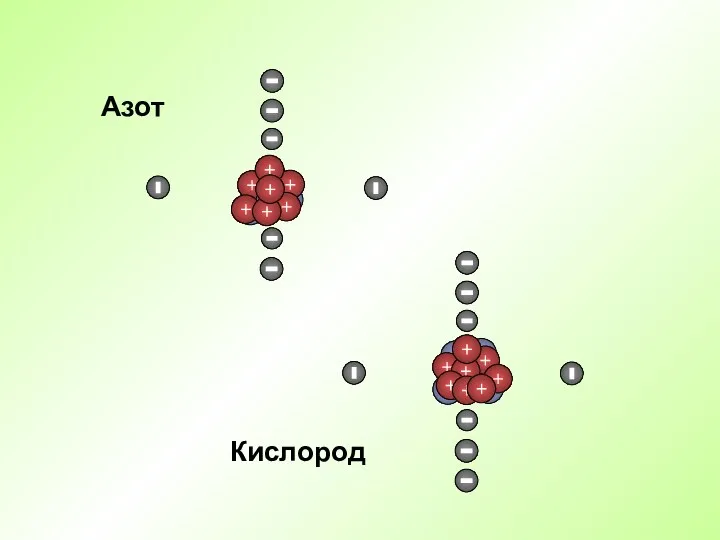
- 17. Кислород Азот
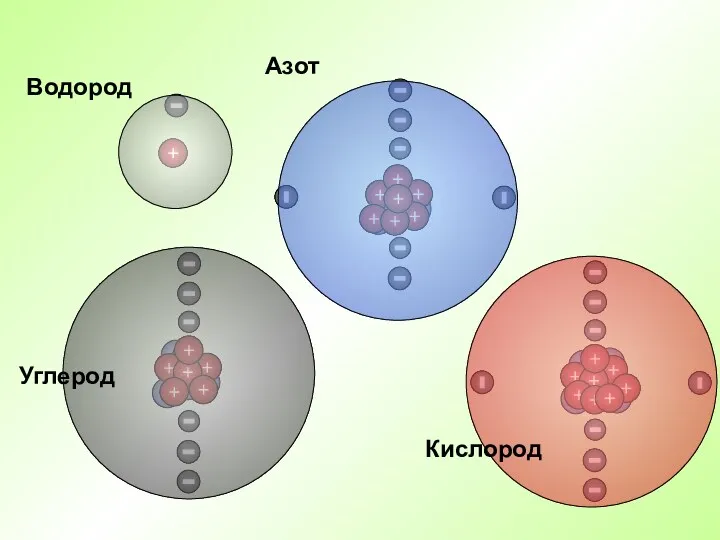
- 18. Водород Азот Кислород Углерод
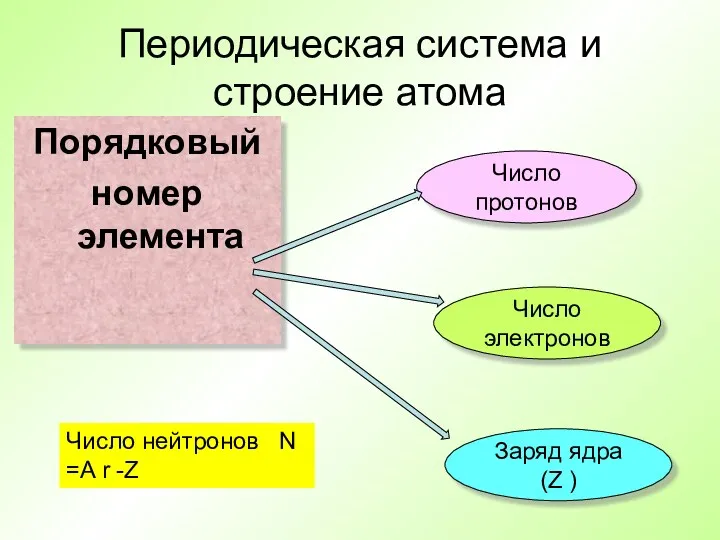
- 19. Периодическая система и строение атома Порядковый номер элемента Число протонов Число электронов Заряд ядра (Z )
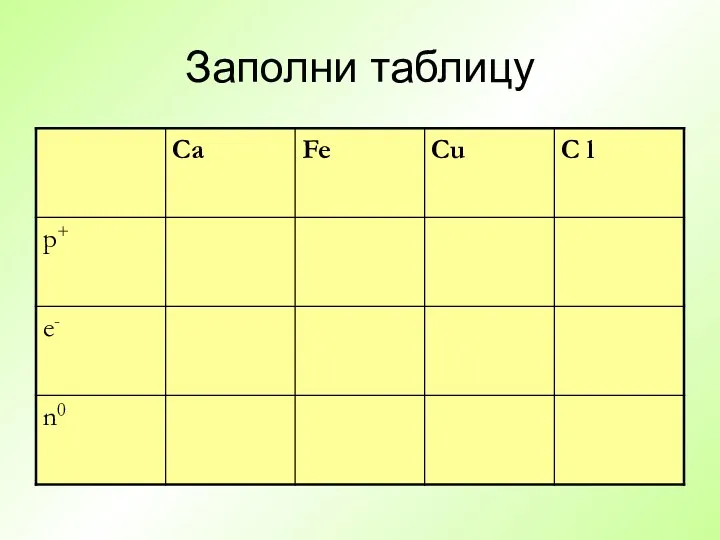
- 20. Заполни таблицу
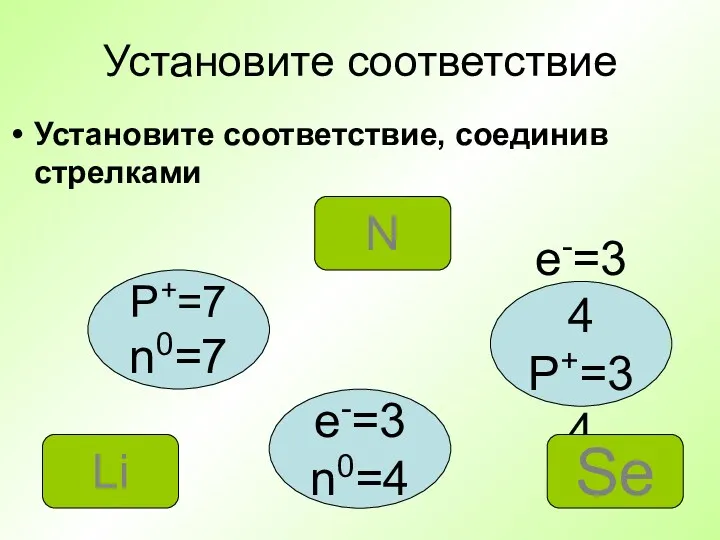
- 21. Установите соответствие Установите соответствие, соединив стрелками P+=7 n0=7 e-=34 P+=34 e-=3 n0=4 N Se Li
- 22. Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от зарядов атомных ядер
- 23. Тестовые задания Заряд ядра атома азота равен : а) 7 б) 13 в) 4 г) 29
- 24. Тестовые задания Заряд ядра атома азота равен : а) 7 б) 13 в) 4 г) 29
- 26. Скачать презентацию









 Социальные иституты
Социальные иституты Гемолитические анемии. Клиника, диагностика, лечение
Гемолитические анемии. Клиника, диагностика, лечение Требования к оформлению исследовательской работы для научно-исследовательской конференции
Требования к оформлению исследовательской работы для научно-исследовательской конференции Презентация, классный час Новый год в разных странах
Презентация, классный час Новый год в разных странах презентация Виды сказок в работе с детьми дошкольного возраста
презентация Виды сказок в работе с детьми дошкольного возраста Влияние телевизора на здоровье младшего школьника
Влияние телевизора на здоровье младшего школьника Первоцветы 1 класс внеурочная деятельность Я и мой мир
Первоцветы 1 класс внеурочная деятельность Я и мой мир Воспитательный час Семья и Отечество
Воспитательный час Семья и Отечество Заболевания носа, придаточных пазух
Заболевания носа, придаточных пазух Медицинская деонтология и этика. Основные термины и понятия
Медицинская деонтология и этика. Основные термины и понятия Воспаление: определение, сущность, биологическое значение
Воспаление: определение, сущность, биологическое значение phpOdviwa_rozhdestvo
phpOdviwa_rozhdestvo Проект Сказки Г.Х.Андерсена
Проект Сказки Г.Х.Андерсена Перспективы развития агроэкотуризма в Витебской области в соответствии с международным экологическим стандартом качества ЕСЕАТ
Перспективы развития агроэкотуризма в Витебской области в соответствии с международным экологическим стандартом качества ЕСЕАТ Путешествие по островам природы
Путешествие по островам природы Разработка технологического процесса изготовления детали Крышка
Разработка технологического процесса изготовления детали Крышка Каспий маңы мұнай-газды бассейнінің оңтүстік-шығыс бөлігінің шоғырлар бойынша жіктемесі
Каспий маңы мұнай-газды бассейнінің оңтүстік-шығыс бөлігінің шоғырлар бойынша жіктемесі Про те, якими ми не є
Про те, якими ми не є История применения математических методов в экономике
История применения математических методов в экономике Таблица сложения. 1 класс
Таблица сложения. 1 класс каверин
каверин Вибрато. Виды
Вибрато. Виды Кинезиология. Развивающая программа
Кинезиология. Развивающая программа Экологический анализ предприятий
Экологический анализ предприятий Жизнь класса
Жизнь класса Герметизация фиссур
Герметизация фиссур Картотека игр на участке в летний период
Картотека игр на участке в летний период New York is the most populous city in US
New York is the most populous city in US