Содержание
- 2. Цели урока Обобщение сведений о важнейших открытиях физики XIX-XX веков в области строения атома Объяснение строения
- 3. Первоначальные представления об атомах Представления древних: Демокрит полагал, что свойства того или иного вещества определяются формой,
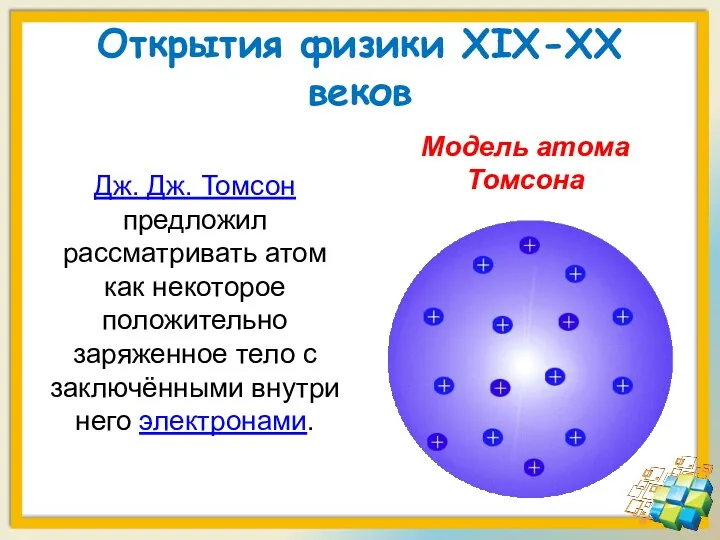
- 4. Открытия физики XIX-XX веков 1. Модель атома Томсона Джозеф Джон Томсон (1856 – 1940)
- 5. Открытия физики XIX-XX веков Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с
- 6. Открытия физики XIX-XX веков Недостатки модели атома Томсона не объясняла дискретный характер излучения атома и его
- 7. Открытия физики XIX-XX веков 2. Модель атома Резерфорда Атом представляет собой подобие планетной системы, в которой
- 8. Открытия физики XIX-XX веков Недостатки модели атома Резерфорда не объясняла явления излучения и поглощения энергии атомом
- 9. Открытия физики XIX-XX веков 3. Квантовая модель Эйнштейна-Бора Нильс Бор (1885-1962) Альберт Эйнштейн (1879 - 1955)
- 10. Открытия физики XIX-XX веков Постулаты квантовой модели: Электрон может вращаться вокруг ядра по стационарным круговым орбитам.
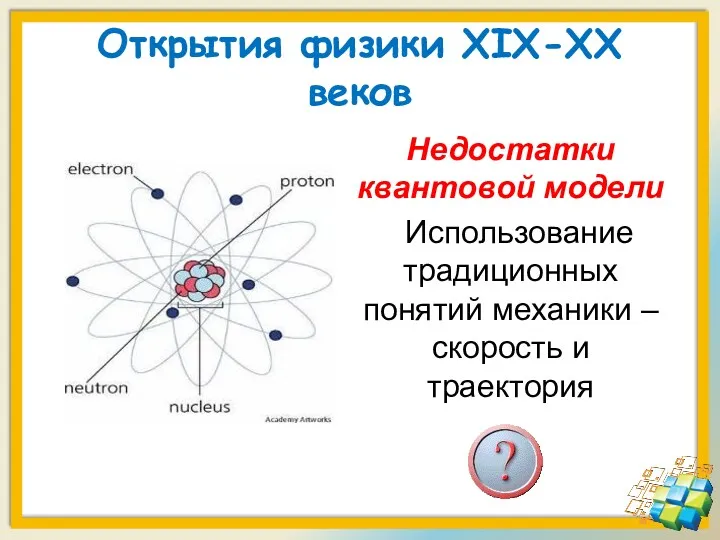
- 11. Открытия физики XIX-XX веков Недостатки квантовой модели Использование традиционных понятий механики – скорость и траектория
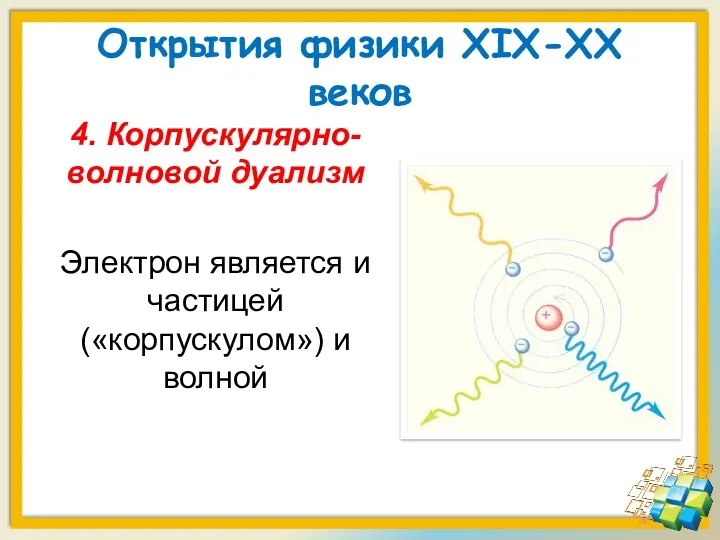
- 12. Открытия физики XIX-XX веков 4. Корпускулярно-волновой дуализм Электрон является и частицей («корпускулом») и волной
- 13. 5.Квантово-механическая модель атома Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит
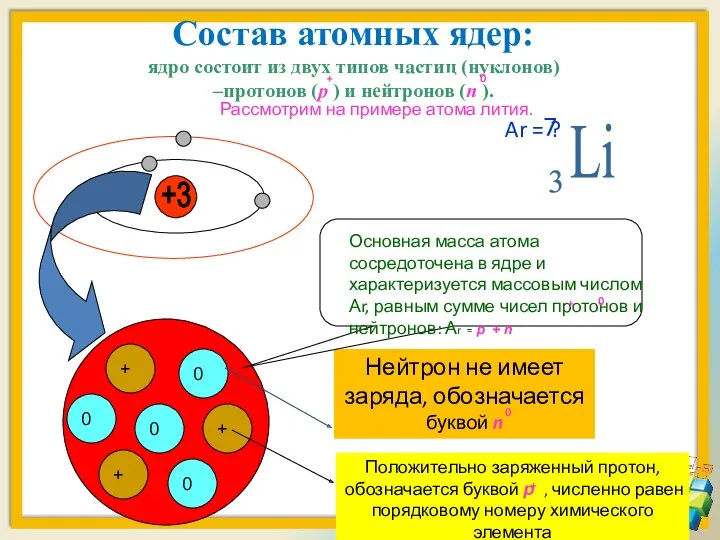
- 14. Состав атомных ядер: ядро состоит из двух типов частиц (нуклонов) –протонов (p ) и нейтронов (n
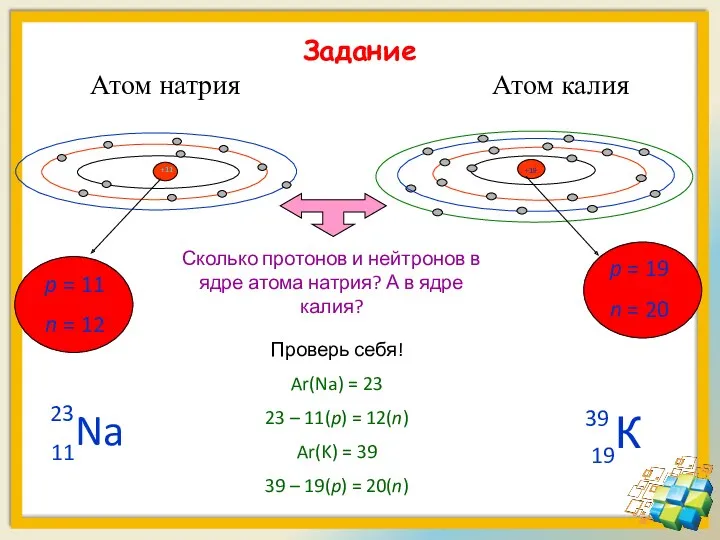
- 15. Задание Атом натрия Атом калия p = 11 n = 12 p = 19 n =
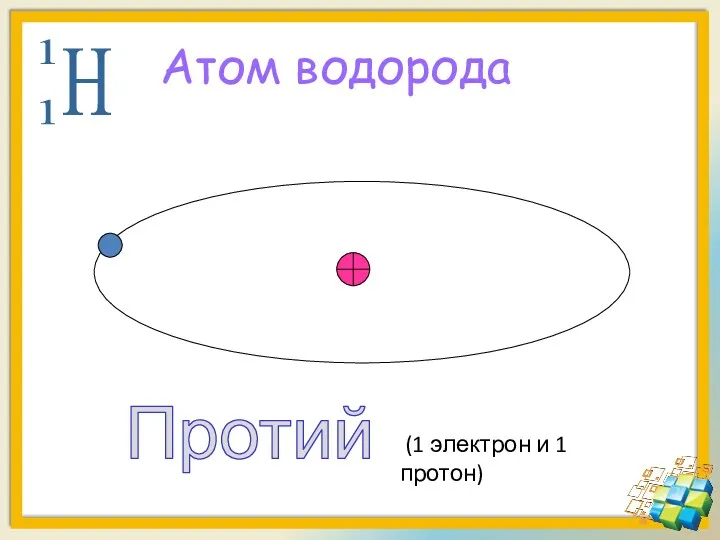
- 16. Атом водорода Протий (1 электрон и 1 протон)
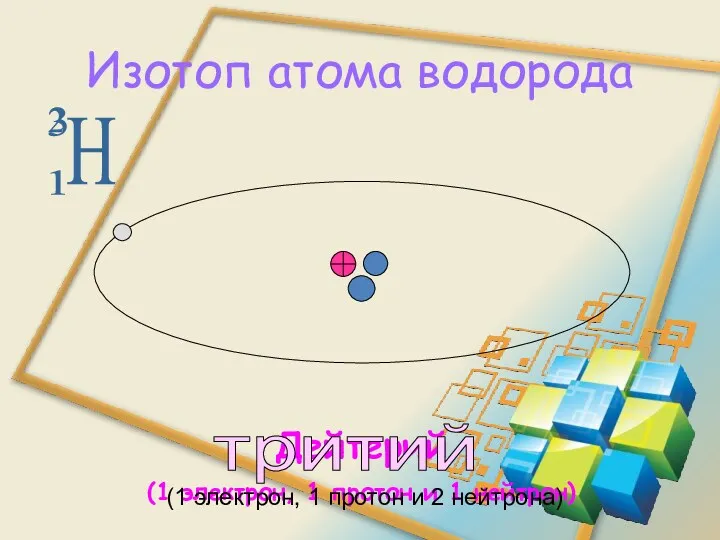
- 17. H 2 1 Изотоп атома водорода Дейтерий (1 электрон, 1 протон и 1 нейтрон) 3 тритий
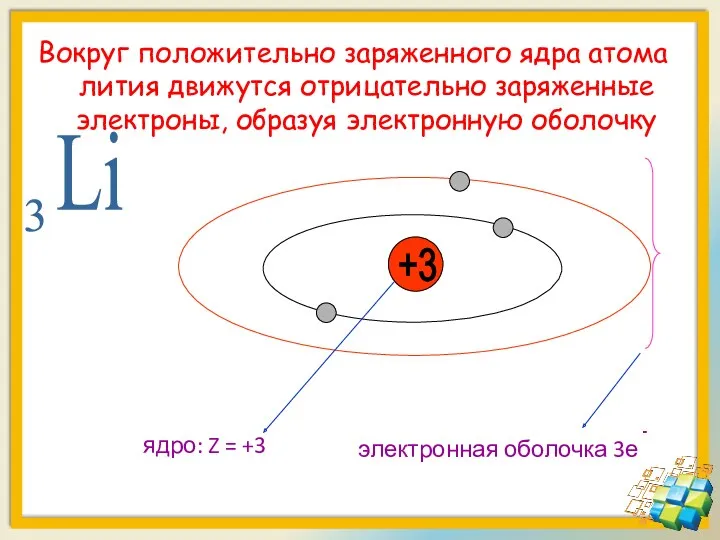
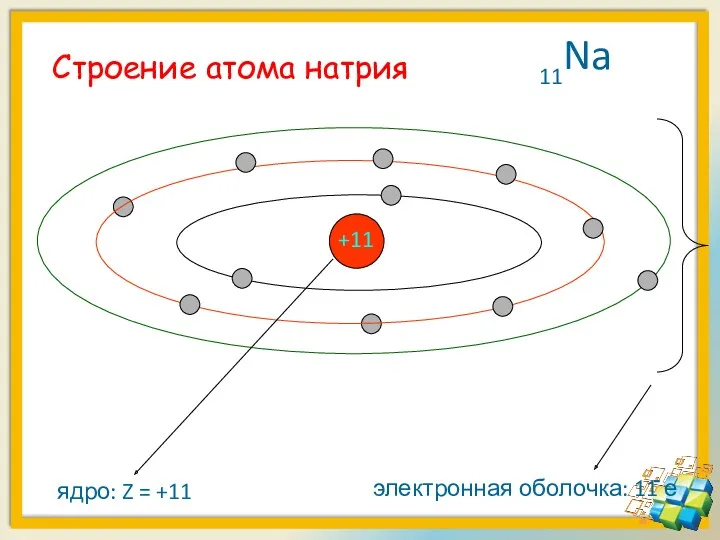
- 18. Вокруг положительно заряженного ядра атома лития движутся отрицательно заряженные электроны, образуя электронную оболочку +3
- 19. Строение атома натрия +11
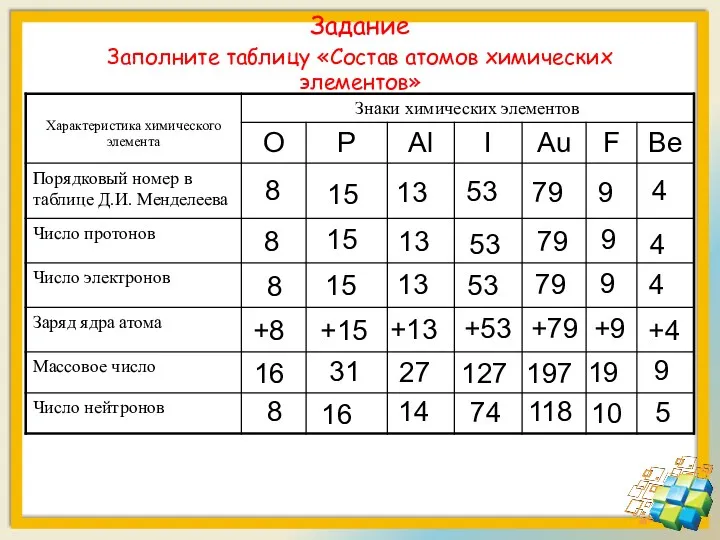
- 20. Задание Заполните таблицу «Состав атомов химических элементов»
- 22. Скачать презентацию









 Серебряный век русской поэзии (1900-1917)
Серебряный век русской поэзии (1900-1917) Самая чудесная девушка на свете
Самая чудесная девушка на свете Организация управленческого труда. Корпоративная культура организации
Организация управленческого труда. Корпоративная культура организации Презентация к логопедическому занятию по теме Звук и буква Ш
Презентация к логопедическому занятию по теме Звук и буква Ш Презентатор Microsoft Power Point
Презентатор Microsoft Power Point Автоматизация и механизация процессов листовой штамповки
Автоматизация и механизация процессов листовой штамповки Діни бостандық жариялануының қазақ жастарына әсері?
Діни бостандық жариялануының қазақ жастарына әсері? Игры, направленные на формирование культурно – гигиенических навыков и навыков самообслуживания
Игры, направленные на формирование культурно – гигиенических навыков и навыков самообслуживания игра в 5 классе
игра в 5 классе Автоматизированное хранилище ценностей клиентов АХЦК
Автоматизированное хранилище ценностей клиентов АХЦК Словарные слова (1-2 класс)
Словарные слова (1-2 класс) Последовательное соединение проводников
Последовательное соединение проводников Сравнительный подход к оценке недвижимости. (Тема 8)
Сравнительный подход к оценке недвижимости. (Тема 8) Биология - наука о жизни. Вводная 5 кл
Биология - наука о жизни. Вводная 5 кл Церковный язык
Церковный язык Мультимедийная разработка НОД Откуда пришел дождик
Мультимедийная разработка НОД Откуда пришел дождик Банковский менеджмент
Банковский менеджмент Развитие высших хордовых. Птицы
Развитие высших хордовых. Птицы Сharacteristics of young learners
Сharacteristics of young learners Бизнес-планирование производственной деятельности. (Тема 10, 11)
Бизнес-планирование производственной деятельности. (Тема 10, 11) Призентация открытого занятия для детей младшего дошкольного возраста. Сказка Колобок на новый лад с использованием мягких игрушек.
Призентация открытого занятия для детей младшего дошкольного возраста. Сказка Колобок на новый лад с использованием мягких игрушек. Презентация к занятию по внеурочной деятельности Многоцветные кружева родного края Безенчукский район
Презентация к занятию по внеурочной деятельности Многоцветные кружева родного края Безенчукский район Об изобретателях
Об изобретателях Газированная вода - вред или польза... (презентация)
Газированная вода - вред или польза... (презентация) Коррозия металлов
Коррозия металлов Фотография. История в фотографиях
Фотография. История в фотографиях Türkiye’de Eğitimin
Türkiye’de Eğitimin Школа и дети в годы войны.
Школа и дети в годы войны.