Слайд 2

Атом и состав атома
Атом это: наименьшая частица химического элемента
Атом состоит из:
Положительно
заряженного ядра
Из протонов и нейтронов (общее название – нуклоны)
Масса протона (p) – 1,0073 а.е.м. Заряд протона - +1 (условный)
Масса нейтрона (n) – 1,0087 а.е.м., заряд равен 0.
Слайд 3

Атом и состав атома
3. В ядре сосредоточена почти вся масса атома,
так как масса электронов – очень малая велчиниа.
4. Электроны движутся около ядра в соответствии с определенными законами.
Слайд 4

Обозначения
Суммарно число протонов – Z
Суммарное число нейтронов – N
Массовое число –
А
Итог: А= Z+N
Слайд 5

Молекула
Молекула – наименьшая электронейтральная частица вещества, обладающая всеми его химическими свойствами, физически
неделимая, но делимая химически.
Слайд 6

Нуклиды
Это каждый отдельный вид атомов какого-либо химического элемента с ядром, состоящим из строго
определённого числа протонов (Z) и нейтронов (N), причём ядро находится в определённом энергетическом состоянии.
Слайд 7

Изотопы и изобары
Изотопы – это атомы (нуклиды) одного и того же
химического элемента, имеющие одинаковый заряд ядра, но разные массовые числа)
Изобары – это атомы (нуклиды) разных элементов, имеющие одинаковые массовые числа, но различные заряды ядер.
Слайд 8
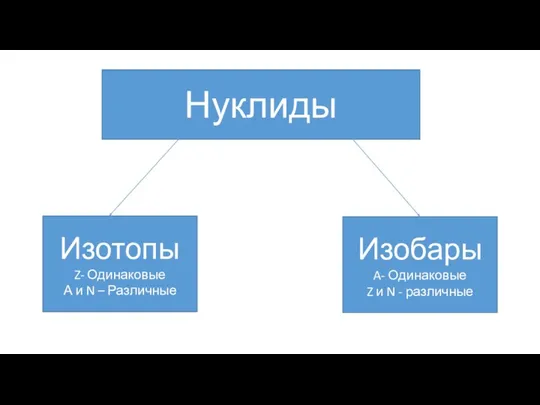
Нуклиды
Изотопы
Z- Одинаковые
А и N – Различные
Изобары
A- Одинаковые
Z и N - различные
Слайд 9

Состояние электрона в атоме
Слайд 10

Электрон
Одновременно проявляет свойства частицы и волны (Корпускулярно-волновой дуализм)
Как частица обладает определенной
массой и зарядом
Электрон в атоме не имеет определенной траектории движения
Слайд 11

Движение электрона
Электрон в атоме находится в постоянном движении вокруг ядра.
Для описания
состояния электрона оценивается вероятность его нахождения в околоядерной области пространства и используются понятия «электронное облако», «электронная орбиталь».
Слайд 12

Слайд 13

Атомная орбиталь
Пространство вокруг ядра атома, в котором наиболее вероятно пребывание электрона.
Слайд 14

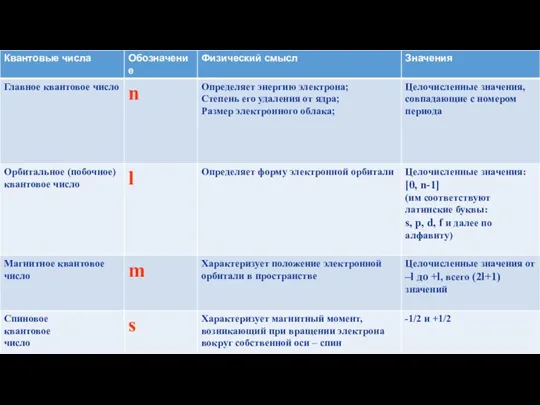
Квантовые числа
Существуют:
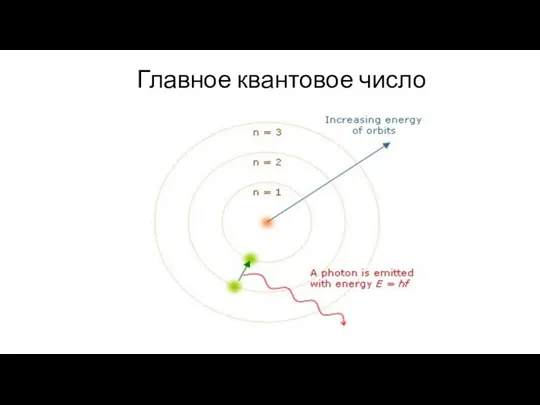
1.Главное квантовое число (n)
2.Орбитальное квантовое число (l)
3.Магнитное квантовое число (ml)
4.Спиновое
квантовое число (ms)
Для чего необходимы?
Необходимы для описания орбиталей и электронов
Слайд 15
Слайд 16
Слайд 17

Орбитальное квантовое число
Слайд 18

Магнитное квантовое число

















 Путешествие по родному краю. Конкурсы
Путешествие по родному краю. Конкурсы Курсовое проектирование как одна из форм подготовки конкурентоспособного специалиста
Курсовое проектирование как одна из форм подготовки конкурентоспособного специалиста Развитие социологии (до 1940-х гг.)
Развитие социологии (до 1940-х гг.) American history
American history Презентация Открытка к 8 марта
Презентация Открытка к 8 марта Технологиялық машиналар және жабдықтар
Технологиялық машиналар және жабдықтар Итоговое сочинение. Критерии оценивания
Итоговое сочинение. Критерии оценивания Проектная задача Буклет для дошкольника
Проектная задача Буклет для дошкольника Лазерная физика. Основные задачи курса
Лазерная физика. Основные задачи курса Буровые растворы. Бурение нефтяных и газовых скважин
Буровые растворы. Бурение нефтяных и газовых скважин Ранние формы религии. Часть I
Ранние формы религии. Часть I Анализ аптечного ассортимента лекарственного растительного сырья, содержащего эфирные масла и препаратов из него
Анализ аптечного ассортимента лекарственного растительного сырья, содержащего эфирные масла и препаратов из него Машины для противоэрозионной обработки почв
Машины для противоэрозионной обработки почв Урок химии в 8 классе Обобщающее повторение по теме сложные вещества
Урок химии в 8 классе Обобщающее повторение по теме сложные вещества Транспортная логистика. (Раздел 2.3)
Транспортная логистика. (Раздел 2.3) Психолого-педагогическое сопровождение семьи, воспитывающей ребенка раннего и дошкольного возраста
Психолого-педагогическое сопровождение семьи, воспитывающей ребенка раннего и дошкольного возраста Строительство поверхностной обработки покрытий
Строительство поверхностной обработки покрытий Doping-legalization
Doping-legalization Русская народная сказка Теремок
Русская народная сказка Теремок красивая речь ребенка
красивая речь ребенка Значение и перспективы развития тары и упаковки в управлении товародвижением в компании “СПСР экспресс”
Значение и перспективы развития тары и упаковки в управлении товародвижением в компании “СПСР экспресс” Давление. 7 класс
Давление. 7 класс Une petite histoire
Une petite histoire Военнослужащие и взаимоотношения между ними
Военнослужащие и взаимоотношения между ними Морфофункциональная характеристика скелета и аппарата движения нижних конечностей человека
Морфофункциональная характеристика скелета и аппарата движения нижних конечностей человека Медиация равных
Медиация равных род.собрание
род.собрание Смешанное вскармливание. Лекция
Смешанное вскармливание. Лекция