Содержание
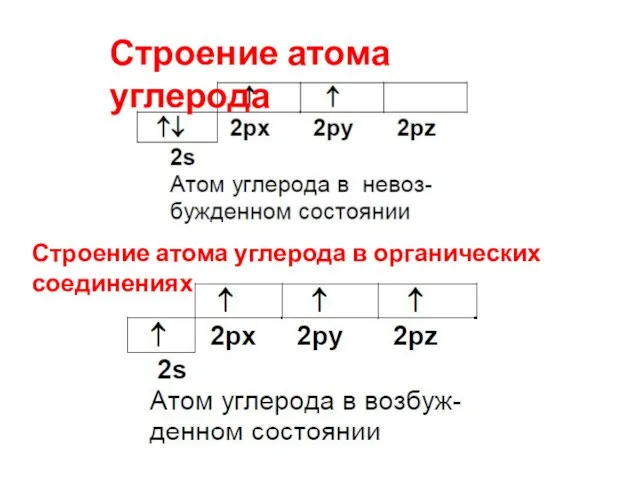
- 2. Строение атома углерода Строение атома углерода в органических соединениях
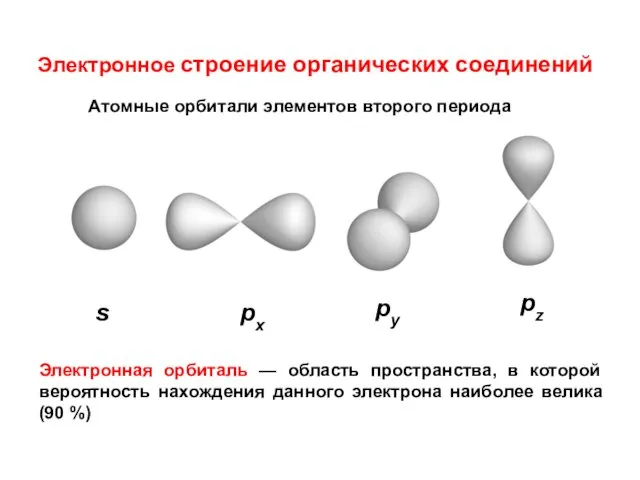
- 3. Электронное строение органических соединений Электронная орбиталь — область пространства, в которой вероятность нахождения данного электрона наиболее
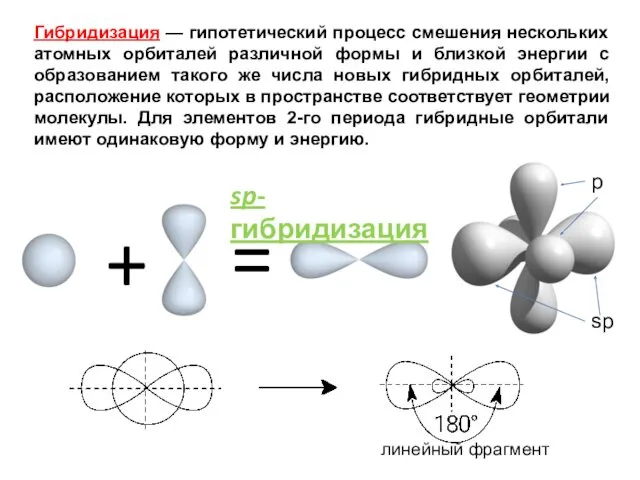
- 4. = + sp-гибридизация Гибридизация — гипотетический процесс смешения нескольких атомных орбиталей различной формы и близкой энергии
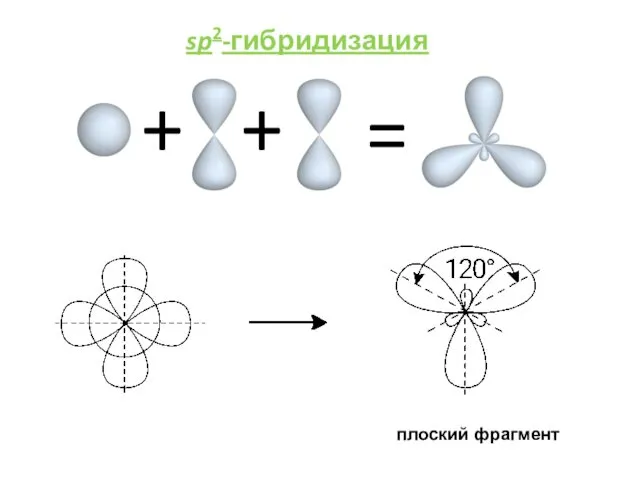
- 5. = + + sp2-гибридизация плоский фрагмент
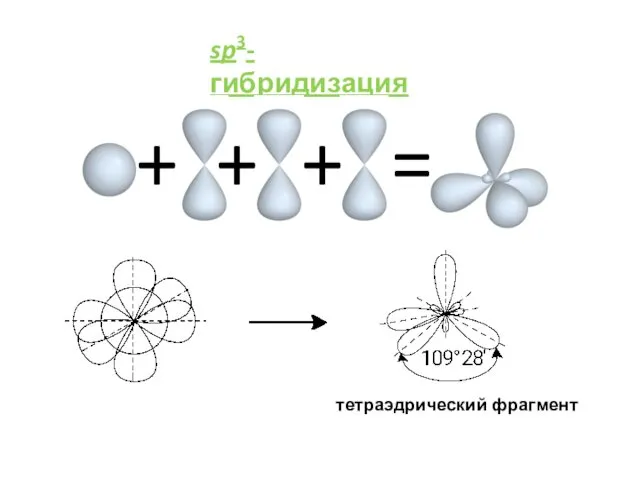
- 6. sp3-гибридизация = + + + тетраэдрический фрагмент
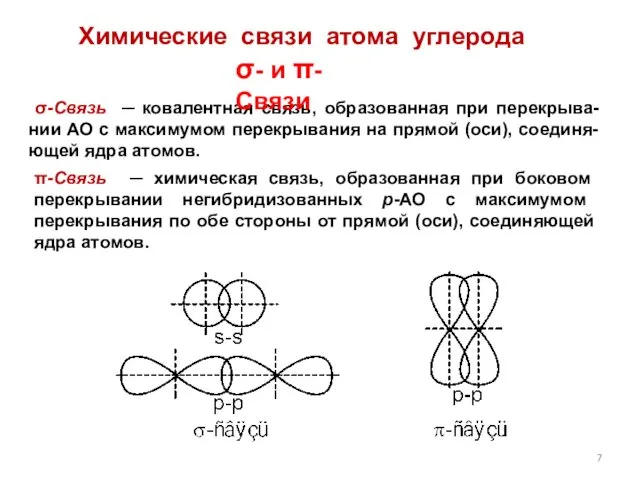
- 7. π-Связь ─ химическая связь, образованная при боковом перекрывании негибридизованных р-АО с максимумом перекрывания по обе стороны
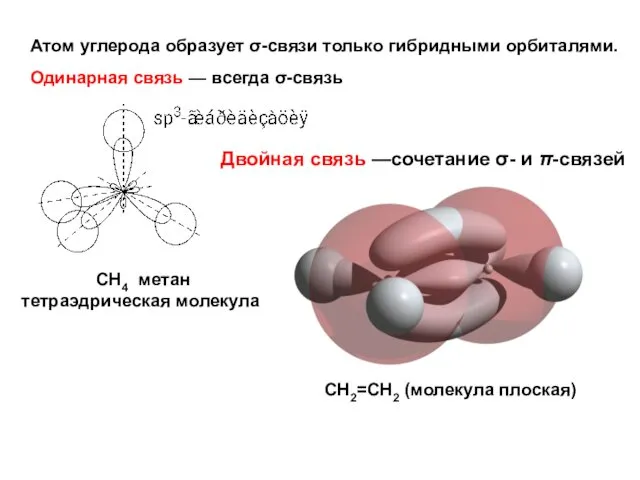
- 8. Атом углерода образует σ-связи только гибридными орбиталями. СН4 метан тетраэдрическая молекула Одинарная связь — всегда σ-связь
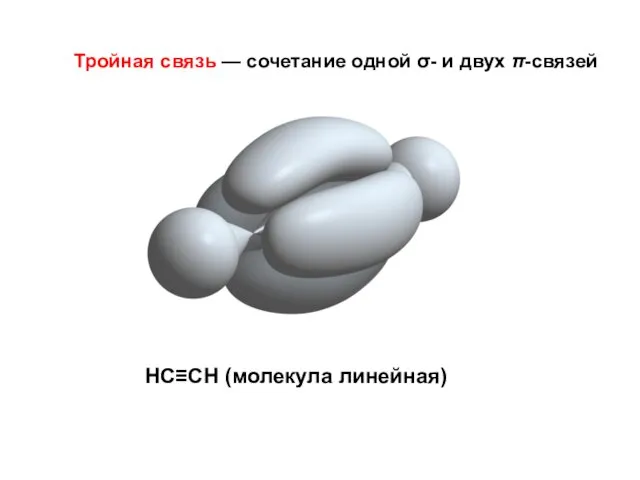
- 9. Тройная связь — сочетание одной σ- и двух π-связей НС≡СН (молекула линейная)
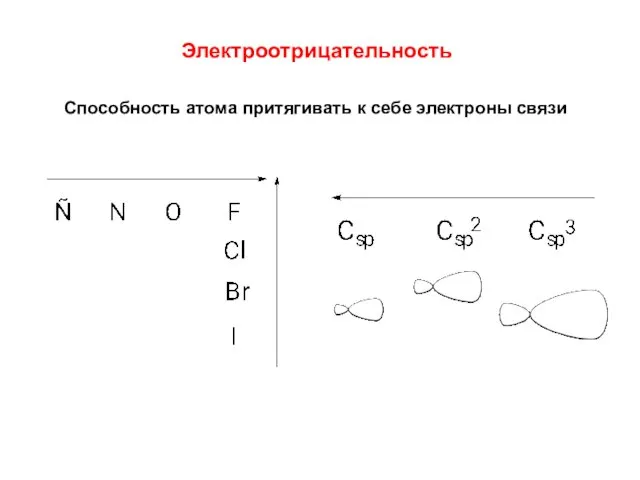
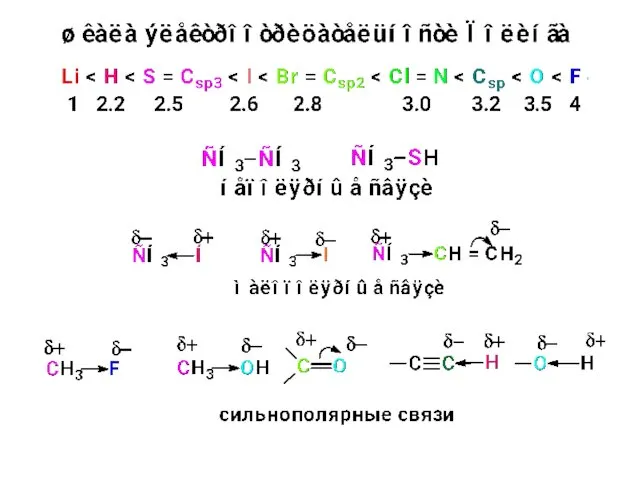
- 10. Электроотрицательность Способность атома притягивать к себе электроны связи
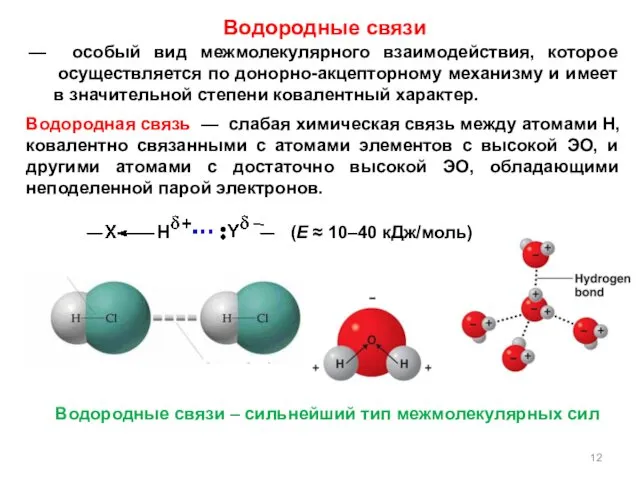
- 12. — особый вид межмолекулярного взаимодействия, которое осуществляется по донорно-акцепторному механизму и имеет в значительной степени ковалентный
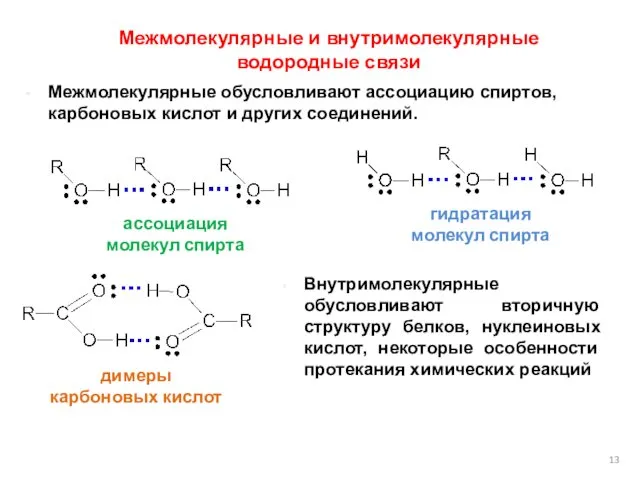
- 13. Межмолекулярные обусловливают ассоциацию спиртов, карбоновых кислот и других соединений. Межмолекулярные и внутримолекулярные водородные связи Внутримолекулярные обусловливают
- 14. Делокализованные химические связи Делокализация электронной плотности ведет к более равномерному распределению электронной плотности в молекуле, что
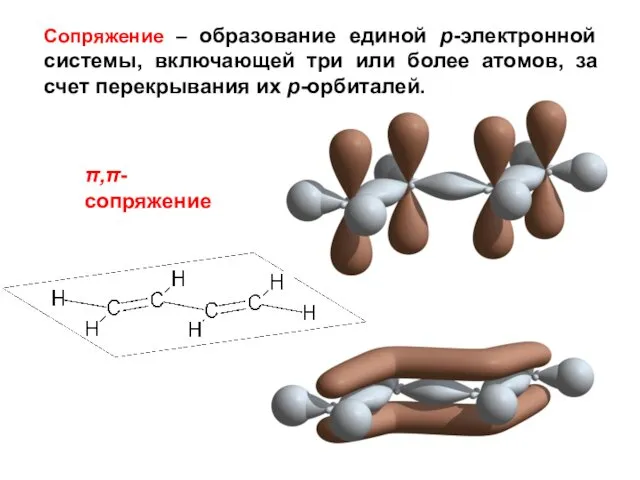
- 15. Сопряжение – образование единой р-электронной системы, включающей три или более атомов, за счет перекрывания их p-орбиталей.
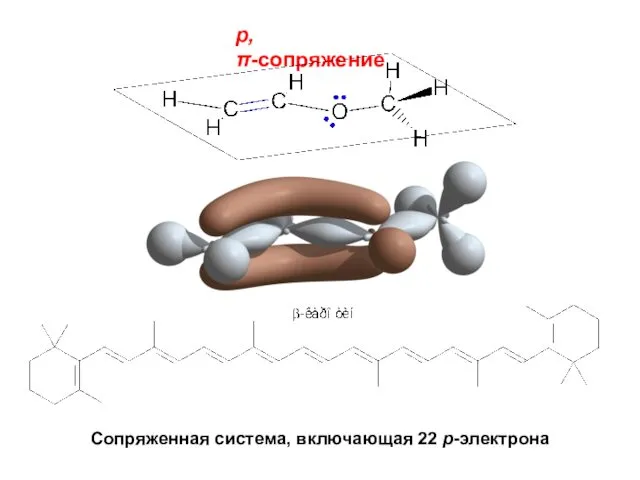
- 16. p,π-cопряжение Сопряженная система, включающая 22 р-электрона
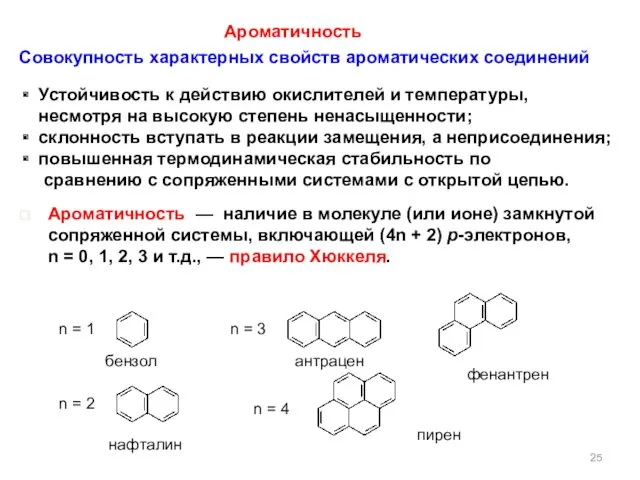
- 17. 25 Совокупность характерных свойств ароматических соединений Устойчивость к действию окислителей и температуры, несмотря на высокую степень
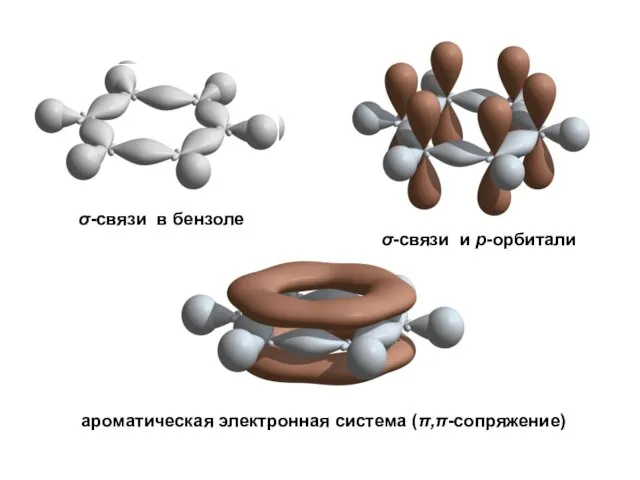
- 18. σ-связи в бензоле σ-связи и р-орбитали ароматическая электронная система (π,π-сопряжение)
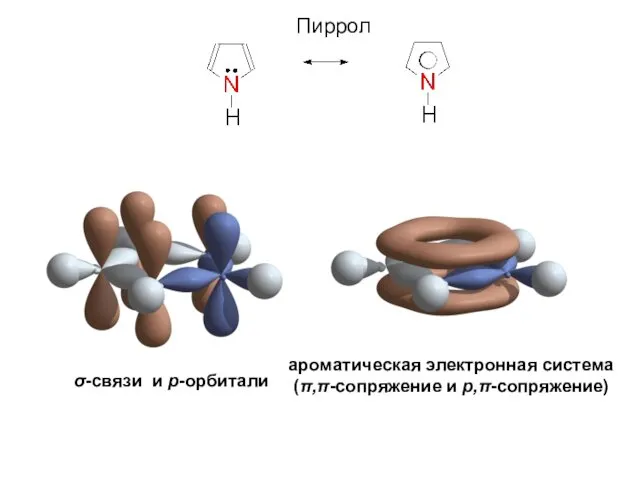
- 19. Пиррол σ-связи и р-орбитали ароматическая электронная система (π,π-сопряжение и p,π-cопряжение)
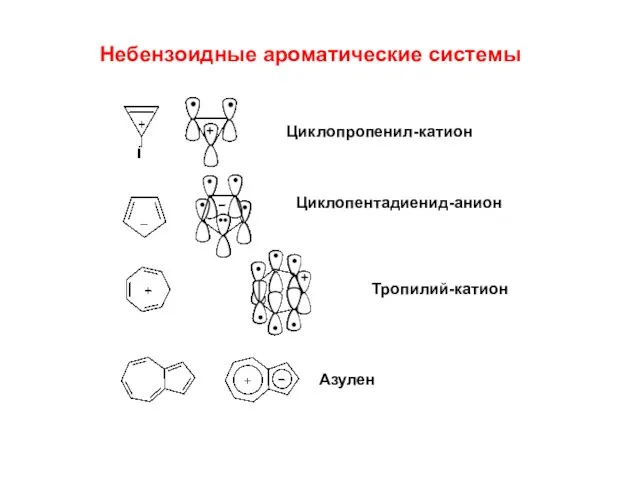
- 20. Небензоидные ароматические системы Циклопропенил-катион Циклопентадиенид-анион Тропилий-катион Азулен
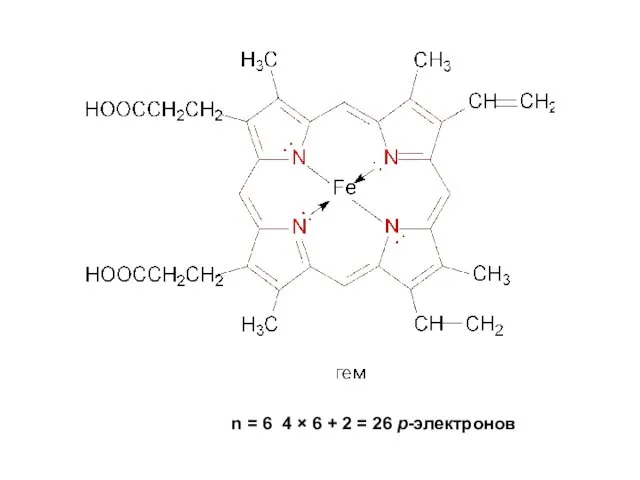
- 21. n = 6 4 × 6 + 2 = 26 p-электронов
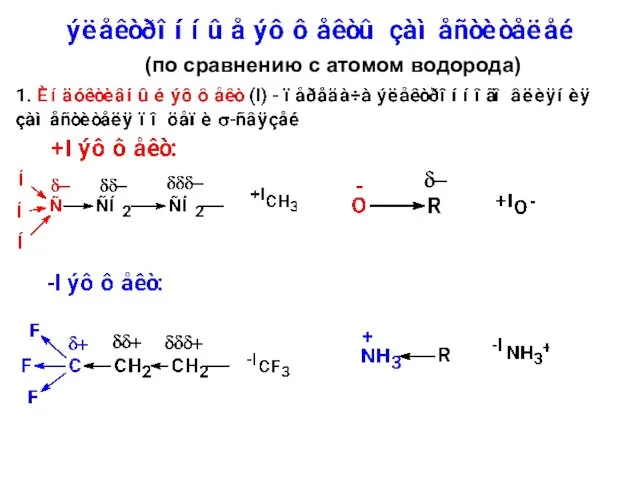
- 22. (по сравнению с атомом водорода)
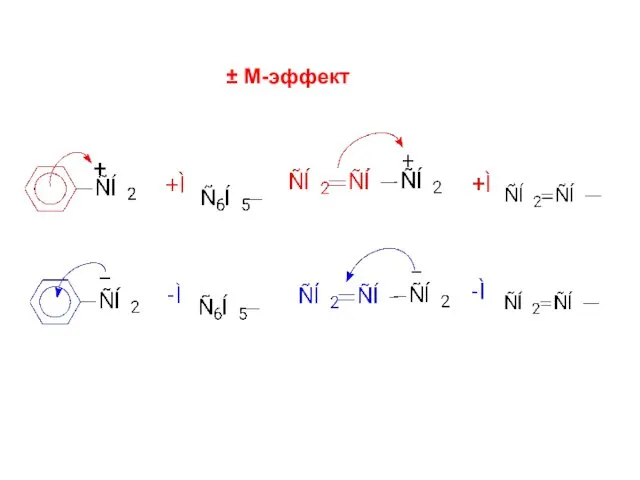
- 24. ± М-эффект
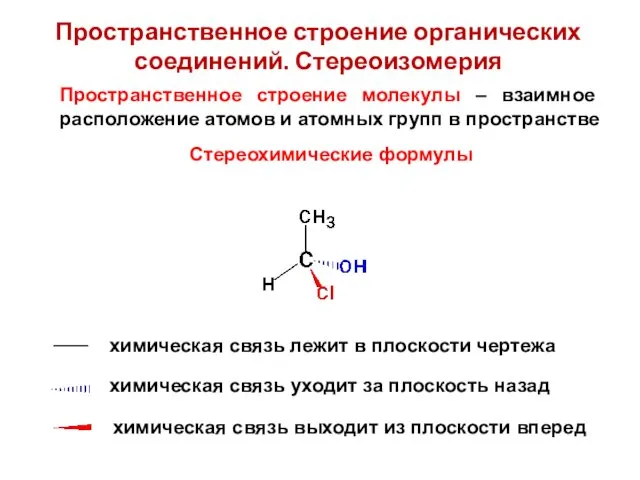
- 25. Пространственное строение органических соединений. Стереоизомерия Стереохимические формулы Пространственное строение молекулы – взаимное расположение атомов и атомных
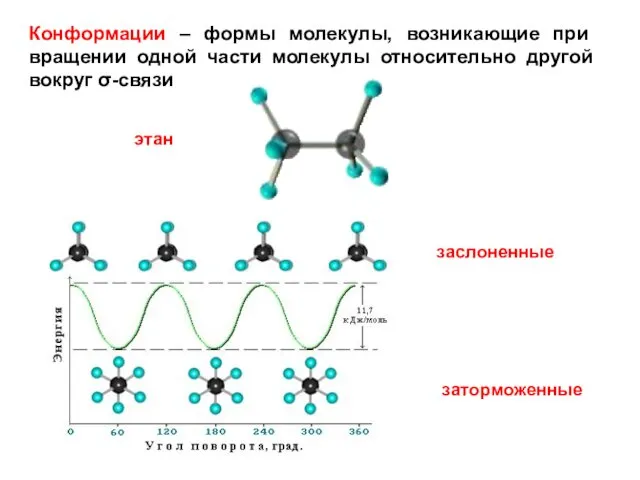
- 26. Конформации – формы молекулы, возникающие при вращении одной части молекулы относительно другой вокруг σ-связи этан заслоненные
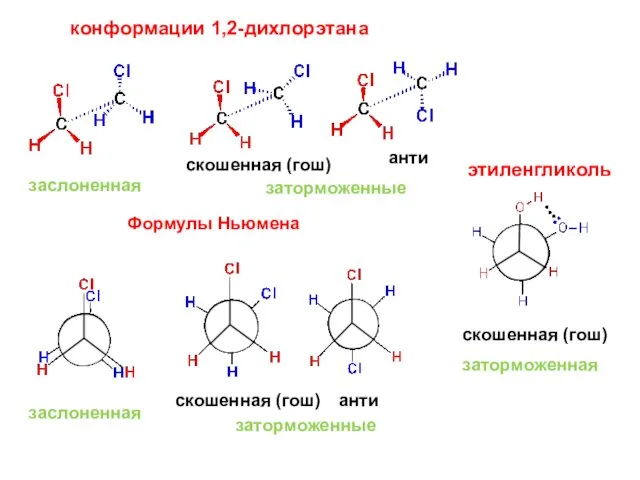
- 27. конформации 1,2-дихлорэтана заслоненная заторможенные скошенная (гош) анти Формулы Ньюмена заслоненная заторможенные скошенная (гош) анти скошенная (гош)
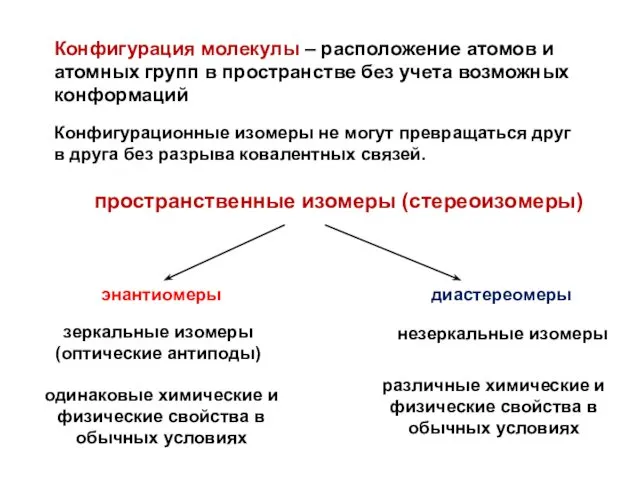
- 28. Конфигурация молекулы – расположение атомов и атомных групп в пространстве без учета возможных конформаций пространственные изомеры
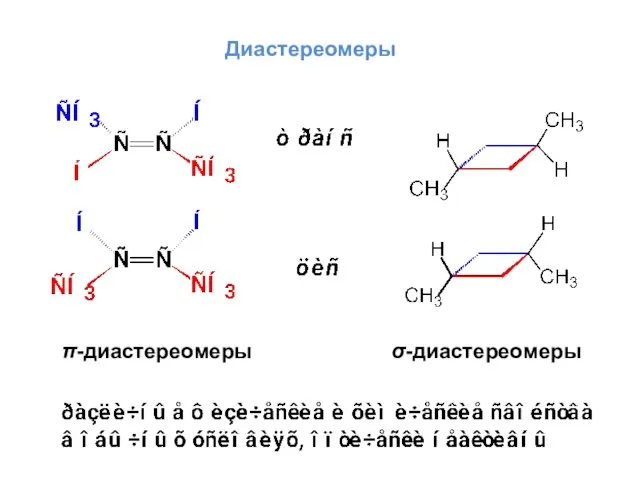
- 29. π-диастереомеры σ-диастереомеры Диастереомеры
- 30. Хиральность – свойство объекта не совпадать со своим зеркальным отражением Асимметрический атом углерода – атом углерода,
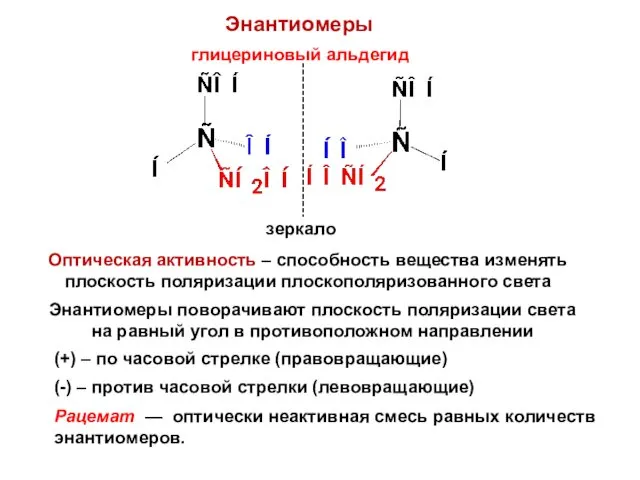
- 31. Энантиомеры глицериновый альдегид зеркало Оптическая активность – способность вещества изменять плоскость поляризации плоскополяризованного света Энантиомеры поворачивают
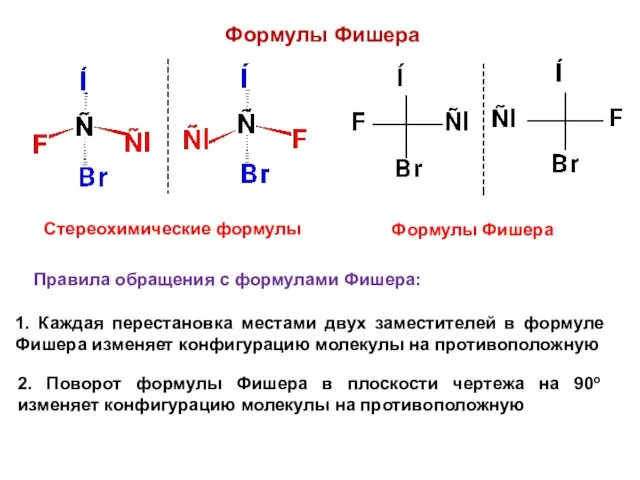
- 32. Формулы Фишера Стереохимические формулы Формулы Фишера Правила обращения с формулами Фишера: 1. Каждая перестановка местами двух
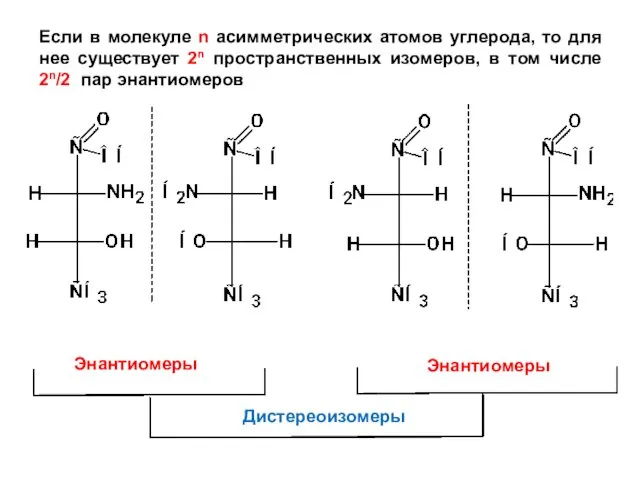
- 33. Если в молекуле n асимметрических атомов углерода, то для нее существует 2n пространственных изомеров, в том
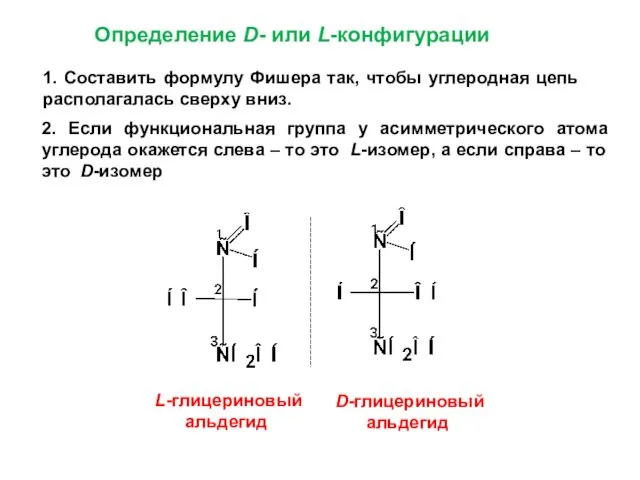
- 34. Определение D- или L-конфигурации 1. Составить формулу Фишера так, чтобы углеродная цепь располагалась сверху вниз. 2.
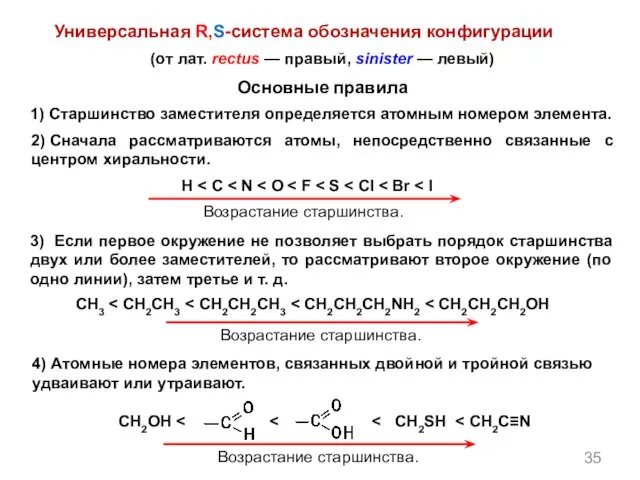
- 35. 1) Старшинство заместителя определяется атомным номером элемента. Основные правила (от лат. rectus — правый, sinister —
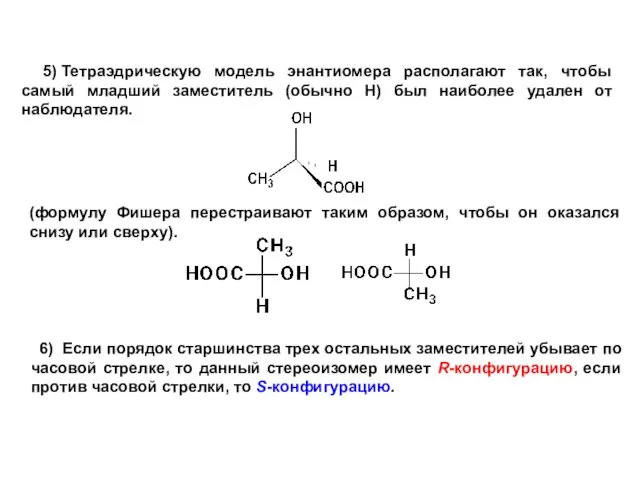
- 36. 5) Тетраэдрическую модель энантиомера располагают так, чтобы самый младший заместитель (обычно Н) был наиболее удален от
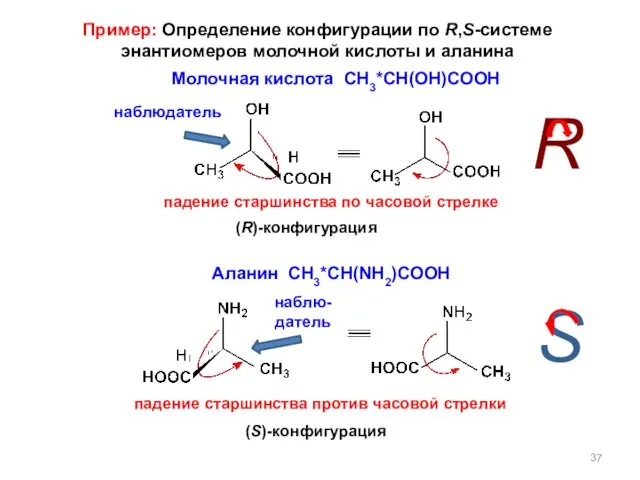
- 37. (R)-конфигурация Молочная кислота СH3*CH(OH)COOH Аланин СH3*CH(NH2)COOH (S)-конфигурация R S Пример: Определение конфигурации по R,S-системе энантиомеров молочной
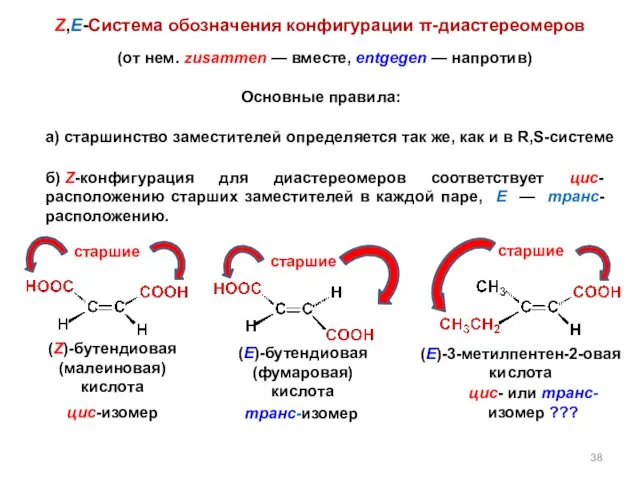
- 38. (от нем. zusammen — вместе, entgegen — напротив) а) старшинство заместителей определяется так же, как и
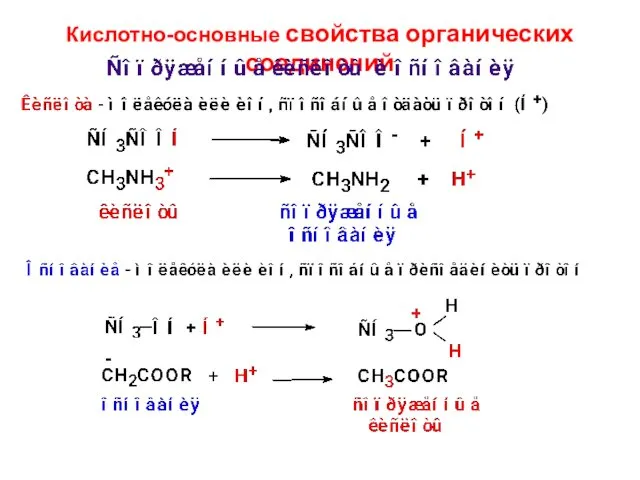
- 39. Кислотно-основные свойства органических соединений
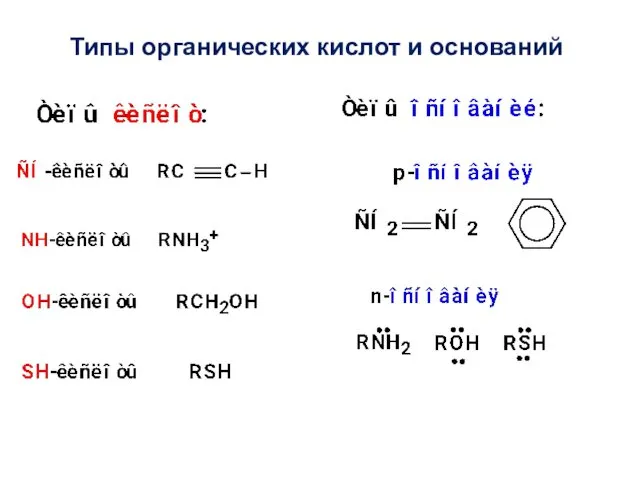
- 40. Типы органических кислот и оснований
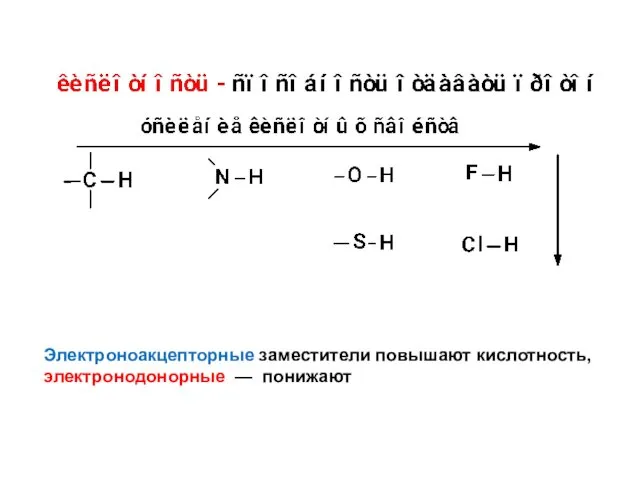
- 41. Электроноакцепторные заместители повышают кислотность, электронодонорные — понижают
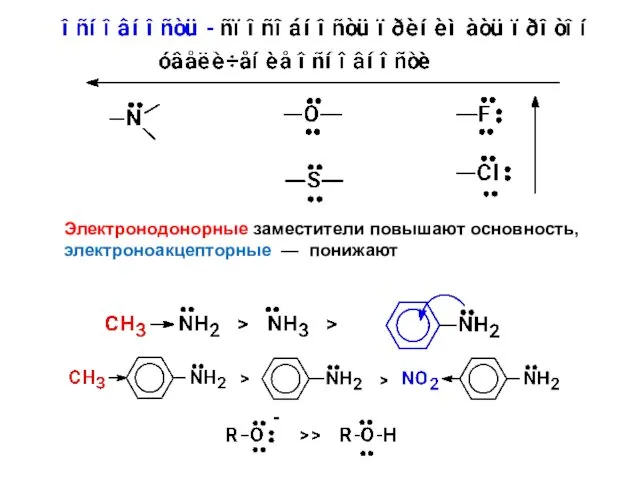
- 43. Электронодонорные заместители повышают основность, электроноакцепторные — понижают
- 45. Скачать презентацию




 Данные. Операции с данными
Данные. Операции с данными 어린이1반. 봄봄 왔어요^^
어린이1반. 봄봄 왔어요^^ Математический КВН для 9 классов
Математический КВН для 9 классов методическая разработка урока Углерод. Физические и химические свойства
методическая разработка урока Углерод. Физические и химические свойства What is Engineering?
What is Engineering? Сүт қышқылды өнімдерді өндіруге пайдаланатын ашытқылардың түрлері және олардың өнім сапасына әсері
Сүт қышқылды өнімдерді өндіруге пайдаланатын ашытқылардың түрлері және олардың өнім сапасына әсері График движения поездов
График движения поездов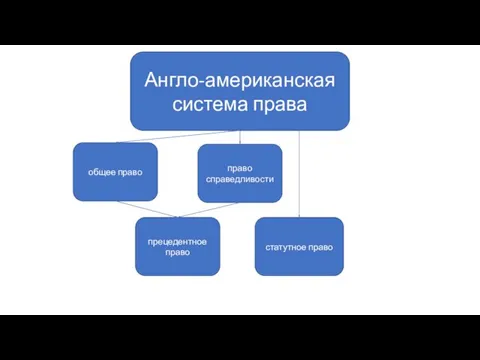 Англо-американская система права
Англо-американская система права Ресурстанудың негізгі терминдері. Экспедициялық ресурстық зерттеулер
Ресурстанудың негізгі терминдері. Экспедициялық ресурстық зерттеулер Miami hotels
Miami hotels Презентация к МК Использование здоровьесберегающих технологий на учебных занятиях
Презентация к МК Использование здоровьесберегающих технологий на учебных занятиях Презентация Развитие речи у неговорящих детей
Презентация Развитие речи у неговорящих детей Зима в картинах русских художников
Зима в картинах русских художников Моделирование сочинения-рассуждения на лингвистическую тему
Моделирование сочинения-рассуждения на лингвистическую тему Чрезвычайные ситуации социального характера
Чрезвычайные ситуации социального характера 20231028_znamenitye_tiraspolchane
20231028_znamenitye_tiraspolchane Базовая программа занятий по первой помощи
Базовая программа занятий по первой помощи Дидактические игры на развитие лексико-грамматического строя речи
Дидактические игры на развитие лексико-грамматического строя речи Методическая разработка
Методическая разработка Традиционные и нетрадиционные направления в искусстве в конце 19 - начале 20в
Традиционные и нетрадиционные направления в искусстве в конце 19 - начале 20в СССР в 1945-1964.г.г
СССР в 1945-1964.г.г Внеклассное мероприятие Праздник мам (конспект + презентация)
Внеклассное мероприятие Праздник мам (конспект + презентация) Театрализованная деятельность в ДОУ
Театрализованная деятельность в ДОУ Дөңестік рельс тізбектері. (Дәріс 20)
Дөңестік рельс тізбектері. (Дәріс 20) презентация дидактические игры
презентация дидактические игры Садимся за уроки
Садимся за уроки Ppk_Osnovy
Ppk_Osnovy Осенний субботник на пришкольной территории
Осенний субботник на пришкольной территории