Содержание
- 2. Насыщаемость Насыщаемость ковалентной связи определяеться числом общих электронных пар,которыми характерезуется тот или иной атом. Насыщенность,это полное
- 3. Изменение полярности молекулы,это неравномерное распределение электронной плотности в молекуле,например в молекуле HCI,электронная плотность около ядра хлора
- 4. Дипольный момент Для оценки полярности пользуются постоянным дипольным моментом м (мю), представляющим собой произведение эффективного заряда
- 5. Полярность молекул.Полярность связей. На примере HCI,эти понятия совпадают! В таких молекулах чем больше разность ЭО, тем
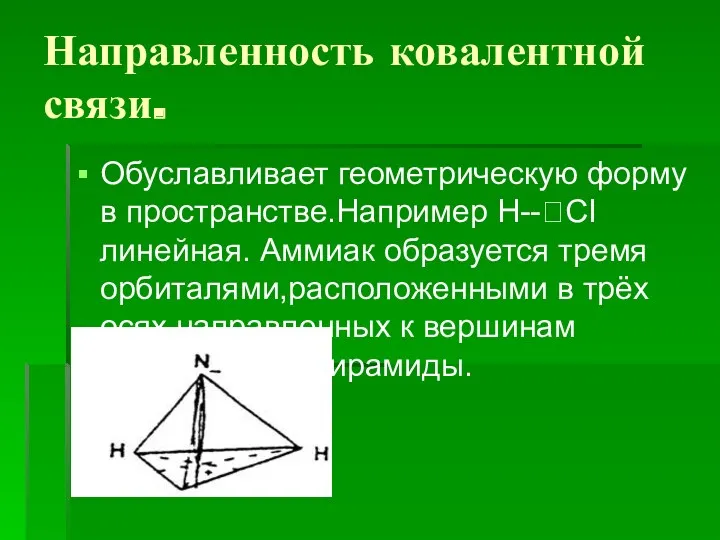
- 6. Направленность ковалентной связи. Обуславливает геометрическую форму в пространстве.Например H--?CI линейная. Аммиак образуется тремя орбиталями,расположенными в трёх
- 7. Гибридизация валентных орбиталей. Гибридизация орбиталей– это смешение их и выравнивание по форме в форму неправильной восьмёрки
- 8. Тип гибридизации определяет форму молекулы SP гибридизация в молекуле изменяет форму две орбитали центрального атома S
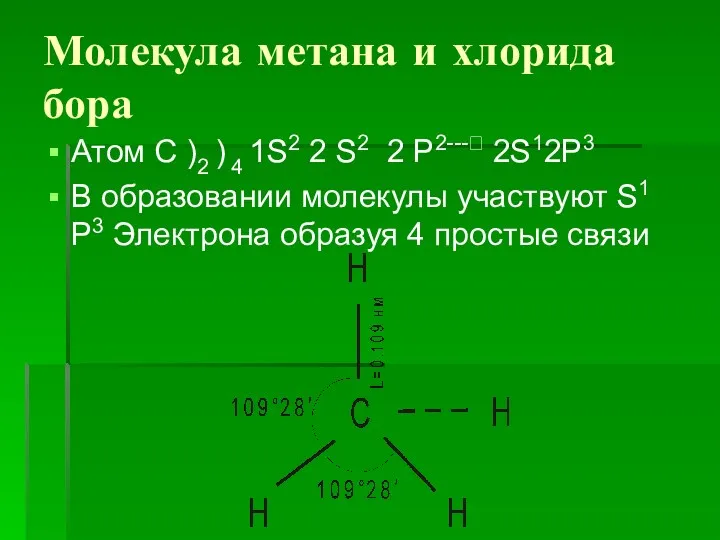
- 9. Молекула метана и хлорида бора Атом С )2 ) 4 1S2 2 S2 2 P2---? 2S12P3
- 11. Скачать презентацию






 наш класс
наш класс классная работа
классная работа Презентация загадок для малышей
Презентация загадок для малышей Математика на 2 февраля
Математика на 2 февраля Стихи на уроках 3
Стихи на уроках 3 Самбо
Самбо Бессоюзное сложное предложение и пунктуация в нем
Бессоюзное сложное предложение и пунктуация в нем Не померкнет летопись Победы посвящается 71-летие Победы советского народа в Великой Отечественной войне
Не померкнет летопись Победы посвящается 71-летие Победы советского народа в Великой Отечественной войне Қазақстан экологиясының өткір де өзекті мәселелерін шешуге бағытталған қандай әдістер бар
Қазақстан экологиясының өткір де өзекті мәселелерін шешуге бағытталған қандай әдістер бар перелыгина
перелыгина Комплексная программа инновационного развития холдинга РЖД
Комплексная программа инновационного развития холдинга РЖД Программно-методические материалы к занятиям по программе В мире мягкой фантазии. Стыковочный шов
Программно-методические материалы к занятиям по программе В мире мягкой фантазии. Стыковочный шов Пришкольный детский лагерь отдыха Солнышко МАОУ СОШ №27 с дневным пребыванием детей
Пришкольный детский лагерь отдыха Солнышко МАОУ СОШ №27 с дневным пребыванием детей Present continuous
Present continuous Педагогический опыт учителей словесности города Симферополя на форуме Российская словесность – культурный код нации
Педагогический опыт учителей словесности города Симферополя на форуме Российская словесность – культурный код нации Циклы в программировании на языке Паскаль
Циклы в программировании на языке Паскаль Инновационные процессы в образовании Ростов-на-Дону – 2019
Инновационные процессы в образовании Ростов-на-Дону – 2019 Мир художественной культуры Просвещения
Мир художественной культуры Просвещения Глубокая очистка сточных вод от соединений фосфора с использованием минеральных реагентов
Глубокая очистка сточных вод от соединений фосфора с использованием минеральных реагентов Головоломки мира
Головоломки мира Презентация непосредственно- образовательной деятельности учителя- логопеда с детьми подготовительного возраста по автоматизации звука [ж] в слогах, словах и предложениях
Презентация непосредственно- образовательной деятельности учителя- логопеда с детьми подготовительного возраста по автоматизации звука [ж] в слогах, словах и предложениях Урок истории Древнего мира в 5 классе
Урок истории Древнего мира в 5 классе Методы, средства и оборудование подогрева нефтепродуктов на нефтебазах
Методы, средства и оборудование подогрева нефтепродуктов на нефтебазах Технология точения древесины на токарном станке
Технология точения древесины на токарном станке Парадигмы –доминанты в современном языкознании
Парадигмы –доминанты в современном языкознании Семинар Интеграция и реализация образовательных областей согласно ФГТ
Семинар Интеграция и реализация образовательных областей согласно ФГТ Обогащение полезных ископаемых. Природные ресурсы Красноярского края
Обогащение полезных ископаемых. Природные ресурсы Красноярского края Презентация к уроку Западно-Сибирская равнина. Особенности природы
Презентация к уроку Западно-Сибирская равнина. Особенности природы