Содержание
- 2. Основная задача Т лимфоцитов - контролировать внутриклеточные патогены (АТ не могут этого делать) – те, что
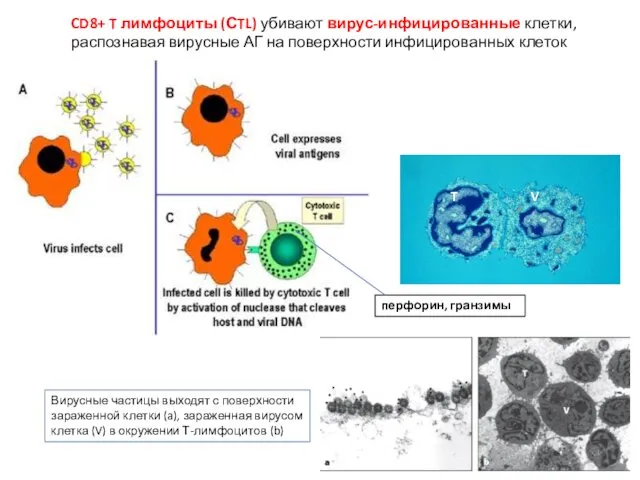
- 3. CD8+ T лимфоциты (СTL) убивают вирус-инфицированные клетки, распознавая вирусные АГ на поверхности инфицированных клеток T V
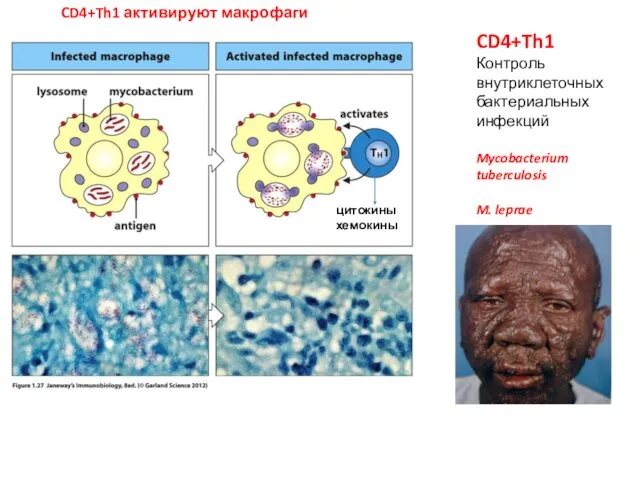
- 4. CD4+Th1 Контроль внутриклеточных бактериальных инфекций Mycobacterium tuberculosis M. leprae CD4+Th1 активируют макрофаги
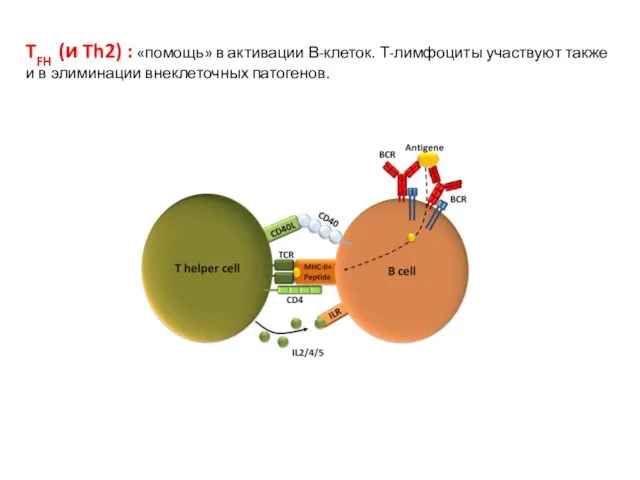
- 5. TFH (и Th2) : «помощь» в активации В-клеток. Т-лимфоциты участвуют также и в элиминации внеклеточных патогенов.
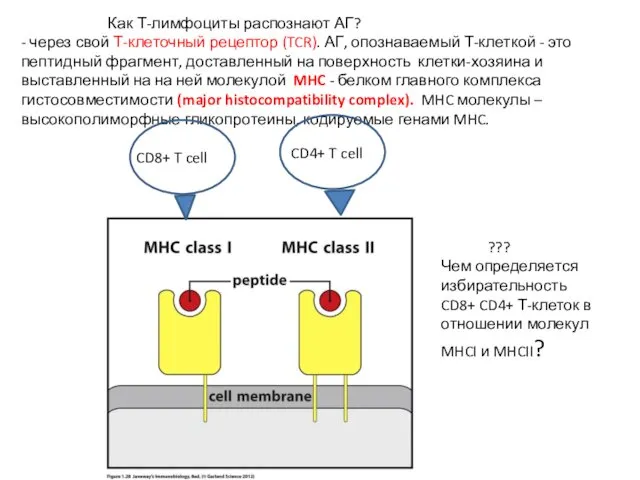
- 6. Как Т-лимфоциты распознают АГ? - через свой Т-клеточный рецептор (TCR). АГ, опознаваемый Т-клеткой - это пептидный
- 7. Чем определяется избирательность CD8+ и CD4+ Т-клеток в отношении молекул MHCI и MHCII? - 1. Природой
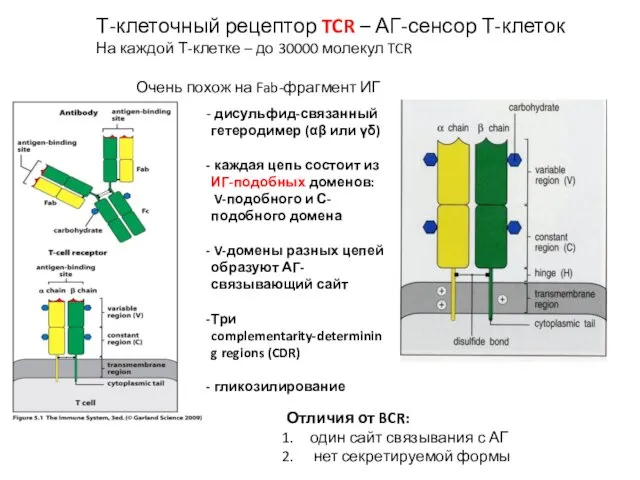
- 8. Т-клеточный рецептор TCR – АГ-сенсор Т-клеток На каждой Т-клетке – до 30000 молекул TCR Очень похож
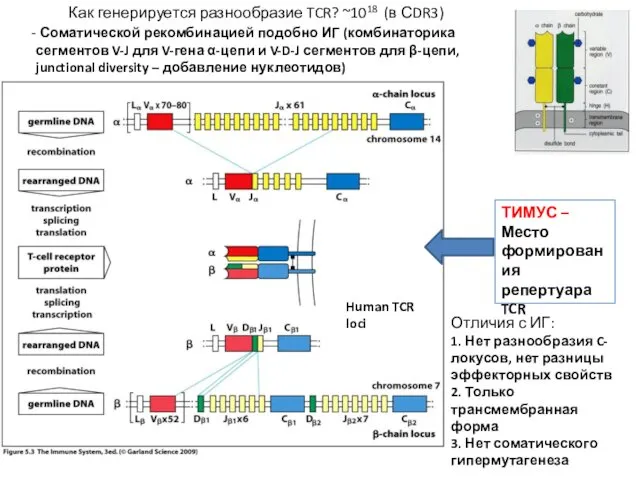
- 9. Как генерируется разнообразие TCR? ~1018 (в СDR3) Соматической рекомбинацией подобно ИГ (комбинаторика сегментов V-J для V-гена
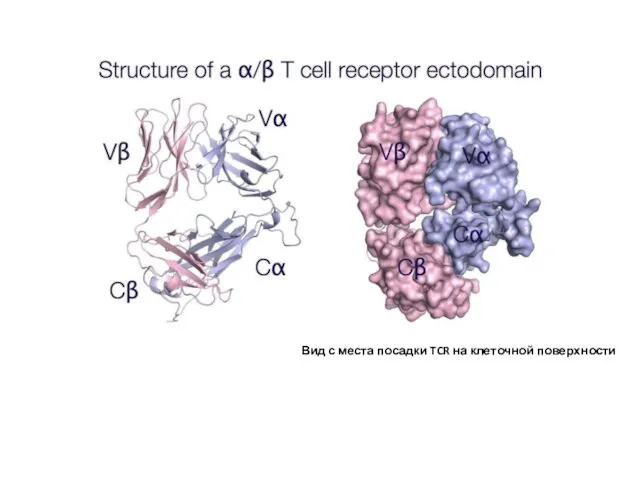
- 10. Вид с места посадки TCR на клеточной поверхности
- 11. TCR распознает АГ в форме комплекса пептида (короткая аминокислотная цепь АГ), связанного с молекулой MHC. Распознавание
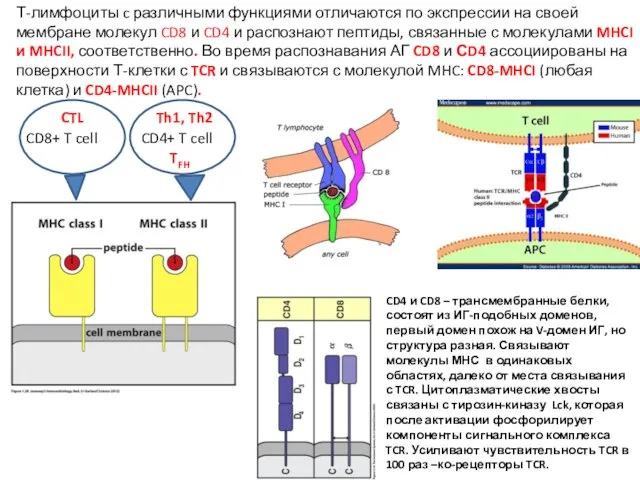
- 12. Т-лимфоциты c различными функциями отличаются по экспрессии на своей мембране молекул CD8 и CD4 и распознают
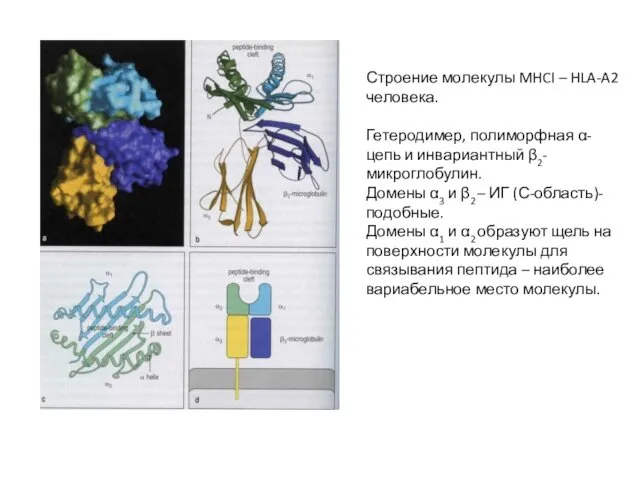
- 13. Строение молекулы MHCI – HLA-A2 человека. Гетеродимер, полиморфная α-цепь и инвариантный β2-микроглобулин. Домены α3 и β2
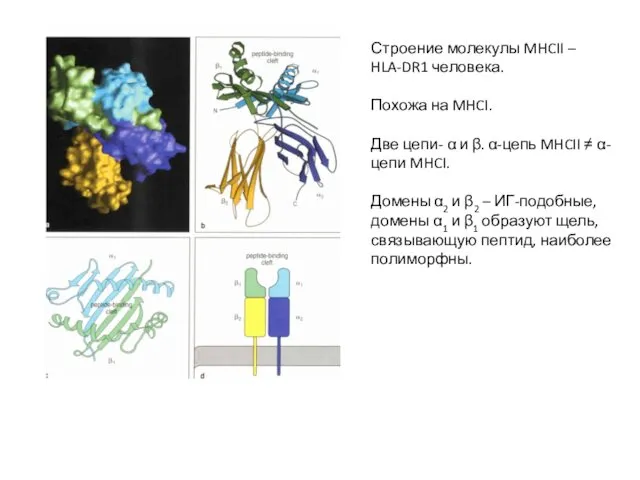
- 14. Строение молекулы MHCII – HLA-DR1 человека. Похожа на MHCI. Две цепи- α и β. α-цепь MHCII
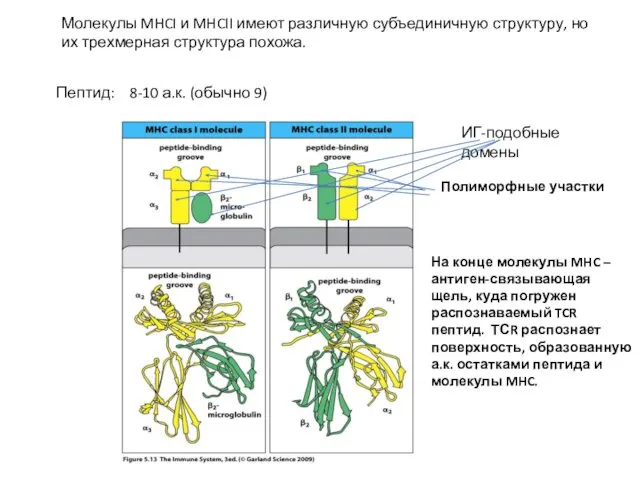
- 15. Молекулы MHCI и MHCII имеют различную субъединичную структуру, но их трехмерная структура похожа. ИГ-подобные домены Полиморфные
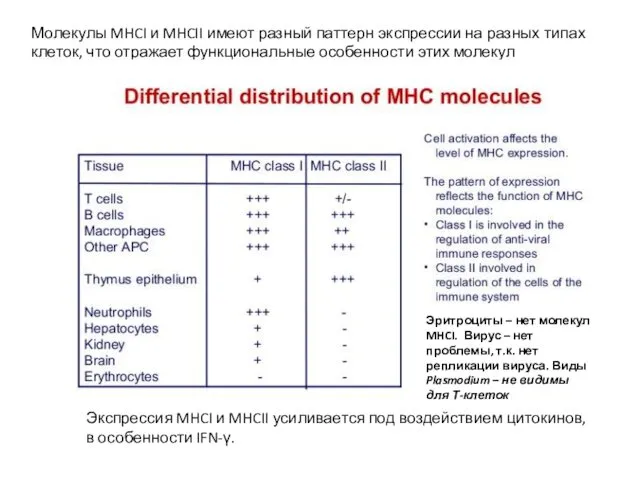
- 16. Молекулы MHCI и MHCII имеют разный паттерн экспрессии на разных типах клеток, что отражает функциональные особенности
- 17. Пептид-связывающий сайт каждой молекулы MHC может связать некоторое разнообразие пептидов (но ограниченное определенным а.к. мотивом). Пептид
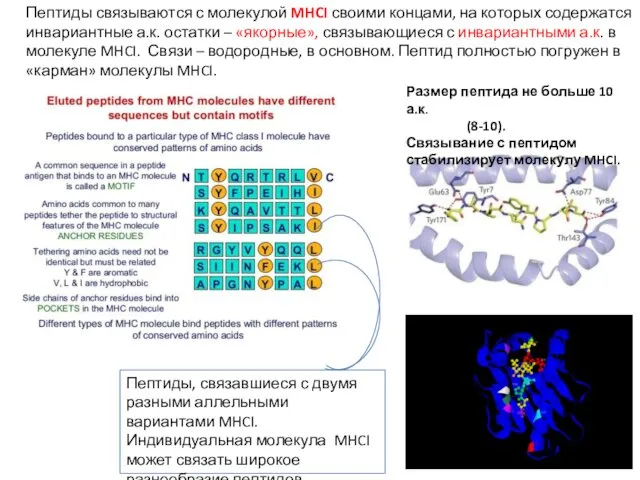
- 18. Пептиды связываются с молекулой MHCI своими концами, на которых содержатся инвариантные а.к. остатки – «якорные», связывающиеся
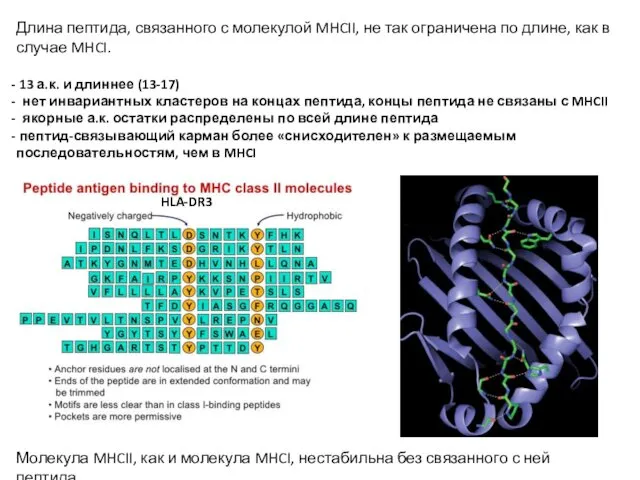
- 19. Длина пептида, связанного с молекулой MHCII, не так ограничена по длине, как в случае MHCI. 13
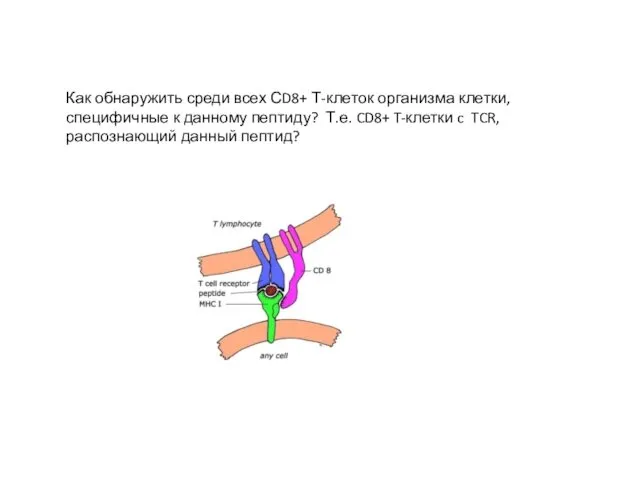
- 20. Как обнаружить среди всех СD8+ Т-клеток организма клетки, специфичные к данному пептиду? Т.е. CD8+ T-клетки c
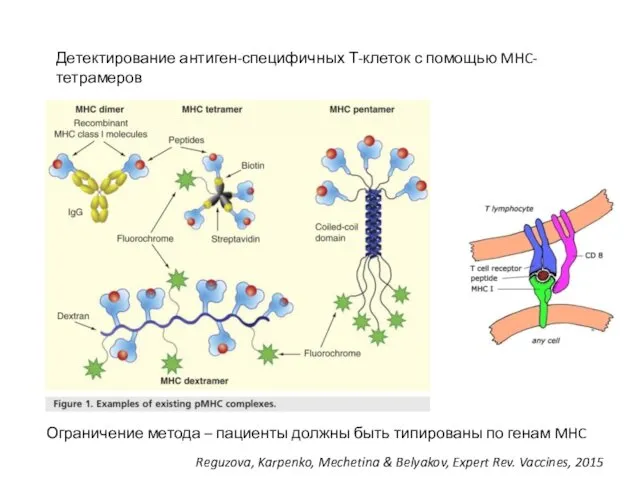
- 21. Детектирование антиген-специфичных Т-клеток с помощью MHC-тетрамеров Reguzova, Karpenko, Mechetina & Belyakov, Expert Rev. Vaccines, 2015 Ограничение
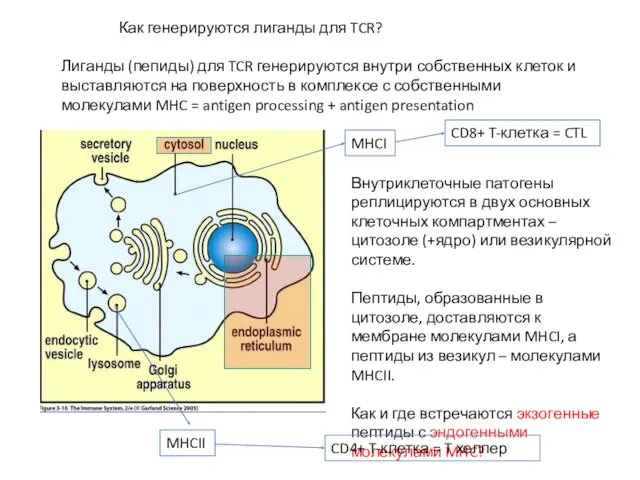
- 22. Как генерируются лиганды для TCR? Лиганды (пепиды) для TCR генерируются внутри собственных клеток и выставляются на
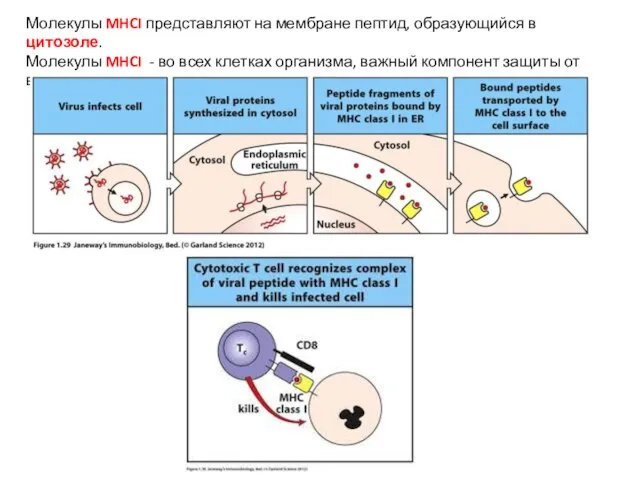
- 23. Молекулы MHCI представляют на мембране пептид, образующийся в цитозоле. Молекулы MHCI - во всех клетках организма,
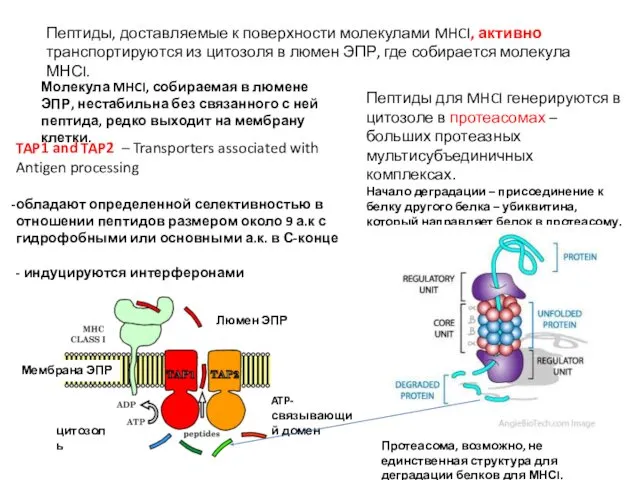
- 24. Пептиды, доставляемые к поверхности молекулами MHCI, активно транспортируются из цитозоля в люмен ЭПР, где собирается молекула
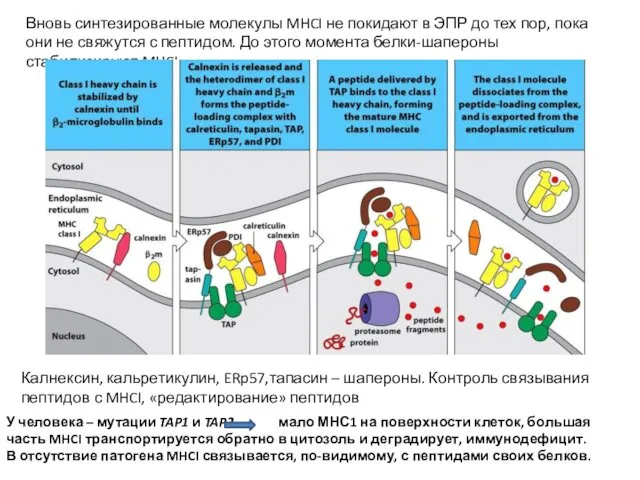
- 25. Вновь синтезированные молекулы MHCI не покидают в ЭПР до тех пор, пока они не свяжутся с
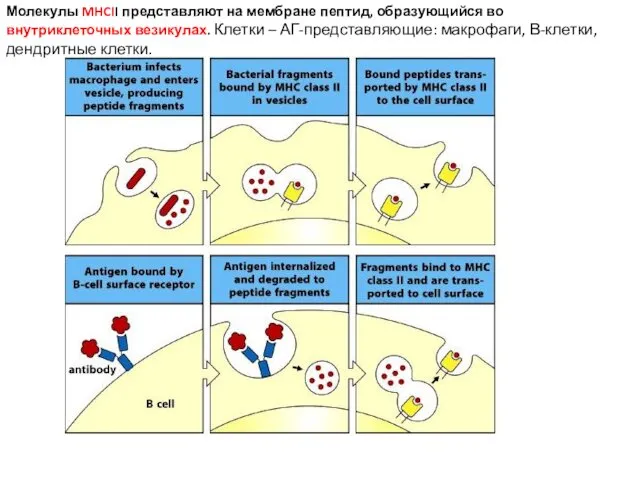
- 26. Молекулы MHCII представляют на мембране пептид, образующийся во внутриклеточных везикулах. Клетки – АГ-представляющие: макрофаги, В-клетки, дендритные
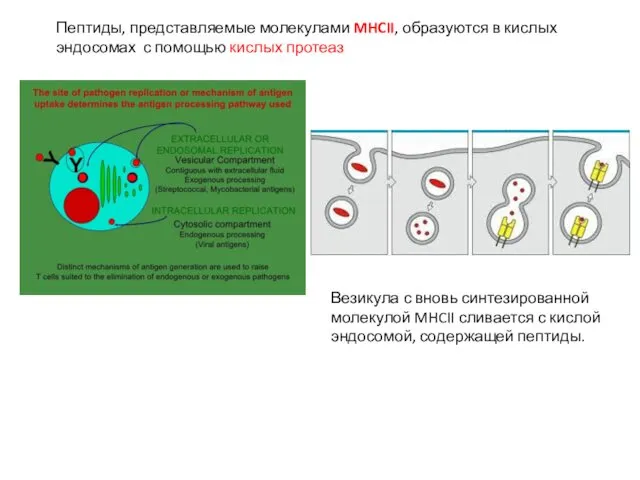
- 27. Пептиды, представляемые молекулами MHCII, образуются в кислых эндосомах с помощью кислых протеаз Везикула с вновь синтезированной
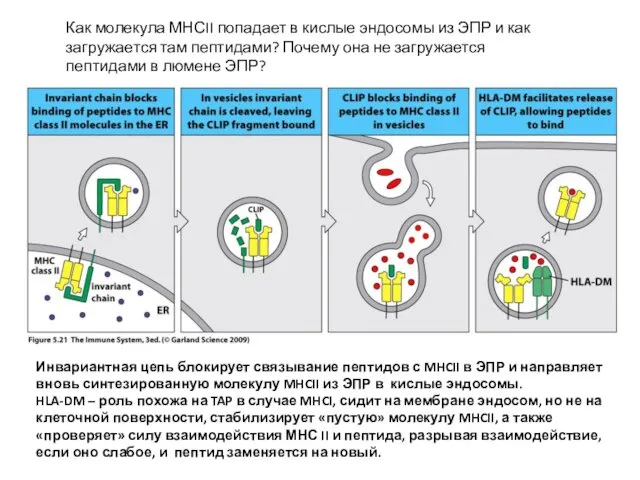
- 28. Инвариантная цепь блокирует связывание пептидов с MHCII в ЭПР и направляет вновь синтезированную молекулу MHCII из
- 30. Скачать презентацию




 Centrum logistyczne to jest wyspecjalizowana struktura
Centrum logistyczne to jest wyspecjalizowana struktura Предмет и метод микроэкономики
Предмет и метод микроэкономики The main types of nutrition in microorganisms
The main types of nutrition in microorganisms Страна Англия
Страна Англия Вялікія геаграфічныя адкрыцці
Вялікія геаграфічныя адкрыцці Мнемотаблица на тему Зима
Мнемотаблица на тему Зима Культура организации. (Тема 17)
Культура организации. (Тема 17)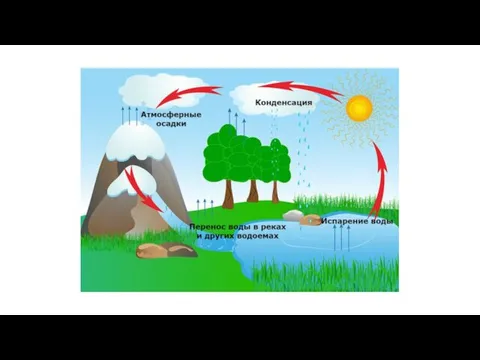 Циклы. Цикл FOR
Циклы. Цикл FOR Геометрия 8 класс Свойства параллелограмма
Геометрия 8 класс Свойства параллелограмма Антон Павлович Чехов
Антон Павлович Чехов Презентация по лексической теме Профессии
Презентация по лексической теме Профессии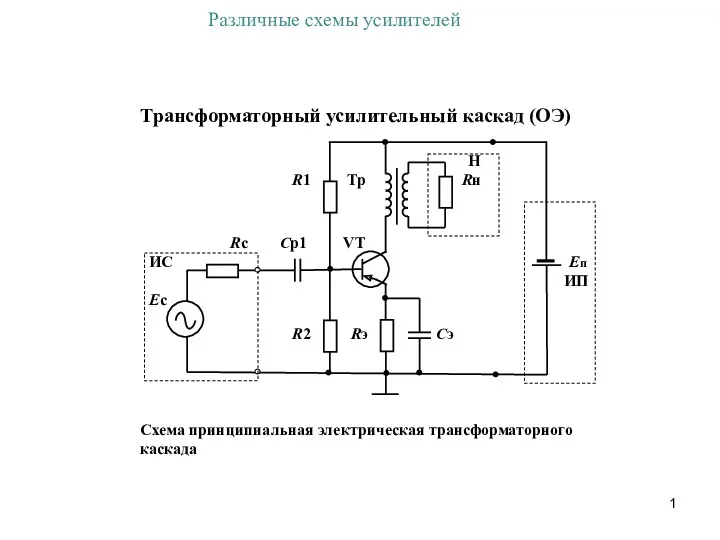 Различные схемы усилителей
Различные схемы усилителей Южная Корея.
Южная Корея. Сложные эфиры. Жиры
Сложные эфиры. Жиры Правила оформления ВКР, курсовых работ, рефератов по ГОСТ 7.32-2001
Правила оформления ВКР, курсовых работ, рефератов по ГОСТ 7.32-2001 Проектирование противопожарной защиты учреждений системы образования для маломобильных групп населения. Тема 3.2.2
Проектирование противопожарной защиты учреждений системы образования для маломобильных групп населения. Тема 3.2.2 Кожа. Виды кожи
Кожа. Виды кожи Технико-экономические параметры вагона
Технико-экономические параметры вагона презентация на тему: Правила поведения безопасности в кабинете информатики
презентация на тему: Правила поведения безопасности в кабинете информатики Активизация творческой деятельности
Активизация творческой деятельности Электронное колье NeckTec: носимый компьютер будущего
Электронное колье NeckTec: носимый компьютер будущего Отчётная презентация
Отчётная презентация Из жизни слов. Слово любовь
Из жизни слов. Слово любовь Проекты в доу
Проекты в доу Отделочные материалы и изделия
Отделочные материалы и изделия Алгоритмы. Подсказки
Алгоритмы. Подсказки Лекция-09.03.22
Лекция-09.03.22 Plotva-2
Plotva-2