Содержание
- 2. Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных,
- 3. Фосфор. Строение атома, аллотропия, свойства и применение фосфора.
- 4. Цель: Определить положение серы в периодической системе химических элементов Д.И. Менделеева; Рассмотреть строение атома серы, физические
- 5. Положение фосфора в периодической системе химических элементов Д.И. Менделеева ?
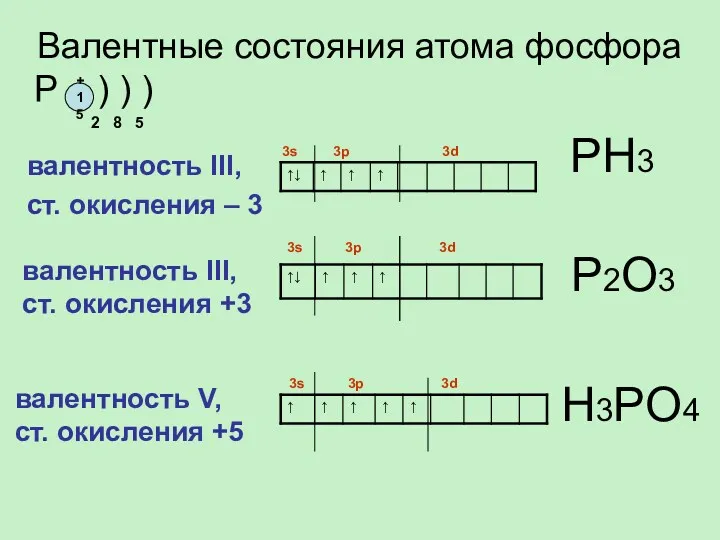
- 7. валентность III, ст. окисления – 3 Валентные состояния атома фосфора P ) ) ) 2 8
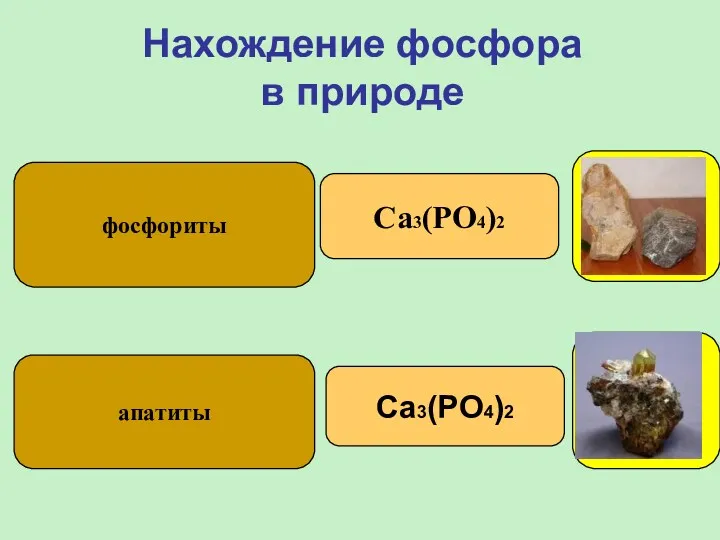
- 8. Нахождение фосфора в природе фосфориты апатиты Ca3(PO4)2 Ca3(PO4)2
- 9. Физические свойства фосфора Твердое вещество в воде не растворяется
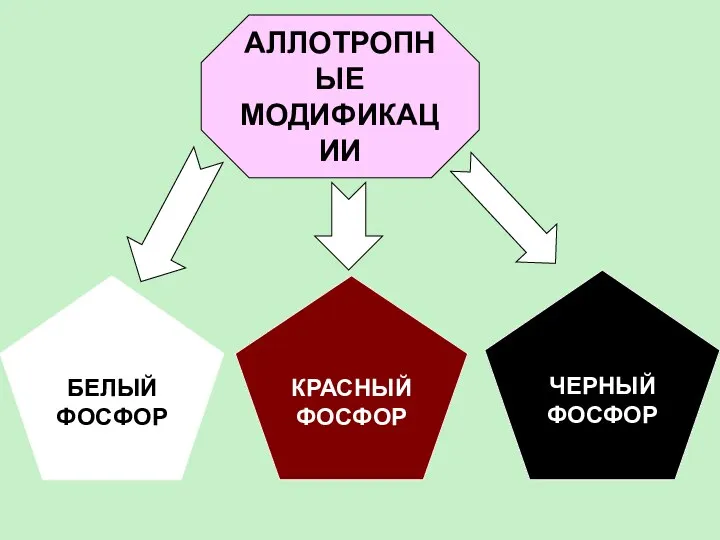
- 10. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ КРАСНЫЙ ФОСФОР ЧЕРНЫЙ ФОСФОР БЕЛЫЙ ФОСФОР
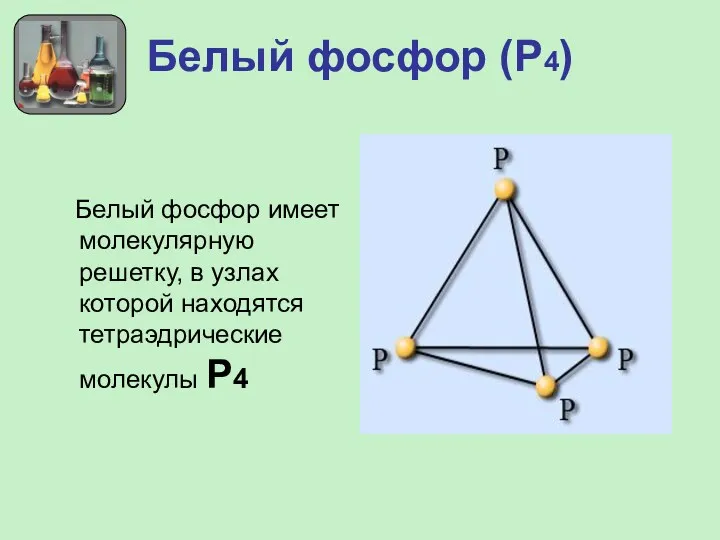
- 11. Белый фосфор (Р4) Белый фосфор имеет молекулярную решетку, в узлах которой находятся тетраэдрические молекулы Р4
- 12. Белый фосфор (Р4) Белое кристаллическое вещество с желтоватый оттенком легко режется ножом в воде не растворяется,
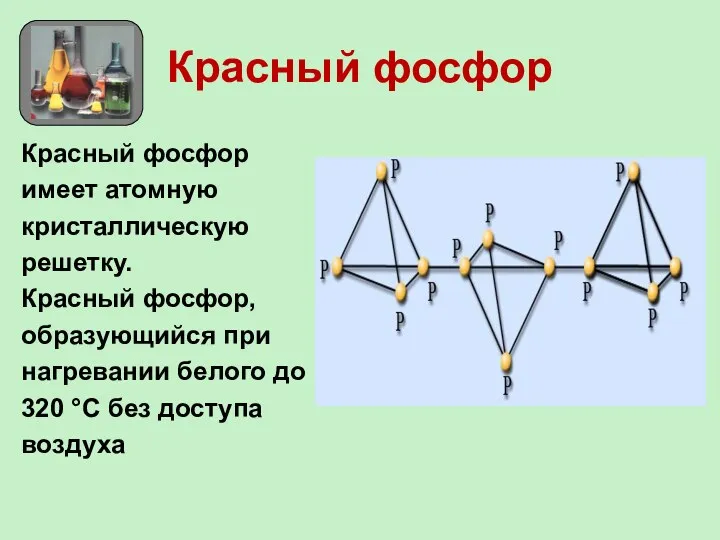
- 13. Красный фосфор Красный фосфор имеет атомную кристаллическую решетку. Красный фосфор, образующийся при нагревании белого до 320
- 14. Красный фосфор аморфное вещество без запаха, красно-бурого цвета, не ядовит. не огнеопасен в воде и сероуглероде
- 15. Черный фосфор Черный фосфор имеет атомную кристаллическую решетку. Образуется при нагревании белого фосфора без доступа воздуха.
- 16. Черный фосфор полимерное вещество с металлическим блеском, похож на графит, без запаха, жирный на ощупь. нерастворим
- 17. Химические свойства фосфора Взаимодействие фосфора с простыми веществами Фосфор реагирует: А) с металлами, образуя фосфиды 3Са
- 18. Химические свойства фосфора Взаимодействие фосфора с сложными веществами Фосфор реагирует: А) с хлоратом калия 6P +
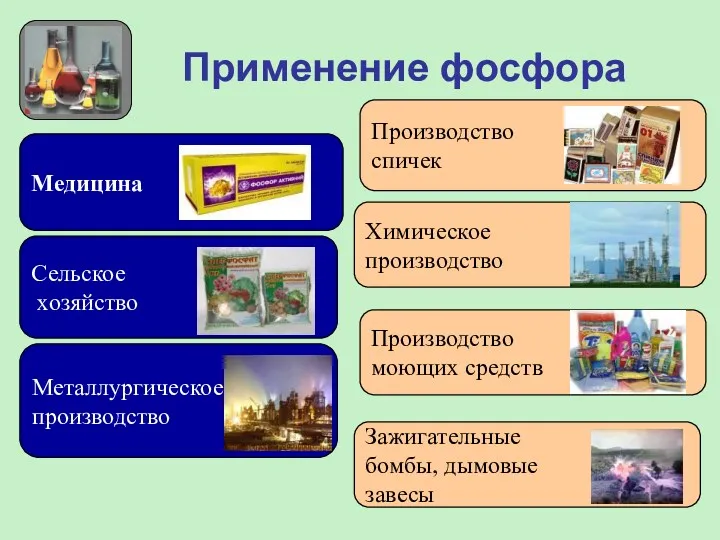
- 19. Применение фосфора Медицина Сельское хозяйство Металлургическое производство Производство спичек Химическое производство Производство моющих средств Зажигательные бомбы,
- 20. Выберите правильный ответ В каком соединении фосфор проявляет степень окисления -3? А) Н3РО4 Б) РН3 В)
- 21. Ответьте на вопросы: В каком виде фосфор находится в природе? Охарактеризуйте физические свойства фосфора (красного, белого,
- 22. Выберите правильный ответ С каким веществом реагирует фосфор образуя фосфид: А) водой Б) водородом В) магнием
- 23. Домашнее задание § 28, упр. 3
- 25. Скачать презентацию
















 Презентация Коллективная разработка ПО
Презентация Коллективная разработка ПО Невынашивание беременности
Невынашивание беременности Мікропроцесорна техніка (лекція 7)
Мікропроцесорна техніка (лекція 7) 7 класс: Оледенение С.Америки
7 класс: Оледенение С.Америки Чем археолог отличается от криминалиста. Социальные ландшафты: вещи в динамике прошлого
Чем археолог отличается от криминалиста. Социальные ландшафты: вещи в динамике прошлого Functional styles of the english language: newspaper style
Functional styles of the english language: newspaper style Статус - отчет по ремонту Сормовский 3060
Статус - отчет по ремонту Сормовский 3060 К юбилею В.Г. Распутина, Героя Социалистического Труда, дважды лауреата Государственной премии СССР
К юбилею В.Г. Распутина, Героя Социалистического Труда, дважды лауреата Государственной премии СССР Планиметрия. Повторение. Часть 1
Планиметрия. Повторение. Часть 1 Мартеновский способ производства стали. Выплавка стали в электропечах
Мартеновский способ производства стали. Выплавка стали в электропечах How to present in English
How to present in English Интеллектуальные роботы состояние и перспективы
Интеллектуальные роботы состояние и перспективы Презентация С правом по жизни.
Презентация С правом по жизни. особенности изображения Земли на глобусе и на карте
особенности изображения Земли на глобусе и на карте Декоративные злаки
Декоративные злаки Мы вместе. Часть 2
Мы вместе. Часть 2 Рисуем пластилином
Рисуем пластилином Монтаж и эксплуатация ПВО. Противовыбросовое оборудование иностранных производителей
Монтаж и эксплуатация ПВО. Противовыбросовое оборудование иностранных производителей Философия Августина Блаженного
Философия Августина Блаженного Классный час 1сентября Эхо Бесланской печали
Классный час 1сентября Эхо Бесланской печали Конспект урока географии в 6 классе Тайны подземных бурь.
Конспект урока географии в 6 классе Тайны подземных бурь. Закрепление изученного в 4 классе
Закрепление изученного в 4 классе Стандартизация свойств. Физические, механические, физико-химические свойства СМ. Долговечность и надежность
Стандартизация свойств. Физические, механические, физико-химические свойства СМ. Долговечность и надежность презентация
презентация Биосфера Земли. Тест
Биосфера Земли. Тест Презентация Автоматизация звука Л в словах
Презентация Автоматизация звука Л в словах Священная Библейская история Ветхого Завета. Грехопадение и его последствия (Быт.3)
Священная Библейская история Ветхого Завета. Грехопадение и его последствия (Быт.3) Нарушения обмена хромопротеидов
Нарушения обмена хромопротеидов