Содержание
- 2. Первый закон термодинамики является законом сохранения энергии в термодинамических процессах. Внутренняя энергия U, Дж — это
- 3. Количество теплоты Q, Дж — это энергия, передаваемая системе в процессе теплообмена, т.е. без совершения механической
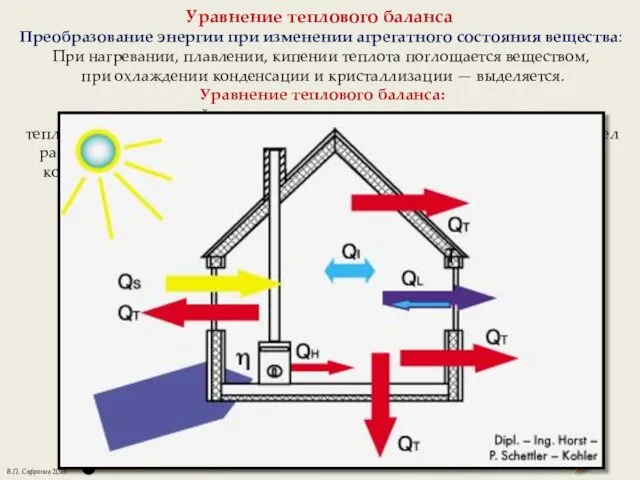
- 4. Уравнение теплового баланса Преобразование энергии при изменении агрегатного состояния вещества: При нагревании, плавлении, кипении теплота поглощается
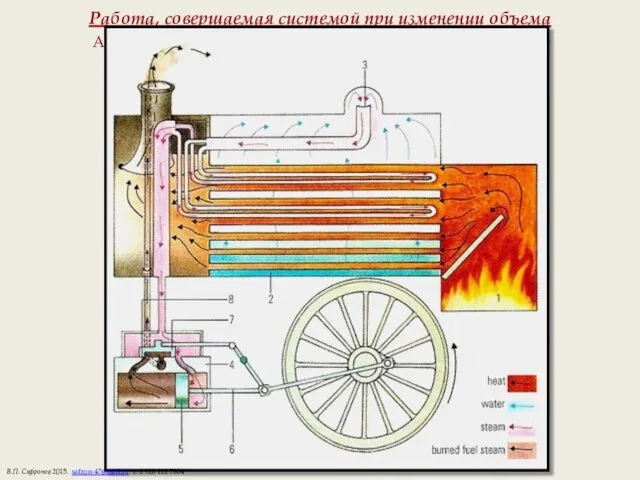
- 5. Работа, совершаемая системой при изменении объема А, Дж совершается только при изменении объема и зависит от
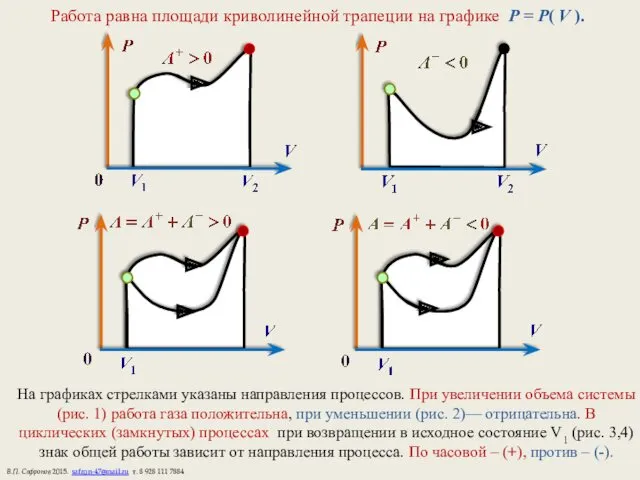
- 6. Работа равна площади криволинейной трапеции на графике P = P( V ). На графиках стрелками указаны
- 7. Первый закон термодинамики является законом сохранения энергии в термодинамических процессах: Количество теплоты Q, сообщенное системе, идет
- 8. Первый закон термодинамики в изопроцессах Изохорный процесс происходит без изменения объема : Так как V =
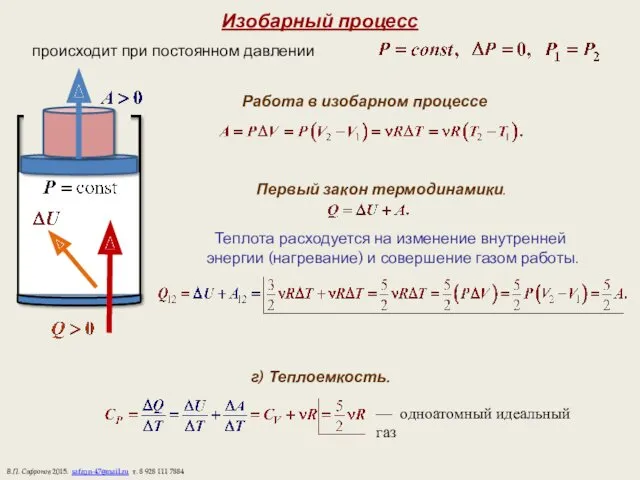
- 9. Изобарный процесс происходит при постоянном давлении Работа в изобарном процессе Первый закон термодинамики. Теплота расходуется на
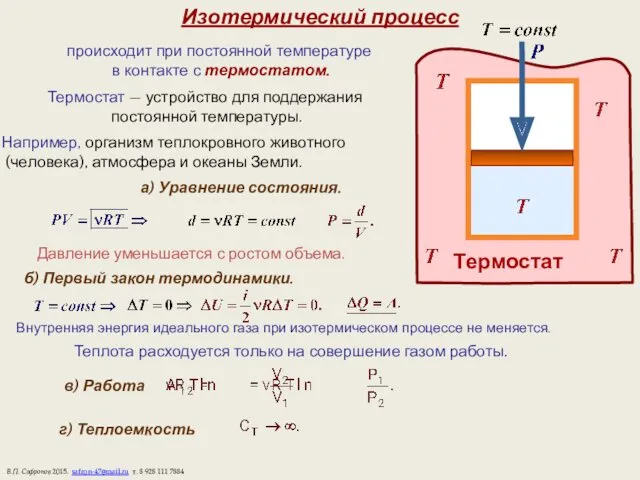
- 10. Изотермический процесс происходит при постоянной температуре в контакте с термостатом. Термостат — устройство для поддержания постоянной
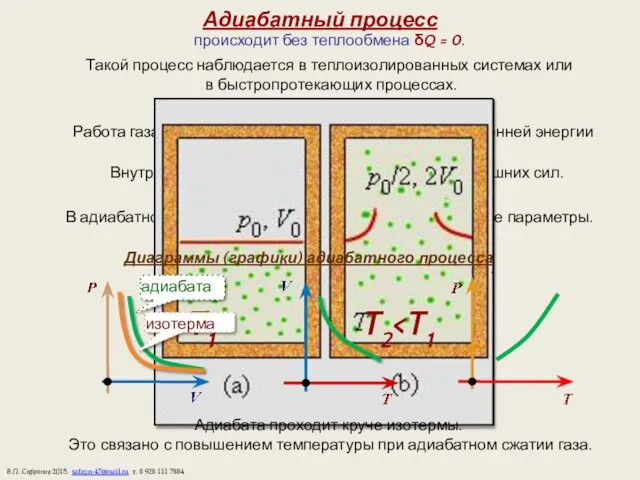
- 11. Адиабатный процесс происходит без теплообмена δQ = 0. Такой процесс наблюдается в теплоизолированных системах или в
- 12. в) Работа в адиабатном процессе г)Теплоемкость По определению, адиабатная теплоемкость Так как Адиабатная теплоемкость равна нулю.
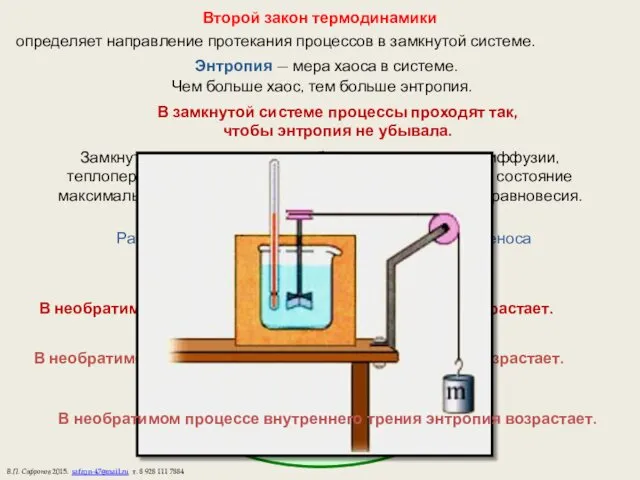
- 13. Второй закон термодинамики определяет направление протекания процессов в замкнутой системе. Энтропия — мера хаоса в системе.
- 14. Принцип действия тепловых машин (двигателей) Круговые процессы или циклы — это процессы, в результате которых система
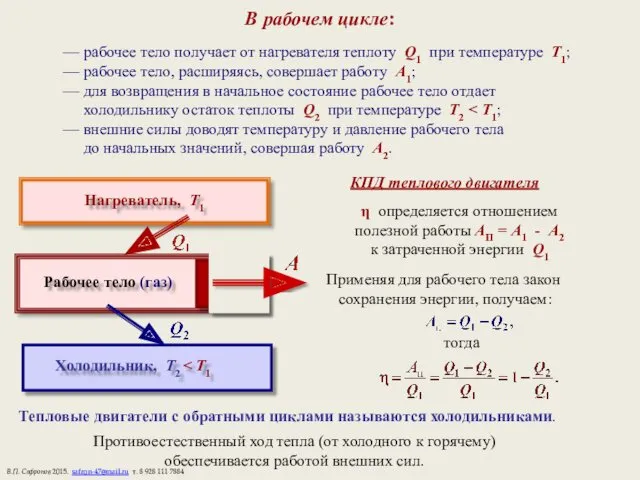
- 15. В рабочем цикле: — рабочее тело получает от нагревателя теплоту Q1 при температуре Т1; — рабочее
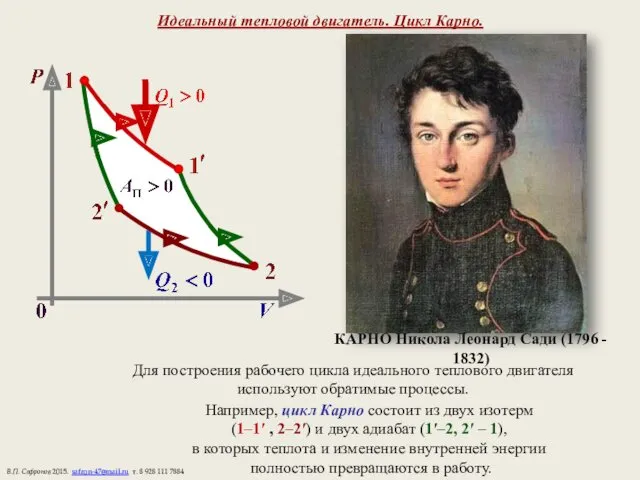
- 16. Идеальный тепловой двигатель. Цикл Карно. Для построения рабочего цикла идеального теплового двигателя используют обратимые процессы. Например,
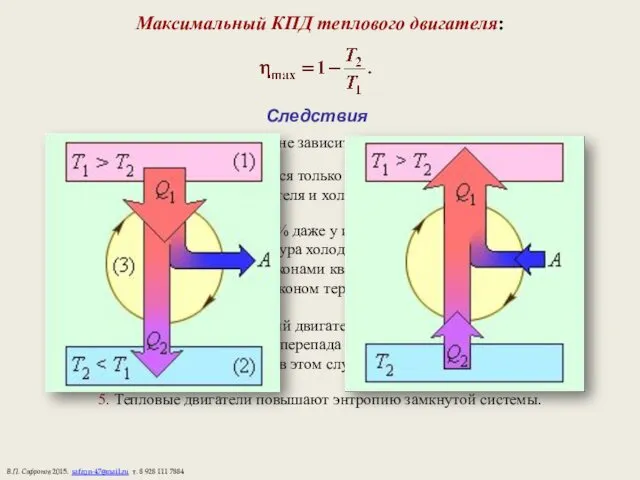
- 17. Максимальный КПД теплового двигателя: Следствия 1. КПД цикла Карно не зависит от рода рабочего тела. 2.
- 18. Цикл Карно В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
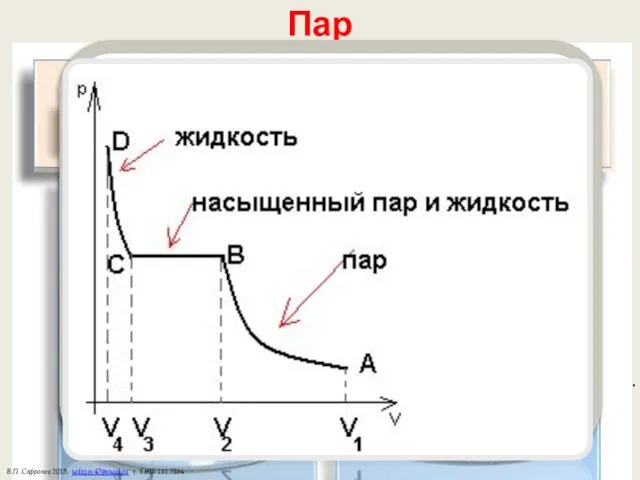
- 19. При сжатии лишняя масса пара конденсируется в жидкость. Насыщенные пары подчиняются закону Менделеева-Клаперона и закону Дальтона.
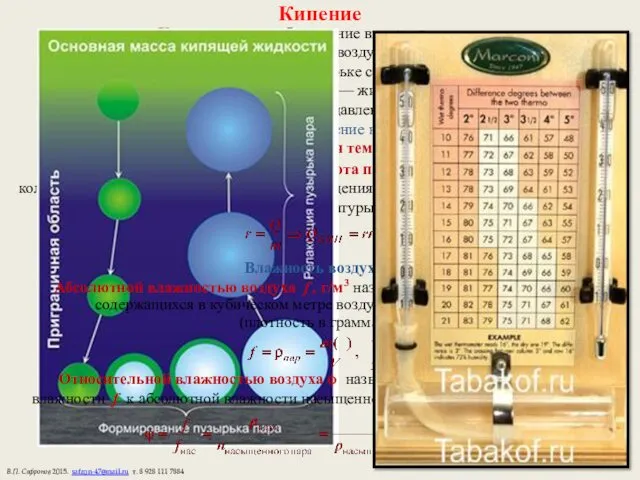
- 20. Кипение Кипение — парообразование внутри жидкости. Молекулы испаряются в пузырьки воздуха — зародыши кипения. Когда давление
- 22. Скачать презентацию






 20230419_predmet_himii
20230419_predmet_himii Выполнение работ по одной или нескольким профессиям рабочих, должностям служащих
Выполнение работ по одной или нескольким профессиям рабочих, должностям служащих Использование Су-Джок терапии - при коррекции речевых нарушений
Использование Су-Джок терапии - при коррекции речевых нарушений Просечной металл. Приемы изготовления просечного металла
Просечной металл. Приемы изготовления просечного металла Как проектировать парк. 7 шагов к созданию хорошей зеленой территории
Как проектировать парк. 7 шагов к созданию хорошей зеленой территории Валя Котик
Валя Котик Презентация по теме США 11 класс
Презентация по теме США 11 класс Волго-Вятский район
Волго-Вятский район Развитие выносливости у подростков 13-14 лет в школьной секции общей физической подготовки
Развитие выносливости у подростков 13-14 лет в школьной секции общей физической подготовки урок по ППД
урок по ППД электронное портфолио
электронное портфолио Система NTSC
Система NTSC Школьные правила в стихах.
Школьные правила в стихах. Презентация Развитие российско-китайских отношений в 17-сер. 19 вв.
Презентация Развитие российско-китайских отношений в 17-сер. 19 вв. Социальные взаимодействия
Социальные взаимодействия Что такое информация
Что такое информация Клиникалық жағдай. Anamnesis morbi
Клиникалық жағдай. Anamnesis morbi Шаблоны презентаций Художники
Шаблоны презентаций Художники Облицовка вертикальной поверхности и короба керамической плиткой способом шов в шов
Облицовка вертикальной поверхности и короба керамической плиткой способом шов в шов Лимфогранулематоз кишечника
Лимфогранулематоз кишечника Советская автопромышленность
Советская автопромышленность Перемещение товаров и транспортных средств через таможенную границу
Перемещение товаров и транспортных средств через таможенную границу Догмат о Церкви Христова (часть 2)
Догмат о Церкви Христова (часть 2) Возможности использования дидактических игр для реализации регионального компонента
Возможности использования дидактических игр для реализации регионального компонента Электролиз
Электролиз Космоквантум. Родительское собрание
Космоквантум. Родительское собрание The Present Simple Tense
The Present Simple Tense Успешные продажи: главное — понять потребности покупателя
Успешные продажи: главное — понять потребности покупателя