Термодинамика. Основные понятия и определения. Теплота и работа как форма передачи энергии презентация
Содержание
- 2. Литература 1. Луканин В.Н., Шатров М.Г. Теплотехника: Учебник для вузов. − М: Высшая школа, 2011. −
- 3. Техническая термодинамика Изучает закономерности взаимного превращения теплоты и работы, происходящие в макроскопических системах; Изучает свойства тел,
- 4. Рабочее тело Посредник, с помощью которого в тепловых машинах, установках получают работу, теплоту или холод. Рабочее
- 5. Термодинамическая система (ТДС) Совокупность рабочих тел, обменивающихся энергией и веществом между собой и окружающей средой, –
- 6. Классификация ТДС Изолированные – отсутствует обмен веществом и энергией с окружающей средой; Закрытые или замкнутые –
- 7. Состояния рабочего тела Стационарное (равновесное) состояние системы – это такое состояние, при котором свойства системы не
- 8. Макропараметры При взаимодействии с окружающей средой рабочее тело переходит из одного состояния в другое. Макропараметры поддаются
- 9. Интенсивные – не зависят от количества вещества в системе; Экстенсивные – изменяются пропорционально величине системы; Удельные
- 10. Термодинамические параметры Макроскопические физические величины, характеризующие систему в состоянии равновесия, − термодинамические параметры состояния системы.
- 11. Основные параметры Абсолютное давление – , Па; Абсолютная температура – , K; Удельный объем – ,
- 12. Термическое уравнение состояния рабочего тела Характеризует термодинамическое состояние вещества, находящегося в состоянии равновесия (во всей массе
- 13. Идеальный и реальный газ Идеальный газ – отсутствуют силы взаимодействия между молекулами; молекулы материальные точки, не
- 14. Термическое уравнение состояния идеальных газов где – газовая постоянная, Дж/(кг⋅К); – универсальна газовая постоянная. Для идеальной
- 15. Уравнение состояния реальных газов Межмолекулярные силы отталкивания позволяют молекулам сближаться до некоторого минимального расстояния. Свободный для
- 16. Уравнение состояния реальных газов Сила притяжения по направлению совпадает с внешним давлением и приводит к возникновению
- 17. Уравнение Ван-дер-Ваальса При больших удельных объемах и невысоких давлениях реального газа уравнение Ван-дер-Ваальса превращается в уравнение
- 18. Законы идеальных газов Закон Дальтона – давление смеси газов равно сумме парциальных давлений компонентов смеси: Закон
- 19. Состав смеси Массовая доля: Мольная доля: Объёмная доля:
- 20. Соотношения для расчёта смесей идеальных газов
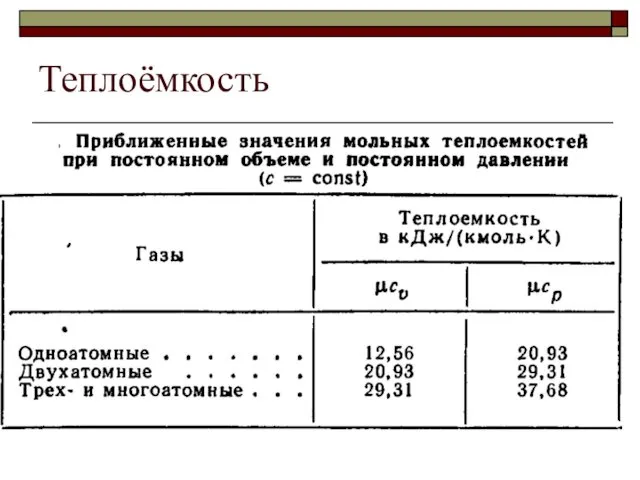
- 21. Теплоёмкость Теплоёмкость C − количество теплоты, необходимой для изменения на 1 градус рабочего тела (вещества): Дж/К.
- 22. Теплоёмкость Теплоёмкость газов величина переменная, зависит от температуры: истинная; средняя. Теплоёмкость газов зависит от протекания процесса:
- 23. Теплоёмкость изохорная − удельная изохорная теплоёмкость − объёмная изохорная теплоёмкость − мольная (молярная) изохорная теплоёмкость изобарная
- 24. Теплоёмкость Массовая (удельная) теплоёмкость Объёмная теплоёмкость Связь объёмной и массовой теплоёмкостей
- 25. Теплоёмкость Средняя теплоёмкость Истинная теплоёмкость
- 26. Теплоёмкость
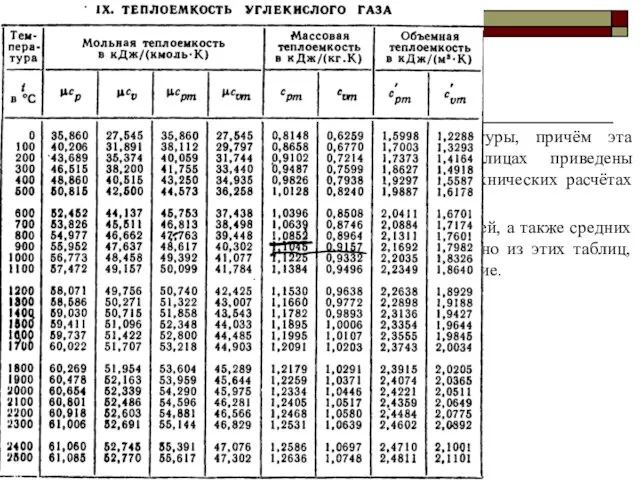
- 27. Теплоёмкость Теплоёмкость газов изменяется с изменением температуры, причём эта зависимость имеет криволинейный характер. В таблицах приведены
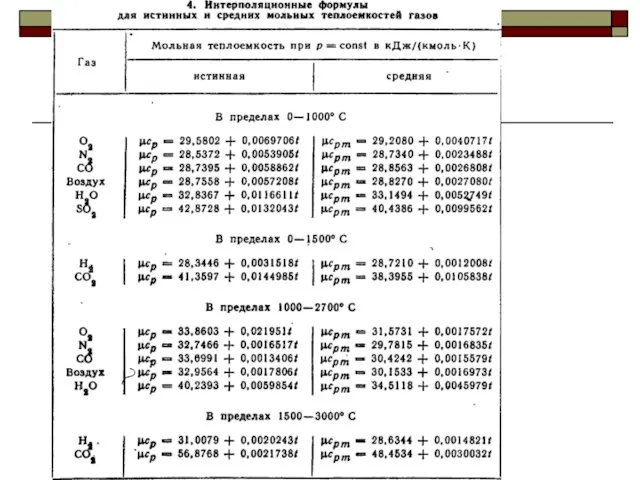
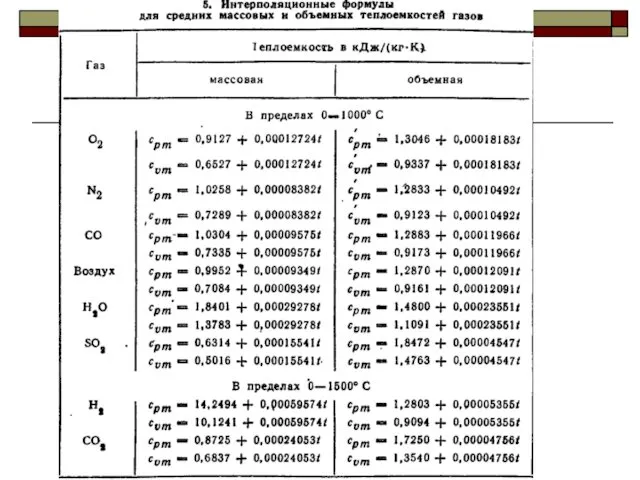
- 28. Нелинейную зависимость истинной теплоёмкости от температуры представляют обычно уравнением вида Линейная зависимость истинной теплоёмкости от температуры
- 31. Теплоёмкость газовой смеси Массовая теплоёмкость Объёмная теплоёмкость Мольная теплоёмкость
- 32. Теплота и работа Теплота и работа представляют две формы передачи энергии от одного тела к другому.
- 33. Различия Работа Макроскопический процесс; Пополняет запас любого вида энергии; Теплота Совокупность микроскопических процессов; Пополняет только внутреннюю
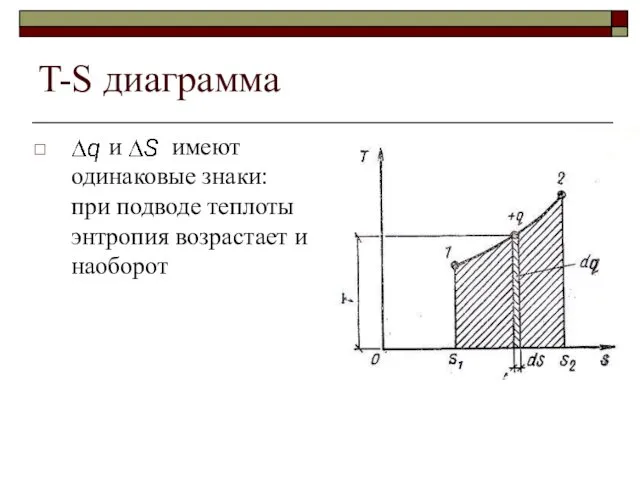
- 34. T-S диаграмма и имеют одинаковые знаки: при подводе теплоты энтропия возрастает и наоборот
- 35. Эквивалентность теплоты и работы Эквивалентность теплоты и работы численно установлена Ю.Майером и У.Томсоном: 1 ккал=4,18 кДж
- 36. Внутренняя энергия Совокупность всех видов энергии тела или системы в данном состоянии, не связанных с движением
- 37. Внутренняя энергия Идеальные газы – энергия взаимодействия равна нулю, энергия их теплового движения зависит от температуры:
- 38. Энтальпия Тепловая функция: Удельная энтальпия: При постоянном давлении изменение энтальпии равно количеству теплоты, подведенной к системе.
- 40. Скачать презентацию
































 Внеклассное мероприятие Звёздный час
Внеклассное мероприятие Звёздный час Физические качества и их развитие
Физические качества и их развитие оригинальные технологии
оригинальные технологии Артур Конан Дойль. Появление Шерлока Холмса
Артур Конан Дойль. Появление Шерлока Холмса Программа экспериментальной работы по естественнонаучному воспитанию младших школьников.
Программа экспериментальной работы по естественнонаучному воспитанию младших школьников. Кодекс этической деятельности педагога
Кодекс этической деятельности педагога Курская битва
Курская битва Приставка контактная KO1-DN11
Приставка контактная KO1-DN11 презентация к уроку в 8 классе Построение модели невидимого объекта. Возникновение в науке теоретических представлений о веществе и химической реакции.
презентация к уроку в 8 классе Построение модели невидимого объекта. Возникновение в науке теоретических представлений о веществе и химической реакции. Игровые технологии в ДОУ
Игровые технологии в ДОУ Реклама програми Power Point
Реклама програми Power Point Ритмика-4-е классы
Ритмика-4-е классы Формирование информационной культуры личности
Формирование информационной культуры личности Презентация к родительскому собранию Путь к толерантности
Презентация к родительскому собранию Путь к толерантности Online - технологии для повышения эффективности бизнеса. Секреты успеха
Online - технологии для повышения эффективности бизнеса. Секреты успеха Категория Электрика
Категория Электрика Опыт работы кл. рук 1
Опыт работы кл. рук 1 Мешочек для новогоднего подарка
Мешочек для новогоднего подарка Социо-игровая технология в работе ДОУ
Социо-игровая технология в работе ДОУ Наибольший общий делитель
Наибольший общий делитель Золотая цепь святости в культуре родного Подмосковья
Золотая цепь святости в культуре родного Подмосковья Великая Отечественная Война
Великая Отечественная Война Биологиялық ұлпалардың дыбыспен әрекеттесуінің физикалық негізі. Медицинада ультрадыбыстық зерттеулерді қолдану
Биологиялық ұлпалардың дыбыспен әрекеттесуінің физикалық негізі. Медицинада ультрадыбыстық зерттеулерді қолдану Становление парламентаризма
Становление парламентаризма История города Павлово
История города Павлово Жилищное законодательство РФ
Жилищное законодательство РФ Die Beschreibungs eines Fotos
Die Beschreibungs eines Fotos Өндірістік іс-сана
Өндірістік іс-сана