Содержание
- 2. Распространённость ТЭЛА ТЭЛА занимает третье место среди причин смерти населения в развитых странах Летальность при ТЭЛА
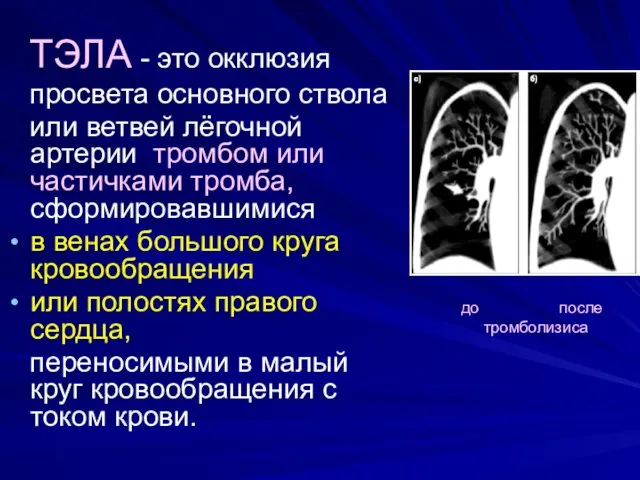
- 3. ТЭЛА - это окклюзия просвета основного ствола или ветвей лёгочной артерии тромбом или частичками тромба, сформировавшимися
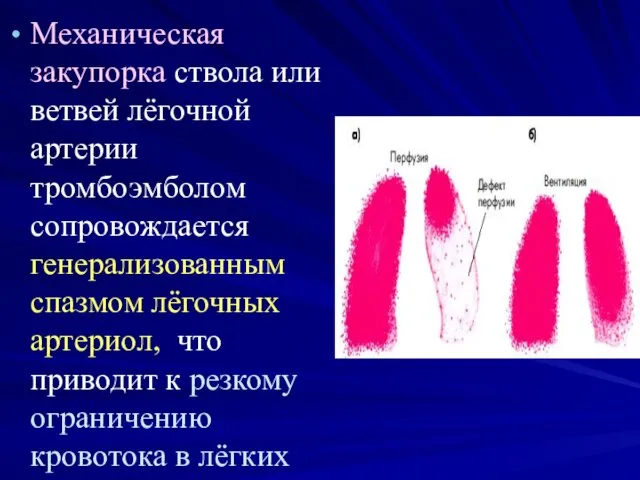
- 4. Механическая закупорка ствола или ветвей лёгочной артерии тромбоэмболом сопровождается генерализованным спазмом лёгочных артериол, что приводит к
- 5. Этиология ТЭЛА Наиболее частой причиной ТЭЛА являются: острый тромбоз глубоких вен илеофеморального сегмента, флеботромбозы глубоких вен
- 6. Генетическая мутация V фактора свертывания крови (фактор Лейдена) : {Проакцелерин образуется в печениобразуется в печени с
- 7. антифосфолипидный синдром (первичный или вторичный) применение оральных контрацептивов прием заместительной гормональной терапии беременность злокачественные новообразования лейкозы
- 8. Факторы, способствующие возникновению тромбоза глубоких вен нижних конечностей Злокачественные новообразования Гиподинамия, в том числе необходимость соблюдение
- 9. Факторы, способствующие возникновению тромбоза глубоких вен нижних конечностей: Пожилой и старческий возраст Хроническая сердечная недостаточность Ожирение
- 10. Факторы, способствующие возникновению тромбоза глубоких вен нижних конечностей: Эритремия Первичные гиперкоагуляционные состояния Системная красная волчанка Наследственные
- 11. Патогенез ТЭЛА: механическая обструкция лёгочно-артериального русла резко выраженный генерализованный спазм артериол малого круга, обусловленный вазоконстрикторными субстанциями
- 12. Классификация ТЭЛА (Рекомендации Европейского общества кардиологов, 2000 г.) позволяет выбрать стратегию лечения унифицировать статистику и подходы
- 13. При окклюзии ствола или главных ветвей ЛА в клинической картине преобладает кардиальный синдром и тяжелые расстройства
- 14. Клиническая симптоматика субмассивной ТЭЛА: Поражение долевых и сегментарных ветвей ЛА характеризуется течением средней тяжести с внезапным
- 15. Тромбоэмболия мелких ветвей наиболее трудна для диагностики: в 30-45% случаев единственный симптом – появление немотивированной одышки.
- 16. Жалобы при ТЭЛА: Одышка в покое или при небольшой физической нагрузке в 100% случаев Боль в
- 17. Ангинозноподобная боль: возникает при массивной обтурации ЛА обусловлена острым расширением устья ЛА локализуется в области верхней
- 18. Жалобы при ТЭЛА непродуктивный кашель (у 50% больных) кровохарканье (в 30% случаев), в виде прожилок крови
- 19. Физикальное исследование: цианоз, часто сочетается с бледностью кожных покровов (обусловлен снижением АД, спазмом периферических сосудов в
- 20. Физикальное исследование лёгких: ослабленное дыхание шум трения плевры мелкопузырчатые хрипы или крепитация (указывает на развитие инфаркт
- 21. Физикальное исследование ССС: тахикардия (иногда более 100 уд./мин.) акцент II тона на лёгочной артерии (отражает развитие
- 22. Современный алгоритм диагностики ТЭЛА: определение наличия тромбоза по повышению содержания в крови D-димера – продукта деградации
- 23. Если концентрация D-димера в плазме менее 0,5 мкг/мл, наличие тромбоза (легочной артерии, глубоких вен и др.)
- 24. Причины отрицательных результатов теста на D-димер при тромбозе Уровень D-димера, не превышающий пороговое значение, встречается у
- 25. ЭКГ- диагностика: смещение ЭОС вправо признаки перегрузки правого предсердия, высокоамплитудные зубцы «Р» вo II, III, aVF
- 26. Рентгенография органов грудной клетки: высокое стояние купола диафрагмы инфильтрация лёгочной ткани выбухание конуса лёгочной артерии расширение
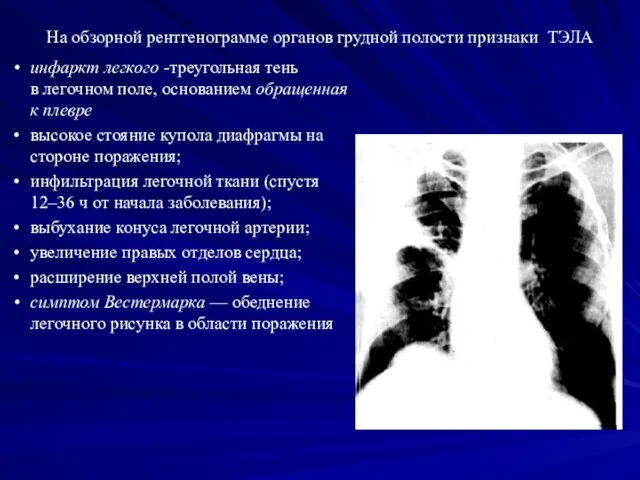
- 27. На обзорной рентгенограмме органов грудной полости признаки ТЭЛА инфаркт легкого -треугольная тень в легочном поле, основанием
- 28. ЭХО-КГ- диагностика: - повышение давления в лёгочной артерии - признаки перегрузки правых отделов сердца
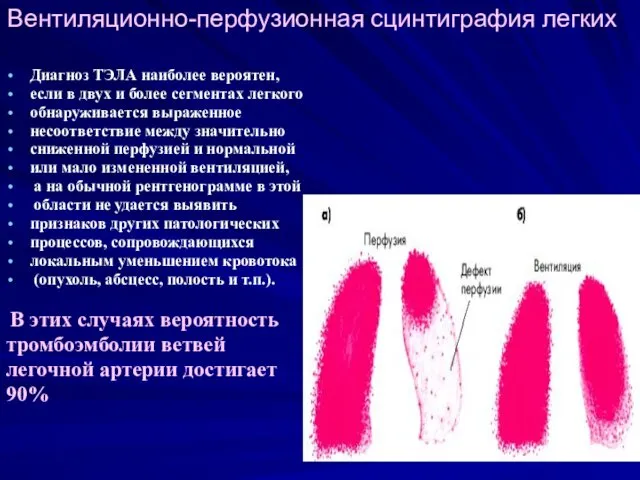
- 29. Вентиляционно-перфузионная сцинтиграфия легких Диагноз ТЭЛА наиболее вероятен, если в двух и более сегментах легкого обнаруживается выраженное
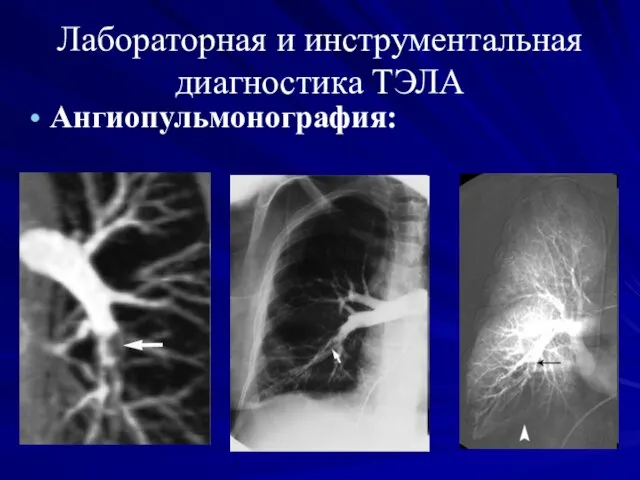
- 30. Лабораторная и инструментальная диагностика ТЭЛА Ангиопульмонография:
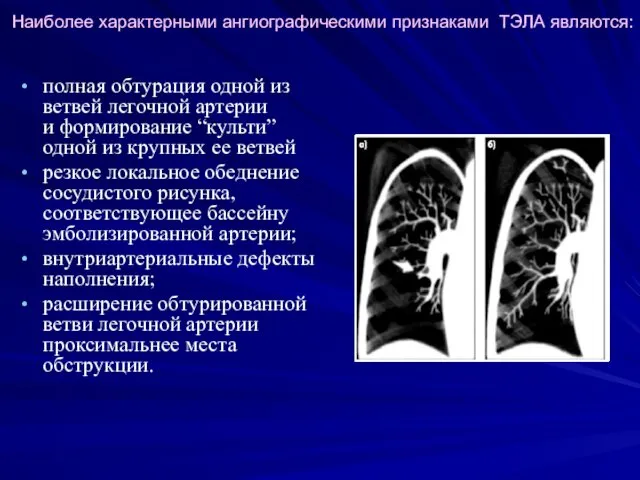
- 31. Наиболее характерными ангиографическими признаками ТЭЛА являются: полная обтурация одной из ветвей легочной артерии и формирование “культи”
- 32. По шкале Wells (канадская шкала) имеется следующий диагностический подход при подозрении на ТЭЛА: • клинические признаки
- 33. Женевская шкала оценки клинической вероятности ТЭЛА Клиническая вероятность ТЭЛА : Высокая — при сумме баллов от
- 34. Дифференциальная диагностика клинических симптомов ТЭЛА: • одышка — ателектаз, БА, пневмония, спонтанный пневмоторакс, острый отек легких,
- 35. Общие принципы лечения ТЭЛА: Купирование болевого синдрома Восстановление кровотока в системе ЛА Профилактика тромбоза в легочных
- 36. Купирование болевого синдрома: ЦЕЛЬ : устранение болевого синдрома разгрузка малого круга кровообращения уменьшение одышки Наркотические анальгетики:
- 37. Тромболитическая терапия: Абсолютным показанием для тромболитической терапии является массивная ТЭЛА, протекающая с выраженными расстройствами гемодинамики: шок
- 38. Стрептокиназа В/в инфузионно 1500000 МЕ за 30 мин. при катетеризации легочной артерии за 60 -120 мин.
- 39. Препарат выбора - тканевой активатор плазминогена (ТАП): Алтеплаза в/в 1 мг/кг ( но не более 100
- 40. Slide Препарат выбора - МЕТАЛИЗЕ Тенектеплаза в/в болюсом: 30 мг при МТ 35 мг при 60-70
- 41. Slide Антикоагулянты прямого действия - НФГ: в/в болюс 60 МЕ/кг (не более 4000 МЕ) затем инфузия
- 42. Slide Низкомолекулярные гепарины: Фраксипарин (надропарин) 0,6 мл 2 раза в сутки Фрагмин (дальтепарин) 2500 Ед через
- 43. Slide НЕПРЯМЫЕ АНТИКОАГУЛЯНТЫ МЕХАНИЗМ ДЕЙСТВИЯ – уменьшение образования печенью 4-х витамин К-зависимых факторов свертывания крови: II,
- 44. Непрямые антикоагулянты Прямые ингибиторы тромбина дабигатран - Прадакса Ингибиторы Xa фактора : ривароксибан – Ксарелто, Apixaban,
- 45. Slide АНТИТРОМБОЦИТАРНАЯ ТЕРАПИЯ Ацетилсалициловая кислота - блокирует циклооксигеназу и угнетает образование тромбоксана А2 ПРОИЗВОДНЫЕ ТИЕНОПИРИДИНА –
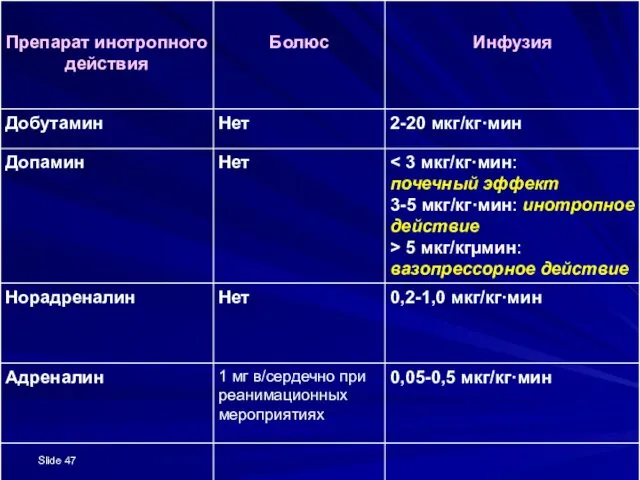
- 46. Cимптоматическая терапия: При шоке и выраженной системной артериальной гипотензии назначают внутривенное введение симпатомиметиков Преднизолон в дозе
- 47. Slide
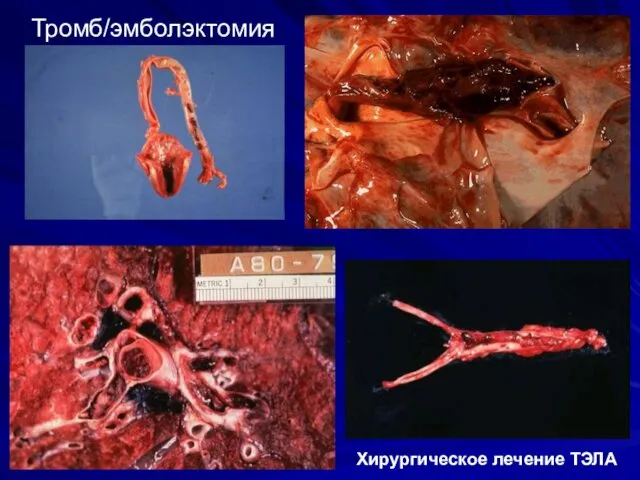
- 48. Тромб/эмболэктомия Хирургическое лечение ТЭЛА
- 49. Профилактика ТЭЛА и тромбоза глубоких вен нижних конечностей своевременное хирургическое лечение при обнаружении флотирующего тромба: установление
- 50. Профилактика ТЭЛА и тромбоза глубоких вен нижних конечностей Медикаментозная профилактика тромбозов глубоких вен нижних конечностей и
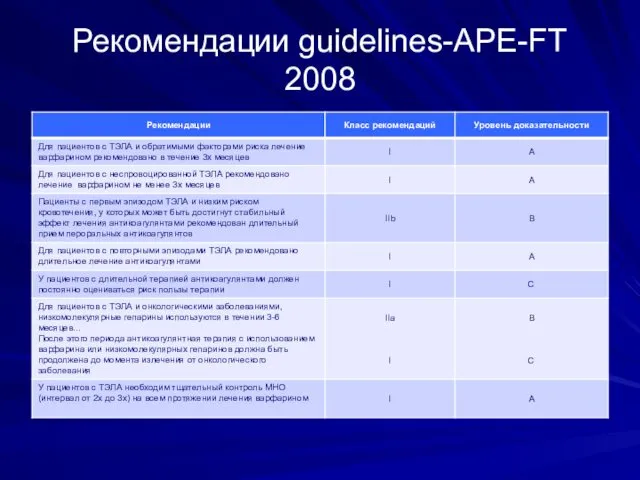
- 51. Рекомендации guidelines-APE-FT 2008
- 52. Препарат Adempas ® (риоцигуат) компании Bayer разрешен к применению в ЕС и США для лечения двух
- 53. компания Bayer Риоцигуат - первый представитель инновационного класса соединений, который был открыт и разработан в качестве
- 54. Препарат Adempas ® (риоцигуат) Общепринятым и потенциально излечивающим методом лечения ХТЛГ является легочная эндартерэктомия (ЛЭ) –
- 55. Препарат Adempas ® (риоцигуат) разрешен к применению: в США при ХТЛГ и ЛАГ в октябре 2013
- 57. Скачать презентацию













































 Становлення глобальної економіки
Становлення глобальної економіки Мочекаменная болезнь: этиология и патогенез
Мочекаменная болезнь: этиология и патогенез 20240130_master-klass
20240130_master-klass My home
My home Web-дизайн. Введение в цветоведение
Web-дизайн. Введение в цветоведение Уроки настоящего. Новые технологии для предприятий Краснодарского края
Уроки настоящего. Новые технологии для предприятий Краснодарского края Архитектор Михаил Павлович Малахов (1781-1842)
Архитектор Михаил Павлович Малахов (1781-1842) Физкультминутки в детском саду
Физкультминутки в детском саду Повседневная жизнь горожан на Руси X-XIII века
Повседневная жизнь горожан на Руси X-XIII века Формирование учетной политики организации
Формирование учетной политики организации Аналитическая геометрия
Аналитическая геометрия Самозанятые. Краткое руководство
Самозанятые. Краткое руководство Физические основы механики молекулярная физика. Основы термодинамики
Физические основы механики молекулярная физика. Основы термодинамики Что такое толерантность?
Что такое толерантность? Методы и устройства согласования трактов СВЧ. Лекция 2
Методы и устройства согласования трактов СВЧ. Лекция 2 Животные весной
Животные весной Изображение и обозначение резьбы
Изображение и обозначение резьбы Make an opening statement on the subject of the project work
Make an opening statement on the subject of the project work Имануил Валлерстайн и Теда Скопкол. Историческая ориентация в марксизме
Имануил Валлерстайн и Теда Скопкол. Историческая ориентация в марксизме Презентация по краеведению
Презентация по краеведению Методы увеличения углеводородоотдачи
Методы увеличения углеводородоотдачи Agriculture Dialogue 2015
Agriculture Dialogue 2015 Вводное занятие по геометрии для учащихся 7 класса
Вводное занятие по геометрии для учащихся 7 класса Презентация Берингово море
Презентация Берингово море G`alamat online school
G`alamat online school Стальной низкотемпературный водогрейный котёл. Logano SK655/SK755
Стальной низкотемпературный водогрейный котёл. Logano SK655/SK755 Дресс-код делового человека
Дресс-код делового человека Богословие IV века. Святой Кирилл Иерусалимский (315-387 годы)
Богословие IV века. Святой Кирилл Иерусалимский (315-387 годы)