Слайд 2

А зачем вы сегодня пришли ко мне на урок?
Продолжаем познавать
новое!
Слайд 3

Что такое атом?
Из чего состоит атом?
Какие вещества относятся к простым ,
а какие к сложным?
Слайд 4

-Что такое химическая связь?
-Что такое валентность?
Определите валентность: HCl, H2O, CH4.
Слайд 5

ПРОБЛЕМА !!!
Каким образом атомы
удерживаются друг возле друга в молекулах простых
и сложных веществ ?
О₂, Н₂, Н₂О, HCl, Н₃N
Слайд 6

Виды химической связи
КОВАЛЕНТНАЯ
ХИМИЧЕСКАЯ СВЯЗЬ
Слайд 7

Задачи:
Обучающие
раскрыть сущность образования химической связи между атомами,
Развивающие:
формировать умение записывать схемы образования ковалентной полярной и неполярной связи, продолжить развитие умений анализировать, выделять главное в изучаемом учебном материале, делать выводы;
Воспитательные:
продолжить формирование убежденности в познаваемости мира веществ и взаимосвязи противоположностей
Слайд 8

Почему атомы вступают в химическую связь?
Все ли валентные электроны будут участвуют
в образовании химической связи?
Слайд 9

Как определяется число валентных электронов и неспаренных электронов?
Число неспаренных
электронов =
8-номер группы
Слайд 10

Слайд 11

Сколько неспаренных электронов у атомов,
I V, V, VI ,
VII группы?
Слайд 12

Составьте электронные формулы:
Сl 2, H2, N2, HF.
Слайд 13

Химическая связь, возникающая в результате образования общих электронных пар, называется атомной
или ковалентной
неМе + неМе
Электронная
формула
Слайд 14

1.Определить валентные электроны .
2.Определить количество неспаренных электронов
2. Валентные электроны каждого
атома обозначить точками вокруг символа элемента. В атоме хлора один электрон находится в неспаренном состоянии.
••
׃Cl •
••
Сколько электронов не хватает атому хлора до завершения внешнего электронного слоя ?
3.Показать взаимодействие атомов,
•• •• •• ••
׃Cl • + • Cl ׃ = ׃Cl ׃ Cl ׃
•• •• •• ••
4.Выделите общие электронные пары.
• • •• •• ••
׃Cl • + • Cl ׃ = ׃Cl (׃) Cl ׃
•• •• •• ••
5 . Составляем структурную формулу.
Cl - Cl
Слайд 15

Задание.
Пользуясь алгоритмом, составить cхемы образования ковалентных связей в молекулах кислорода
и азота.
Слайд 16

одинарная связь – это ковалентная связь, которая образована одной
электронной парой.
Н – Н CL-Cl
двойная связь
О=О
тройная связь
N Ξ N
Чем определяется количество связей между атомами химических элементов в молекуле?
Слайд 17

изобразить схему образования связи
в молекуле хлорводорода HCl ;
••
••
H• + • Cl ׃ = H (׃) Cl ׃
•• ••
что произошло с электронными слоями
у водорода и хлора в результате образования ковалентной связи?
Слайд 18

Рефлексия
Какую задачу ставили?
Чем занимались на уроке?
Какие сложности возникли?
Как оцениваете свою работу?
Слайд 19

Закрепление
1.Составьте электронную схему строения атома серы.
2. Подчеркните валентные электроны и обозначьте
их точками вокруг символа элемента.
3. Укажите , сколько электронов атома серы могут участвовать в образовании связей с атомами водорода.
4.Какой тип связи при этом образуется?


















 Презентация по правилам дорожного движения для детей.
Презентация по правилам дорожного движения для детей. Круг. Окружность. Длина окружности. Площадь круга
Круг. Окружность. Длина окружности. Площадь круга Тамырдаш сүзләр темасына презентация.
Тамырдаш сүзләр темасына презентация. Презентация по ПДД
Презентация по ПДД Элементы линейной алгебры. Лекция 10
Элементы линейной алгебры. Лекция 10 Презентация на педсовет Историко-педагогическая гостиная Чтобы вырастить патриота….
Презентация на педсовет Историко-педагогическая гостиная Чтобы вырастить патриота…. Концепция свадьбы по мотивам фильма В живых останутся только любовники
Концепция свадьбы по мотивам фильма В живых останутся только любовники Викторина для детей
Викторина для детей Радиационная безопасность на предприятиях нефтегазового комплексе
Радиационная безопасность на предприятиях нефтегазового комплексе Цветные металлы и сплавы
Цветные металлы и сплавы Столение начала Первой мировой войны
Столение начала Первой мировой войны Константин Дмитриевич Ушинский
Константин Дмитриевич Ушинский ИТПС. Специальные единицы (дБ и Нп)
ИТПС. Специальные единицы (дБ и Нп) Эвентрация. Методы лечения эвентрации
Эвентрация. Методы лечения эвентрации МЕТОДИЧЕСКАЯ РАЗРАБОТКА ИГРА-ОТКРЫТИЕ ПУТЕШЕСТВИЕ В АРКТИКУ
МЕТОДИЧЕСКАЯ РАЗРАБОТКА ИГРА-ОТКРЫТИЕ ПУТЕШЕСТВИЕ В АРКТИКУ Пешеходная улица в Сыктывкаре
Пешеходная улица в Сыктывкаре Частная бактериология. Возбудители бактериальных инфекций
Частная бактериология. Возбудители бактериальных инфекций Научный проект №1. Кондиционер на фасаде – плюсы и минусы
Научный проект №1. Кондиционер на фасаде – плюсы и минусы ВКР: Логистический подход к формированию конкурентоспособности предприятия на рынке
ВКР: Логистический подход к формированию конкурентоспособности предприятия на рынке Информационная безопасность. Системы управления базами данных. (Лекция 11)
Информационная безопасность. Системы управления базами данных. (Лекция 11) Проектная и исследовательская деятельность как способ формирования метапредметных результатов обучения
Проектная и исследовательская деятельность как способ формирования метапредметных результатов обучения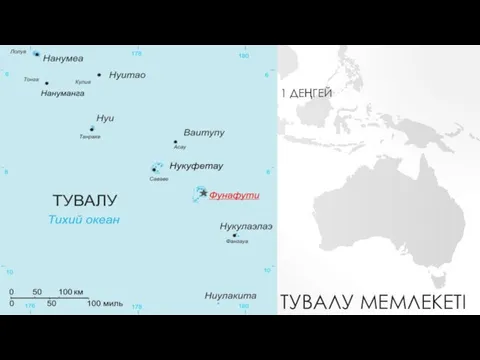 Тувалу жағдайы
Тувалу жағдайы Теорія граничної корисності і поведінка споживача
Теорія граничної корисності і поведінка споживача Тайна имени Илья
Тайна имени Илья мейоз
мейоз Начни с воды
Начни с воды Средства измерений параметров формы сигналов, их поверка и калибровка
Средства измерений параметров формы сигналов, их поверка и калибровка Стационарные случайные процессы
Стационарные случайные процессы