Содержание
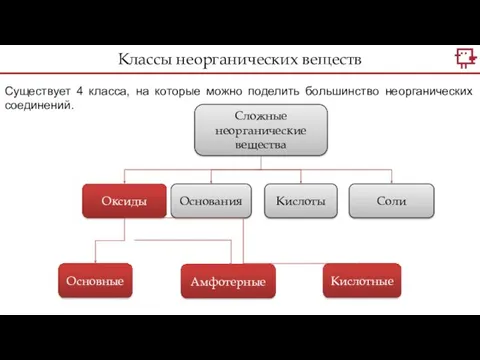
- 2. Существует 4 класса, на которые можно поделить большинство неорганических соединений. Классы неорганических веществ Сложные неорганические вещества
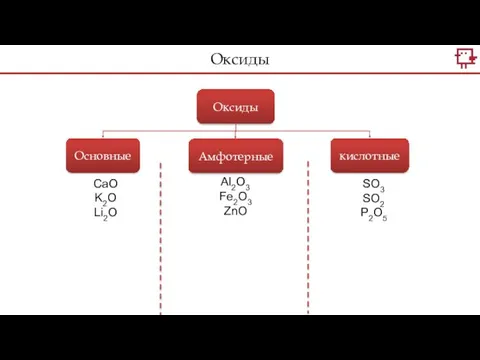
- 3. Оксиды Оксиды Основные Амфотерные кислотные CaO K2O Li2O Al2O3 Fe2O3 ZnO SO3 SO2 P2O5
- 4. Оксиды. Химические свойства
- 5. Оксиды. Химические свойства
- 6. N2O5 + H2SO4 ? CaO + H2SO4 ? Mn2O7 + H2SO4 ? Оксиды. Химические свойства
- 7. N2O5 ? не основный CaO + H2SO4 ? CaSO4 + H2O Mn2O7 ? HMnO4 Оксиды. Химические
- 8. H2O + H2O ? CaO + H2O ? OF2+ H2O ? Оксиды. Химические свойства
- 9. H2O ? не основный CaO + H2O ? Ca(OH)2 OF2 ? не основный Оксиды. Химические свойства
- 10. SO3+ SO2? CO + CO2? MgO + P2O5? Оксиды. Химические свойства
- 11. Чего-то не хватает? K2O + P2O5 ? K3PO4 Оксиды. Химические свойства
- 12. N2O5 + Mg(OH)2 ? RbO + KOH? P2O5 + NaOH? Оксиды. Химические свойства
- 13. N2O5 + Mg(OH)2 ? RbO + KOH? P2O5 + 6NaOH? 2Na3PO4 +___ H2O Не растворимо Не
- 14. CO2 + H2O ? P2O5 + H2O ? SiO2 + H2O ? Оксиды. Химические свойства
- 15. CO2 + H2O ? H2CO3 P2O5 + H2O ? H3PO4 Запомни: SiO2 + H2O ? Оксиды.
- 16. Составит три уравнения реакций: Летучие кислоты: HF HCl HBr HI H2S HNO3 H2CO3 H2SO3 Нелетучие кислоты:
- 17. Напишите уравнения реакций, подходящих для схемы: Ca ? CaO ? Ca(OH)2 P ? P2O5 ? H3PO4
- 18. Основания Существует 4 класса, на которые можно поделить большинство неорганических соединений. Сложные неорганические вещества Оксиды Основания
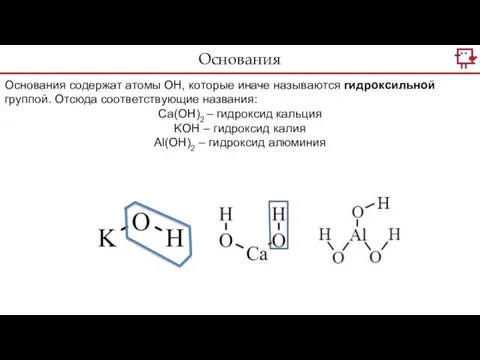
- 19. Основания содержат атомы ОН, которые иначе называются гидроксильной группой. Отсюда соответствующие названия: Са(ОН)2 – гидроксид кальция
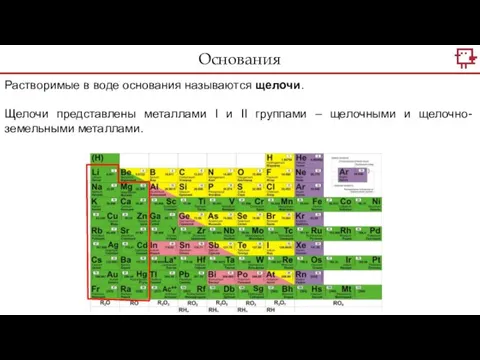
- 20. Растворимые в воде основания называются щелочи. Щелочи представлены металлами I и II группами – щелочными и
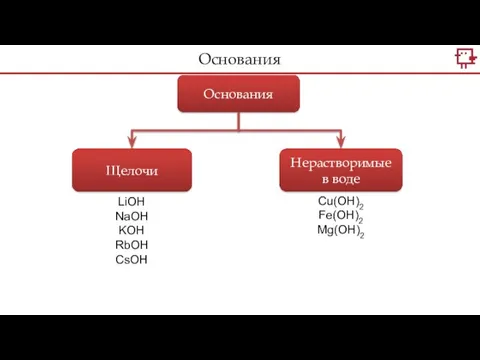
- 21. Основания Щелочи Нерастворимые в воде Cu(OH)2 Fe(OH)2 Mg(OH)2 LiOH NaOH KOH RbOH CsOH Основания
- 22. Основания Получение оснований: Щелочи можно получить при взаимодействии активных металлов и их оксидов с водой. СаО
- 24. Скачать презентацию
















 Солнечная Система
Солнечная Система Мастер - класс для педагогов
Мастер - класс для педагогов Модель ученического самоуправления в начальной школе.
Модель ученического самоуправления в начальной школе. Инструменты – предшественники фортепиано
Инструменты – предшественники фортепиано История варежки
История варежки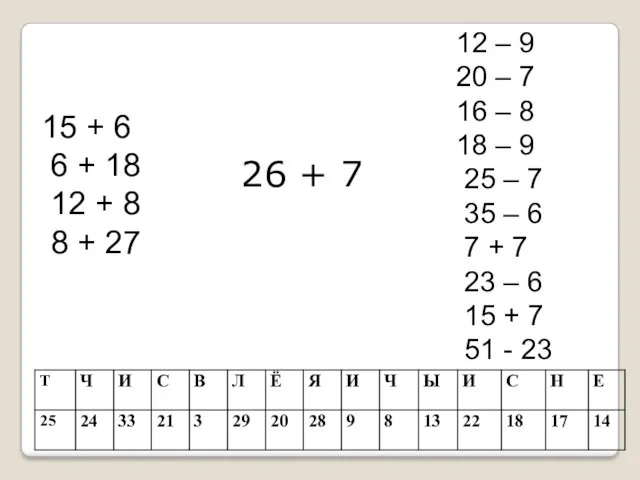 Счет и вычисления. Повторение курса начальной школы
Счет и вычисления. Повторение курса начальной школы Алгоритмы оказания допсихологической помощи при ОСР
Алгоритмы оказания допсихологической помощи при ОСР Синдром Лайелла
Синдром Лайелла Виды и способы отделки изделий из древесины. 5 класс
Виды и способы отделки изделий из древесины. 5 класс Криптография. Основные понятия. Симметричные криптосистемы
Криптография. Основные понятия. Симметричные криптосистемы Путешественники. Южная Америка. Занятие 5. 2 класс
Путешественники. Южная Америка. Занятие 5. 2 класс Развитие карьеры в рамках уголовно-правовой специализации
Развитие карьеры в рамках уголовно-правовой специализации Казахская философия. (Тема 8)
Казахская философия. (Тема 8) Война 1812 года Диск
Война 1812 года Диск Презентация .Школа гражданского мужества гимназистов СЛАВИЯ
Презентация .Школа гражданского мужества гимназистов СЛАВИЯ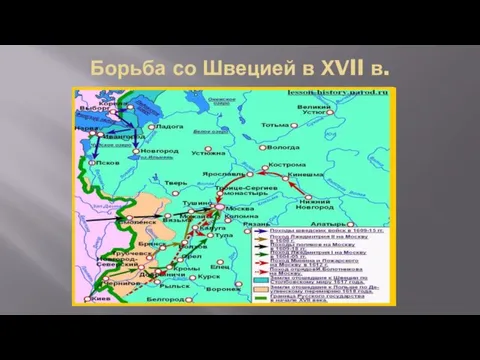 Борьба со Швецией в ХVll веке
Борьба со Швецией в ХVll веке Презентация для родителей Как развивать речь ребенка?
Презентация для родителей Как развивать речь ребенка? Нормативно – правовая база введения курса ОРКСЭ
Нормативно – правовая база введения курса ОРКСЭ Классификация психических явлений
Классификация психических явлений Количество вещества. Моль. Молярная масса
Количество вещества. Моль. Молярная масса Конвенция ЮНЕСКО об охране всемирного культурного и природного наследия
Конвенция ЮНЕСКО об охране всемирного культурного и природного наследия Виробники електроніки E.next Nternational Electrotechnical Group
Виробники електроніки E.next Nternational Electrotechnical Group Мастер класс по изготовлению мягкой игрушки.
Мастер класс по изготовлению мягкой игрушки. Работа в САДД Дело
Работа в САДД Дело Презентация Задачи учителя истории и обществознания
Презентация Задачи учителя истории и обществознания Люблю тебя, мой край родной, Воскресенск!
Люблю тебя, мой край родной, Воскресенск! Ключевые показатели работы КЦ
Ключевые показатели работы КЦ Культурная жизнь Кубани 1917-1920
Культурная жизнь Кубани 1917-1920