Выделение нуклеиновых кислот из различного клинического материала. ПЦР и электрофорез в медицинской генетике презентация
Содержание
- 2. Из какого материала приходится выделять ДНК и РНК при проведении биомедицинских исследований? Клеточные «суспензии» Ликвор, плазма
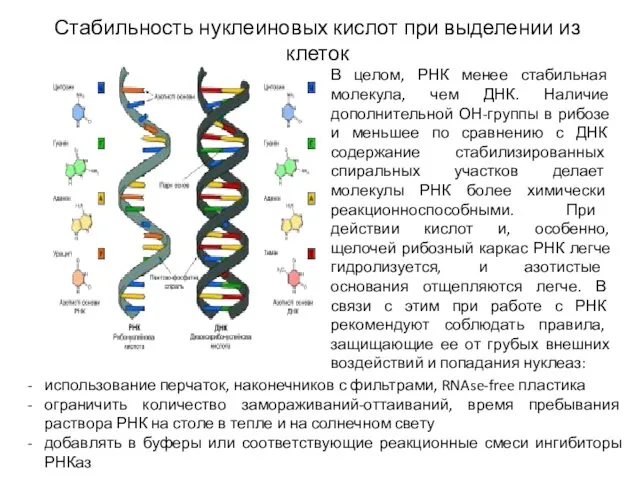
- 3. Стабильность нуклеиновых кислот при выделении из клеток В целом, РНК менее стабильная молекула, чем ДНК. Наличие
- 4. Экспресс-методы выделения нуклеиновых кислот Образец биоматериала инкубируется с лизирующим буфером при высокой температуре (порядка 90-95оС), в
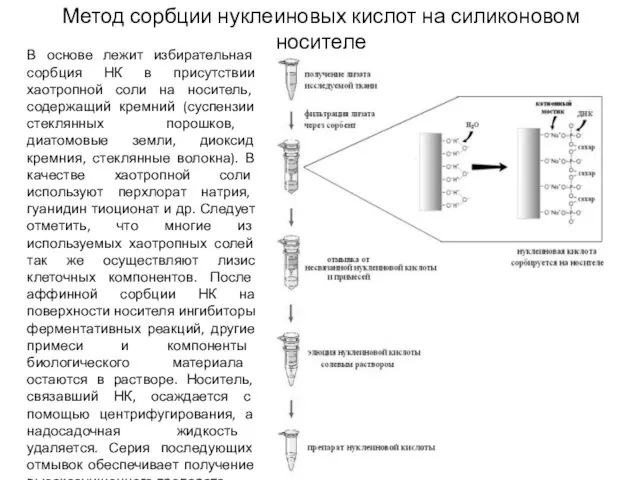
- 5. Метод сорбции нуклеиновых кислот на силиконовом носителе В основе лежит избирательная сорбция НК в присутствии хаотропной
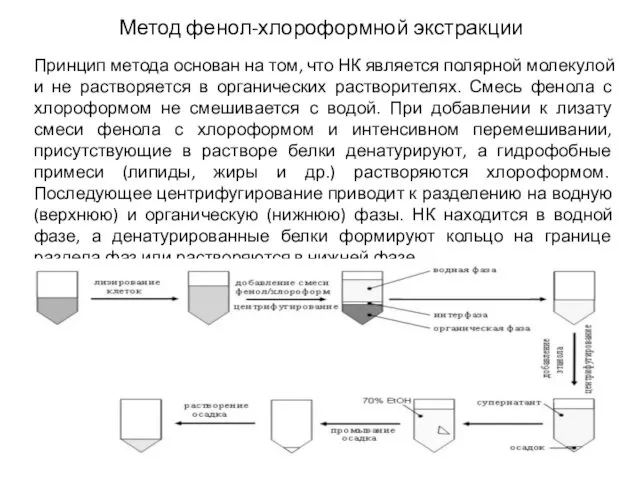
- 6. Метод фенол-хлороформной экстракции Принцип метода основан на том, что НК является полярной молекулой и не растворяется
- 7. Выделение ДНК и РНК из парафиновых блоков Получение срезов. После того, как морфолог отберет нужный блок,
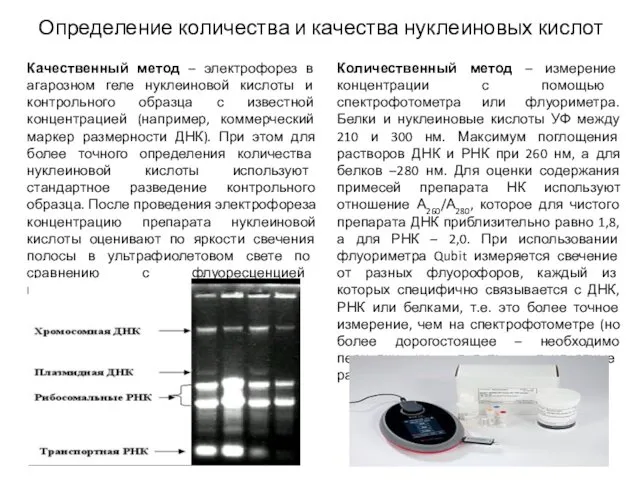
- 8. Определение количества и качества нуклеиновых кислот Качественный метод – электрофорез в агарозном геле нуклеиновой кислоты и
- 9. Дополнительная обработка образцов нуклеиновых кислот ферментами нуклеинового обмена Если нужно получить ДНК без примеси РНК, то
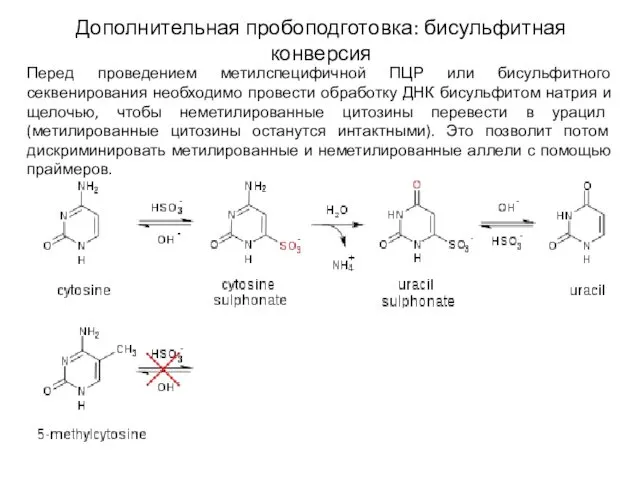
- 10. Дополнительная пробоподготовка: бисульфитная конверсия Перед проведением метилспецифичной ПЦР или бисульфитного секвенирования необходимо провести обработку ДНК бисульфитом
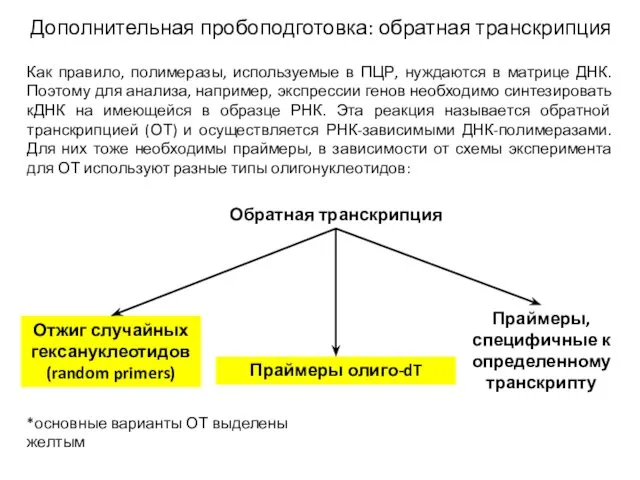
- 11. Дополнительная пробоподготовка: обратная транскрипция Обратная транскрипция Отжиг случайных гексануклеотидов (random primers) Праймеры олиго-dT Праймеры, специфичные к
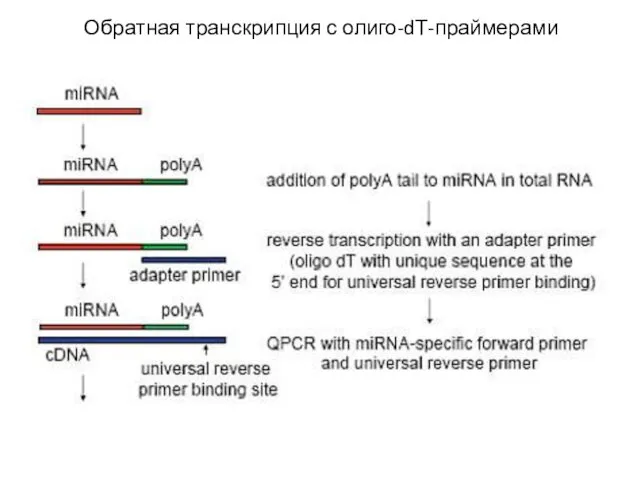
- 12. Обратная транскрипция с олиго-dТ-праймерами
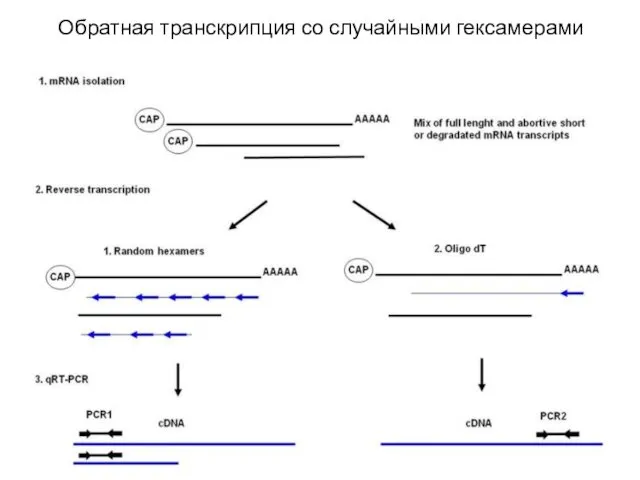
- 13. Обратная транскрипция со случайными гексамерами
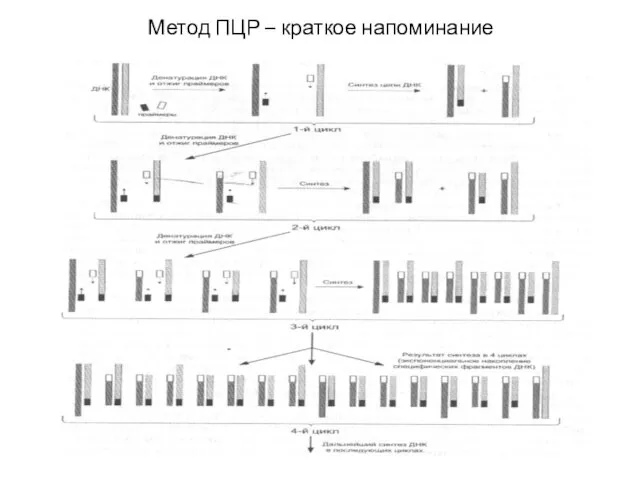
- 14. Метод ПЦР – краткое напоминание
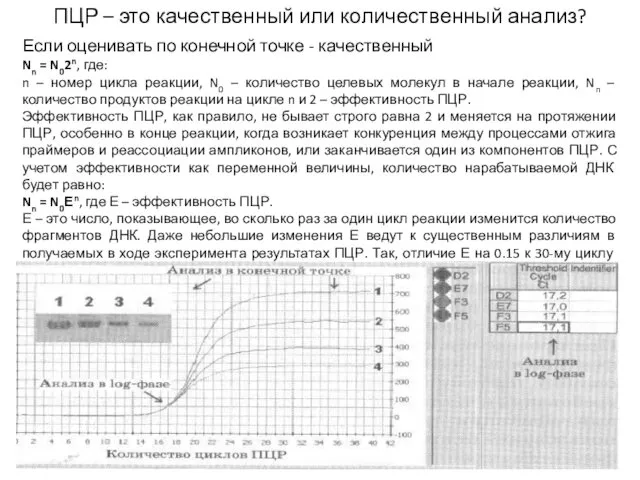
- 15. ПЦР – это качественный или количественный анализ? Если оценивать по конечной точке - качественный Nn =
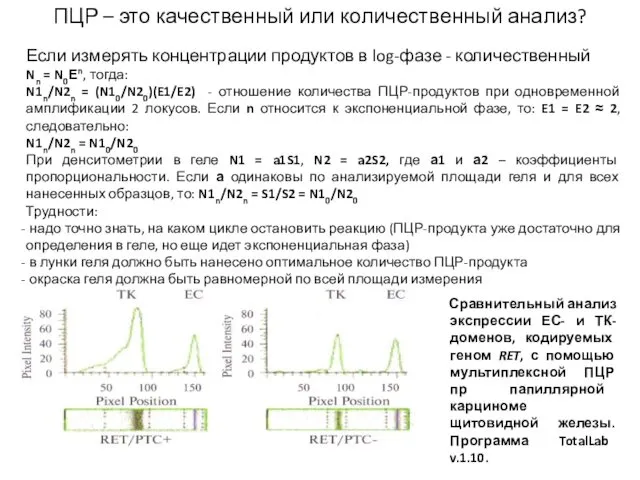
- 16. ПЦР – это качественный или количественный анализ? Если измерять концентрации продуктов в log-фазе - количественный Nn
- 17. Программируемые термоциклеры Что важно учитывать при выборе: Формат (стандартные 0,2 мл, или 0,1 мл, или 0,5
- 18. Мультиплексная ПЦР При увеличении количества локусов в мультиплексной ПЦР, практически, экспоненциально растут затраты времени на отработку
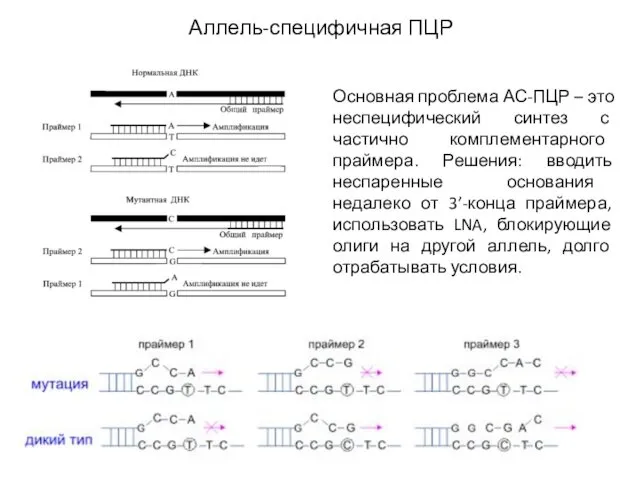
- 19. Аллель-специфичная ПЦР Основная проблема АС-ПЦР – это неспецифический синтез с частично комплементарного праймера. Решения: вводить неспаренные
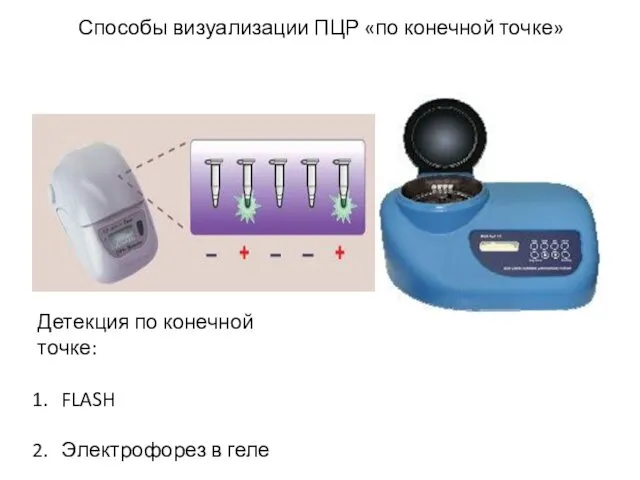
- 20. Способы визуализации ПЦР «по конечной точке» Детекция по конечной точке: FLASH Электрофорез в геле
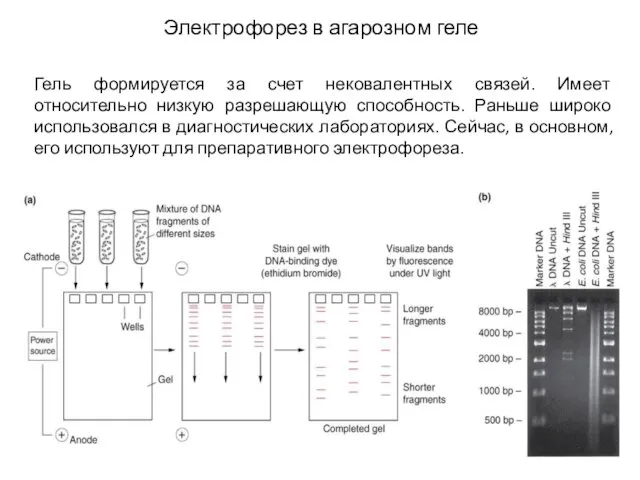
- 21. Электрофорез в агарозном геле Гель формируется за счет нековалентных связей. Имеет относительно низкую разрешающую способность. Раньше
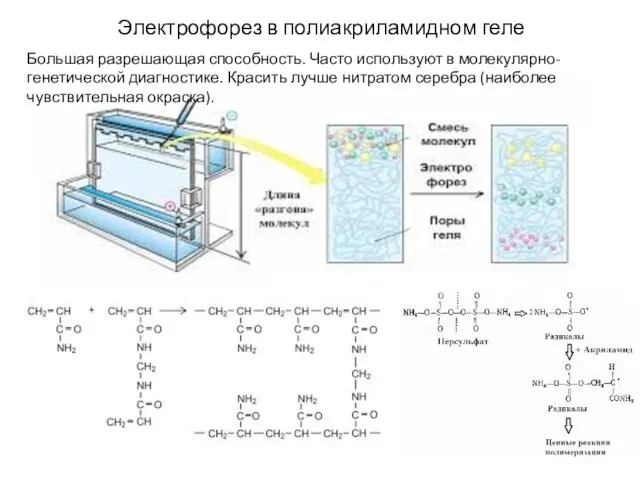
- 22. Электрофорез в полиакриламидном геле Большая разрешающая способность. Часто используют в молекулярно-генетической диагностике. Красить лучше нитратом серебра
- 23. Гетеродуплексный анализ Метод основан на том, что при ренатурации смеси нормальных и мутантных аллелей наряду с
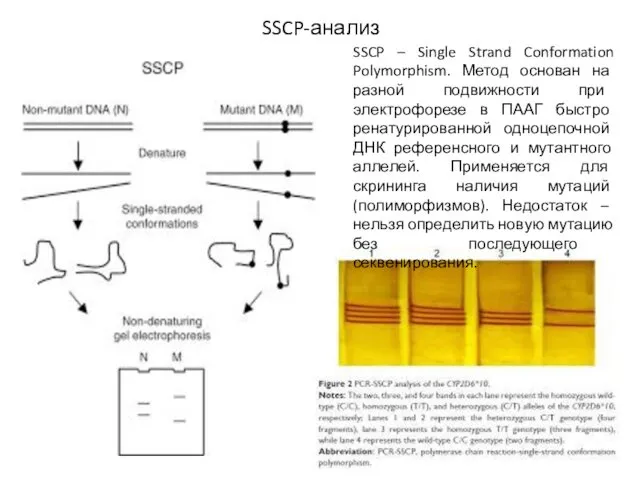
- 24. SSCP-анализ SSCP – Single Strand Conformation Polymorphism. Метод основан на разной подвижности при электрофорезе в ПААГ
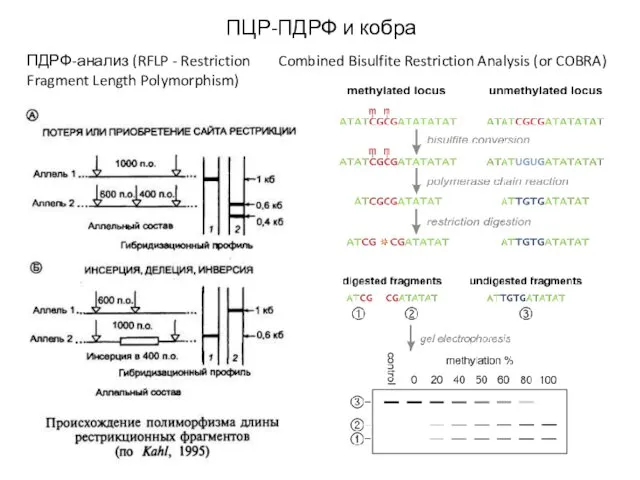
- 25. ПЦР-ПДРФ и кобра ПДРФ-анализ (RFLP - Restriction Fragment Length Polymorphism) Combined Bisulfite Restriction Analysis (or COBRA)
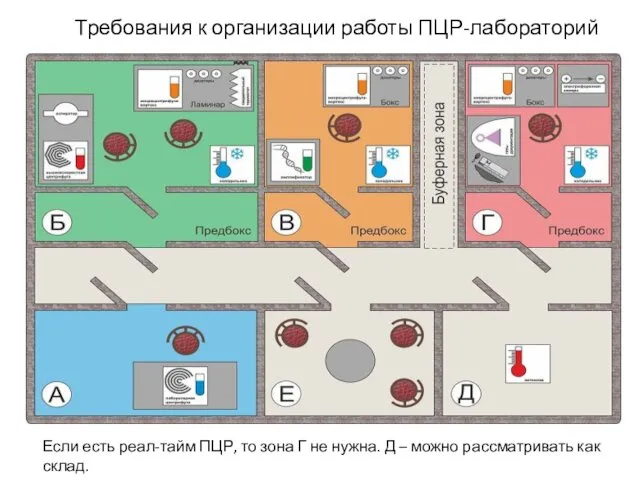
- 26. Требования к организации работы ПЦР-лабораторий Если есть реал-тайм ПЦР, то зона Г не нужна. Д –
- 28. Скачать презентацию







 Работа с тревожными детьми
Работа с тревожными детьми Индивидуальная теория личности Альфреда Адлера
Индивидуальная теория личности Альфреда Адлера Экономика и особенности деятельности отраслей культуры
Экономика и особенности деятельности отраслей культуры Этапы развития исторического знания. Становление и развитие взглядов на мир. Периодизация всемирной истории
Этапы развития исторического знания. Становление и развитие взглядов на мир. Периодизация всемирной истории Состав числа из двух меньших чисел
Состав числа из двух меньших чисел Взаимосвязь биологических и социальных факторов в психическом развитии
Взаимосвязь биологических и социальных факторов в психическом развитии Pro-файл. Екатерина Смольянова
Pro-файл. Екатерина Смольянова мы против наркотиков
мы против наркотиков Общественное здоровье населения как экономическая категория. Здоровье населения. Медико-социальные аспекты здоровья
Общественное здоровье населения как экономическая категория. Здоровье населения. Медико-социальные аспекты здоровья Презентация проекта Прогулки с интересом
Презентация проекта Прогулки с интересом Последствия курения (кл.час)
Последствия курения (кл.час) История_Духовенство
История_Духовенство Й-Ї
Й-Ї Как путешествует письмо?
Как путешествует письмо? HAICTC el planeta es para nuestros hijos. BIOMASA primera fuente de energías renovables
HAICTC el planeta es para nuestros hijos. BIOMASA primera fuente de energías renovables Номинальные напряжения в системах электроснабжения городов
Номинальные напряжения в системах электроснабжения городов Нормативно-правовые документы и рекомендации, регламентирующие деятельность образовательных организаций
Нормативно-правовые документы и рекомендации, регламентирующие деятельность образовательных организаций Презентация Парциальные программы по театрализованной деятельности детей дошкольного возраста
Презентация Парциальные программы по театрализованной деятельности детей дошкольного возраста Основы оперативной техники
Основы оперативной техники Препарат Райкат старт
Препарат Райкат старт Объектно-ориентированное программирование. Обзор среды разработки Visual Studio .NET
Объектно-ориентированное программирование. Обзор среды разработки Visual Studio .NET Духовно – нравственное и патриотическое воспитание детей дошкольного возраста посредством использования устного народного творчества: фольклор.
Духовно – нравственное и патриотическое воспитание детей дошкольного возраста посредством использования устного народного творчества: фольклор. Юность. Николай Алексеевич Некрасов
Юность. Николай Алексеевич Некрасов Атомные электростанции (АЭС)
Атомные электростанции (АЭС) Единый орфографический режим в начальной школе
Единый орфографический режим в начальной школе Виды биопсий
Виды биопсий Счастливейшая женщина планеты. С юбилеем
Счастливейшая женщина планеты. С юбилеем E-waste
E-waste