Содержание
- 2. Аминокислоты – это гетерофункциональные органические соединения, содержащие одновременно карбоксильную –СООН и аминогруппы –NH2
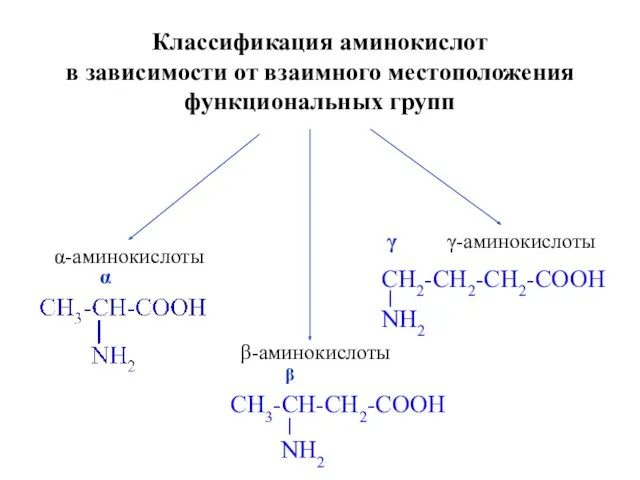
- 3. Классификация аминокислот в зависимости от взаимного местоположения функциональных групп α-аминокислоты γ-аминокислоты β-аминокислоты α CH3-CH-CH2-COOH NH2 β
- 4. Классификации аминокислот. 1. По природе радикала 2. Полярность бокового радикала: Неполярные (с гидрофобными радикалами). Полярные (гидрофильными
- 5. 3. По числу кислотных и основных групп - Нейтральные – одна NH2 и одна СООН группы
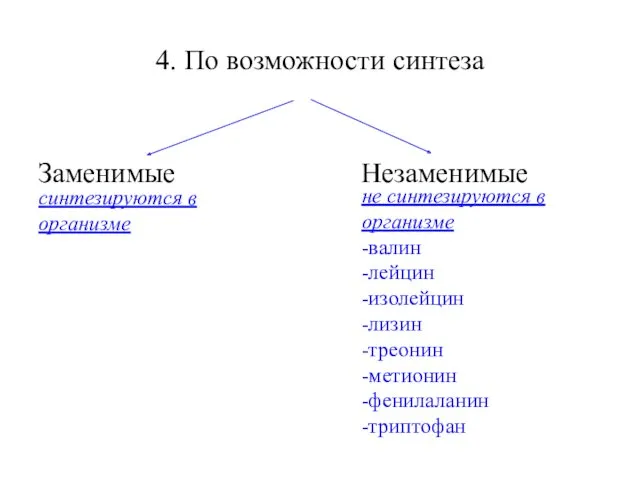
- 6. 4. По возможности синтеза Заменимые Незаменимые синтезируются в организме не синтезируются в организме -валин -лейцин -изолейцин
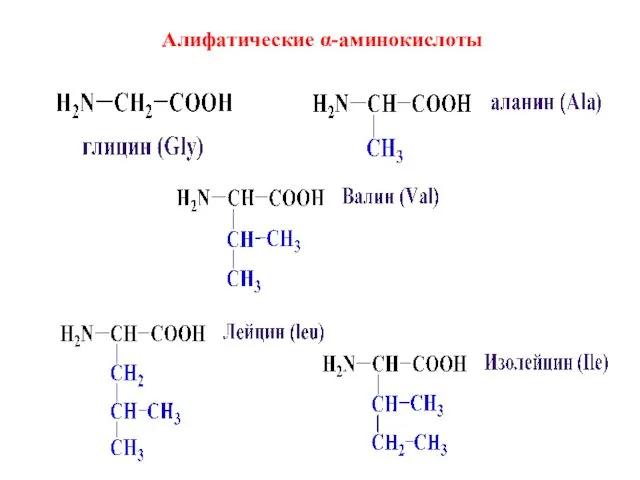
- 7. Алифатические α-аминокислоты
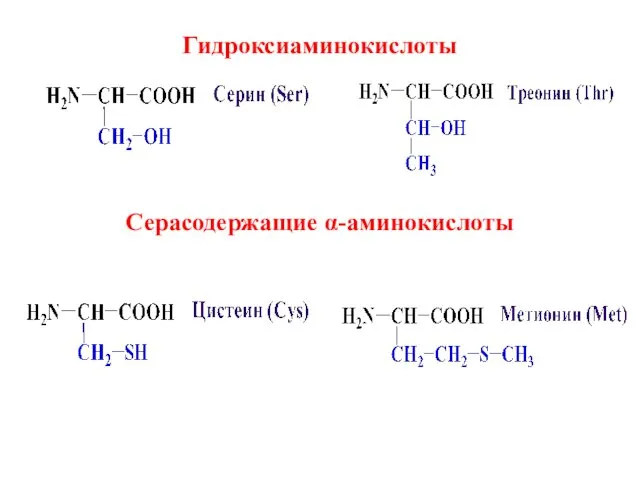
- 8. Гидроксиаминокислоты Серасодержащие α-аминокислоты
- 9. α-Аминодикарбоновые кислоты и их амиды
- 10. Диаминокарбоновые кислоты
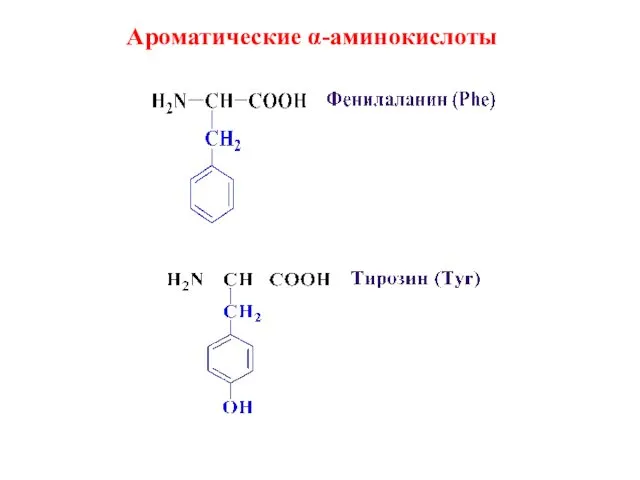
- 11. Ароматические α-аминокислоты
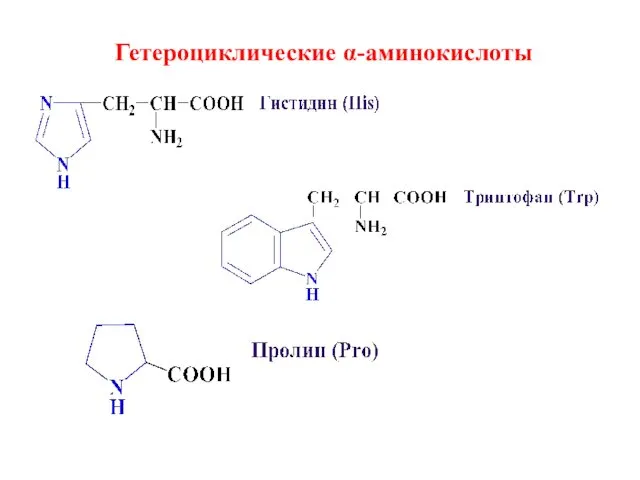
- 12. Гетероциклические α-аминокислоты
- 13. Физические свойства Аминокислоты: бесцветные кристаллические вещества сладкие на вкус хорошо растворяются в воде имеют температуру плавления
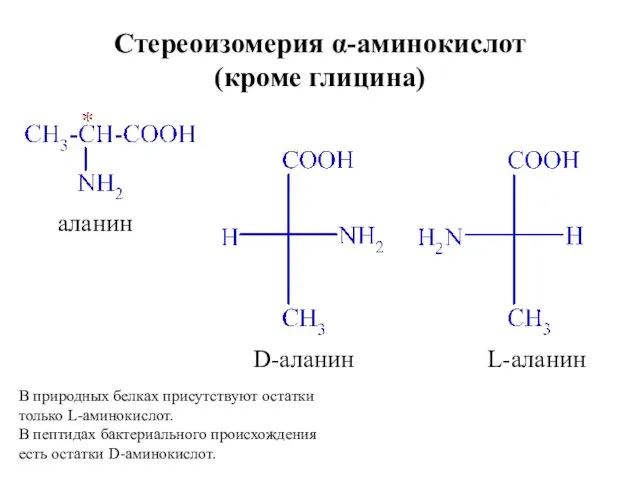
- 14. Стереоизомерия α-аминокислот (кроме глицина) аланин L-аланин D-аланин В природных белках присутствуют остатки только L-аминокислот. В пептидах
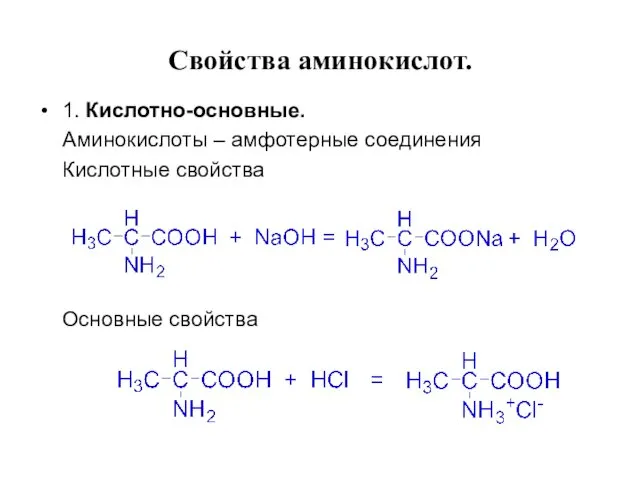
- 15. Свойства аминокислот. 1. Кислотно-основные. Аминокислоты – амфотерные соединения Кислотные свойства Основные свойства
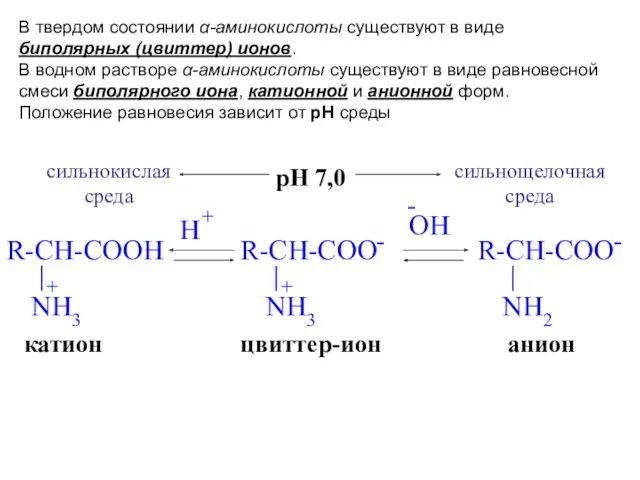
- 16. цвиттер-ион анион катион pH 7,0 сильнокислая среда сильнощелочная среда В твердом состоянии α-аминокислоты существуют в виде
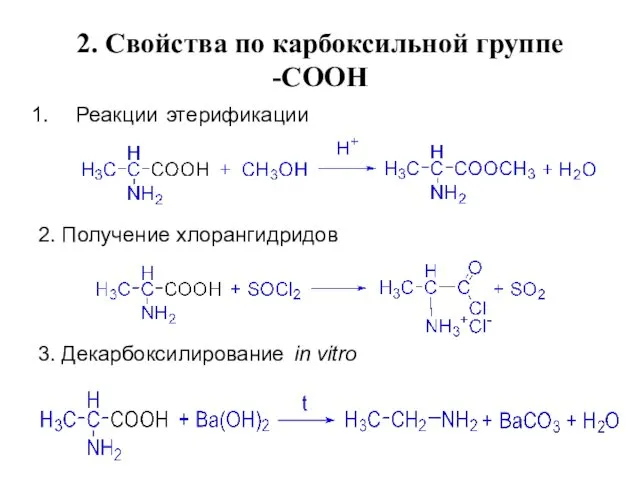
- 17. 2. Свойства по карбоксильной группе -СООН Реакции этерификации 2. Получение хлорангидридов 3. Декарбоксилирование in vitro
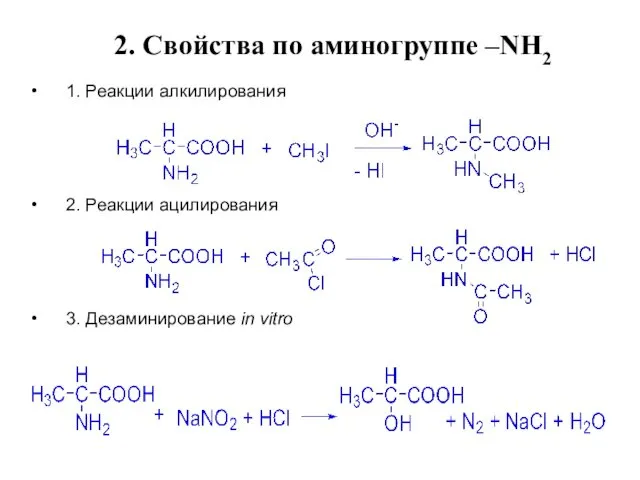
- 18. 2. Свойства по аминогруппе –NН2 1. Реакции алкилирования 2. Реакции ацилирования 3. Дезаминирование in vitro
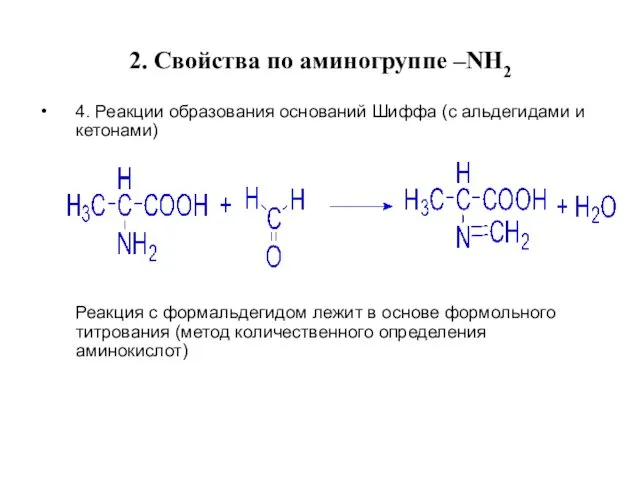
- 19. 2. Свойства по аминогруппе –NН2 4. Реакции образования оснований Шиффа (с альдегидами и кетонами) Реакция с
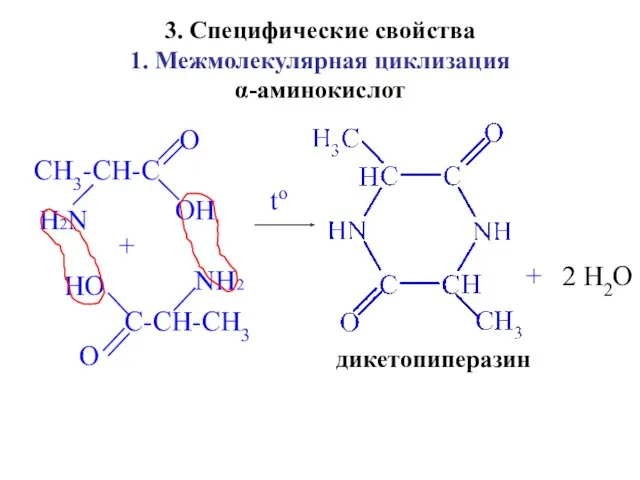
- 20. 3. Специфические свойства 1. Межмолекулярная циклизация α-аминокислот CH3-CH-C H2N O O H C-CH-CH3 O H O
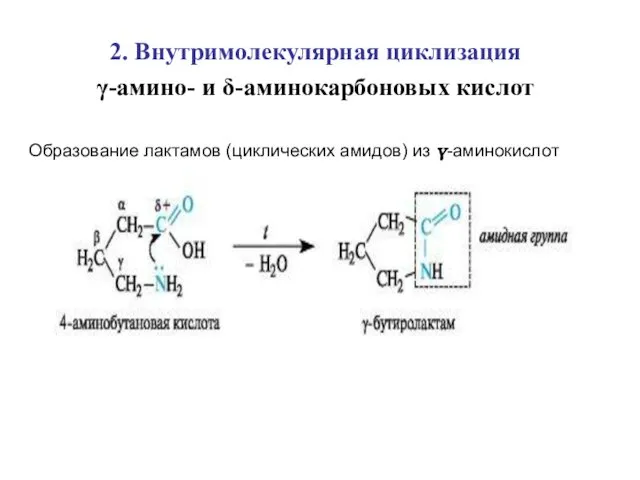
- 21. 2. Внутримолекулярная циклизация γ-амино- и δ-аминокарбоновых кислот Образование лактамов (циклических амидов) из γ-аминокислот
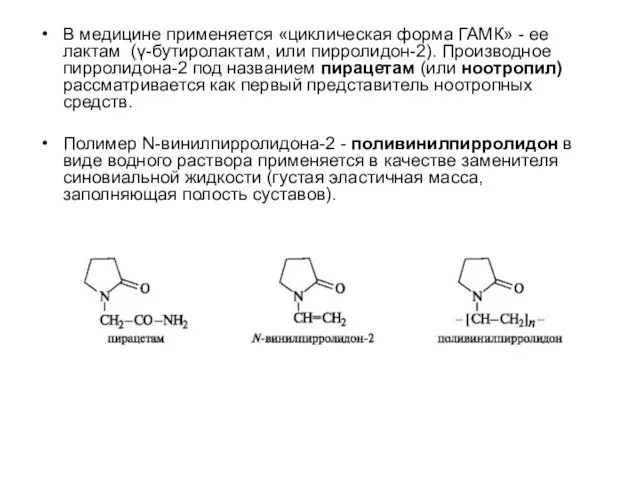
- 22. В медицине применяется «циклическая форма ГАМК» - ее лактам (γ-бутиролактам, или пирролидон-2). Производное пирролидона-2 под названием
- 23. Реакции α-аминокислот in vivo 1. декарбоксилирование 2. дезаминирование - окислительное; - неокислительное 3. восстановительное аминирование 4.
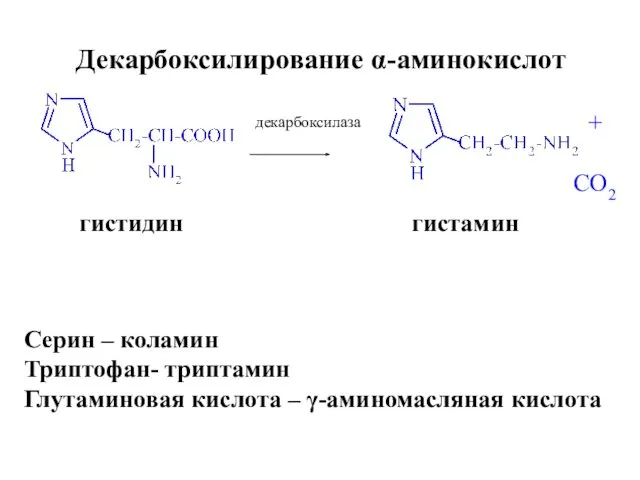
- 24. Декарбоксилирование α-аминокислот гистидин гистамин + CO2 декарбоксилаза Серин – коламин Триптофан- триптамин Глутаминовая кислота – γ-аминомасляная
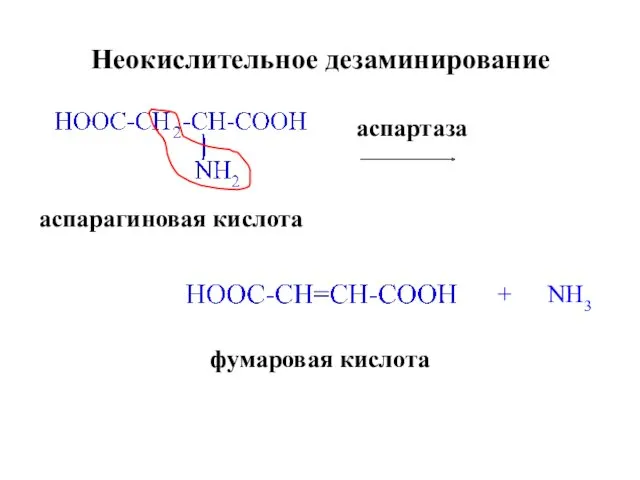
- 25. Неокислительное дезаминирование аспартаза + NH3 аспарагиновая кислота фумаровая кислота
- 26. Окислительное дезаминирование аланин [O] оксидаза, НАД+ α-иминокислота H2O фермент пировиноградная кислота + NH3
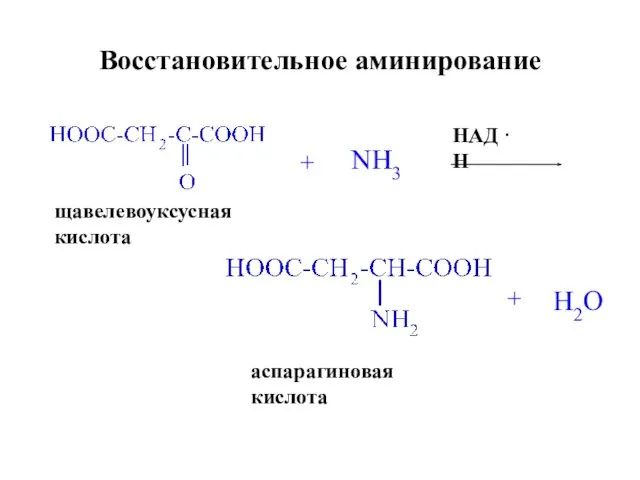
- 27. Восстановительное аминирование щавелевоуксусная кислота + NH3 НАД · Н аспарагиновая кислота + H2O
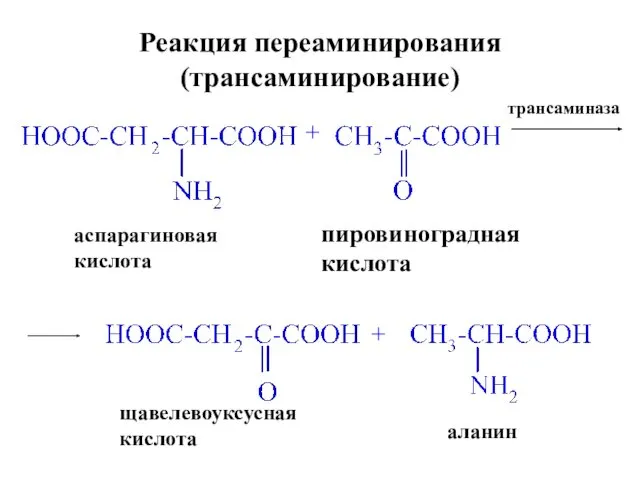
- 28. Реакция переаминирования (трансаминирование) аспарагиновая кислота + трансаминаза + пировиноградная кислота щавелевоуксусная кислота аланин
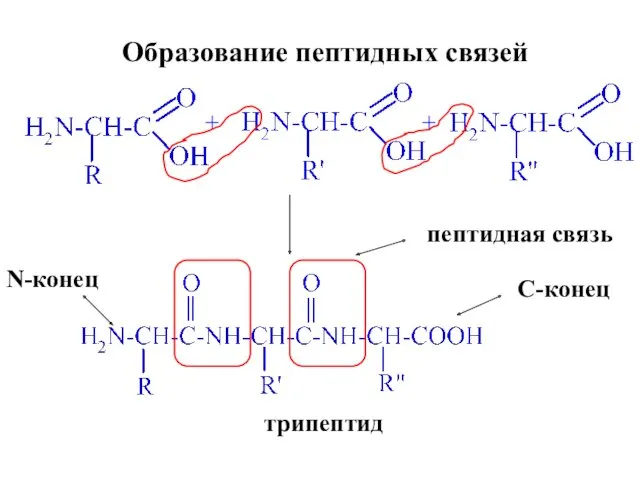
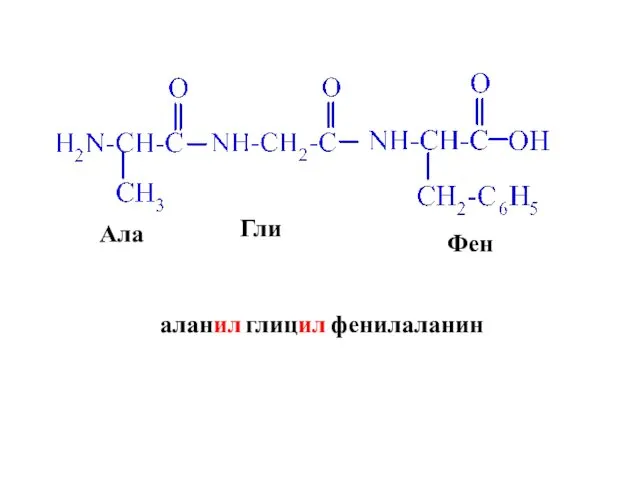
- 29. + + трипептид пептидная связь N-конец C-конец Образование пептидных связей
- 30. Ала Гли Фен аланил глицил фенилаланин
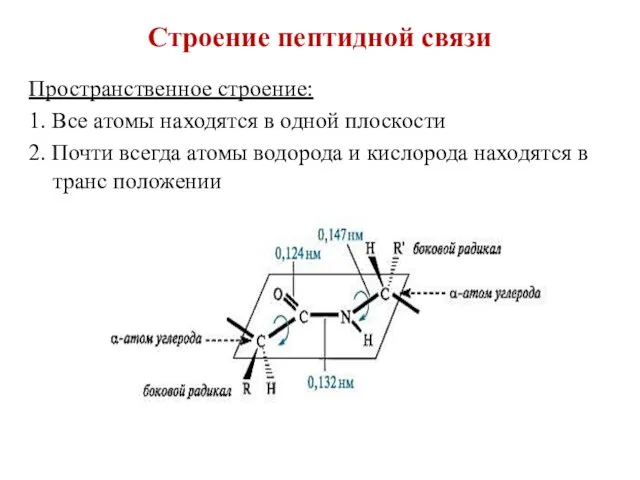
- 31. Строение пептидной связи Пространственное строение: 1. Все атомы находятся в одной плоскости 2. Почти всегда атомы
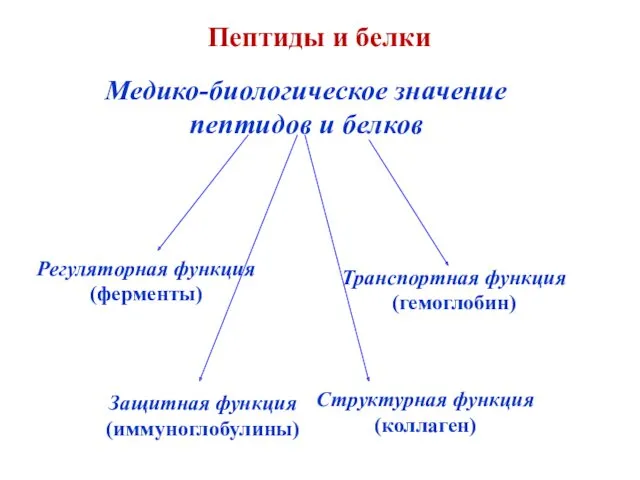
- 32. Пептиды и белки Медико-биологическое значение пептидов и белков Регуляторная функция (ферменты) Защитная функция (иммуноглобулины) Транспортная функция
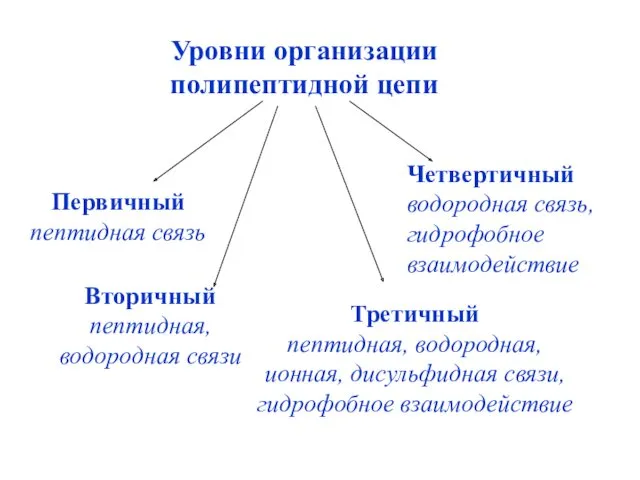
- 33. Уровни организации полипептидной цепи Первичный пептидная связь Вторичный пептидная, водородная связи Третичный пептидная, водородная, ионная, дисульфидная
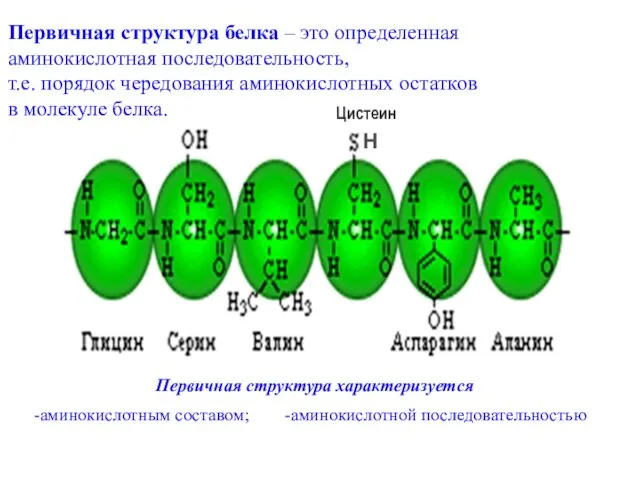
- 34. Первичная структура белка – это определенная аминокислотная последовательность, т.е. порядок чередования аминокислотных остатков в молекуле белка.
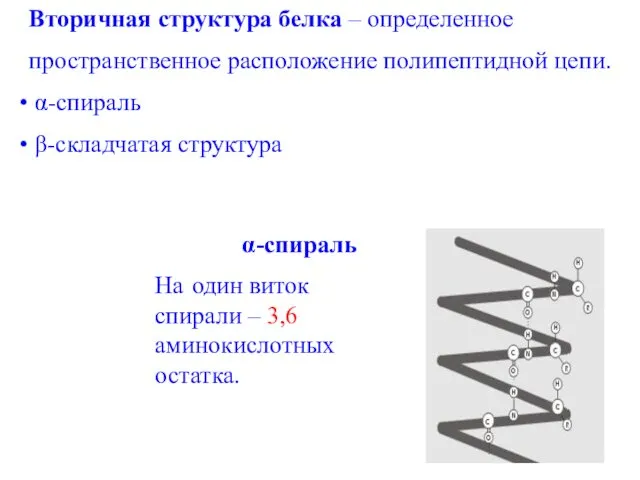
- 35. Вторичная структура белка – определенное пространственное расположение полипептидной цепи. α-спираль β-складчатая структура На один виток спирали
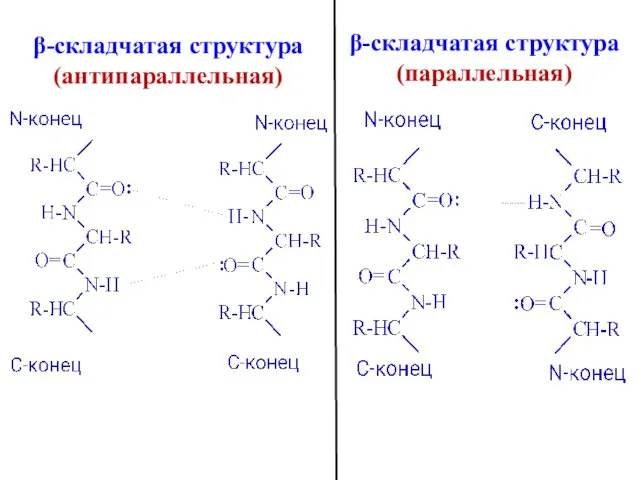
- 36. β-складчатая структура (параллельная) β-складчатая структура (антипараллельная)
- 37. Третичная структура белка Асп + Лиз ионная связь Цис Цис + [O] + H2O дисульфидный мостик
- 38. Четвертичная структура Четвертичная структура - агрегат нескольких белковых молекул образующих одну структуру Взаимодействия: ионные, водородные, гидрофобные,
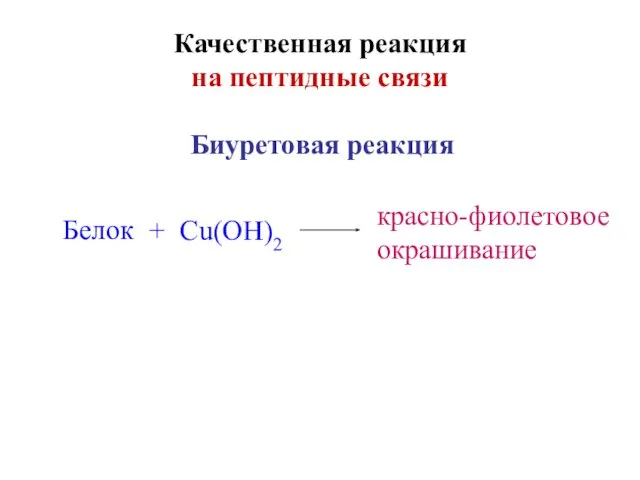
- 39. Качественная реакция на пептидные связи Белок + Cu(OH)2 красно-фиолетовое окрашивание Биуретовая реакция
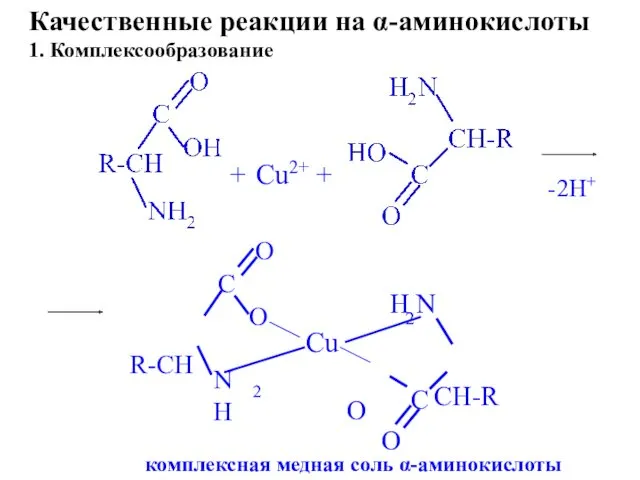
- 40. + Cu2+ + комплексная медная соль α-аминокислоты Качественные реакции на α-аминокислоты 1. Комплексообразование -2Н+
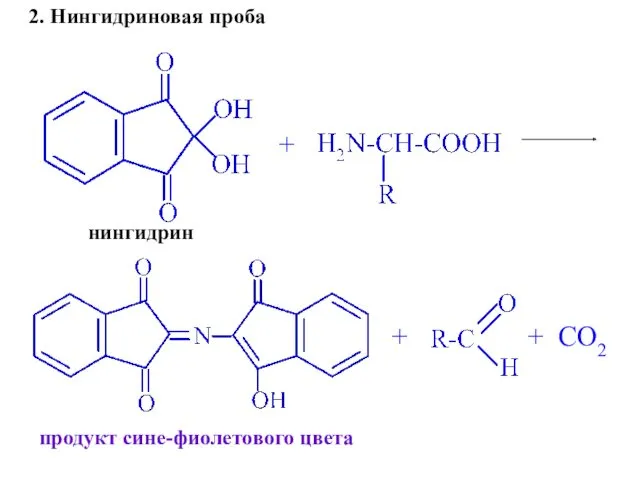
- 41. + + + CO2 нингидрин продукт сине-фиолетового цвета 2. Нингидриновая проба
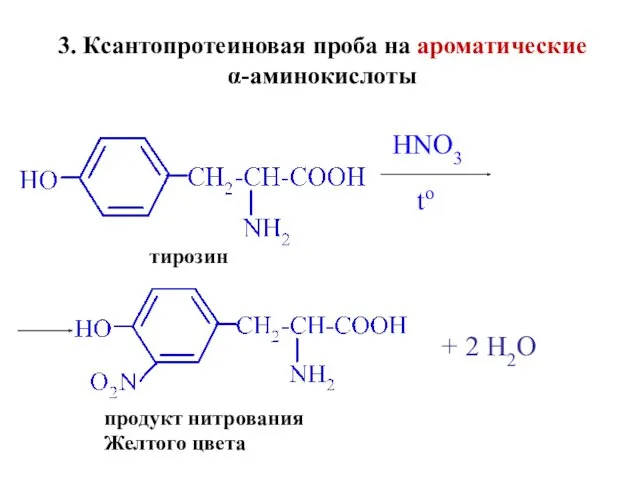
- 42. 3. Ксантопротеиновая проба на ароматические α-аминокислоты HNO3 to тирозин продукт нитрования Желтого цвета + 2 H2O
- 44. Скачать презентацию







![Окислительное дезаминирование аланин [O] оксидаза, НАД+ α-иминокислота H2O фермент пировиноградная кислота + NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/106738/slide-25.jpg)
![Третичная структура белка Асп + Лиз ионная связь Цис Цис + [O] + H2O дисульфидный мостик](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/106738/slide-36.jpg)

 Физиология питания
Физиология питания Тема. Корень. Внешнее строение корня. (6 класс)
Тема. Корень. Внешнее строение корня. (6 класс) Удивительное животное. Дельфин
Удивительное животное. Дельфин Внутрішня будова птахів
Внутрішня будова птахів Мир растений
Мир растений Біохімічний рівень організації
Біохімічний рівень організації Биомеханика опорно-двигательного аппарата человека
Биомеханика опорно-двигательного аппарата человека Раннее развитие эмбрионов млекопитающих
Раннее развитие эмбрионов млекопитающих Мастер-класс Формы работы с одаренными детьми
Мастер-класс Формы работы с одаренными детьми Селекцiя
Селекцiя Саморазвитие экосистемы
Саморазвитие экосистемы Среда обитания организмов. Тухватуллина Азалия
Среда обитания организмов. Тухватуллина Азалия Почему ромашка белая
Почему ромашка белая Обитатели водоёмов
Обитатели водоёмов Многообразие животных
Многообразие животных Местообитание и внешнее строение рыб
Местообитание и внешнее строение рыб Обмен углеводов
Обмен углеводов Общие сведения о строении организма человека
Общие сведения о строении организма человека Жануарлар әлемі
Жануарлар әлемі игра Что Где Когда по биологии
игра Что Где Когда по биологии Организм, как единая саморазвивающаяся и саморегулирующаяся биологическая система
Организм, как единая саморазвивающаяся и саморегулирующаяся биологическая система Эпизоотологическое и эпидемиологическое значение грызунов. Дератизация
Эпизоотологическое и эпидемиологическое значение грызунов. Дератизация междисциплинарное обучение
междисциплинарное обучение Биопотенциалдарды тіркейтін құралдардың жұмыс істеу принципі. (Дәріс 8)
Биопотенциалдарды тіркейтін құралдардың жұмыс істеу принципі. (Дәріс 8) Естественный отбор и его формы.
Естественный отбор и его формы. Дослідження процесу росту вегетативних органів (пагін і корінь): пшениці, квасолі, насіння соняшника
Дослідження процесу росту вегетативних органів (пагін і корінь): пшениці, квасолі, насіння соняшника Лошади русской верховой породы
Лошади русской верховой породы Строение и функции белков
Строение и функции белков