Содержание
- 2. Движение грузов: модели Модель 1: везикулярный транспорт (разработана по клетках человека и животных) Модель 2: мембранный
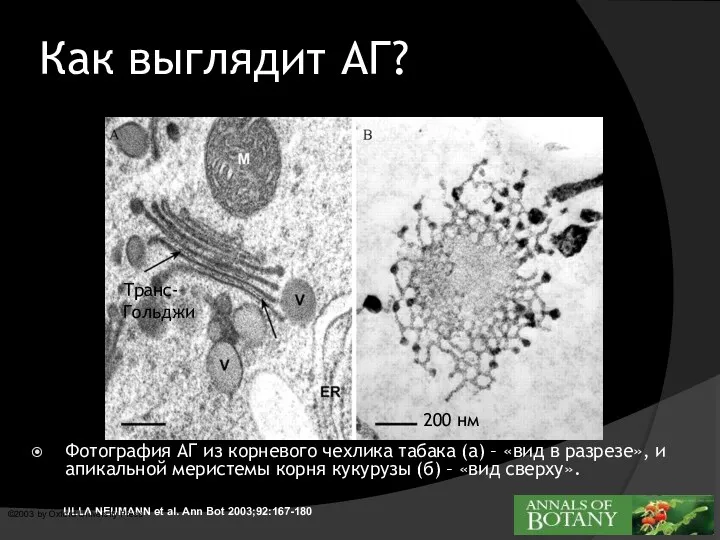
- 3. ULLA NEUMANN et al. Ann Bot 2003;92:167-180 ©2003 by Oxford University Press Как выглядит АГ? Фотография
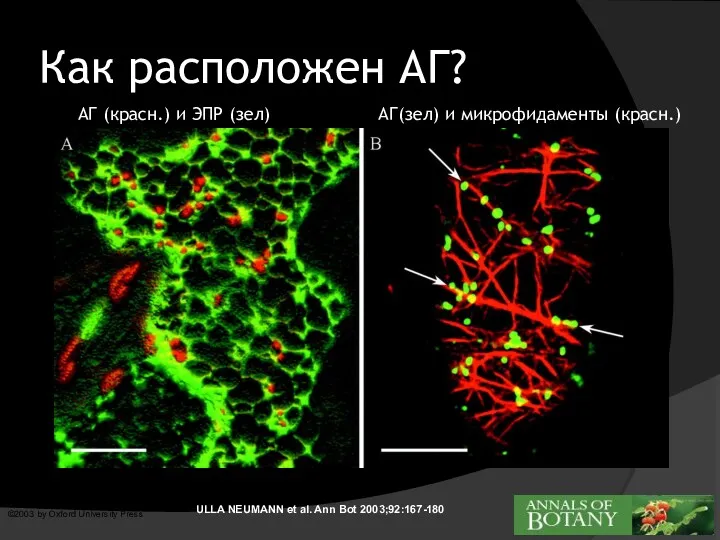
- 4. ULLA NEUMANN et al. Ann Bot 2003;92:167-180 ©2003 by Oxford University Press Как расположен АГ? АГ
- 5. Что держит цистерны вместе? Каждый АГ состоит из 5-8 цистерн. ribosome-exclusion zone – зона вокруг АГ,
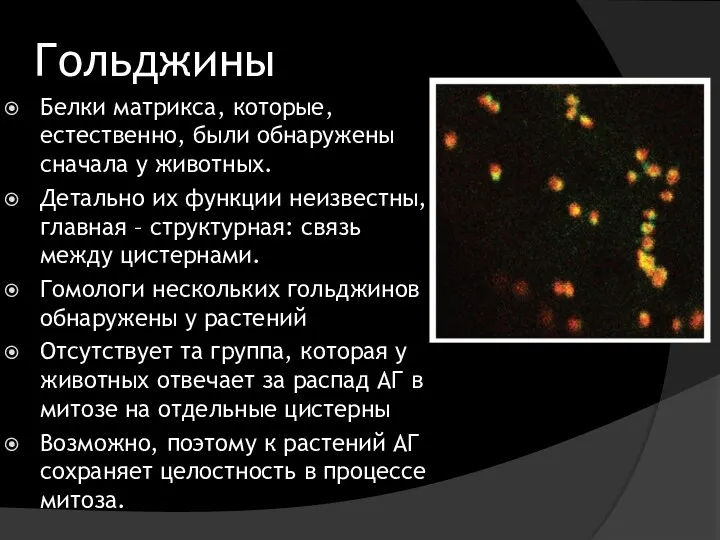
- 6. Гольджины Белки матрикса, которые, естественно, были обнаружены сначала у животных. Детально их функции неизвестны, главная –
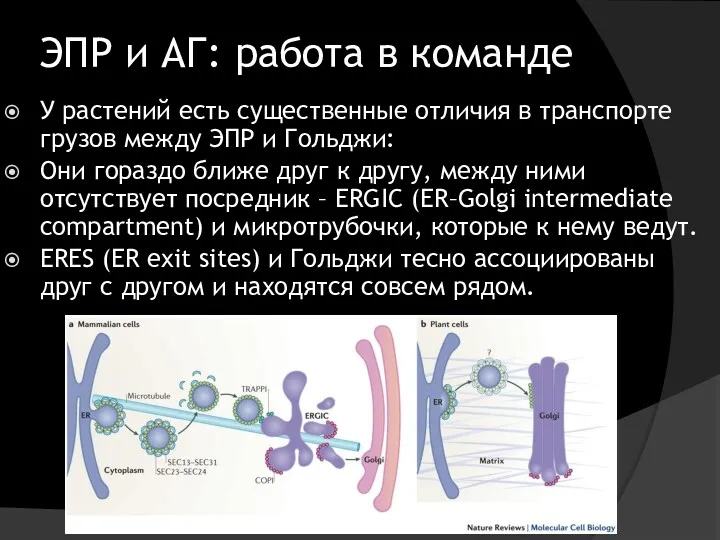
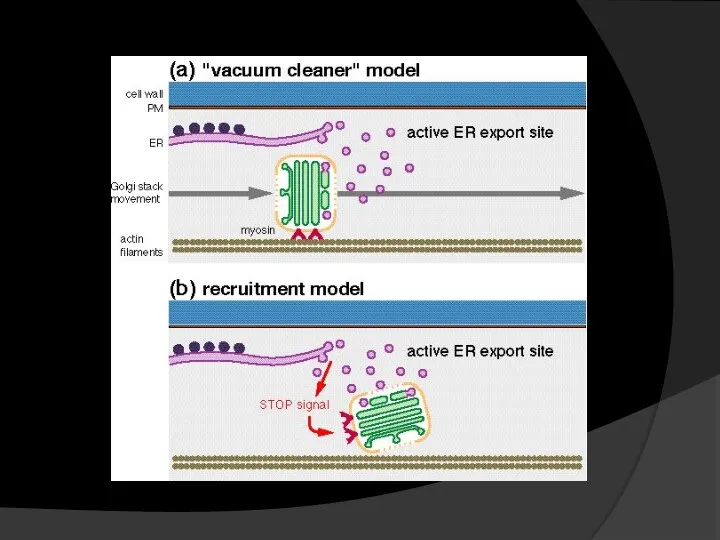
- 7. ЭПР и АГ: работа в команде У растений есть существенные отличия в транспорте грузов между ЭПР
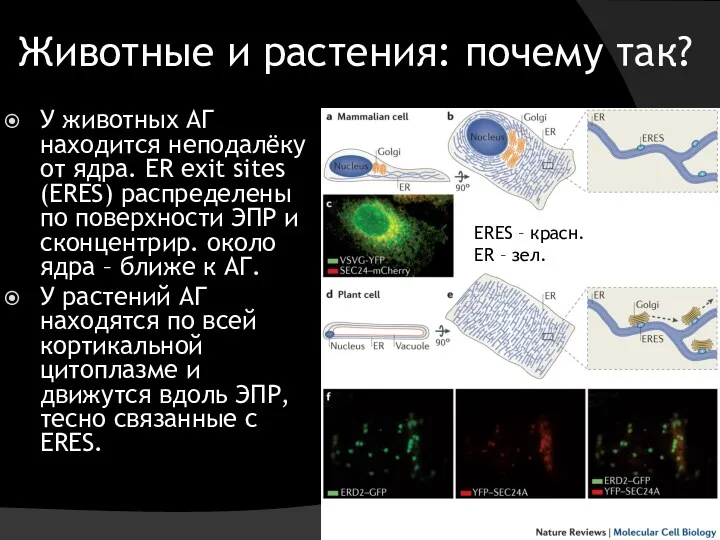
- 8. Животные и растения: почему так? У животных АГ находится неподалёку от ядра. ER exit sites (ERES)
- 9. Fig. 3. ULLA NEUMANN et al. Ann Bot 2003;92:167-180 ©2003 by Oxford University Press ЭПР и
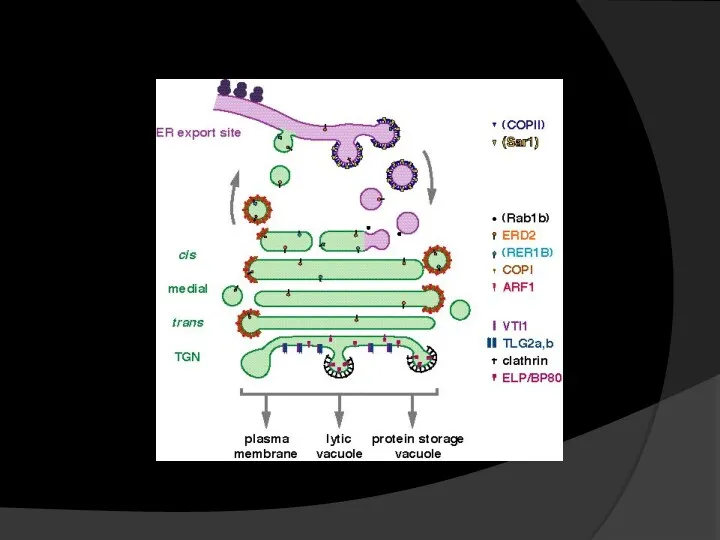
- 11. Отцы и дети… Ряд авторов рассматривает АГ как «потомка» ЭПР. В принципе, это не влияет на
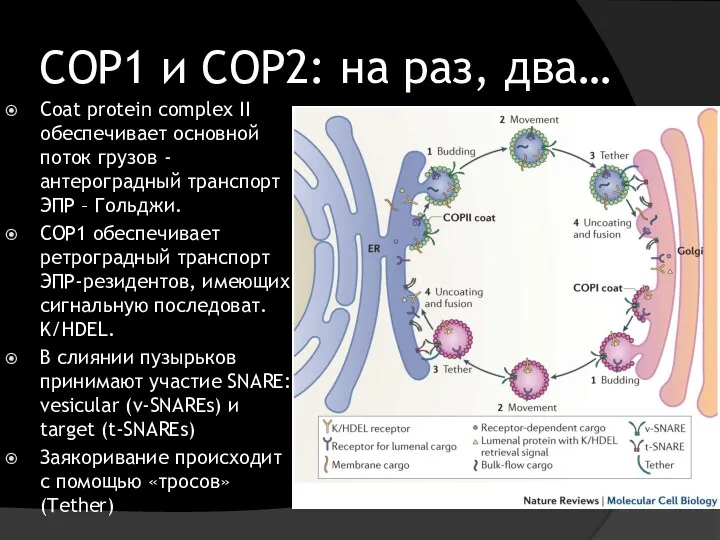
- 12. COP1 и COP2: на раз, два… Сoat protein complex II обеспечивает основной поток грузов - антероградный
- 13. Белки COP2 – молекулярные клетки Подвижная (гибкая) архитектура Формируют правильные многогранные «клетки»: 24-гранные и 60-гранные При
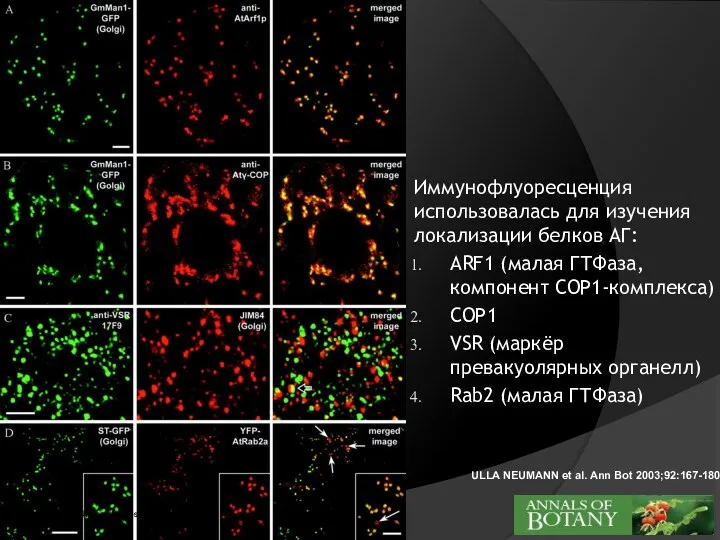
- 15. ULLA NEUMANN et al. Ann Bot 2003;92:167-180 ©2003 by Oxford University Press Иммунофлуоресценция использовалась для изучения
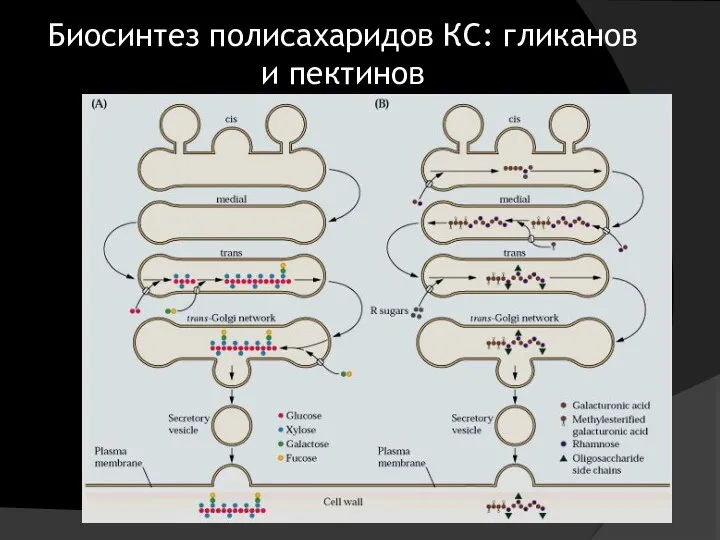
- 16. «Дозревание» белков, предназначенных для секреторного пути (гликозилирование) Биосинтез полисахаридов клеточной стенки и ферментов, обеспечивающих её формирование
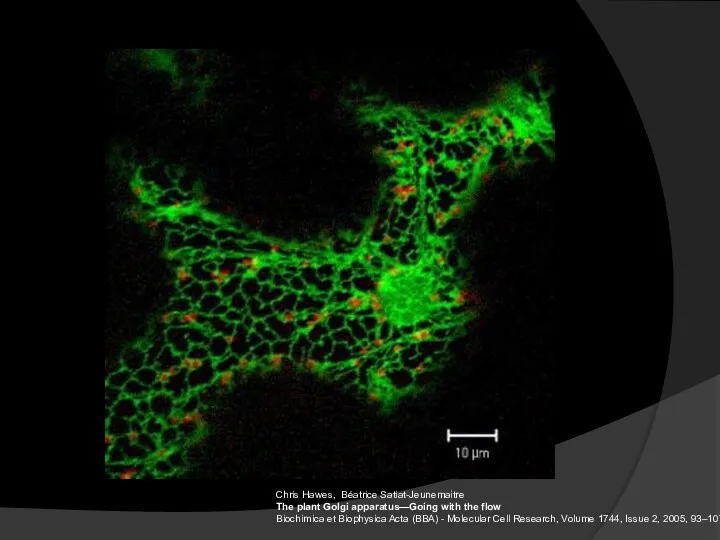
- 17. Chris Hawes, Béatrice Satiat-Jeunemaitre The plant Golgi apparatus—Going with the flow Biochimica et Biophysica Acta (BBA)
- 18. Гликозилтрансферазы Задача – манипуляции с углеводным компонентом: - N-гликозилированных пептидов - Будущих полимеров клеточной стенки Это
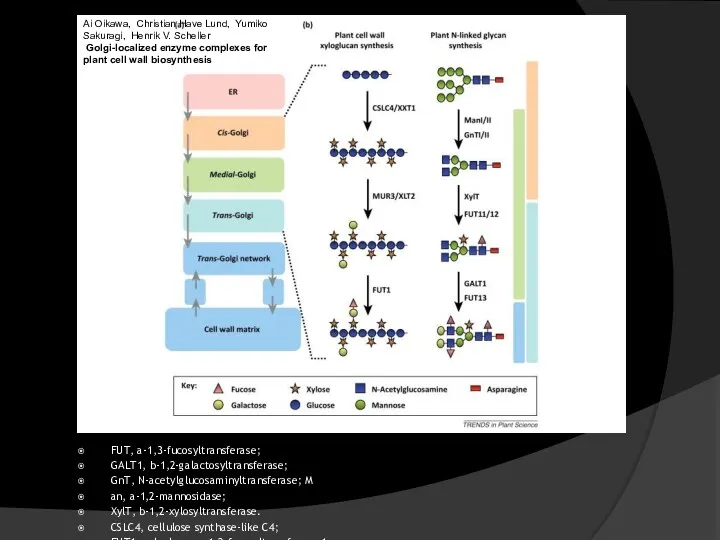
- 19. Ai Oikawa, Christian Have Lund, Yumiko Sakuragi, Henrik V. Scheller Golgi-localized enzyme complexes for plant cell
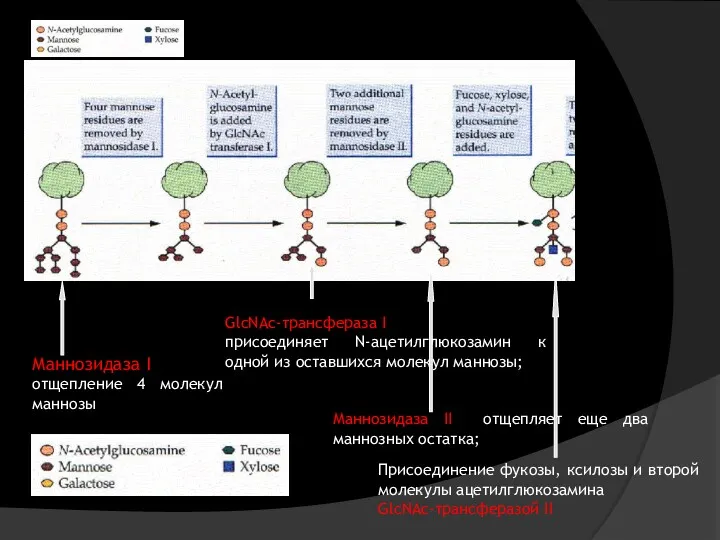
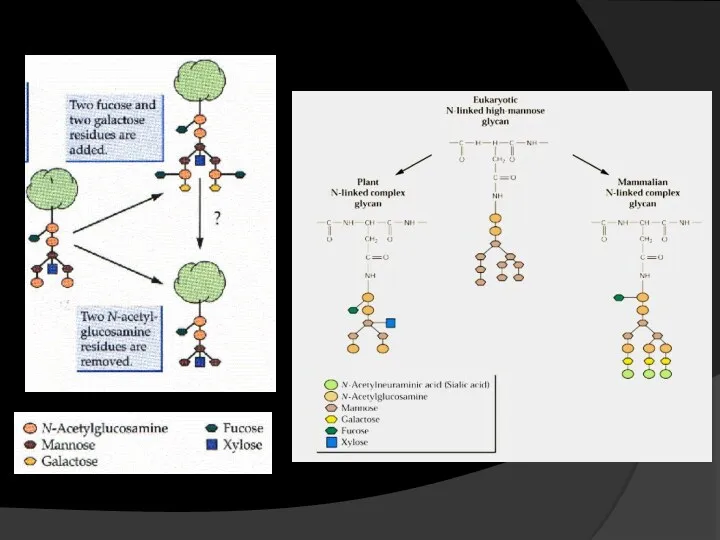
- 20. Маннозидаза I отщепление 4 молекул маннозы GlcNAc-трансфераза I присоединяет N-ацетилглюкозамин к одной из оставшихся молекул маннозы;
- 22. Биосинтез полисахаридов КС: гликанов и пектинов
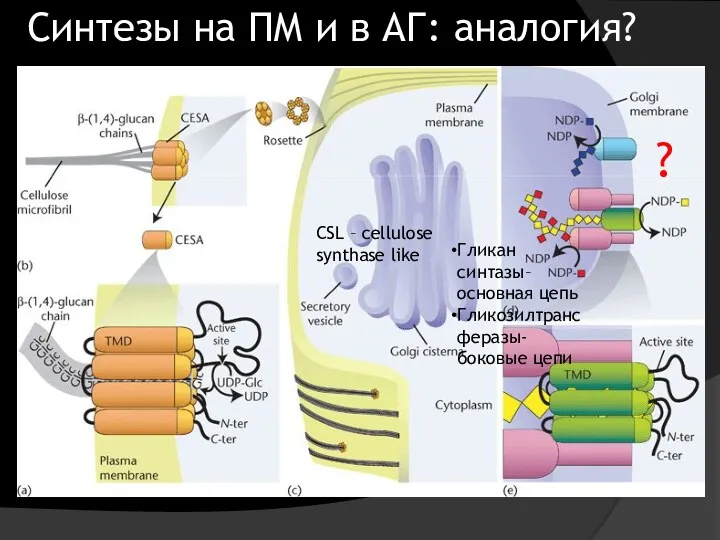
- 23. Гликан синтазы– основная цепь Гликозилтрансферазы- боковые цепи CSL – cellulose synthase like Синтезы на ПМ и
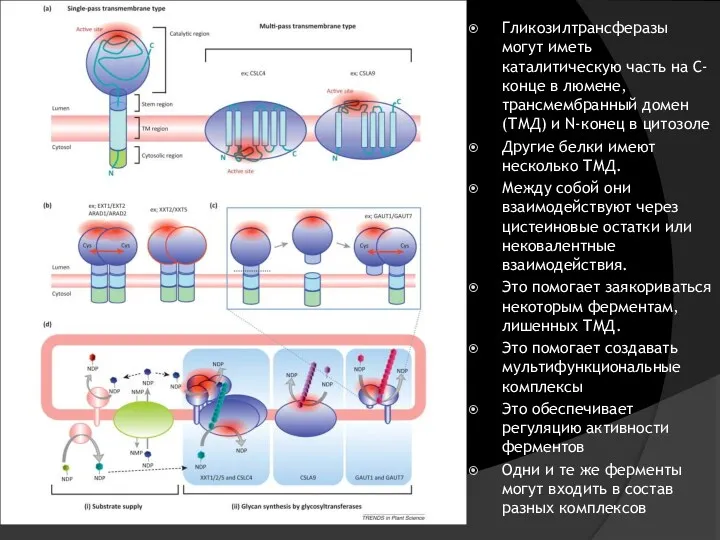
- 24. Гликозилтрансферазы могут иметь каталитическую часть на С-конце в люмене, трансмембранный домен (ТМД) и N-конец в цитозоле
- 25. Методы Как изучать направления и пути транспорта?
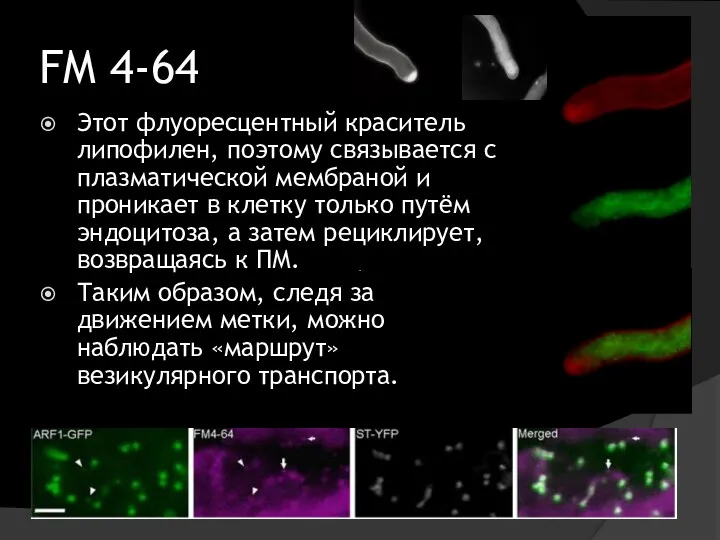
- 26. FM 4-64 Этот флуоресцентный краситель липофилен, поэтому связывается с плазматической мембраной и проникает в клетку только
- 27. BFA-bodies: ингибиторный анализ Давным-давно для изучения секреции начали использовать Брефельдин А – «ингибитор секреции». Он останавливает
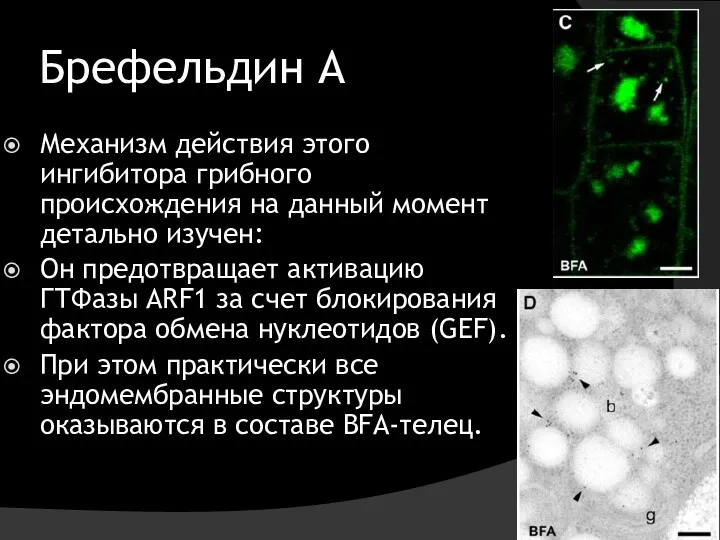
- 28. Брефельдин А Механизм действия этого ингибитора грибного происхождения на данный момент детально изучен: Он предотвращает активацию
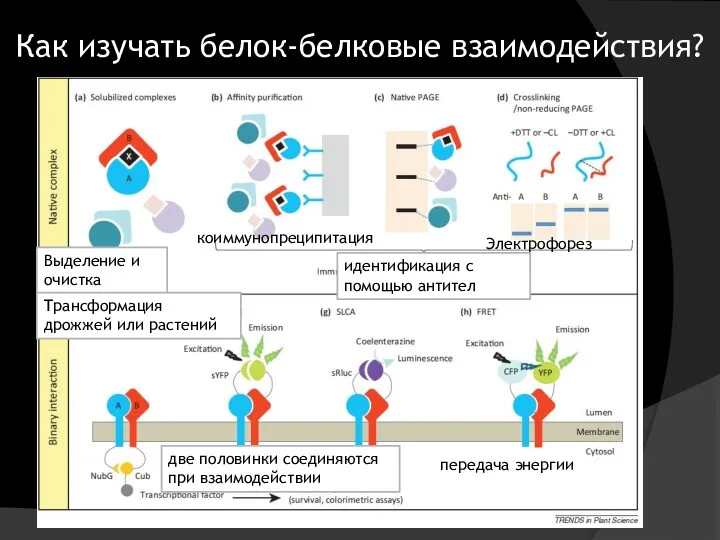
- 29. Как изучать белок-белковые взаимодействия? Выделение и очистка коиммунопреципитация идентификация с помощью антител Электрофорез две половинки соединяются
- 30. ПОСТ-ГОЛЬДЖИ ТРАНСПОРТ Секреторный путь. Эндоцитозный путь. Дополнительные органеллы.
- 31. Транс Гольджи Сеть Также носит название «ЕЕ» (early endosome) Движется независимо от АГ и лишь временно
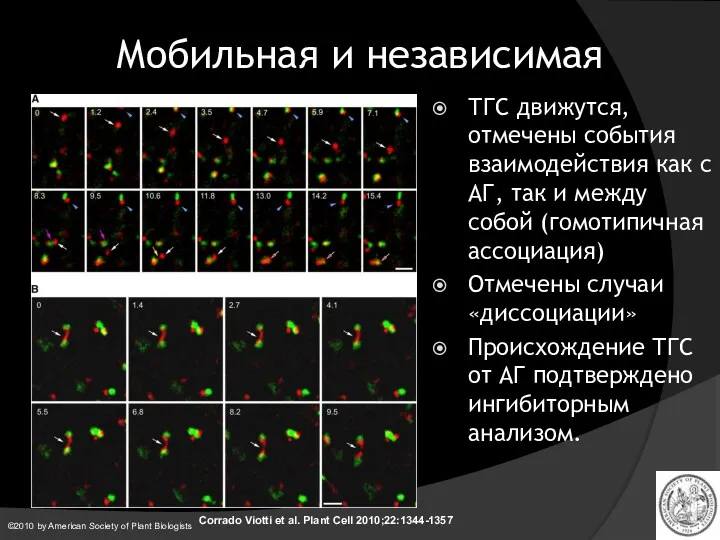
- 32. Мобильная и независимая Corrado Viotti et al. Plant Cell 2010;22:1344-1357 ©2010 by American Society of Plant
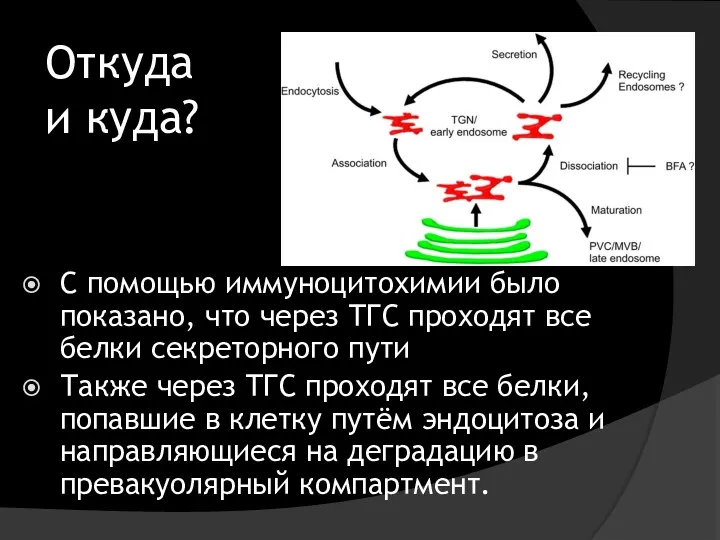
- 33. Откуда и куда? C помощью иммуноцитохимии было показано, что через ТГС проходят все белки секреторного пути
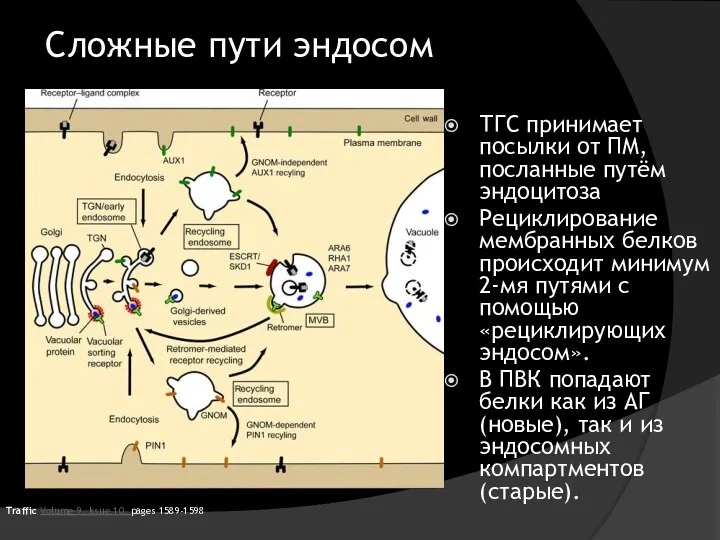
- 34. Сложные пути эндосом ТГС принимает посылки от ПМ, посланные путём эндоцитоза Рециклирование мембранных белков происходит минимум
- 35. ПреВакуолярный Компартмент ПВК получил свое второе название МВТ – мультивезикулярное тело - благодаря своей способности образовывать
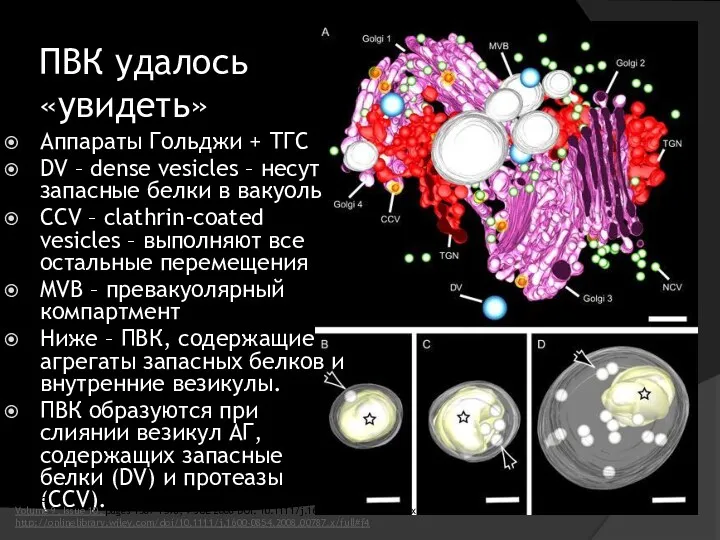
- 36. ПВК удалось «увидеть» Аппараты Гольджи + ТГС DV – dense vesicles – несут запасные белки в
- 37. Значение эндоцитоза Эндоцитоз и эндосомы играют ключевую роль в дифференциации зародыша, гравитропизме, дифференциация эпидермиса, устьичных движениях,
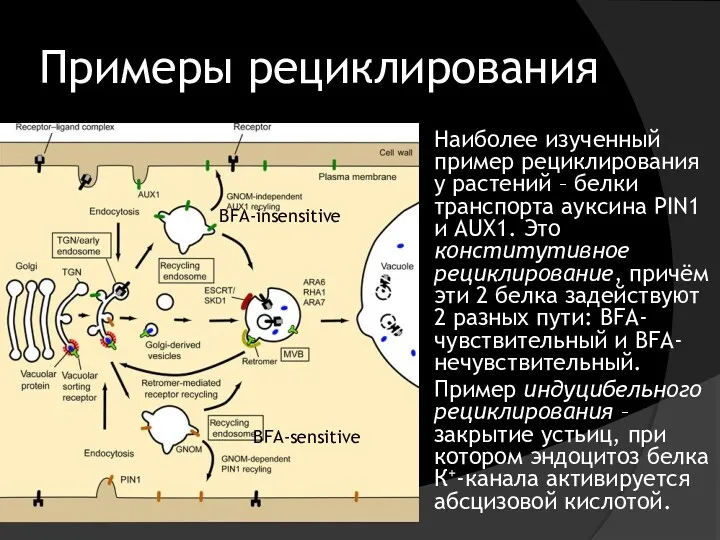
- 38. Примеры рециклирования Наиболее изученный пример рециклирования у растений – белки транспорта ауксина PIN1 и AUX1. Это
- 39. На деградацию! Сортировка белков ПМ в эндоцитозные везикулы и далее во внутренние везикулы ПВК – важный
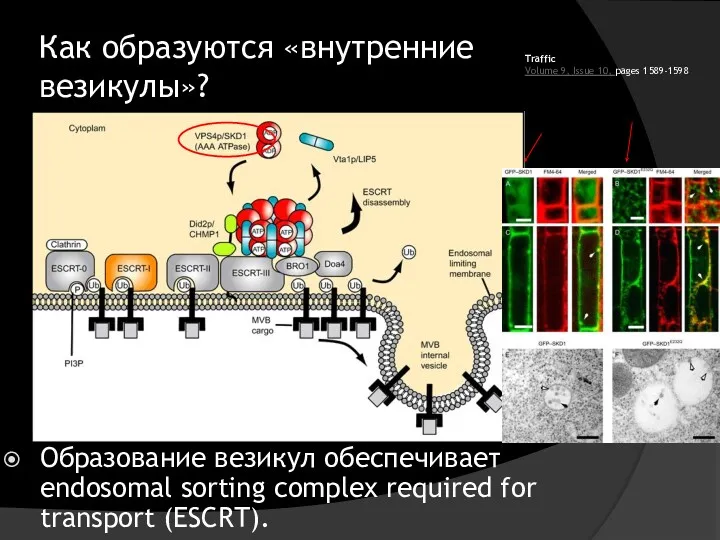
- 40. Как образуются «внутренние везикулы»? Образование везикул обеспечивает endosomal sorting complex required for transport (ESCRT). Traffic Volume
- 41. Как образуются «внутренние везикулы»? Меченый убиквитином рецептор попадает в эндосому и инициирует сборку клатриновой шубы. В
- 42. Эндосомы и сигналинг Эндоцитоз не только помогает убирать с поверхности активированные рецепторы Он также может доставлять
- 43. Niko Geldner, and Silke Robatzek Plant Physiol. 2008;147:1565-1574 ©2008 by American Society of Plant Biologists Эндосомы
- 44. Происхождения эндосомного сигналинга «Столпотворение»? рецепторам не хватает места на поверхности клетки; эндоцитоз создаёт дополнительные «посадочные места».
- 45. Вакуоли: 2 или 1 Известно 2 основных типа вакуолей: LV (литическая) и PSV (белок-запасающая). Их локализацию
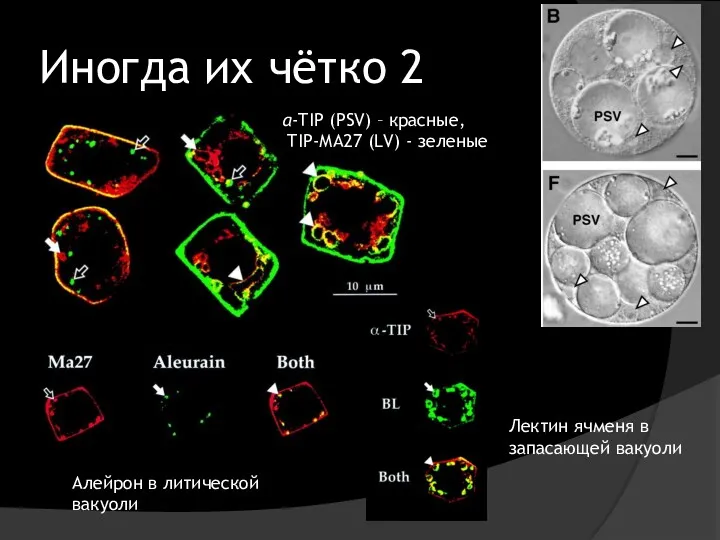
- 46. Иногда их чётко 2 Алейрон в литической вакуоли Лектин ячменя в запасающей вакуоли α-TIP (PSV) –
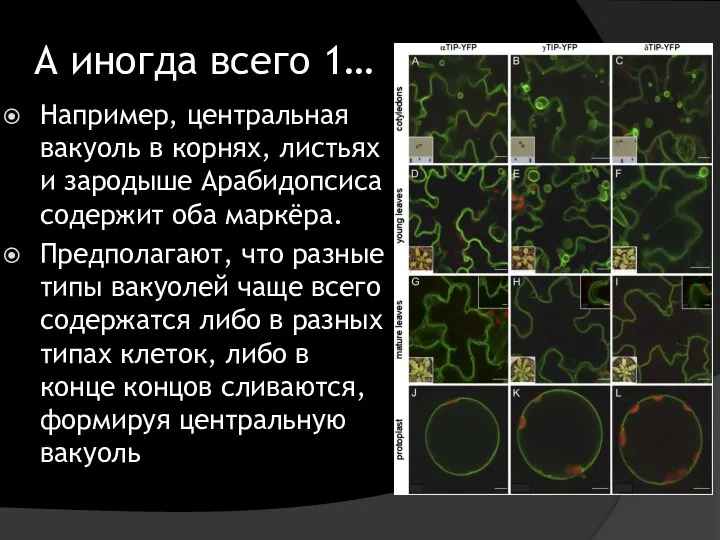
- 47. А иногда всего 1… Например, центральная вакуоль в корнях, листьях и зародыше Арабидопсиса содержит оба маркёра.
- 49. Скачать презентацию



















 20181126_razvitie_nasekomyh
20181126_razvitie_nasekomyh Презентация к уроку Методы изучения природы
Презентация к уроку Методы изучения природы Слуховой и вестибулярный анализаторы
Слуховой и вестибулярный анализаторы Презентация к уроку Тип Хордовые
Презентация к уроку Тип Хордовые Клетка. 10 класс
Клетка. 10 класс Обоняние. Система обоняния человека
Обоняние. Система обоняния человека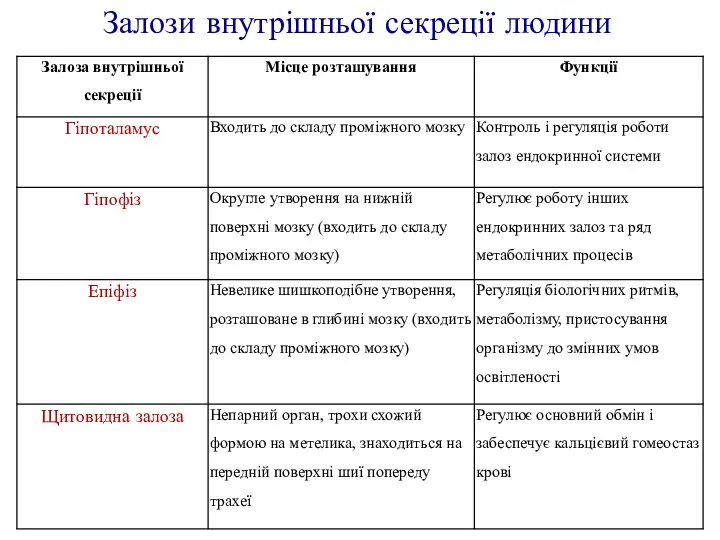 Залози внутрішньої секреції людини
Залози внутрішньої секреції людини Cellular neurophysiology
Cellular neurophysiology Почему звенит звонок. 1 класс
Почему звенит звонок. 1 класс Посттрансляционная регуляция экспрессии генов
Посттрансляционная регуляция экспрессии генов Подцарство Многоклеточные (Metazoa). Тип Круглые или Первичнополостные черви (Nemathelminthes) класс Нематоды (Nematoda)
Подцарство Многоклеточные (Metazoa). Тип Круглые или Первичнополостные черви (Nemathelminthes) класс Нематоды (Nematoda) От мозга к искусственному интеллекту
От мозга к искусственному интеллекту Функциональная анатомия нервной системы,
Функциональная анатомия нервной системы, Кровеносная система. Кровь
Кровеносная система. Кровь Систематика. Классификацией живых организмов
Систематика. Классификацией живых организмов Выделение. Процесс выделения у растений и животных
Выделение. Процесс выделения у растений и животных Мой домашний питомец – красноухая черепаха
Мой домашний питомец – красноухая черепаха Класс Двудольные. Семейство Крестоцветные
Класс Двудольные. Семейство Крестоцветные Микробы (Окружающий мир, 3 класс)
Микробы (Окружающий мир, 3 класс) Dolly the sheep - the first cloned mammal
Dolly the sheep - the first cloned mammal Biotechnology (applied biology)
Biotechnology (applied biology) Виды чеснока. Способы выращивания
Виды чеснока. Способы выращивания Аграрний сервіс майбутнього
Аграрний сервіс майбутнього Своя игра. Знатоки млекопитающих
Своя игра. Знатоки млекопитающих Дыхание растений. Урок биологии. 6 класс
Дыхание растений. Урок биологии. 6 класс Строение и работа сердца
Строение и работа сердца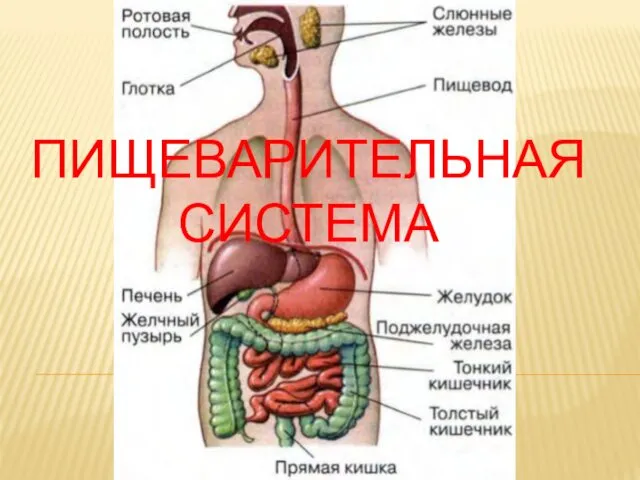 Пищеварительная система
Пищеварительная система Вводный урок
Вводный урок