Содержание
- 2. Возбудителями острых гнойных и хронических маститов являются: Staphylococcus aureus, α- и β-стрептококки, E.coli, Klebsiella, Proteus, Ps.aeruginosa,
- 3. Взятие материала Материал (молоко)отбирают из пораженных долек с соблюдением правил асептики. перед взятием соски вымени коров
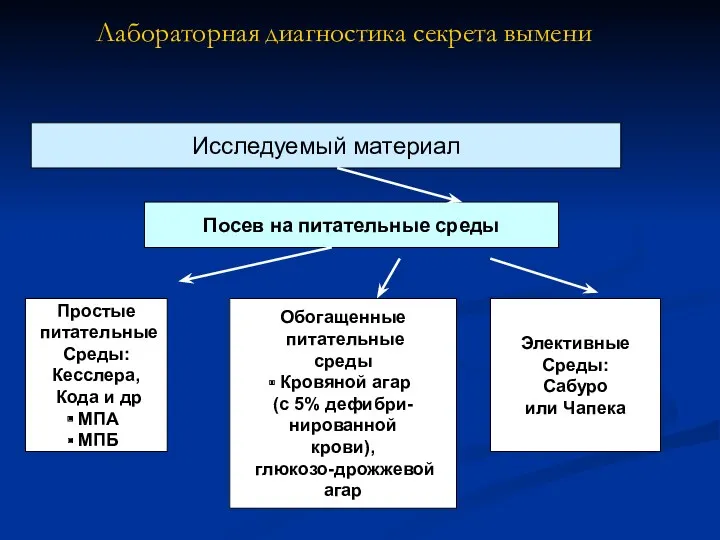
- 4. Лабораторная диагностика секрета вымени Исследуемый материал Посев на питательные среды Простые питательные Среды: Кесслера, Кода и
- 5. Оценка результатов исследования При появлении роста на плотных питательных средах изучают выросшие колонии, проводят качественную и
- 6. Рост стафилококков на кровяном агаре и желточно-солевом агаре Чистовича
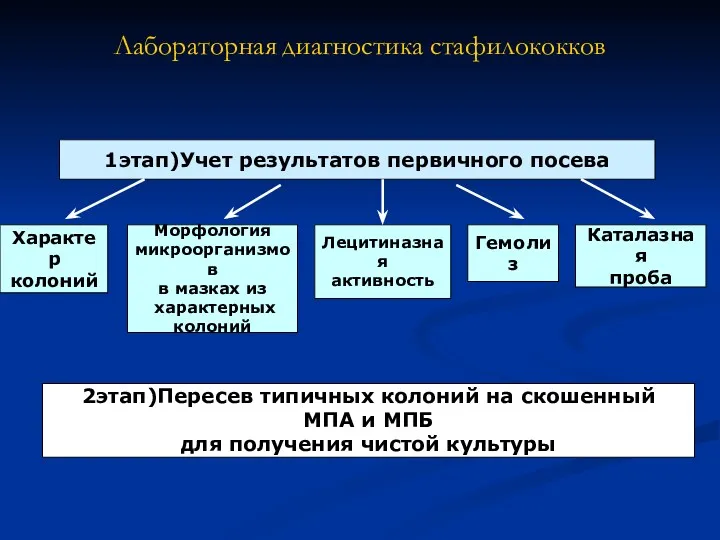
- 7. Лабораторная диагностика стафилококков 1этап)Учет результатов первичного посева Характер колоний Морфология микроорганизмов в мазках из характерных колоний
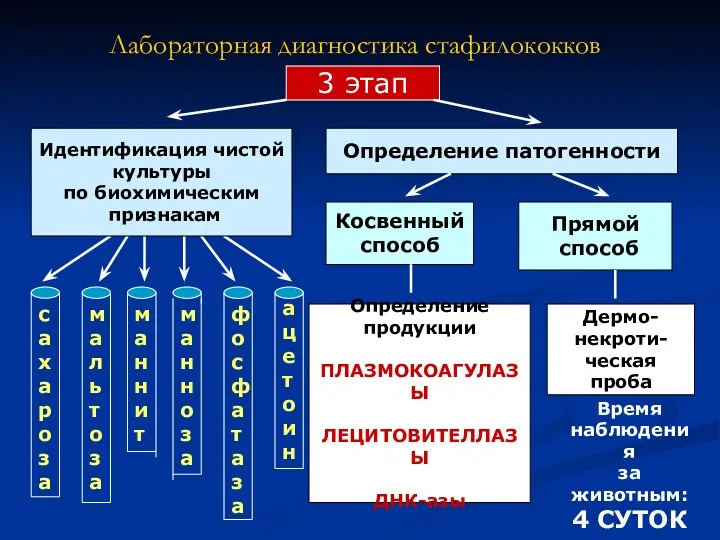
- 8. Определение продукции ПЛАЗМОКОАГУЛАЗЫ ЛЕЦИТОВИТЕЛЛАЗЫ ДНК-азы Лабораторная диагностика стафилококков 3 этап Определение патогенности Косвенный способ Прямой способ
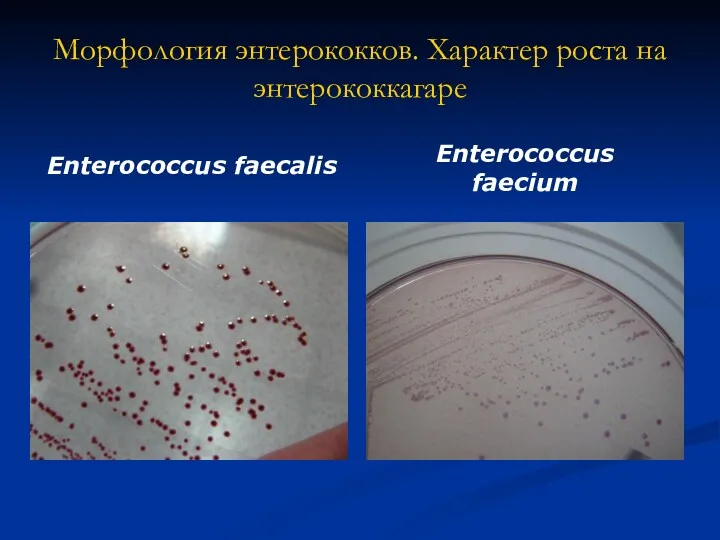
- 9. Морфология энтерококков. Характер роста на энтерококкагаре Enterococcus faecalis Enterococcus faecium
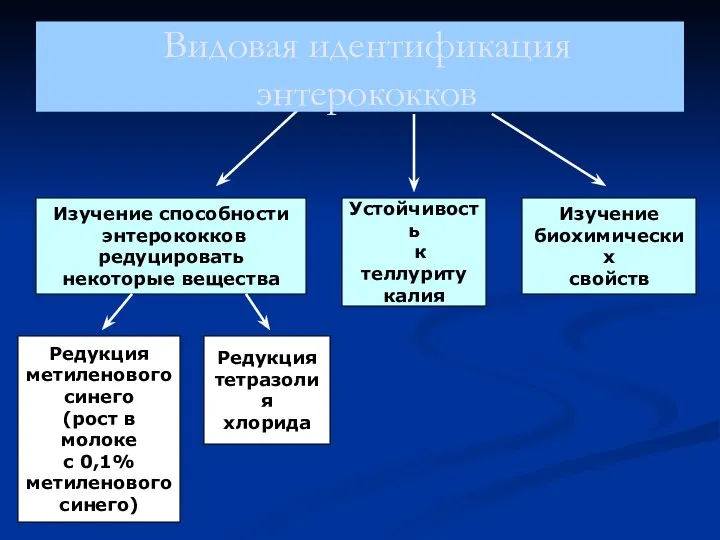
- 10. Лабораторная диагностика энтерококков Подтверждение принадлежности выделенных микроорганизмов к роду Enterococcus Тест на каталазу (отрицательный) при 45ºС
- 11. Изучение способности энтерококков редуцировать некоторые вещества Изучение биохимических свойств Редукция метиленового синего (рост в молоке с
- 12. Характер роста стрептококков на кровяном агаре α-гемолитический стрептококк β-гемолитический стрептококк
- 13. Микробиологические методы идентификации микробов семейства стрептококковых Просмотр чашек с посевами
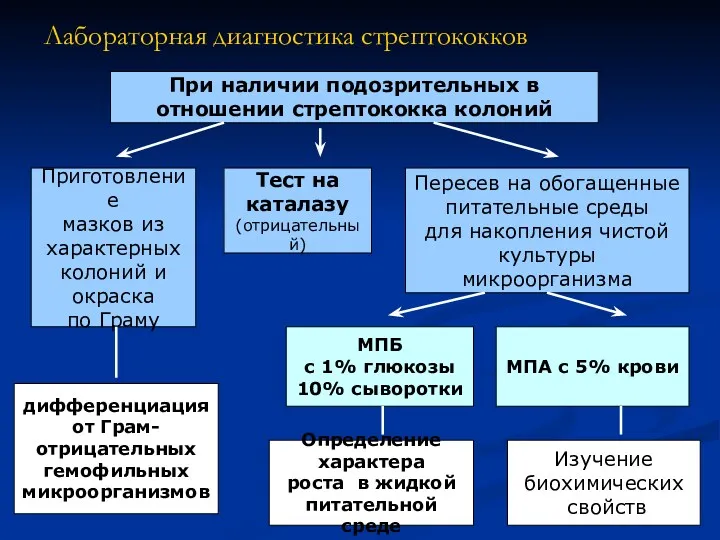
- 14. Лабораторная диагностика стрептококков При наличии подозрительных в отношении стрептококка колоний Приготовление мазков из характерных колоний и
- 15. Лабораторная диагностика эшерихий 1-й день исследования Исследуемый материал Первичный посев Ср. Кесслера, Кода и др МПБ,
- 16. Лабораторная диагностика 2-й день исследования Учет результатов первичного посева Морфология микроорганизмов в мазках из характерных колоний
- 17. Лабораторная диагностика 3-й день исследования Идентификация чистой культуры по биохимическим признакам
- 18. Пробу молока засевают в пробирки со средой Кесслера/ Кода . Посевы инкубируют при t - 43/37°С.
- 19. Рост на средах 4 типа колоний Escherichia coli на плотных питательных средах: сочные, вариабельно выпуклые, серовато-
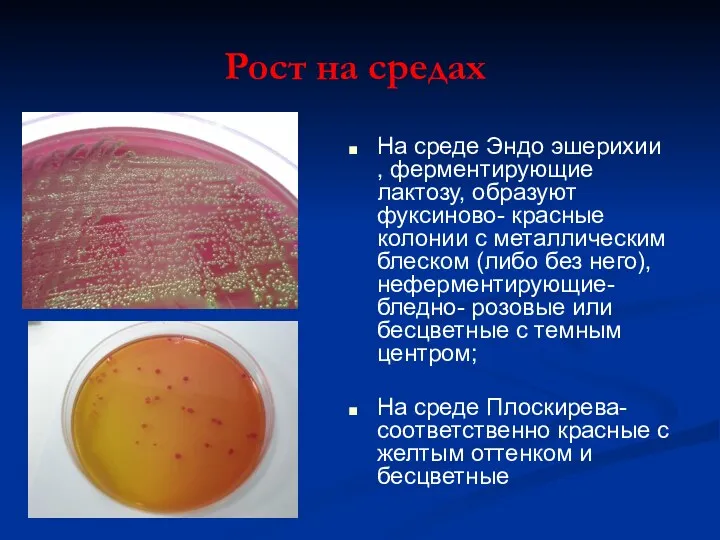
- 20. Рост на средах На среде Эндо эшерихии , ферментирующие лактозу, образуют фуксиново- красные колонии с металлическим
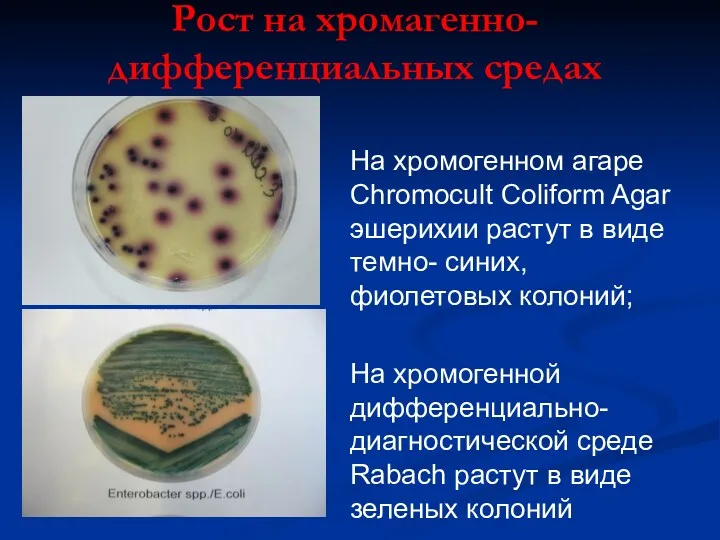
- 21. Рост на хромагенно- дифференциальных средах На хромогенном агаре Chromocult Coliform Agar эшерихии растут в виде темно-
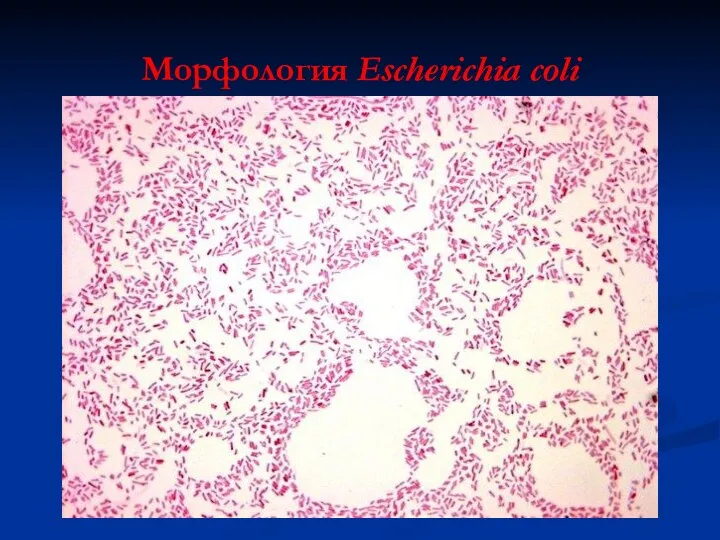
- 22. Морфология Escherichia coli
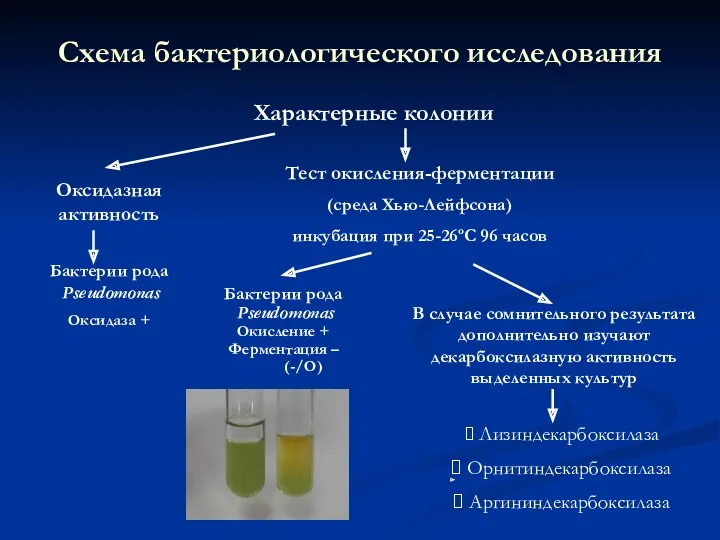
- 23. Схема бактериологического исследования на синегнойную палочку Высевы из молока на МПБ или МПА Инкубация при 37Сº
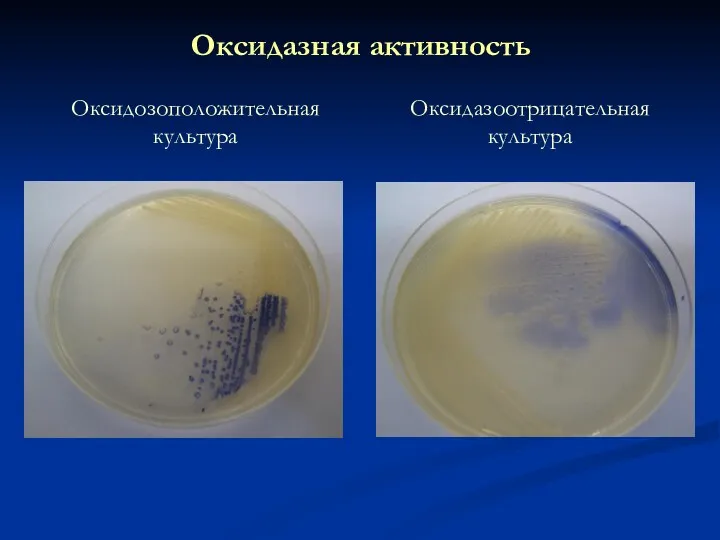
- 24. Оксидазная активность Бактерии рода Pseudomonas Оксидаза + Тест окисления-ферментации (среда Хью-Лейфсона) инкубация при 25-26ºС 96 часов
- 25. Оксидазная активность Оксидозоположительная культура Оксидазоотрицательная культура
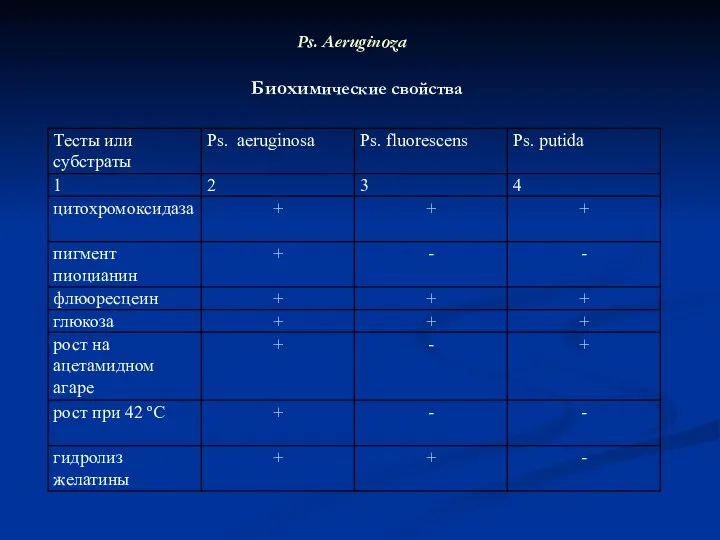
- 26. Ps. Aeruginoza Биохимические свойства
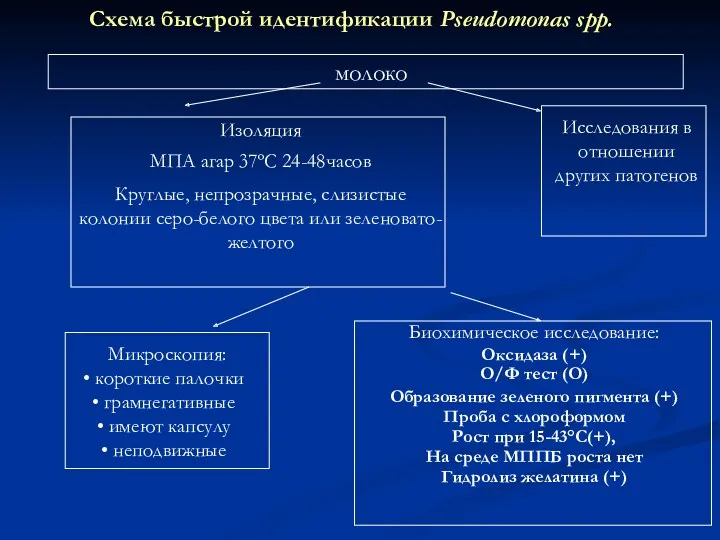
- 27. Схема быстрой идентификации Pseudomonas spp. Изоляция МПA агар 37ºС 24-48часов Круглые, непрозрачные, слизистые колонии серо-белого цвета
- 28. Микробиологические методы идентификации микробов семейства Enterobacteriaceae Морфолого-физиологические признаки: Грамотрицательные палочки с закругленными концами (0,5-2,0х2,0-4,0 мкм) без
- 29. Рост на средах На среде Эндо колонии представителей семейства Enterobacteriaceae обычно выпуклые с правильными очертаниями (круга),
- 30. Выделение и идентификация грибов рода Candida Посевы молока (секреты вымени) делают на среды Чапека или Сабуро
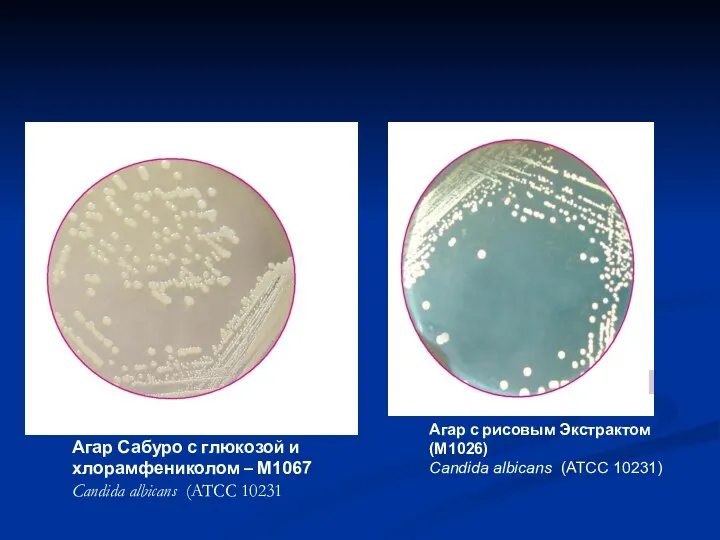
- 31. Агар Сабуро с глюкозой и хлорамфениколом – M1067 Candida albicans (ATCC 10231 Агар с рисовым Экстрактом
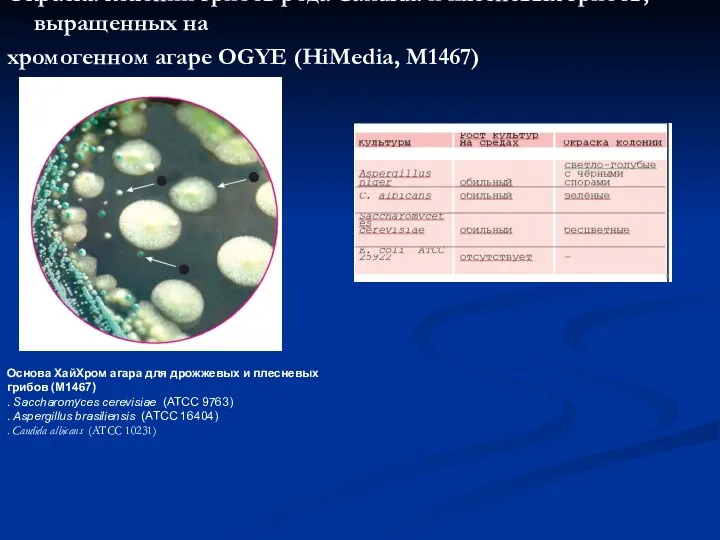
- 32. Окраска колоний грибов рода Candida и плесневых грибов, выращенных на хромогенном агаре OGYE (HiMedia, М1467) Основа
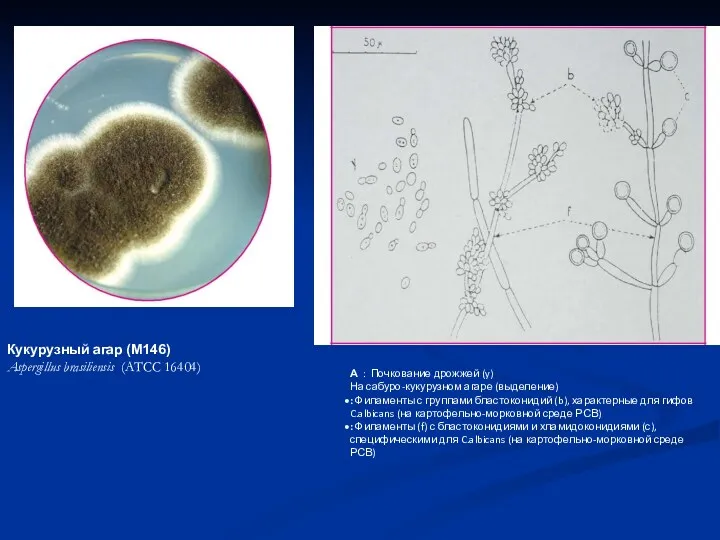
- 33. А : Почкование дрожжей (y) На сабуро-кукурузном агаре (выделение) : Филаменты с группами бластоконидий (b), характерные
- 36. Скачать презентацию

















 Органы и системы органов животных
Органы и системы органов животных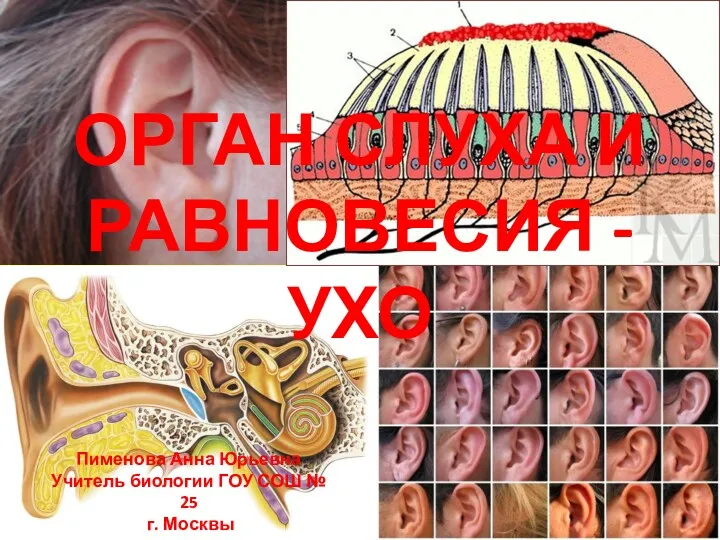 Орган слуха и равновесия - ухо
Орган слуха и равновесия - ухо Дыхательная система
Дыхательная система Онтогенез нервной системы
Онтогенез нервной системы Ферменты,структура и механизм действия. Классификация и номенклатура. (Лекция 4)
Ферменты,структура и механизм действия. Классификация и номенклатура. (Лекция 4) Разнообразие организмов (5 класс)
Разнообразие организмов (5 класс) Углеводы. Лекция 4
Углеводы. Лекция 4 Нервная система
Нервная система Кардиоангиология. Сердечно-сосудистая система
Кардиоангиология. Сердечно-сосудистая система Зоология - наука о животных. Подготовка к ОГЭ и ЕГЭ по биологии
Зоология - наука о животных. Подготовка к ОГЭ и ЕГЭ по биологии Красная книга животных Гафурийского района
Красная книга животных Гафурийского района Городские зимующие птицы Сибири
Городские зимующие птицы Сибири Клебсиеллы. Классификация. Заболевания, вызываемые ими. Микробиология
Клебсиеллы. Классификация. Заболевания, вызываемые ими. Микробиология Сахарный диабет. Гормоны – производные аминокислот
Сахарный диабет. Гормоны – производные аминокислот Использование ИКТ на уроках биологии
Использование ИКТ на уроках биологии Наследование признаков при взаимодействии генов
Наследование признаков при взаимодействии генов Вид. Популяция
Вид. Популяция Опорно-двигательная система. Скелет человека
Опорно-двигательная система. Скелет человека Технология выращивания томатов
Технология выращивания томатов Пищеварение 1.1
Пищеварение 1.1 Однодольные растения. Liliopsida, Monocotyledones, Monocotyledoneae
Однодольные растения. Liliopsida, Monocotyledones, Monocotyledoneae Строение прокариотической и эукариотической клеток
Строение прокариотической и эукариотической клеток Тип Хордовые. Подтипы: Бесчерепные и Черепные, или Позвоночные
Тип Хордовые. Подтипы: Бесчерепные и Черепные, или Позвоночные Обмін речовин
Обмін речовин Жизнь организмов на разных материках
Жизнь организмов на разных материках Гречиха посевная
Гречиха посевная Зоология позвоночных. Разнообразие млекопитающих. (Лекция 11)
Зоология позвоночных. Разнообразие млекопитающих. (Лекция 11) Макроэволюция. Пути и направления эволюционного процесса
Макроэволюция. Пути и направления эволюционного процесса