Белки соединительной ткани – коллаген, эластин, протеогликаны. Особенности структуры и функции презентация
Содержание
- 2. . Соединительная ткань чрезвычайно распространена в организме. Она есть у всех органах и служит основой для
- 3. Все разновидности соединительной ткани содержат клетки, волокнистые структуры и основную межклеточное вещество. Волокна построены из фибриллярных
- 4. Коллаген – основной структурный белок соединительной ткани Коллагены составляют приблизительно 30 % общего количества белка в
- 5. Строение молекул коллагенов Молекулы коллагенов имеют трехспиральную структуру, полученную при скручивании трех полипептидных α – цепей,
- 6. Особенности аминокислотного состава коллагена Полипептидная цепь коллагена состоит из повторяющихся триплетов: [Гли-Х-Y], где Гли – глицин,
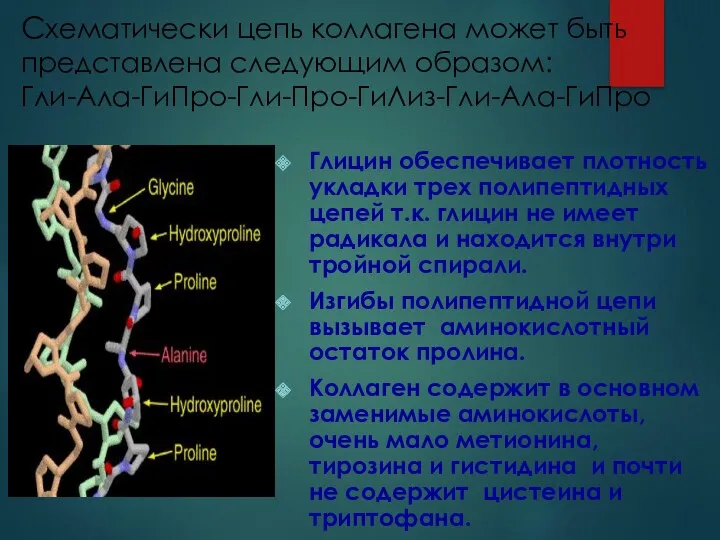
- 7. Схематически цепь коллагена может быть представлена следующим образом: Гли-Ала-ГиПро-Гли-Про-ГиЛиз-Гли-Ала-ГиПро Глицин обеспечивает плотность укладки трех полипептидных цепей
- 8. Синтез коллагена Коллаген синтезируется внутри различных клеток соединительной ткани в виде препроколлагена, содержащего на N –
- 9. Созревание коллагена (процессинг) После синтеза цепи коллагена следует сложный многоступенчатый процесс - созревания коллагена. Включает 2
- 10. Уникальные свойства коллагенов Коллагеновые волокна обладают огромной прочностью и практически нерастяжимы. Они могут выдерживать нагрузку, в
- 11. Катаболизм коллагена Распад коллагена происходит медленно под действием коллагеназ. Основной фермент - Са 2+, Zn 2+
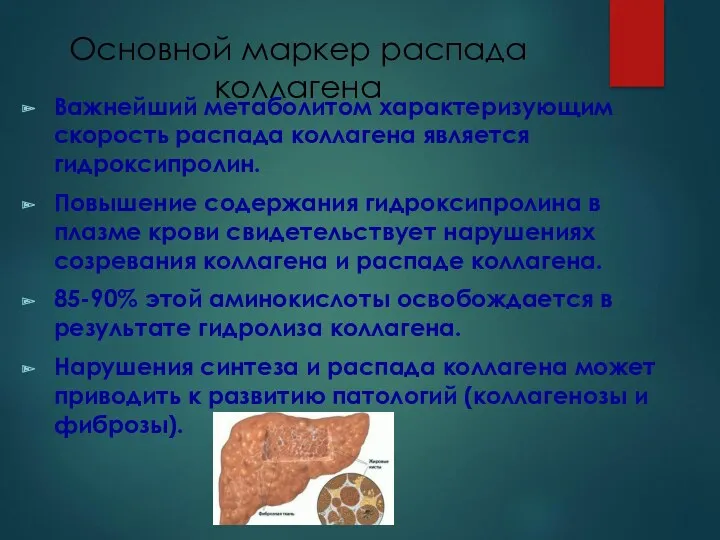
- 12. Основной маркер распада коллагена Важнейший метаболитом характеризующим скорость распада коллагена является гидроксипролин. Повышение содержания гидроксипролина в
- 13. Типы коллагена В настоящее время известно около 20 различных типов коллагена, различающихся по первичной и пространственной
- 14. Наиболее распространенные типы коллагенов.
- 15. Эластин – это основной компонент эластических волокон Содержатся в тканях, обладающих значительной эластичностью - кровеносные сосуды,
- 16. Особенности аминокислотного состава эластина Эластин – гликопротеин с молекулярной массой 70кДа, содержит много гидрофобных аминокислот -
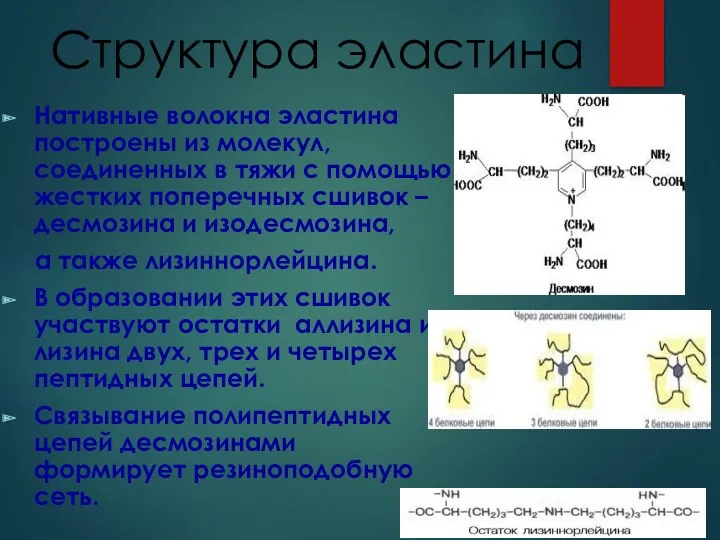
- 17. Структура эластина Нативные волокна эластина построены из молекул, соединенных в тяжи с помощью жестких поперечных сшивок
- 18. Строение протеогликанов В структуре протеогликанов выделяют коровый (COR) белок (от анг. сore – основа, ядро), который
- 19. Основную часть протеогликанов составляют гликозамингликаны (ГАГ) Гликозаминогликаны – гетерополисахариды, состоящие из повторяющихся дисахаридов, в состав которых
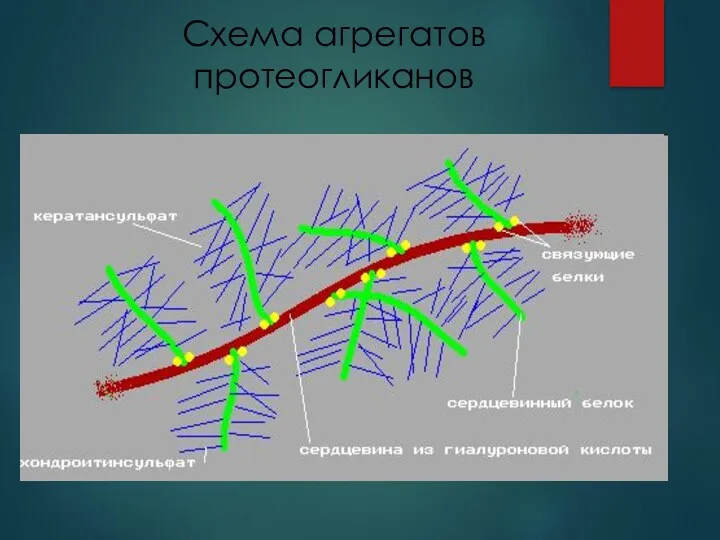
- 20. Схема агрегатов протеогликанов
- 21. Метаболизм протеогликанов Синтез протеогликанов начинается с синтеза корового белка в клетках соединительной ткани, далее к нему
- 22. Витамин С или аскорбиновая кислота – одно из важнейших веществ, необходимых человеческому организму, незаменимый витамин, который
- 23. Витамин С играет роль ко-фактора в реакции синтеза различных видов коллагена – основных структурообразующих белков соединительной
- 25. Скачать презентацию


















 История развития биологии
История развития биологии Белки. Строение белка
Белки. Строение белка Отдел Красные Водоросли. Лекция 7
Отдел Красные Водоросли. Лекция 7 Биохимические изменения компонентов молока в процессе переработки
Биохимические изменения компонентов молока в процессе переработки Факторы окружающей среды. Лекция 5
Факторы окружающей среды. Лекция 5 Анализаторы и органы чувств
Анализаторы и органы чувств Нуклеин қышқылдары
Нуклеин қышқылдары История генетики
История генетики Класс насекомые
Класс насекомые Естественный отбор и его формы
Естественный отбор и его формы Наследование признаков при взаимодействии генов
Наследование признаков при взаимодействии генов Семейства растений
Семейства растений Растения и животные Красной книги Пермского края
Растения и животные Красной книги Пермского края Плоды и ягоды. Семечковые плоды
Плоды и ягоды. Семечковые плоды Презентация по биологии 8 класс темы Строение организма
Презентация по биологии 8 класс темы Строение организма Типы взаимодействия организмов
Типы взаимодействия организмов Обмен белков - 1
Обмен белков - 1 Презентация к уроку Дыхание бактерий, растений и грибов
Презентация к уроку Дыхание бактерий, растений и грибов Порода собак корги
Порода собак корги Бурый медведь
Бурый медведь Лимбическая система мозга
Лимбическая система мозга Растительный и животный мир Антарктиды
Растительный и животный мир Антарктиды Паразитические Круглые черви. Морфологическая характеристика и жизненные циклы. Лабораторная диагностика гельминтозов у человека
Паразитические Круглые черви. Морфологическая характеристика и жизненные циклы. Лабораторная диагностика гельминтозов у человека Стресс у растений. Особенности проявления стрессовых реакций и механизмы устойчивости к стрессовым воздействиям. (Лекция 1-2)
Стресс у растений. Особенности проявления стрессовых реакций и механизмы устойчивости к стрессовым воздействиям. (Лекция 1-2) Тип кишечнополостные
Тип кишечнополостные Ботаника. Ткани растений
Ботаника. Ткани растений Экскурсия по Лапландскому заповеднику
Экскурсия по Лапландскому заповеднику Физиология сенсорных систем
Физиология сенсорных систем