Содержание
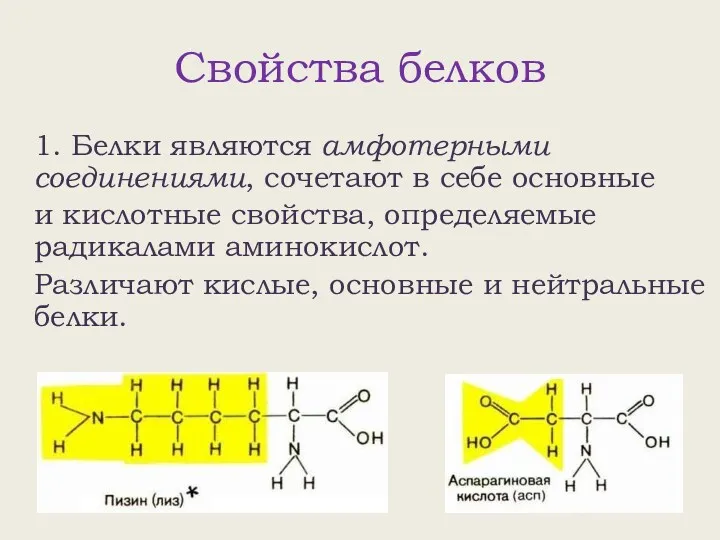
- 2. Свойства белков 1. Белки являются амфотерными соединениями, сочетают в себе основные и кислотные свойства, определяемые радикалами
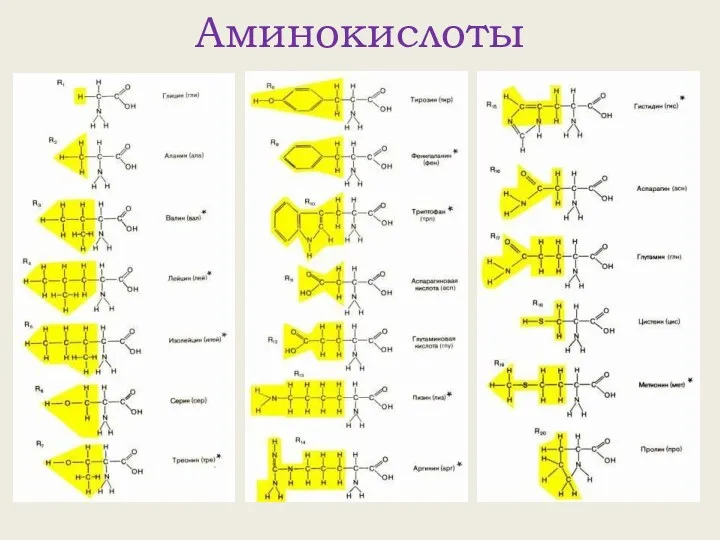
- 3. Аминокислоты
- 4. Фишер Эмиль Герман, немецкий химик-органик и биохимик. В 1899 начал работы по химии белков. Используя созданный
- 6. С точки зрения пищевой ценности белков, определяемой их аминокислотным составом и содержанием так называемых незаменимых аминокислот,
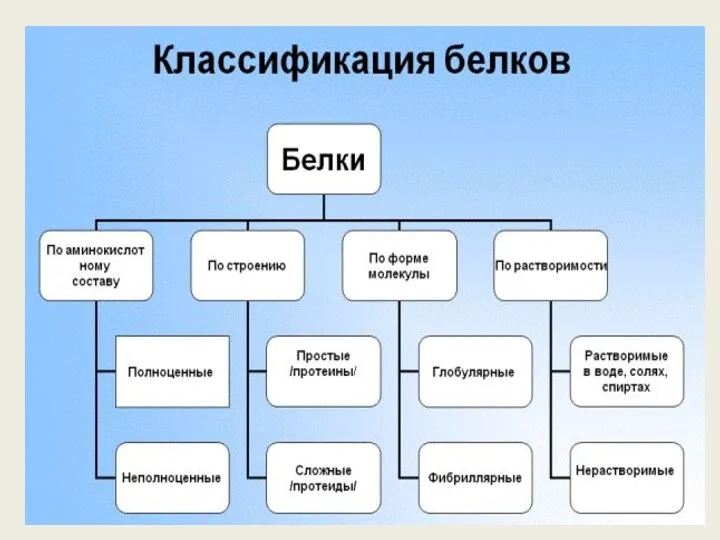
- 7. По общему типу строения белки можно разбить на три группы: 1. Фибриллярные белки — нерастворимы в
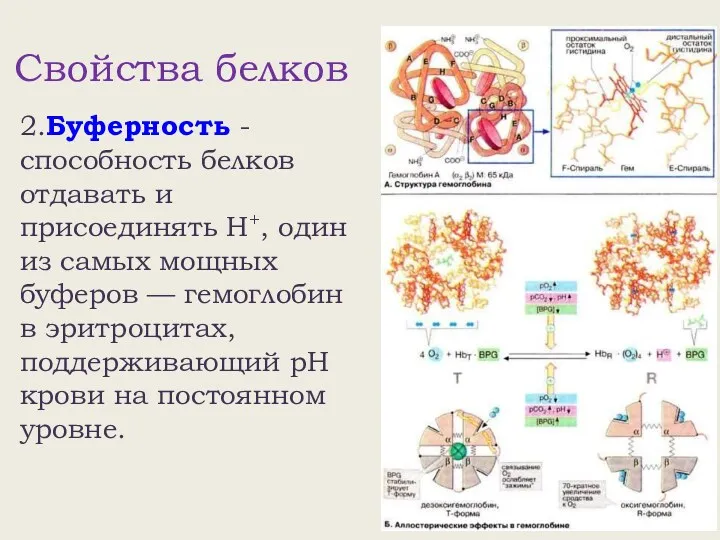
- 8. Свойства белков 2.Буферность - способность белков отдавать и присоединять Н+, один из самых мощных буферов —
- 9. Свойства белков 3. Растворимость в воде. Глобулярные белки растворимы Фибриллярные белки нерастворимы
- 10. Свойства белков 4. Активность. Есть белки необычайно химически активные (ферменты), есть химически неактивные. 5. Устойчивость. Есть
- 11. Свойства белков 6. Денатурация - процесс утраты трехмерной конформации, присущей данной молекуле белка. Причиной денатурации является
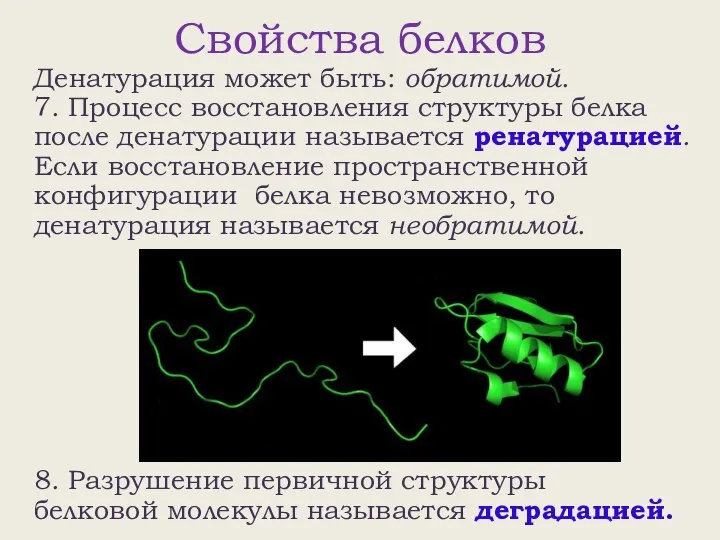
- 12. Свойства белков Денатурация может быть: обратимой. 7. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если
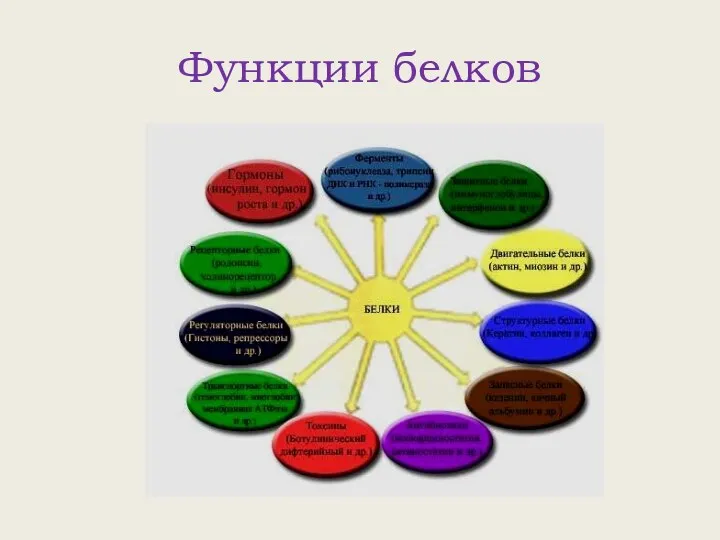
- 13. Функции белков
- 14. Функции белков 1. Структурная функция. Структурные белки в комплексе с липидами являются структурной основой клеточных и
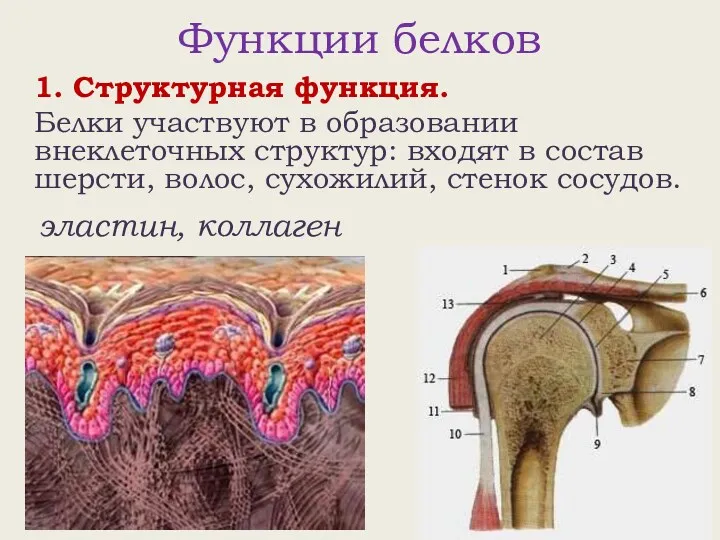
- 15. Функции белков 1. Структурная функция. Белки участвуют в образовании внеклеточных структур: входят в состав шерсти, волос,
- 16. Функции белков 1. Структурная функция. Белки участвуют в образовании внеклеточных структур: входят в состав шерсти, волос,
- 17. Функции белков 2. Транспортная функция. Некоторые белки способны присоединять различные вещества и переносить их к различным
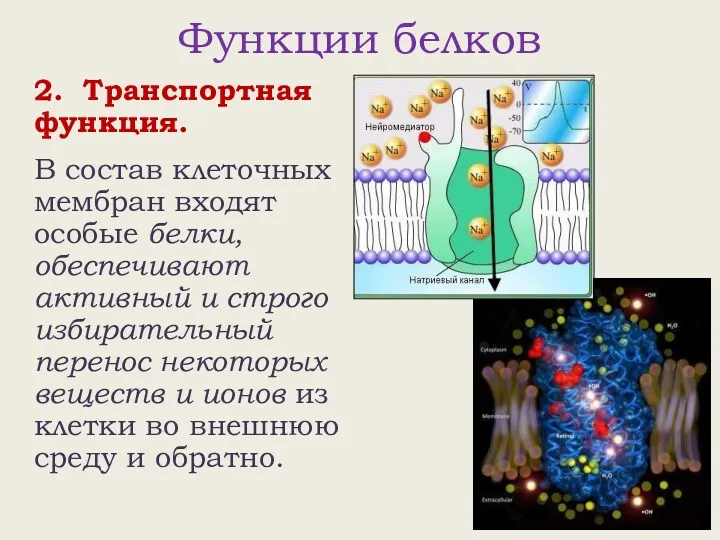
- 18. Функции белков 2. Транспортная функция. В состав клеточных мембран входят особые белки, обеспечивают активный и строго
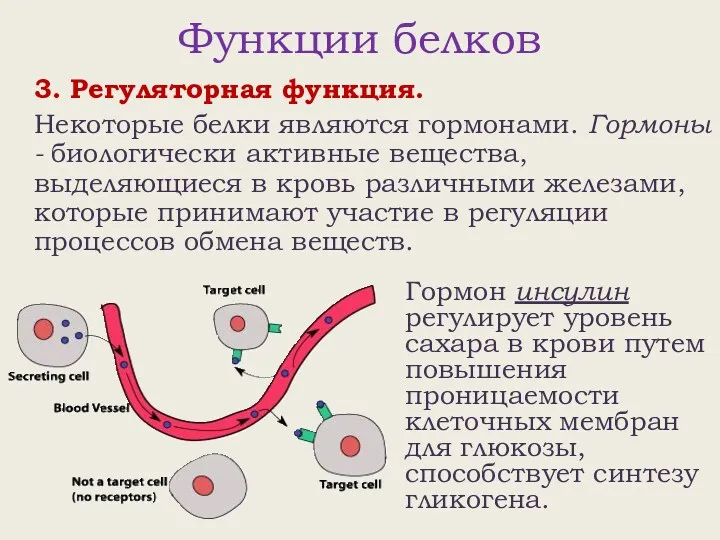
- 19. Функции белков 3. Регуляторная функция. Некоторые белки являются гормонами. Гормоны - биологически активные вещества, выделяющиеся в
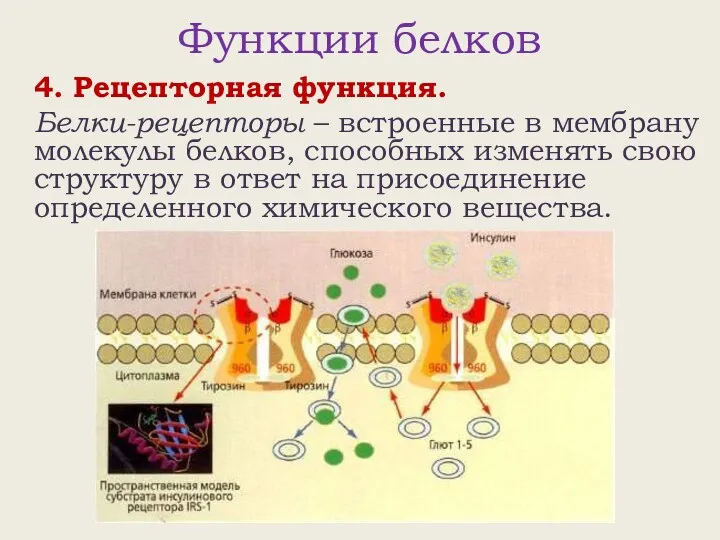
- 20. Функции белков 4. Рецепторная функция. Белки-рецепторы – встроенные в мембрану молекулы белков, способных изменять свою структуру
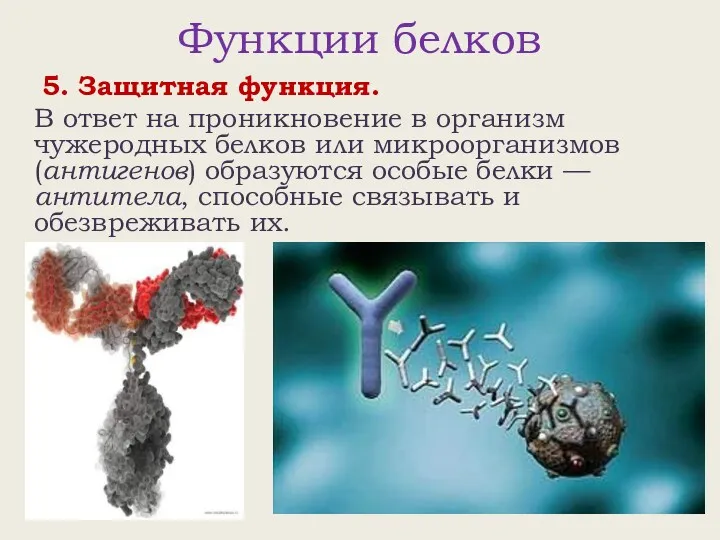
- 21. Функции белков 5. Защитная функция. В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов)
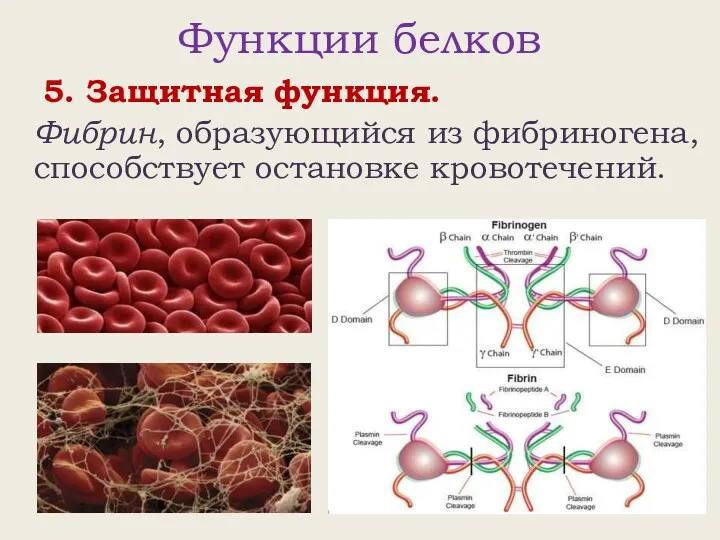
- 22. Функции белков 5. Защитная функция. Фибрин, образующийся из фибриногена, способствует остановке кровотечений.
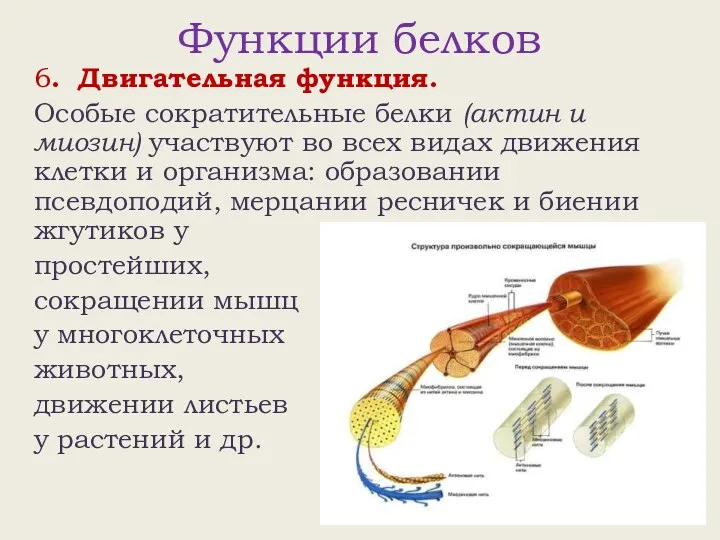
- 23. Функции белков 6. Двигательная функция. Особые сократительные белки (актин и миозин) участвуют во всех видах движения
- 24. Функции белков 7. Запасающая функция. Эту функцию выполняют резервные белки, которые запасаются в качестве источника энергии.
- 25. Функции белков 8. Энергетическая функция. При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж
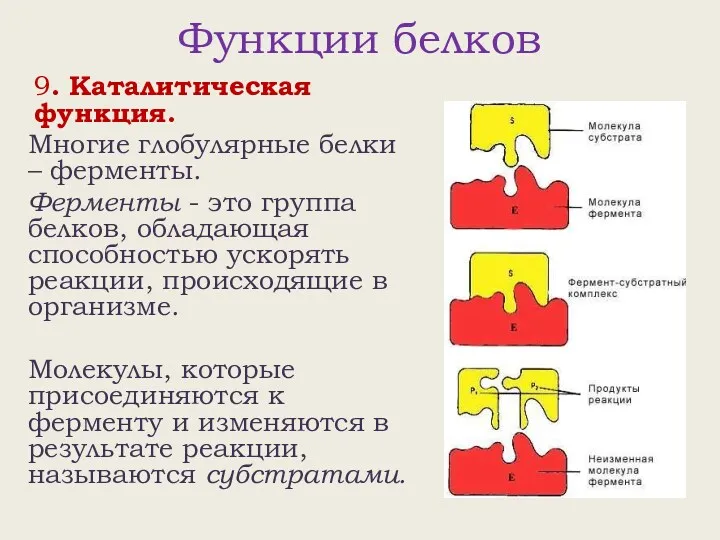
- 26. Функции белков 9. Каталитическая функция. Многие глобулярные белки – ферменты. Ферменты - это группа белков, обладающая
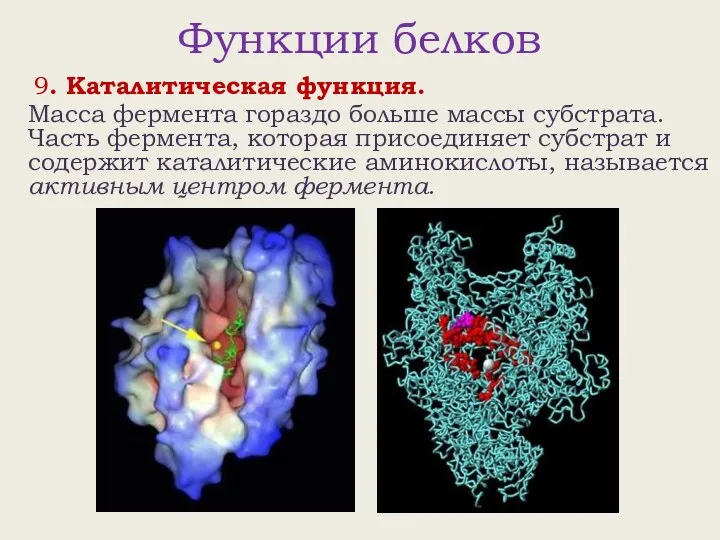
- 27. Функции белков 9. Каталитическая функция. Масса фермента гораздо больше массы субстрата. Часть фермента, которая присоединяет субстрат
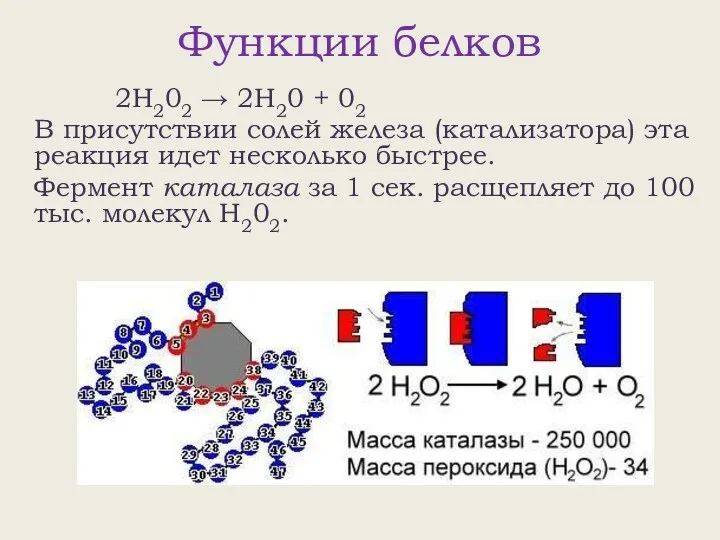
- 28. Функции белков 2Н202 → 2Н20 + 02 В присутствии солей железа (катализатора) эта реакция идет несколько
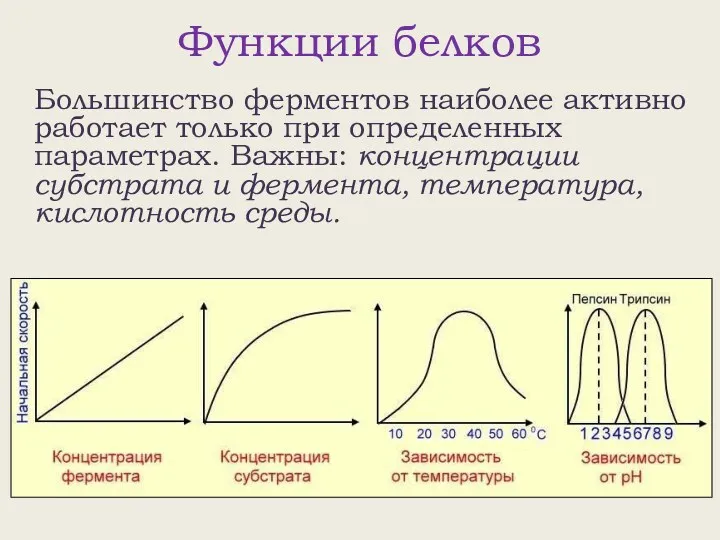
- 29. Функции белков Большинство ферментов наиболее активно работает только при определенных параметрах. Важны: концентрации субстрата и фермента,
- 31. Скачать презентацию











 Биология в мире современных профессий
Биология в мире современных профессий Пищеварение беспозвоночных
Пищеварение беспозвоночных Дигибридное скрещивание
Дигибридное скрещивание Многообразие и происхождение культурных растений
Многообразие и происхождение культурных растений Каталог цветов
Каталог цветов Биология, ее задачи и разделы. Основные этапы формирования биологии. Методы биологических исследований
Биология, ее задачи и разделы. Основные этапы формирования биологии. Методы биологических исследований Скелет опора организма.Биология. Живой организм. 6 класс., учебник Н.И, Сонин
Скелет опора организма.Биология. Живой организм. 6 класс., учебник Н.И, Сонин Физиология дыхания
Физиология дыхания Виртуальная выставка Во саду ли в огороде
Виртуальная выставка Во саду ли в огороде 3c57d4db65194731b010a474653bcc81
3c57d4db65194731b010a474653bcc81 Витамины. Классификация, источники, значение
Витамины. Классификация, источники, значение Систематика найпростіших. Тип microspora
Систематика найпростіших. Тип microspora Городские птицы
Городские птицы Самые умные животные!
Самые умные животные! Постэмбриональное развитие организма
Постэмбриональное развитие организма Тип: моллюски. Класс: двустворчатые. Устрица
Тип: моллюски. Класс: двустворчатые. Устрица Перелетные птицы весной
Перелетные птицы весной Голосовой аппарат
Голосовой аппарат Ротовая полость
Ротовая полость Нейромедиаторы. Нейротрансмиттеры
Нейромедиаторы. Нейротрансмиттеры Вегетативная нервная система
Вегетативная нервная система Внутренняя среда организма человека
Внутренняя среда организма человека Строение гена
Строение гена Ядовитые обитатели Красного моря
Ядовитые обитатели Красного моря Нуклеиновые кислоты и белки. Генетический код
Нуклеиновые кислоты и белки. Генетический код Сердечно-сосудистая система. Сердце. Кровеносные сосуды. Лимфатическая система
Сердечно-сосудистая система. Сердце. Кровеносные сосуды. Лимфатическая система Цитология – наука о клетке
Цитология – наука о клетке Итог производственной практики
Итог производственной практики