Содержание
- 2. План лекции Нервная ткань: определение понятия, классификация по функциям и клеточному составу. Нейрон – как основная
- 3. Функции нервной системы: воспринимает информацию из внешней и внутренней среды; перерабатывает полученную информацию; хранит информацию; генерирует
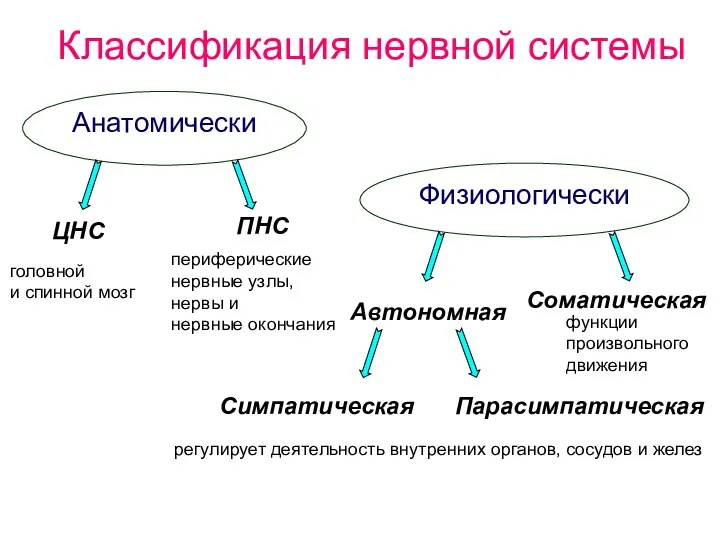
- 4. Классификация нервной системы Анатомически Физиологически ЦНС ПНС Соматическая Автономная Симпатическая Парасимпатическая головной и спинной мозг периферические
- 5. Функциональной тканью нервной системы является нервная. Нервная ткань – это высокоспециализированная ткань, обладающая возбудимостью и проводимостью,
- 6. Нейрон
- 7. Нейроглия (от греческого glia – клей) это клетки нервной системы, которые не проводят нервные импульсы. Глиальные
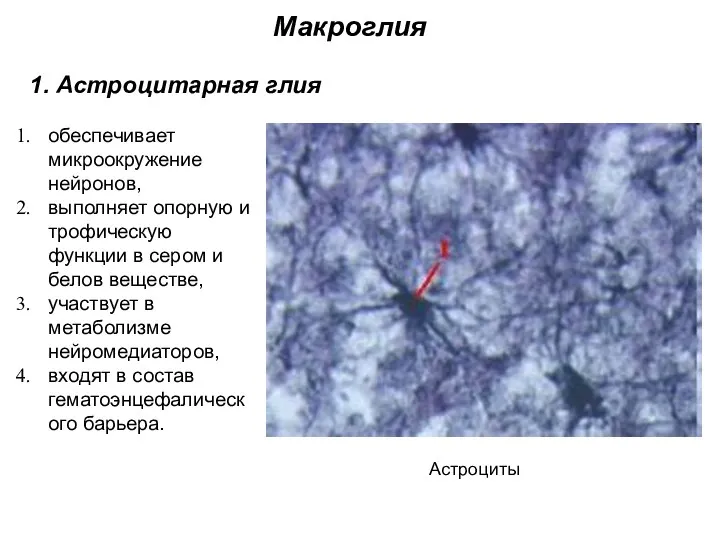
- 8. Макроглия 1. Астроцитарная глия Астроциты обеспечивает микроокружение нейронов, выполняет опорную и трофическую функции в сером и
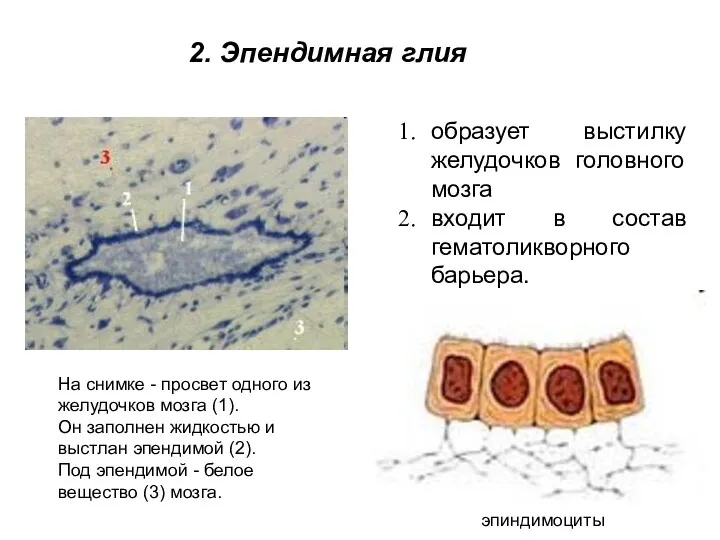
- 9. образует выстилку желудочков головного мозга входит в состав гематоликворного барьера. На снимке - просвет одного из
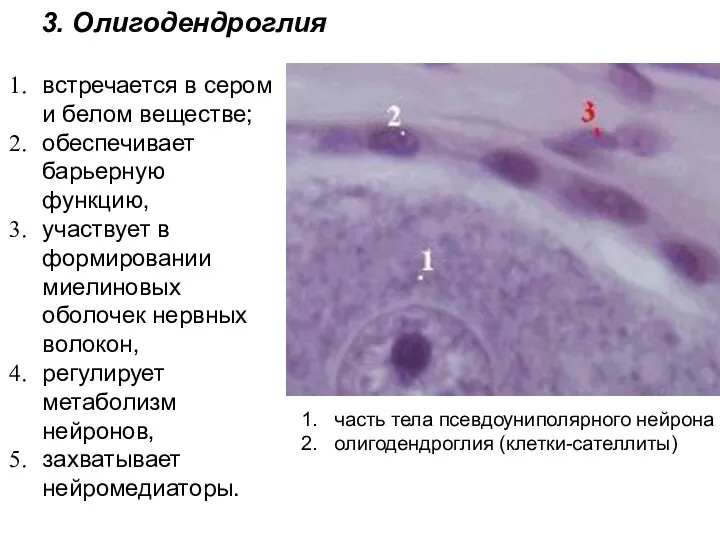
- 10. встречается в сером и белом веществе; обеспечивает барьерную функцию, участвует в формировании миелиновых оболочек нервных волокон,
- 11. Микроглия – специализированные макрофаги ЦНС. Способны к амёбоидным движениям и фагоцитозу Активизируются при воспалительных и дегенеративных
- 12. Серое вещество образовано скоплением нейронов, тонких немиелинизированных нервных волокон и нейроглии (астроциты, олигодендроциты) в ЦНС называется
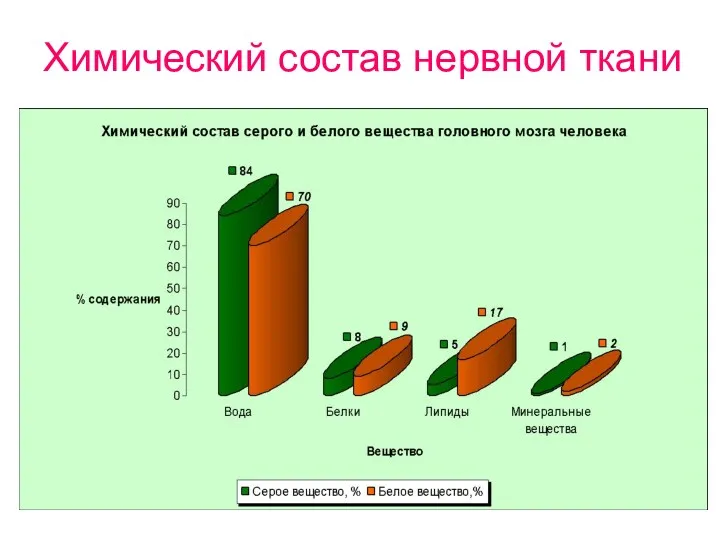
- 13. Химический состав нервной ткани
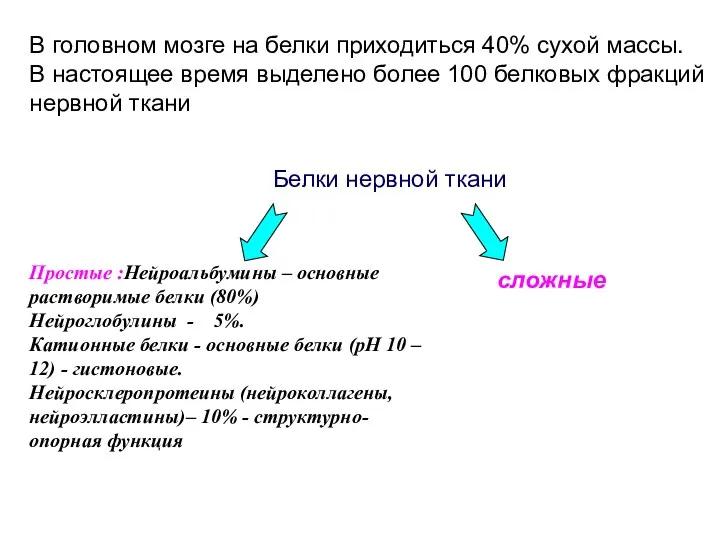
- 14. Белки нервной ткани сложные Простые :Нейроальбумины – основные растворимые белки (80%) Нейроглобулины - 5%. Катионные белки
- 15. Сложные белки Гликопротеины –нейрорецепция Протеолипиды – структурная ф -я Нейроспецифические белки Нейроспецифическая енолаза (Белок 14-3-2) -
- 16. Белок S100 - гетерогенный кислый Сa-связывающий белок, локализуется в нейроглии (в астроцитах) и интенсивно нарабатывается в
- 17. Опиоидные нейропептиды
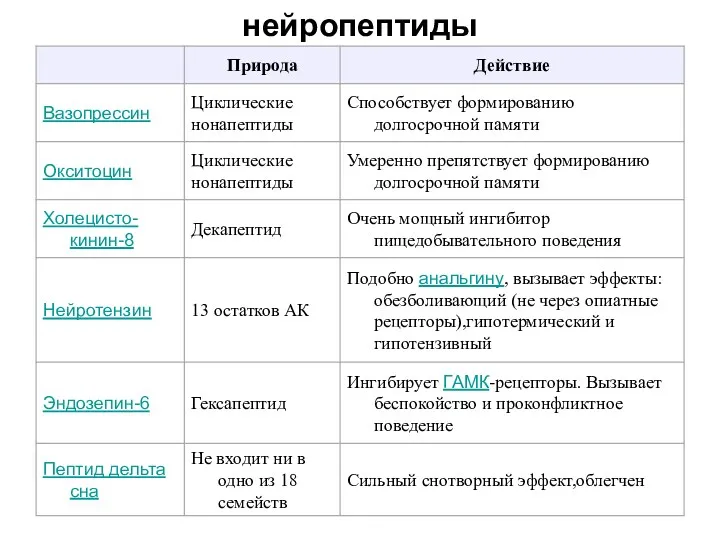
- 18. нейропептиды
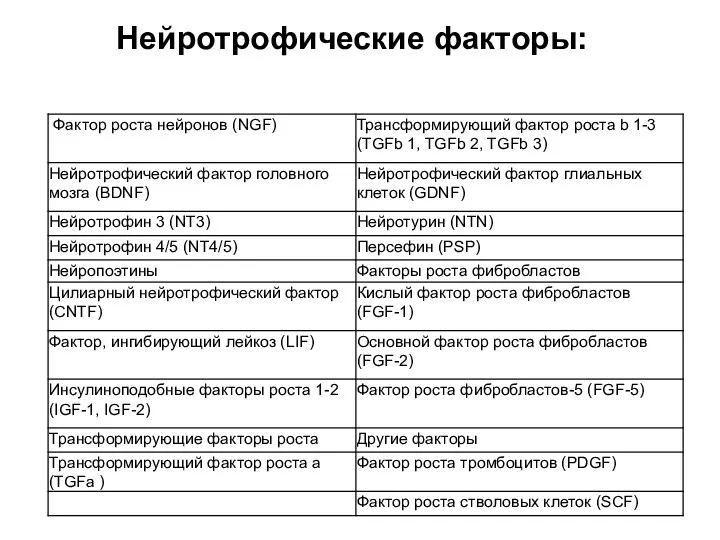
- 19. Нейротрофические факторы:
- 20. Ферменты Нейроспецифическая енолаза ЛДГ (ЛДГ1, ЛДГ2 в нейронах, ЛДГ5 - в глии), АСТ, альдолаза, креатинкиназа (ВВ),
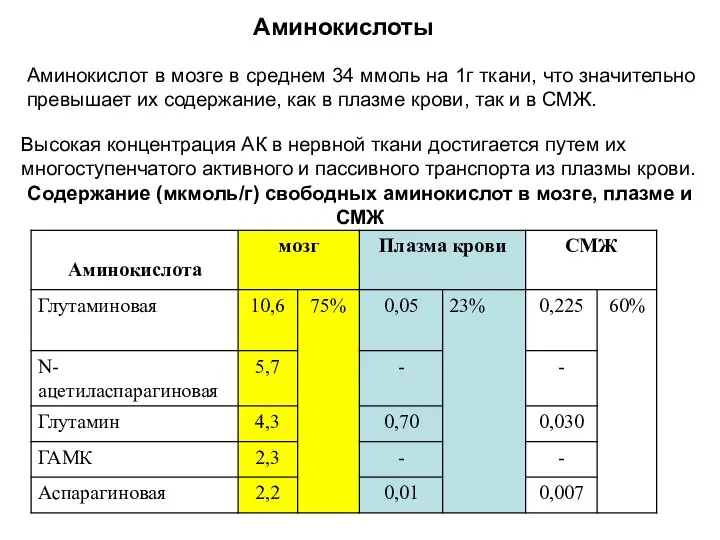
- 21. Аминокислоты Содержание (мкмоль/г) свободных аминокислот в мозге, плазме и СМЖ Аминокислот в мозге в среднем 34
- 22. Липиды нервной ткани фосфоглицериды в сером веществе составляют более 60% от всех липидов, а в белом
- 23. Ганглиозиды - в сером веществе - Gм1, GD1a, GD1b, GT1. Синтез ганглиозидов связан с дифференциацией нейронов.
- 24. Углеводы нервной ткани много олигосахаров (составляют 2-10% массы плазматической мембраны) придают ей индивидуальность и специфичность. мало
- 25. Нуклеотиды нервной ткани Клетки Пуркинье мозжечка содержат избыточное количество ДНК. Необычно короткие нуклеосомные единицы, наличие редких
- 26. Макроэргические соединения нервной ткани Содержание креатина и креатинфосфата более, чем в 2 раза превышает количество адениновых
- 27. Минеральные вещества нервной ткани Na+, K+, Cu2+, Fe2+, Ca2+, Mg2+ и Mn2+ распределены в головном мозге
- 28. Строение нервного волокна. Миелиновая оболочка 1 2 3 1-аксон; 2-миелин; 3-ось волокна; 4-белок (наружные слои) 5-липиды;
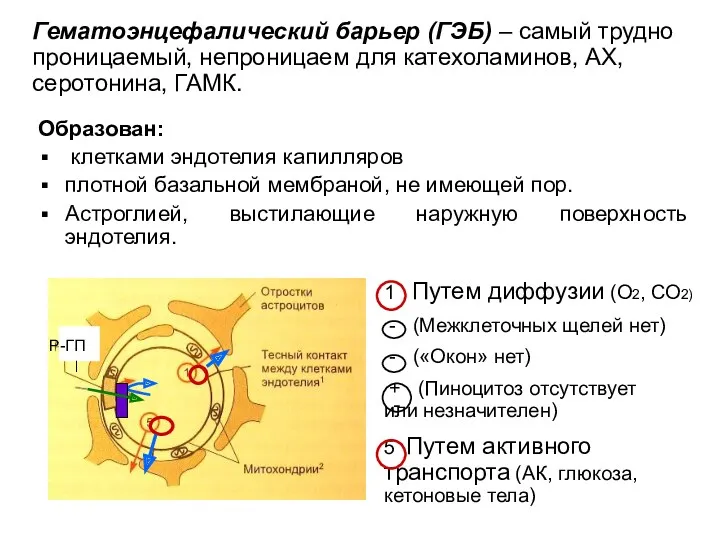
- 29. Образован: клетками эндотелия капилляров плотной базальной мембраной, не имеющей пор. Астроглией, выстилающие наружную поверхность эндотелия. Р-ГП
- 30. Особенности метаболизма нервной ткани Для мозга характерна высокая интенсивность энергетического обмена с преобладанием аэробных процессов. Головной
- 31. Основной энергетический субстрат для нервной ткани - глюкоза За 1 минуту 100 г ткани мозга потребляют
- 32. Обмен белков и аминокислот нервной ткани Нервная ткань характеризуется высоким обменом аминокислот и белков. Максимальная скорость
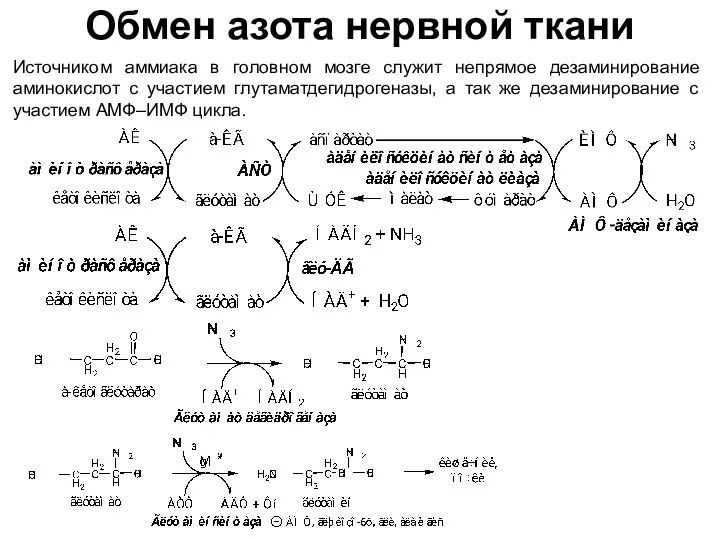
- 33. Обмен азота нервной ткани Источником аммиака в головном мозге служит непрямое дезаминирование аминокислот с участием глутаматдегидрогеназы,
- 34. Липидный обмен нервной ткани Особенность: липиды не используются в качестве энергетического материала, а в основном идут
- 35. Механизмы передачи нервного импульса
- 36. Механизмы передачи нервного импульса по нервному волокну 1. Потенциал покоя (-70 мВ) Na-канал К-канал 2. Потенциал
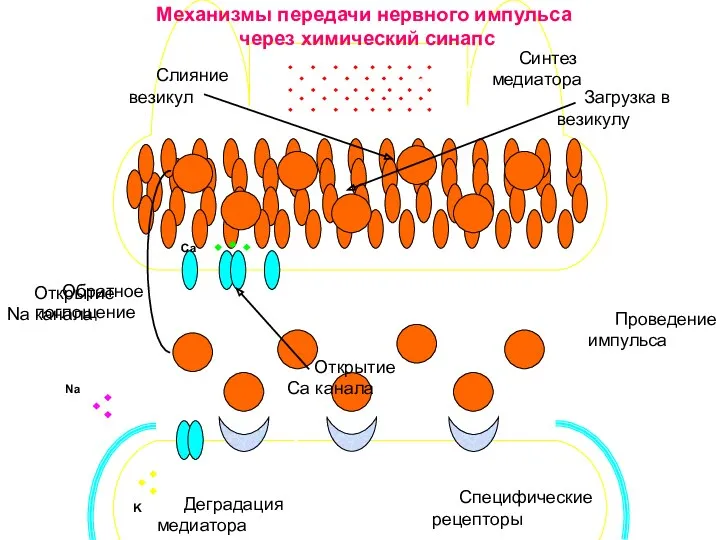
- 37. Са Na K Синтез медиатора Загрузка в везикулу Слияние везикул Специфические рецепторы Открытие Na канала Проведение
- 38. Аминокислотные медиаторы ингибиторные нейтральные (ГАМК, глицин, β-аланин и таурин). возбуждающие кислые (глутамат и аспартат) Глицин открывает
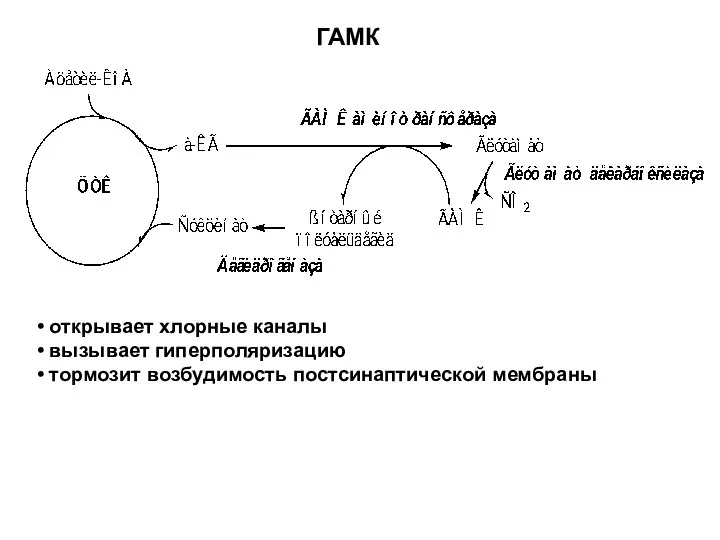
- 39. открывает хлорные каналы вызывает гиперполяризацию тормозит возбудимость постсинаптической мембраны ГАМК
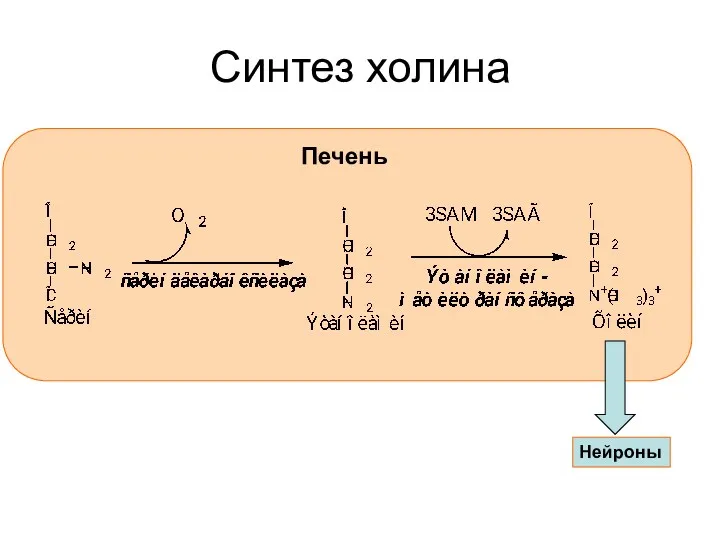
- 40. Синтез холина Печень Нейроны
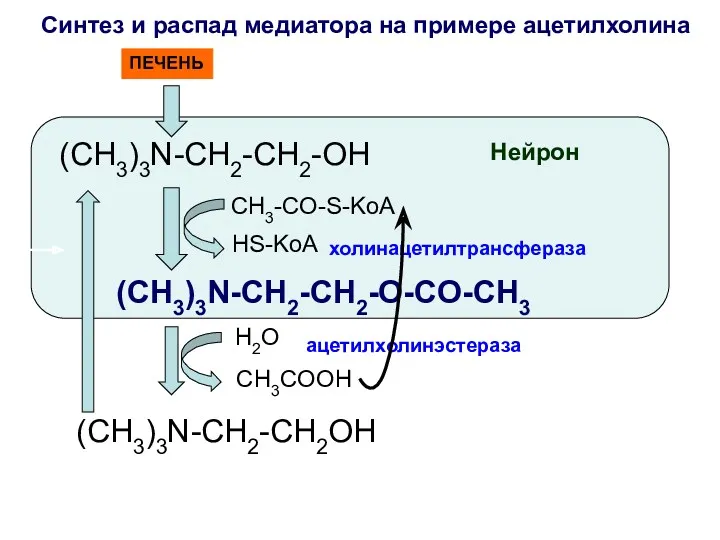
- 41. Синтез и распад медиатора на примере ацетилхолина (CH3)3N-CH2-CH2-OH холинацетилтрансфераза (CH3)3N-CH2-CH2-O-CO-CH3 H2O ацетилхолинэстераза (CH3)3N-CH2-CH2OH Нейрон ПЕЧЕНЬ CH3-CO-S-KoA
- 42. Рецепторы Рецепторы - это белки, встроенные в клеточную мембрану или находящиеся внутри клетки, которые, взаимодействуя с
- 43. Биохимические синдромы в психиатрии Интоксикации (аминокислоты, кетокислоты, аммиак, мочевина) Нарушения окислительно-восстановительных процессов (гипоксия, накопление молочной к-ты,
- 44. Патобиохимия нервной системы 1) Миастения - уменьшение числа холинорецепторов 3) болезнь Паркинсона - дегенерация дофамин содержащих
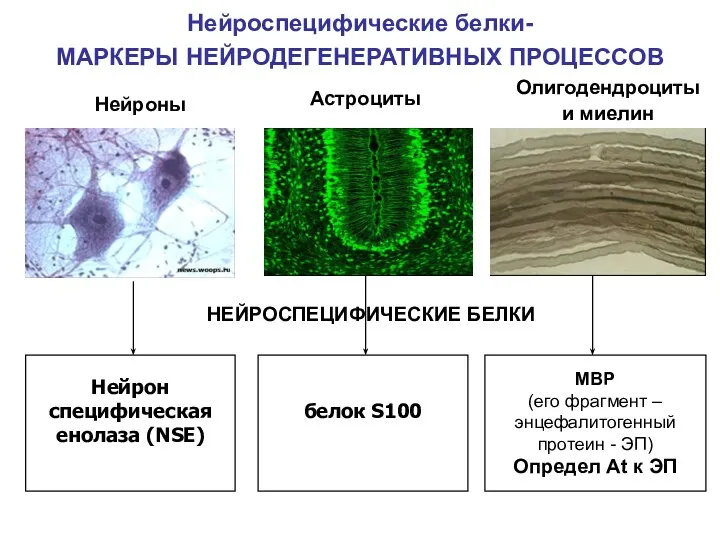
- 45. Нейроспецифические белки- МАРКЕРЫ НЕЙРОДЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ белок S100 Нейрон специфическая енолаза (NSE) Нейроны Астроциты Олигодендроциты и миелин
- 46. Нейронспецифическая енолаза (NSE) Нейроспецифическая енолаза (антиген 14-3-2) NSE – это гликолитический фермент, катализирующий превращение 2-фосфоглицерата в
- 47. Белок S100 S-100 - кальций-связывающий протеин. Локализация мембраны, цитоплазма. участвует в фосфорилировании белка, обеспечивает работу цитоскелета
- 48. антитела к S100β являются специфичными маркерами повреждения астроцитарной глии. Ген S100 находиться в длинном плече 21-й
- 49. Основной белок миелина (MBP) MBP - щелочной белок, с высоким содержанием (25%) основных аминокислот (аргинина, лизина,
- 50. NSE, S100 и MBP – маркеры повреждения мозговой ткани Нейроспецифические белки в нормальных условиях обнаруживаются в
- 51. NSE является высокоспецифичным маркером мелкоклеточного рака легкого и нейробластомы, а также других опухолей нейроэктодермального или нейроэндокринного
- 52. концентрация белка НСБ увеличивается с возрастом, у мужчин в большей степени, чем у женщин NSE, S100
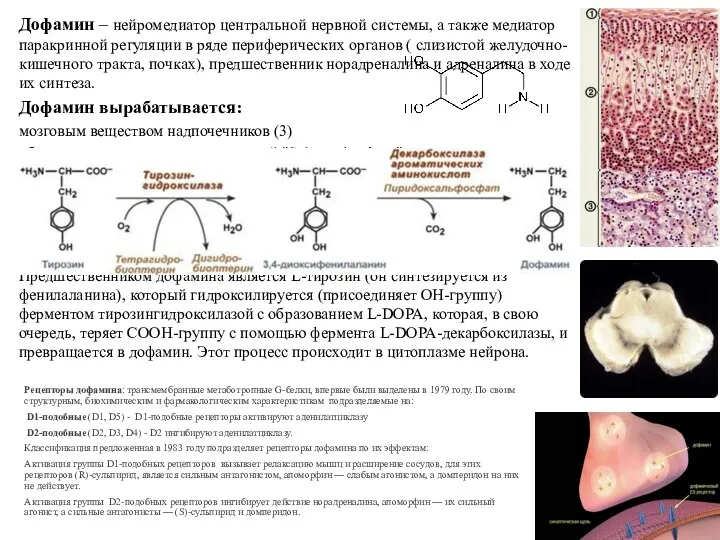
- 53. Дофамин – нейромедиатор центральной нервной системы, а также медиатор паракринной регуляции в ряде периферических органов (
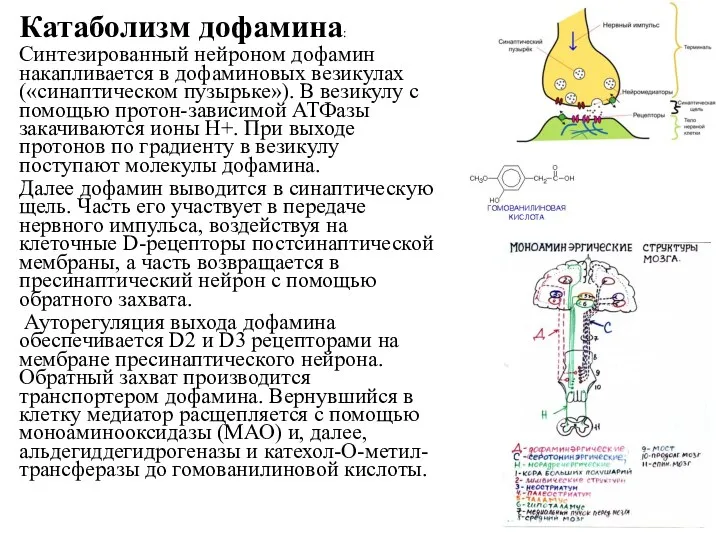
- 54. Катаболизм дофамина: Синтезированный нейроном дофамин накапливается в дофаминовых везикулах («синаптическом пузырьке»). В везикулу с помощью протон-зависимой
- 55. ДОФАМИНЕРГИЧЕСКАЯ СИСТЕМА ГОЛОВНОГО МОЗГА Различают семь отдельных подсистем (первые три являются основными): 1. Нигростриатная 2. Мезокортикальная
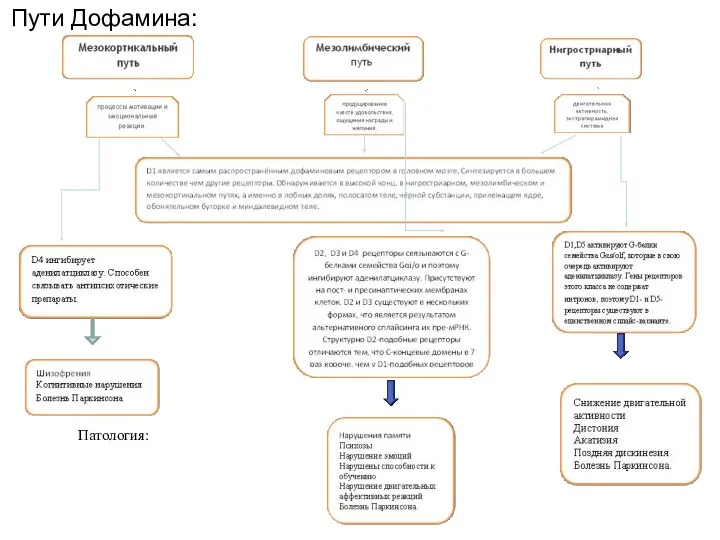
- 56. Пути Дофамина: Патология: Патология Патология
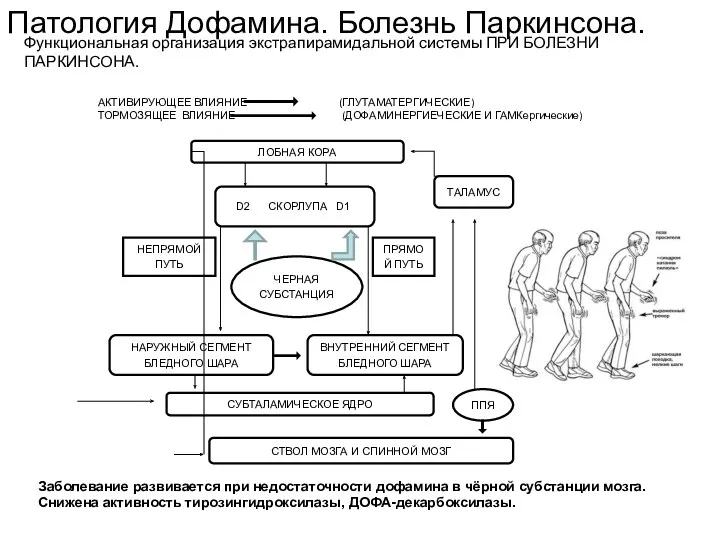
- 57. Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга. Снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы. Патология Дофамина. Болезнь
- 58. Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга. Снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы. Патология Дофамина. Болезнь
- 59. План лекции Функции мышц Классификация мышечных волокон Химический состав мышц Особенности обмена веществ и энергии в
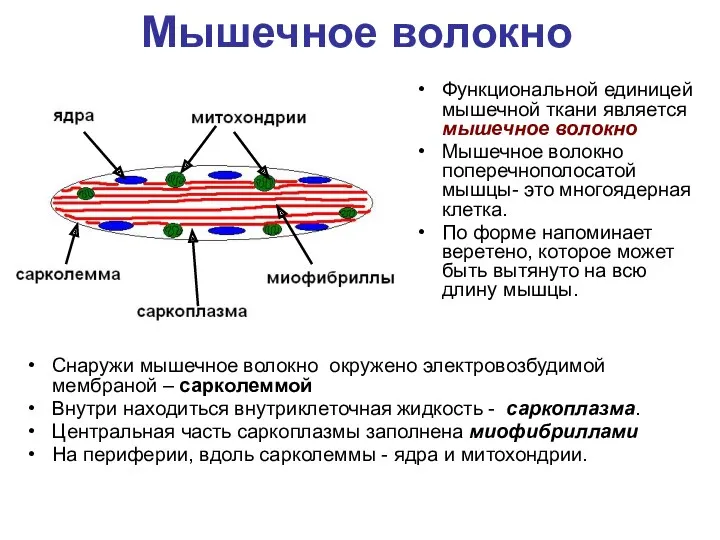
- 60. Мышечное волокно Функциональной единицей мышечной ткани является мышечное волокно Мышечное волокно поперечнополосатой мышцы- это многоядерная клетка.
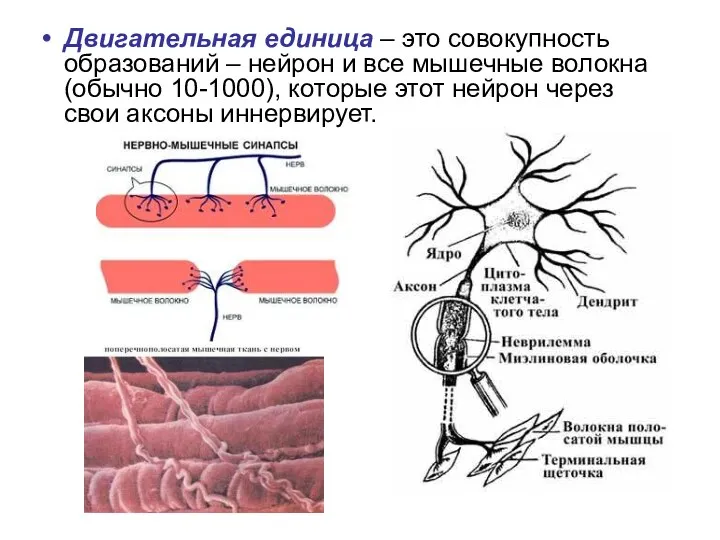
- 61. Двигательная единица – это совокупность образований – нейрон и все мышечные волокна (обычно 10-1000), которые этот
- 62. ХИМИЧЕСКИЙ СОСТАВ МЫШЕЧНОЙ ТКАНИ Вода............................................72—80 Сухой остаток …........................20—28 В том числе: Белки...........................................16,5—20,9 Гликоген......................................0,3—3,0 Фосфатиды.................................0,4—1,0 Холестерин.................................0,06—0,2 Креатин
- 63. 1. Сократительные (миофибриллярные) белки миозин 55% актин 25% тропомиозин (во всех мышцах) тропонины Т, I и
- 64. Углеводы мышечной ткани Гликоген: 0,3-3,0% ГАГ моносахариды глюкоза, фруктоза Липиды мышечной ткани Фосфолипиды (в миокарде больше)
- 65. ОСОБЕННОСТИ ОБМЕНА ВЕЩЕСТВ В МЫШЕЧНОЙ ТКАНИ Обмен белков и аминокислот Мышцы характеризуются высоким обменом белков и
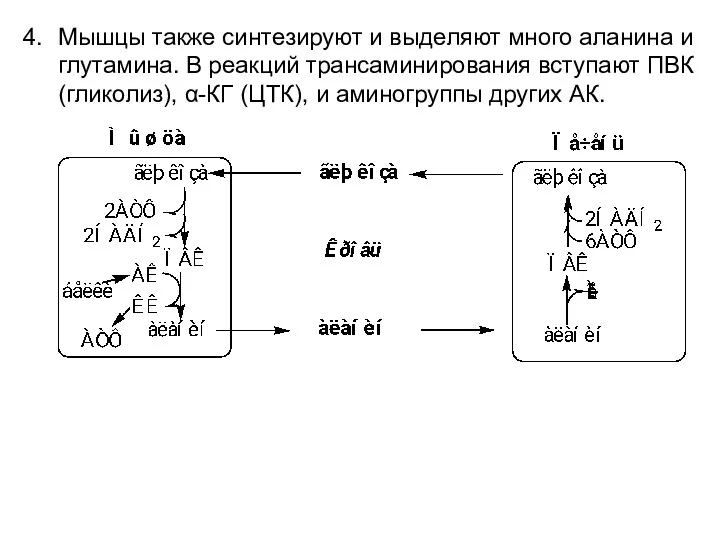
- 66. Мышцы также синтезируют и выделяют много аланина и глутамина. В реакций трансаминирования вступают ПВК (гликолиз), α-КГ
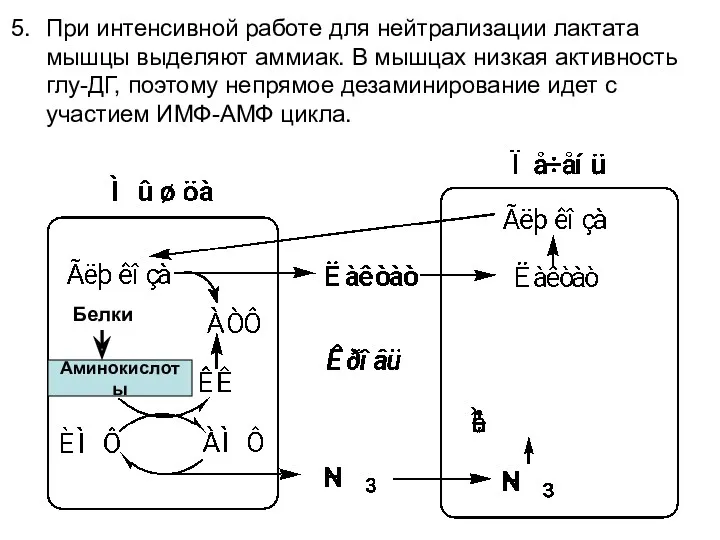
- 67. Аминокислоты Белки При интенсивной работе для нейтрализации лактата мышцы выделяют аммиак. В мышцах низкая активность глу-ДГ,
- 68. Липидный обмен преобладает катаболизм липидов. Жирные кислоты, кетоновые тела в аэробных условиях окисляются в мышцах для
- 69. Углеводный обмен преобладает катаболизм углеводов. глюкоза окисляется в аэробных или анаэробных условиях для синтеза АТФ. Из
- 70. Энергетический обмен Энергетический обмен в состоянии покоя очень низкий, при интенсивной физической нагрузке значительно возрастает. В
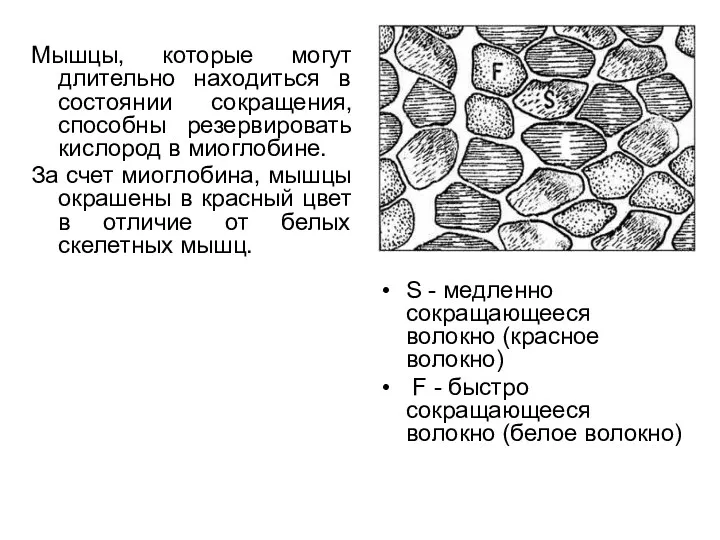
- 71. Мышцы, которые могут длительно находиться в состоянии сокращения, способны резервировать кислород в миоглобине. За счет миоглобина,
- 72. Основной потребитель АТФ - процесс мышечного сокращения. Запасы АТФ быстро истощаются. Источники АТФ: 1) классический путь
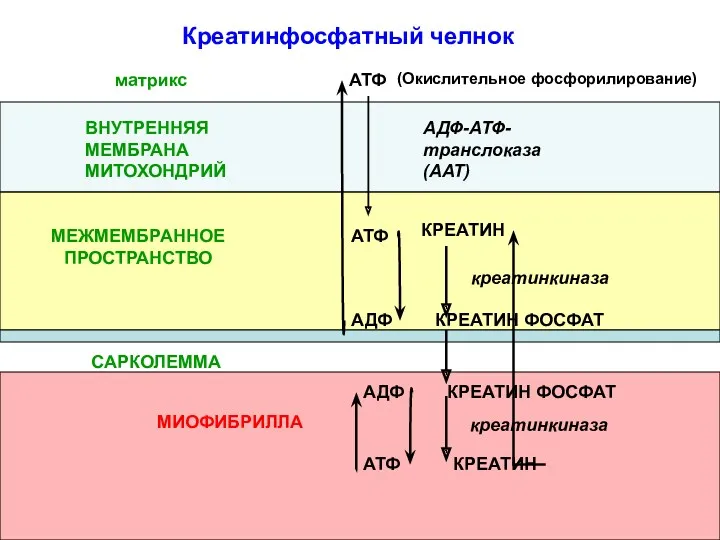
- 73. (Окислительное фосфорилирование) АТФ АДФ-АТФ-транслоказа(ААТ) ВНУТРЕННЯЯ МЕМБРАНА МИТОХОНДРИЙ КРЕАТИН КРЕАТИН ФОСФАТ АТФ АДФ САРКОЛЕММА МИОФИБРИЛЛА КРЕАТИН ФОСФАТ
- 74. Креатинфосфатный челнок предотвращает быстрое истощение запасов АТФ в мышце за счет: запаса макроэргических связей в креатинфосфате
- 75. Характеристика быстрых и медленных скелетных мышц
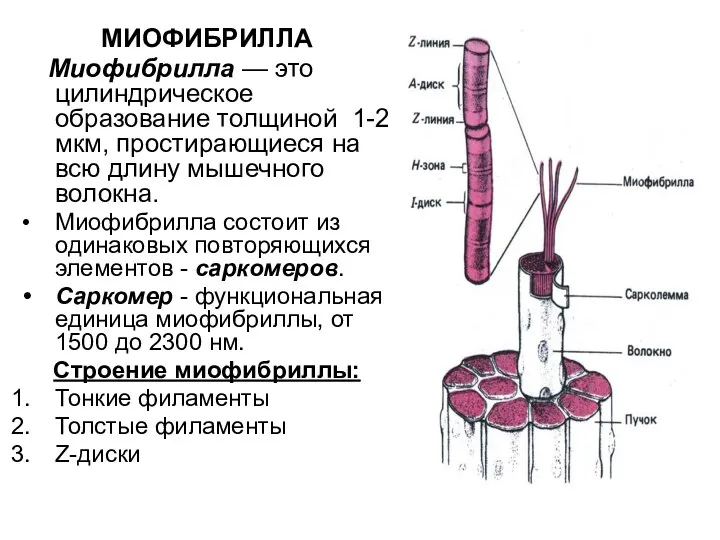
- 76. Миофибрилла
- 77. МИОФИБРИЛЛА Миофибрилла — это цилиндрическое образование толщиной 1-2 мкм, простирающиеся на всю длину мышечного волокна. Миофибрилла
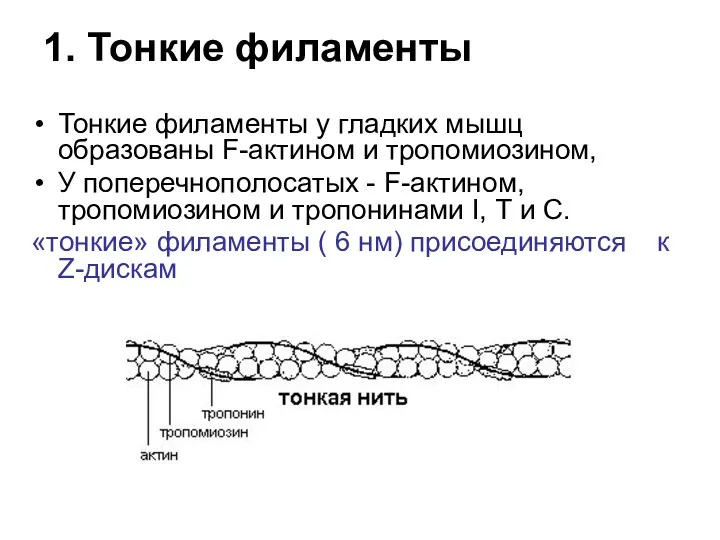
- 78. 1. Тонкие филаменты Тонкие филаменты у гладких мышц образованы F-актином и тропомиозином, У поперечнополосатых - F-актином,
- 79. Актин G-актин - мономерный (глобулярный) белок с массой 43кДа. F-актин. При физиологической величине рН и в
- 80. Тропомиозин - есть во всех мышцах: белок, состоящий из а и р цепей, располагается в щели
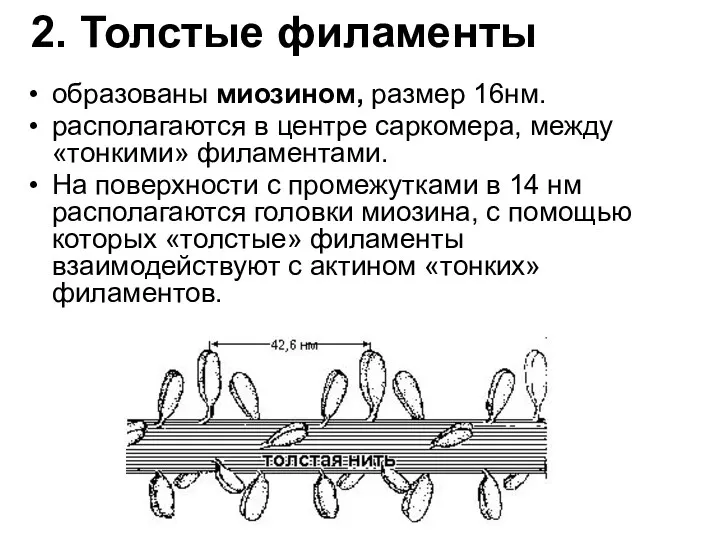
- 81. 2. Толстые филаменты образованы миозином, размер 16нм. располагаются в центре саркомера, между «тонкими» филаментами. На поверхности
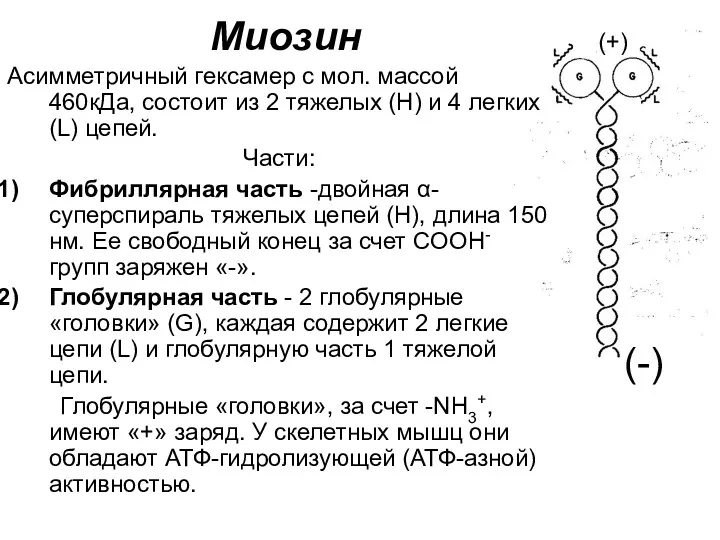
- 82. Миозин Асимметричный гексамер с мол. массой 460кДа, состоит из 2 тяжелых (Н) и 4 легких (L)
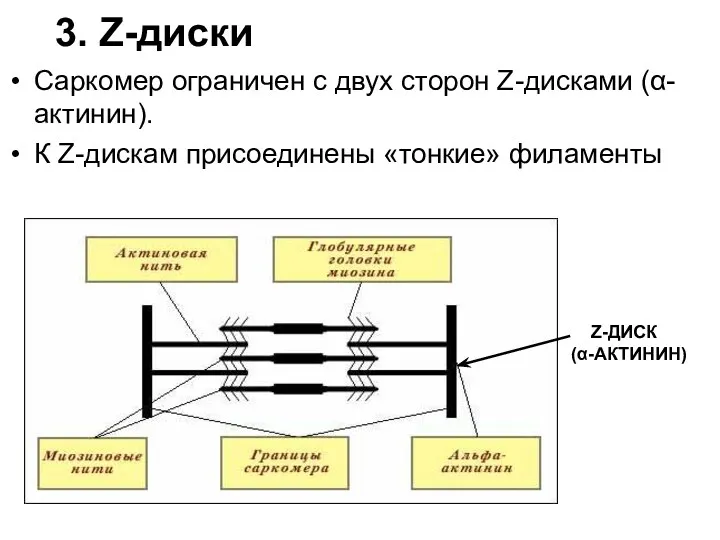
- 83. 3. Z-диски Саркомер ограничен с двух сторон Z-дисками (α-актинин). К Z-дискам присоединены «тонкие» филаменты Z-ДИСК (α-АКТИНИН)
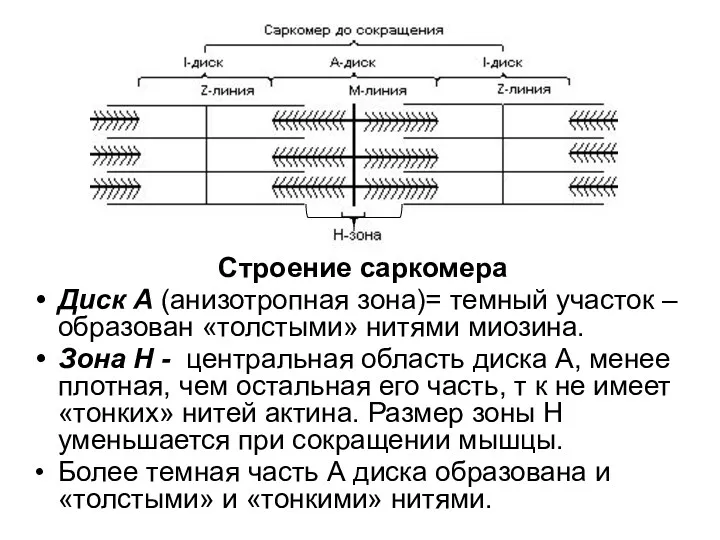
- 84. Строение саркомера Диск А (анизотропная зона)= темный участок –образован «толстыми» нитями миозина. Зона Н - центральная
- 85. Полоса М - пересекает центральную область диска А, образована толстыми нитями, в которых миозин не имеет
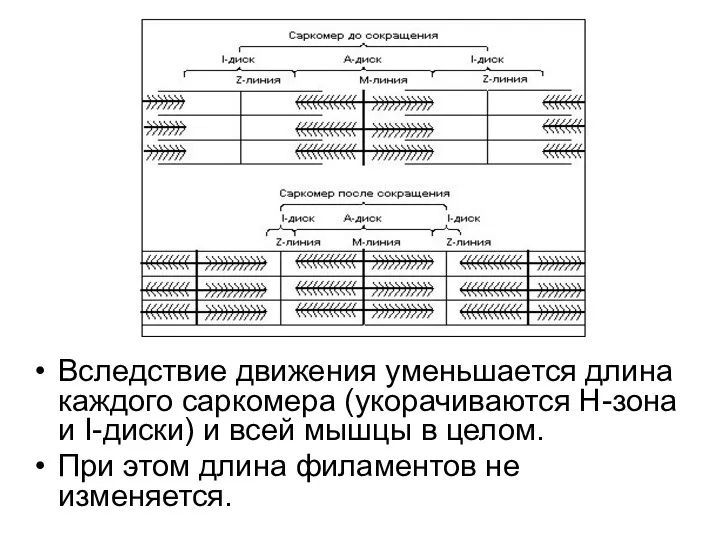
- 86. Вследствие движения уменьшается длина каждого саркомера (укорачиваются Н-зона и I-диски) и всей мышцы в целом. При
- 87. В скелетной мышечной ткани саркомеры миофибрилл располагаются параллельно. За счет этого на срезах скелетные мышцы выглядят
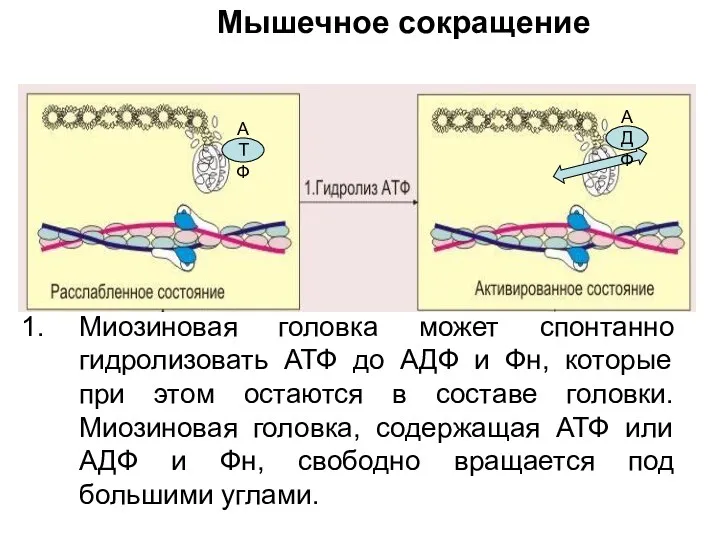
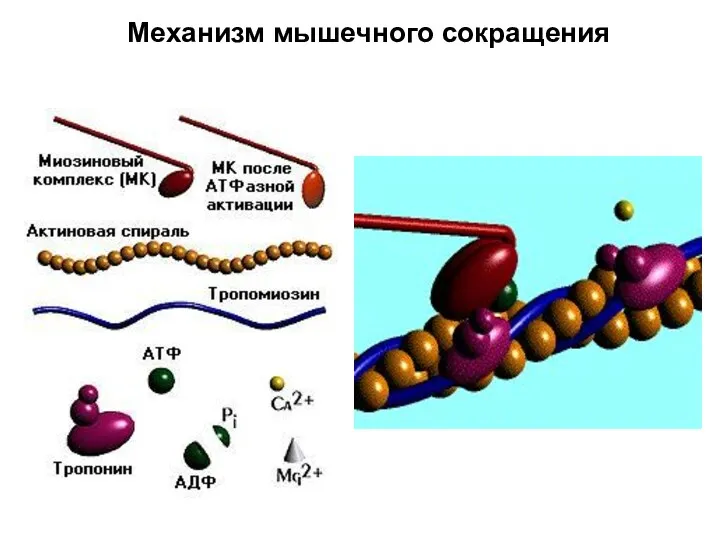
- 88. Миозиновая головка может спонтанно гидролизовать АТФ до АДФ и Фн, которые при этом остаются в составе
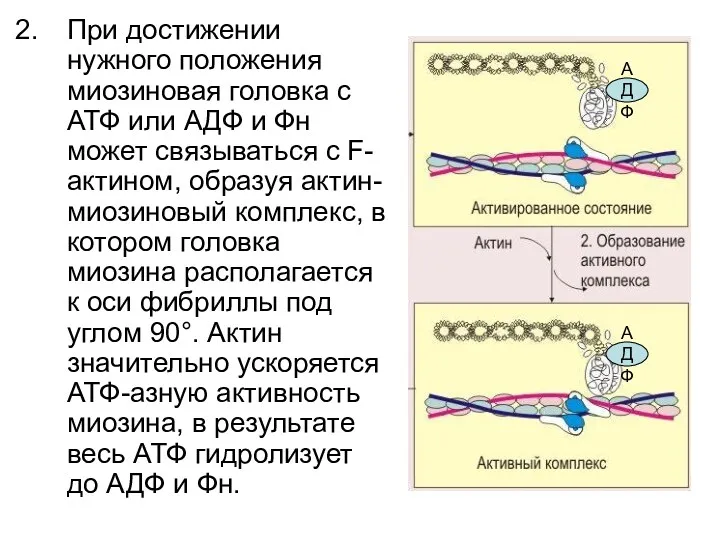
- 89. При достижении нужного положения миозиновая головка с АТФ или АДФ и Фн может связываться с F-актином,
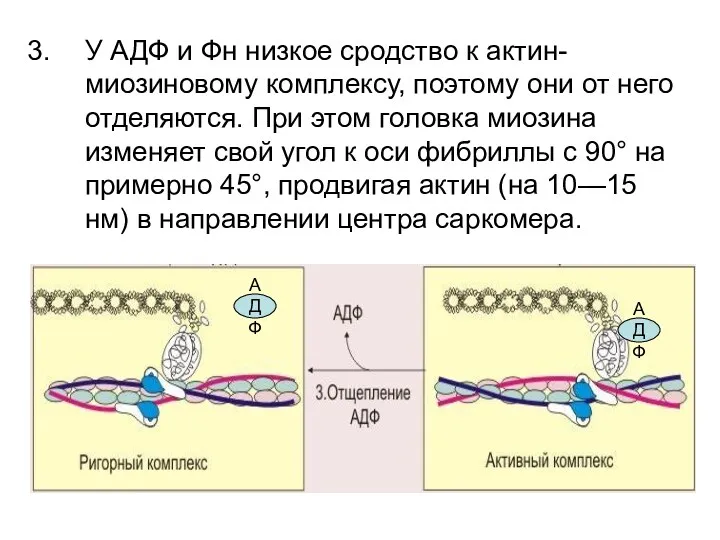
- 90. У АДФ и Фн низкое сродство к актин-миозиновому комплексу, поэтому они от него отделяются. При этом
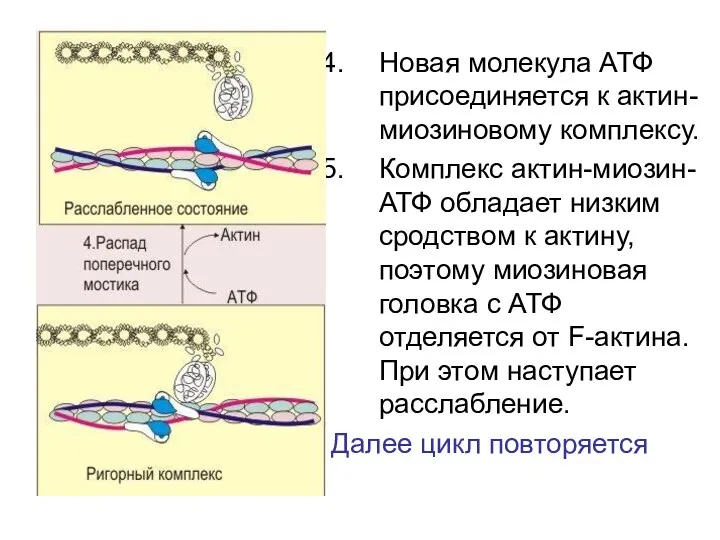
- 91. Новая молекула АТФ присоединяется к актин-миозиновому комплексу. Комплекс актин-миозин-АТФ обладает низким сродством к актину, поэтому миозиновая
- 92. Механизм мышечного сокращения
- 93. Регуляция сокращения и расслабления мышц Любое мышечное сокращение опосредуется Са2+. Кальциевые насосы постоянно перекачивают Са2+ из
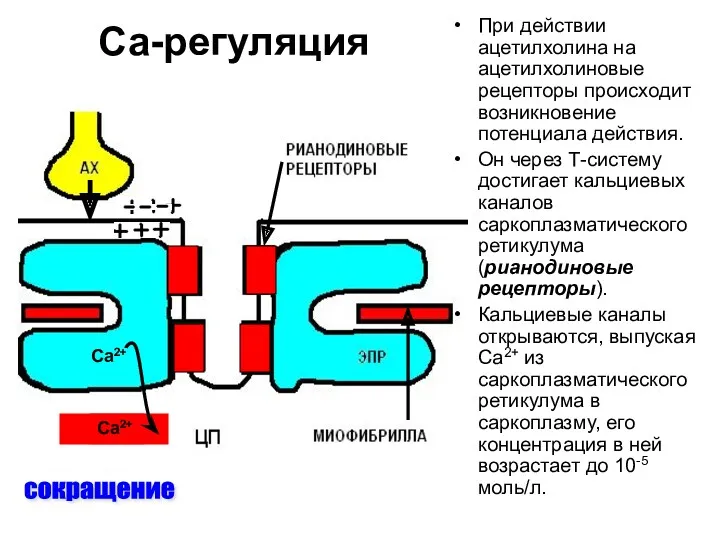
- 94. Са-регуляция сокращение При действии ацетилхолина на ацетилхолиновые рецепторы происходит возникновение потенциала действия. Он через Т-систему достигает
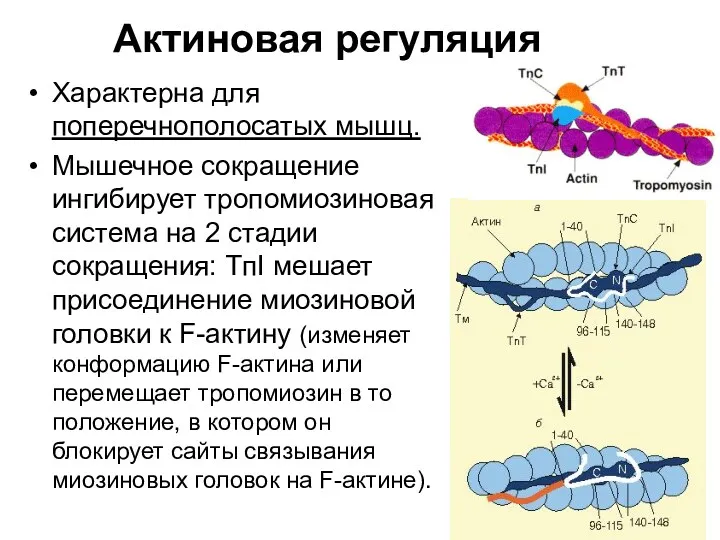
- 95. Актиновая регуляция Характерна для поперечнополосатых мышц. Мышечное сокращение ингибирует тропомиозиновая система на 2 стадии сокращения: TпI
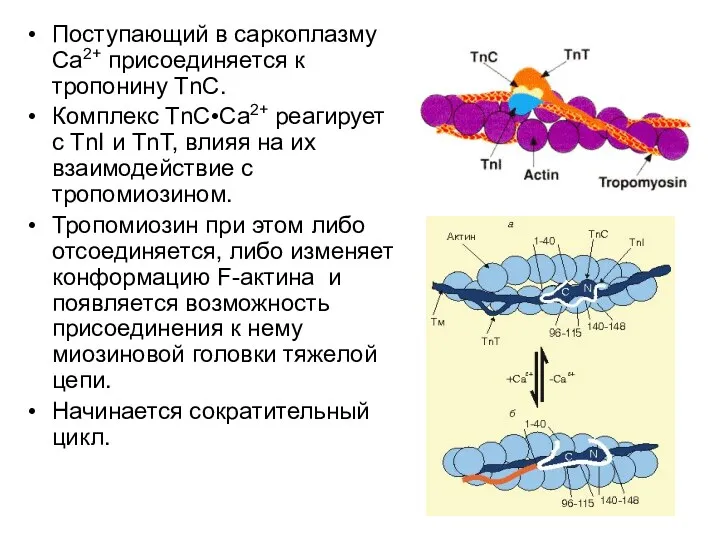
- 96. Поступающий в саркоплазму Са2+ присоединяется к тропонину ТnС. Комплекс ТnС•Са2+ реагирует с TnI и ТnТ, влияя
- 97. Расслабление происходит, когда: 1) При перекачке Са2+ в ЭПР его содержание в саркоплазме падает ниже 10-7
- 98. Миозиновая регуляция Характерна для гладких мышц. нет тропониновой системы, легкая цепь (р-цепь) миозина подавляет его АТФ-азную
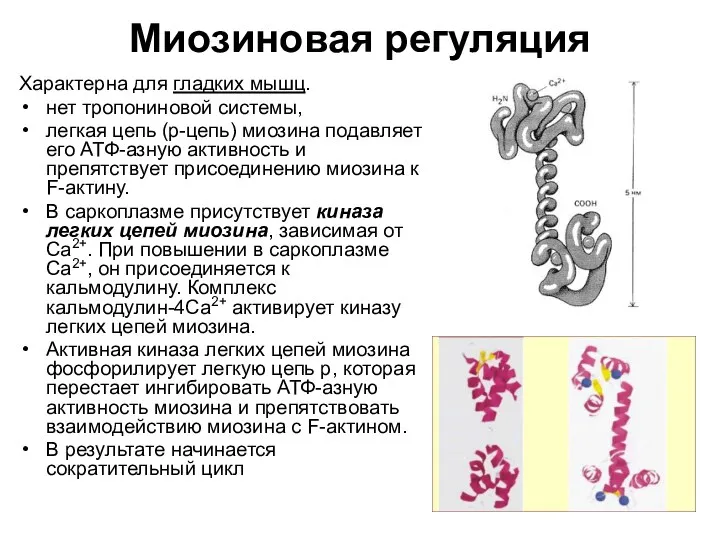
- 99. Расслабление гладких мышц происходит, когда: 1) содержание ионов Са2+ в саркоплазме падает ниже 10-7 моль/л 2)
- 100. Биохимические показатели крови и мочи, отражающие функциональное состояние мышечной ткани Аминотрансферазы -диагностика патологии печени и миокарда.
- 101. Тропонин Т -маркер инфаркта миокарда в острой и подострой фазе. Миоглобин -маркер деструктивных изменений в мышечной
- 102. Миопатии (греч. mys, myos мышца + pathos страдание, болезнь) - нервно-мышечные заболевания, характеризующиеся развитием первичного дистрофического
- 104. БИОХИМИЧЕСКИЕ ИЗМЕНЕНИЯ В МЫШЦАХ ПРИ ПАТОЛОГИИ: снижение содержания миофибриллярных белков возрастание концентрации белков стромы и некоторых
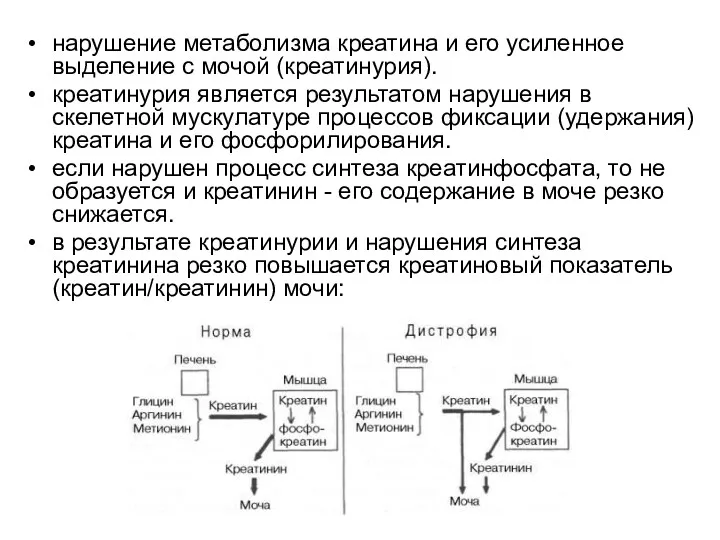
- 105. нарушение метаболизма креатина и его усиленное выделение с мочой (креатинурия). креатинурия является результатом нарушения в скелетной
- 106. Изменение активности ферментов в мышцах: уменьшается активность ферментов, локализованных в саркоплазме изменяется активность ферментов, связанных с
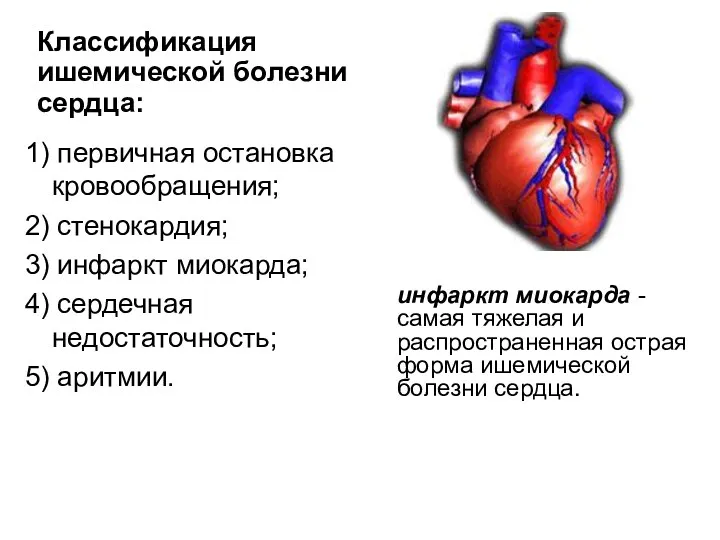
- 107. Ишемическая болезнь сердца ИБС - патологическое состояние, характеризующееся абсолютным или относительным нарушением кровоснабжения миокарда. Причины: обменные
- 108. 1) первичная остановка кровообращения; 2) стенокардия; 3) инфаркт миокарда; 4) сердечная недостаточность; 5) аритмии. Классификация ишемической
- 109. Причины инфаркта миокарда Атеросклероз коронарных артерий Эмболы, тромбы коронарной артерии Спазм коронарных артерий и резко повышение
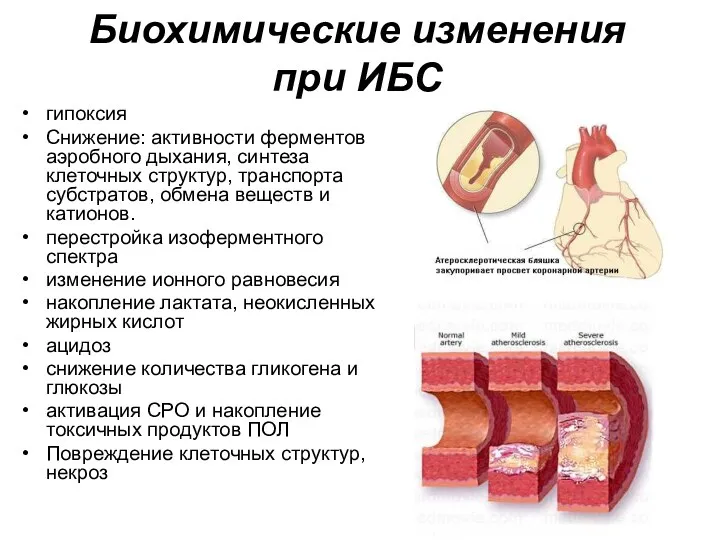
- 110. Биохимические изменения при ИБС гипоксия Снижение: активности ферментов аэробного дыхания, синтеза клеточных структур, транспорта субстратов, обмена
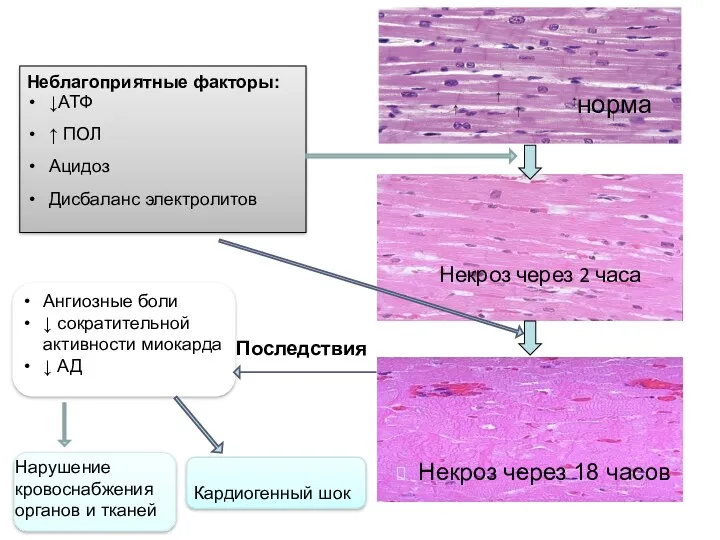
- 111. норма Некроз через 2 часа Некроз через 18 часов Неблагоприятные факторы: ↓АТФ ↑ ПОЛ Ацидоз Дисбаланс
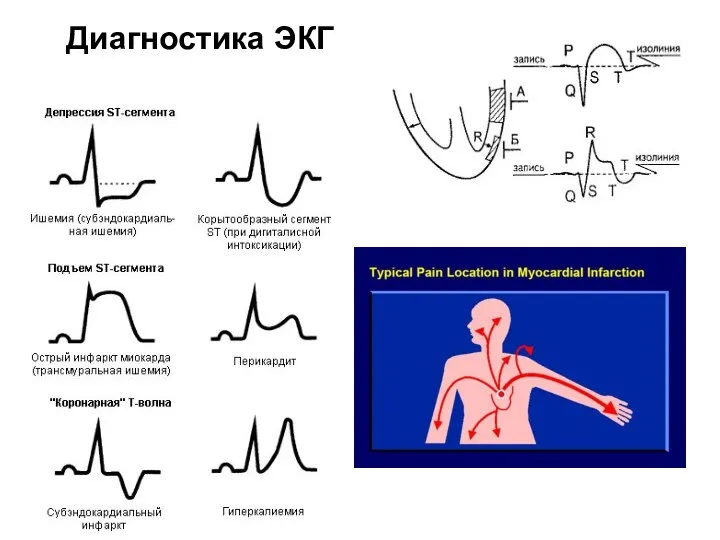
- 112. Диагностика ЭКГ
- 113. При гипоксии миокард поглощает ТГ из липопротеинов, которые не используются, а накапливаются, приводя к ожирению миокарда.
- 114. Терапия
- 115. План лекции Биохимия межклеточного матрикса гетерополисахариды структурные и адгезивные белки Минерализованная соединительная ткань. Ремоделирование костной ткани.
- 116. Межклеточный матрикс Гетерополисахариды и протеогликаны Гликозамингликаны гиалуроновая кислота хондроитинсульфат дерматансульфат гепарансульфат гепарин кератансульфат Протеогликаны (гликозамингликаны +
- 117. Гликозамингликаны, или мукополисахариды (ГАГ) Линейные отрицательно заряженные гетерополисахариды, состоящие из повторяющихся дисахаридных звеньев (см. след. слайд):
- 118. Дисахаридная единица гиалуроновой кислоты (всего несколько тыс. дисахаридных единиц) Дисахаридная единица дерматансульфата Структуру других ГАГ для
- 119. Особенности строения отдельных ГАГ Кератансульфаты вместо гексуроновой кислоты содержат галактозу и кроме дисахаридных единиц –фукозу, маннозу,
- 120. Функции гликозамингликанов и протеогликанов Структурный компонент межклеточного матрикса Формируют тургор тканей (гиалуроновая кислота) «Смазка» в суставах
- 121. Протеогликаны – основное вещество межклеточного матрикса Состав протеогликанов: Гликозамингликаны (кроме гиалуроновой кислоты) – 90-95% Белковая часть
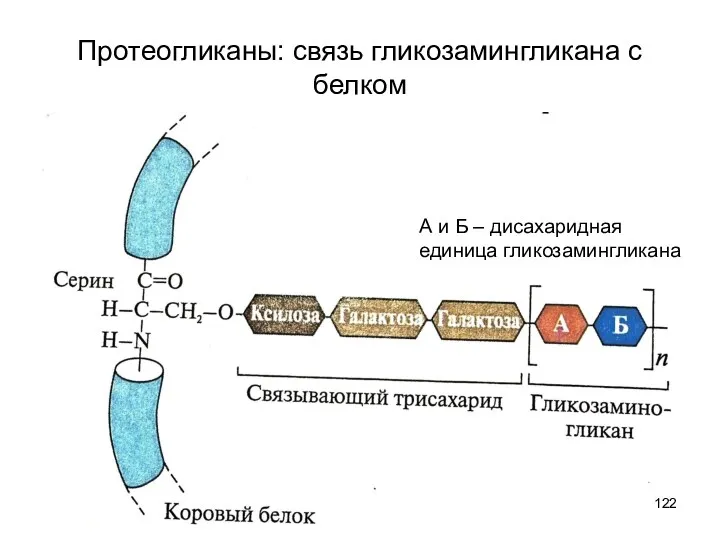
- 122. Протеогликаны: связь гликозамингликана с белком А и Б – дисахаридная единица гликозамингликана
- 123. Синтез протеогликанов 1. Синтез белковой части 2. Образование линкерного трисахарида 3. Рост цепи гликозамингликана Реакции 2
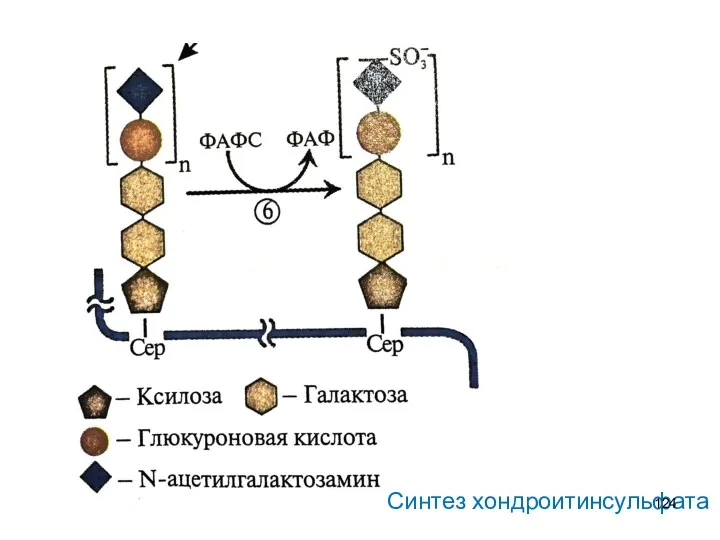
- 124. Синтез хондроитинсульфата
- 125. Катаболизм гликозамингликанов и протеогликанов Полупериод жизни: 3 – 10 дней (кератансульфат 120 дней) Осуществляют лизосомные протеазы,
- 126. Структурные белки соединительной ткани: Коллаген Коллагены – семейство полиморфных фибриллярных белков (19 типов коллагена), имеющих трехспиральную
- 127. Коллаген: особенности строения Пептидная левозакрученная α-спираль коллагена содержит 600 – 3000 АК (в отличие от α-спирали
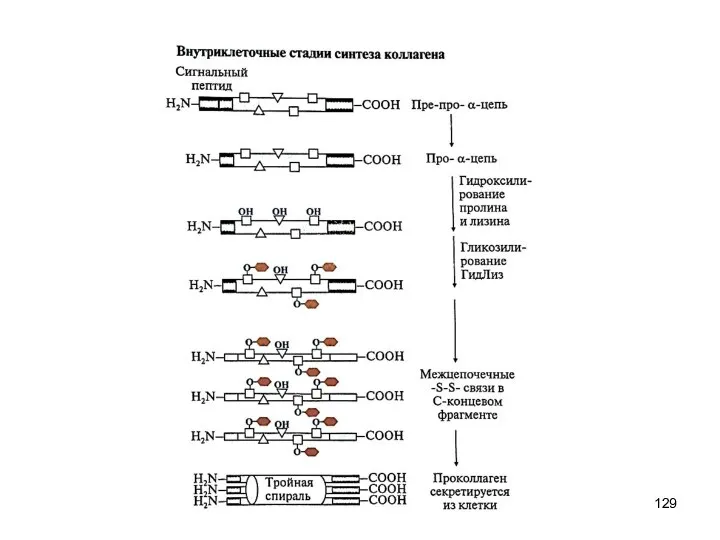
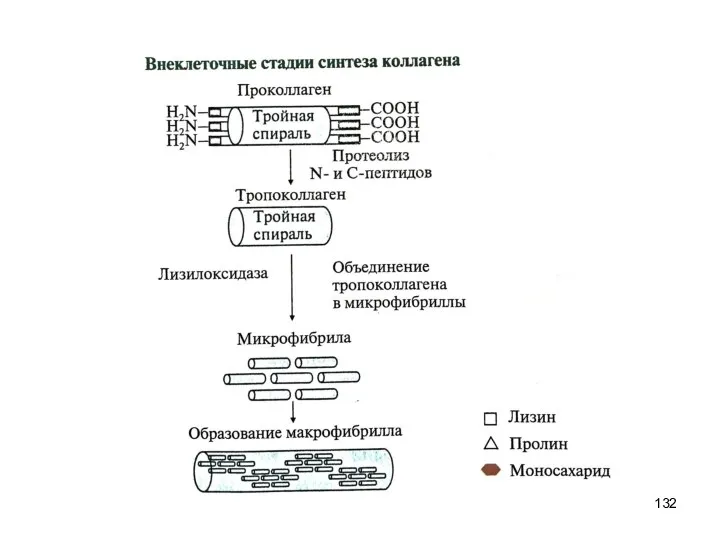
- 128. Синтез и созревание коллагена 1. Внутриклеточный этап (фибробласты, хондробласты, остеобласты): образование пре-про-α-цепи, содержащей сигнальный пептид, облегчающий
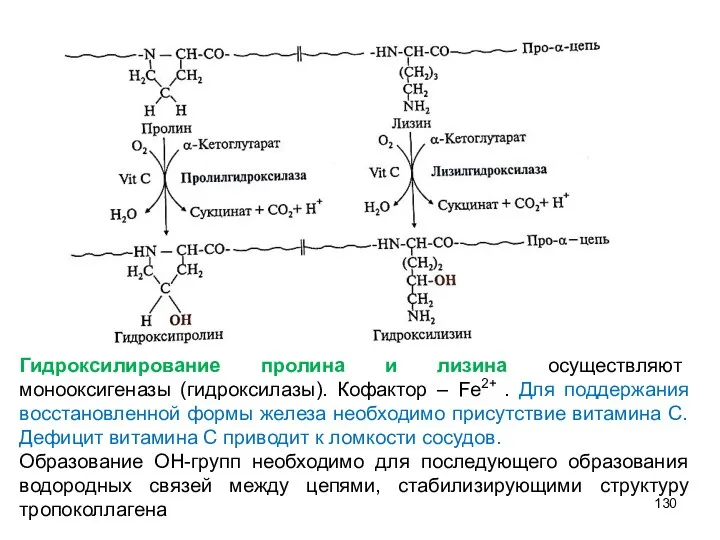
- 130. Гидроксилирование пролина и лизина осуществляют монооксигеназы (гидроксилазы). Кофактор – Fe2+ . Для поддержания восстановленной формы железа
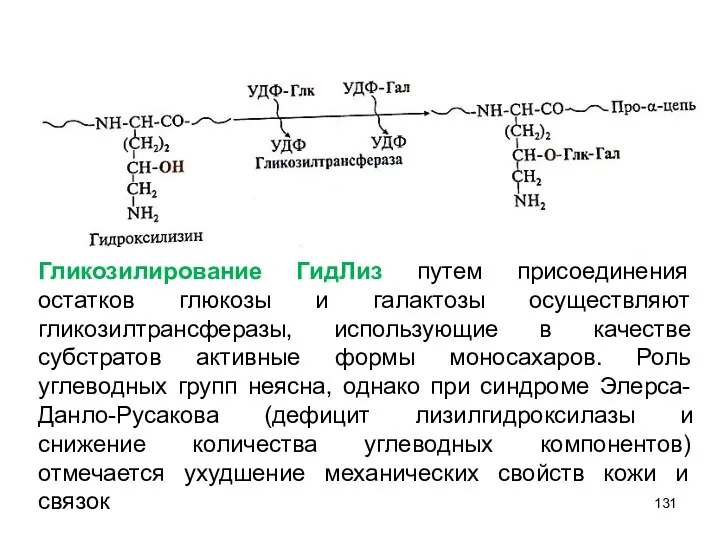
- 131. Гликозилирование ГидЛиз путем присоединения остатков глюкозы и галактозы осуществляют гликозилтрансферазы, использующие в качестве субстратов активные формы
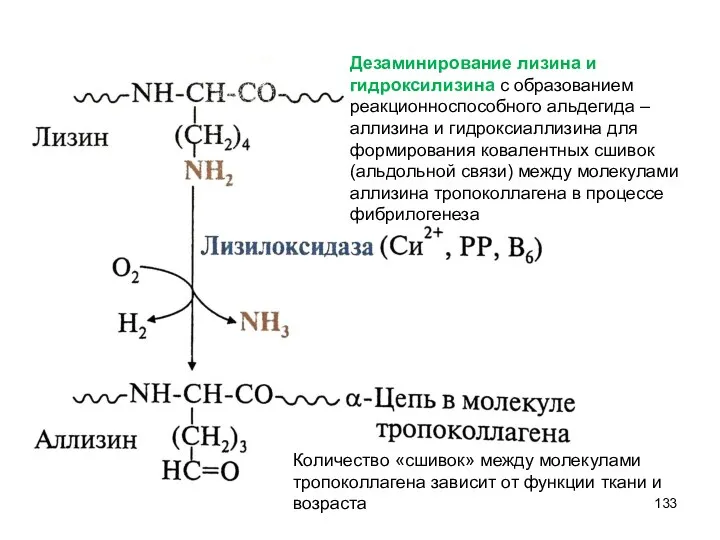
- 133. Дезаминирование лизина и гидроксилизина с образованием реакционноспособного альдегида – аллизина и гидроксиаллизина для формирования ковалентных сшивок
- 134. Макрофибрилла коллагена
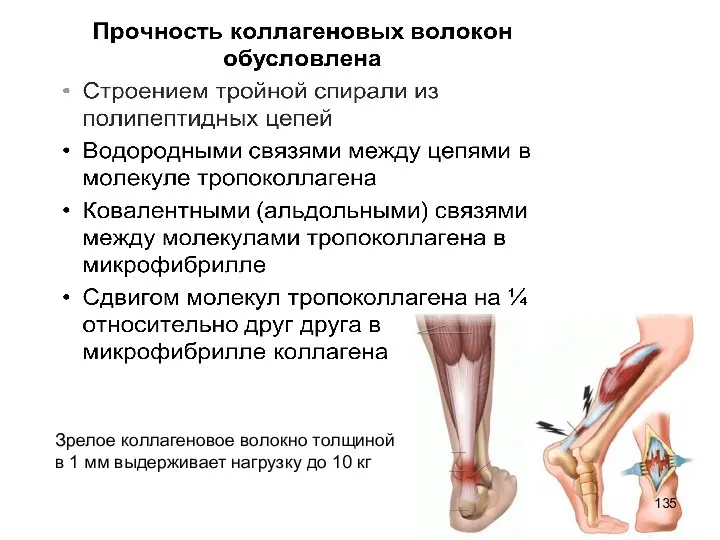
- 135. Зрелое коллагеновое волокно толщиной в 1 мм выдерживает нагрузку до 10 кг
- 136. Катаболизм коллагена Коллаген – медленно обменивающийся белок (время полужизни – недели, месяцы). Обмен более активен у
- 137. Регуляция обмена коллагена Аскорбиновая кислота стимулирует синтеза коллагена, протеогликанов и пролиферацию фибробластов Половые гормоны регулируют синтез
- 138. При старении увеличивается количество поперечных сшивок между молекулами тропоколлагена, затрудняющих действие коллагеназы уменьшается соотношение гликозамингликаны /
- 139. Метаболизм коллагена При патологии Нарушение катаболизма приводит к фиброзу органов Усиление распада происходит при аутоиммунных заболеваниях
- 140. Структурные белки соединительной ткани: Эластин Основной компонент волокон тканей, обладающих значительной эластичностью (сосуды, связки, легкие) 70
- 141. Эластин Время полураспада – 75 лет Протеолиз под действием эластазы (нейтрофилы) Нарушения образования эластина (в частности
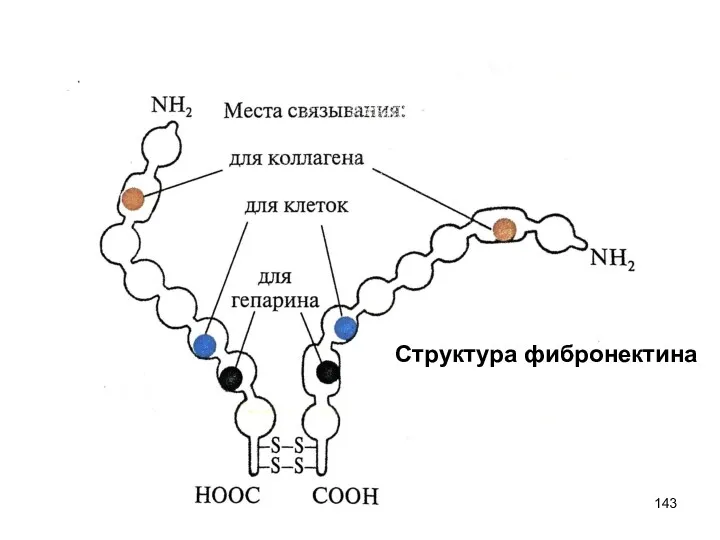
- 142. Адгезивные белки соединительной ткани: фибронектин Димер (2 цепи сходны, но не идентичны, соединены дисульфидными мостиками), гликопротеин,
- 143. Структура фибронектина
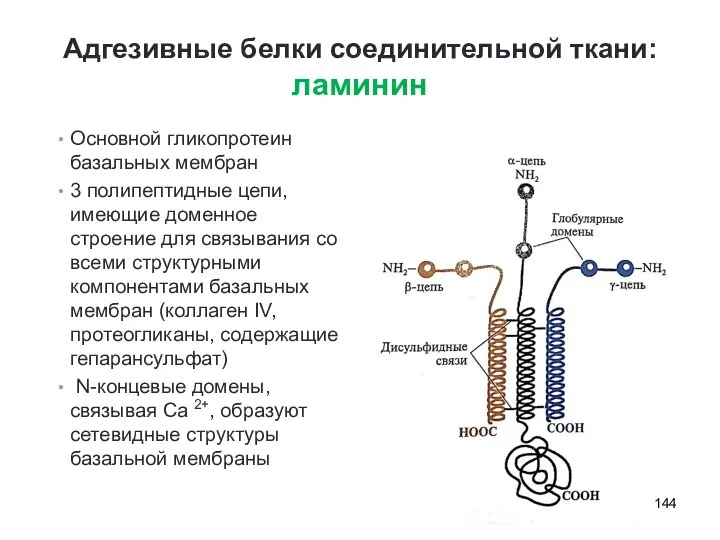
- 144. Адгезивные белки соединительной ткани: ламинин Основной гликопротеин базальных мембран 3 полипептидные цепи, имеющие доменное строение для
- 145. Адгезивные белки соединительной ткани: нидоген Сульфатированный гликопротеин базальных мембран Одна полипептидная цепь Три глобулярных домена: центр
- 146. Кость – минерализованная соединительная ткань Функции: размер и форма тела, защита внутренних органов, минеральный гомеостаз, кроветворение
- 147. Костный обмен Костный обмен (ремоделирование) включает: резорбцию (разрушение) костной ткани костеобразование (обновление, реорганизация органической матрицы и
- 148. Минеральный состав и строение апатитов Ячейка гидроксиапатита Кристалл гидроксиапатита состоит из 2000 ячеек Гидроксиапатит кальция придает
- 149. Строение апатитов Оптимальное расстояние между ионами Са2+ и РО43- задается органической матрицей. Изменение строения компонента матрицы
- 150. Органические вещества кости: коллаген Особенности строения коллагена I типа (остеоколлагена): Больше гидроксипролина, но меньше гидроксилизина Менее
- 151. Органические вещества кости: неколлагеновые белки Большинство неколлагеновых белков – гликопротеины или гликофосфопротеины; присутствуют и в других
- 152. Органические вещества кости: неколлагеновые белки Неколлагеновые белки, содержащие RGD-последовательность: -Арг-Глу-Асп- (комплементарна рецепторам остеокластов): Сиалопротеин, остеопонтин –
- 153. Другие органические вещества кости Факторы роста и дифференцировки (IGF-1, TGF-β, PDGF) Протеогликаны (ГАГ: хондроитин-, дерматан-, кератансульфаты)
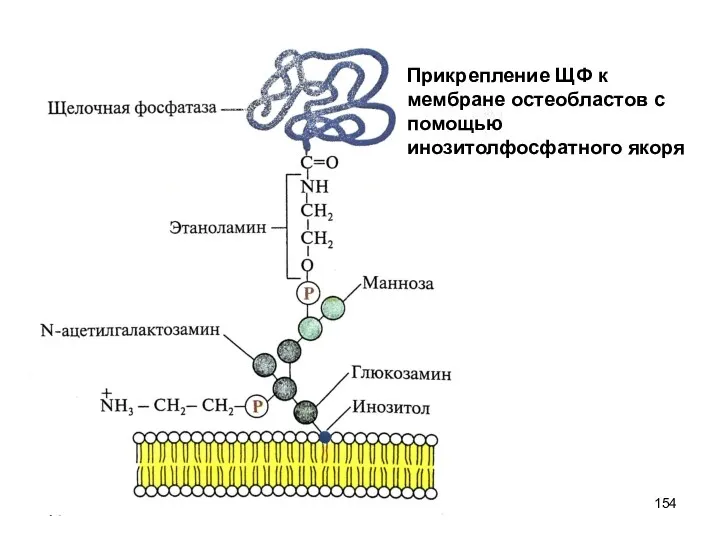
- 154. Прикрепление ЩФ к мембране остеобластов с помощью инозитолфосфатного якоря
- 155. Роль щелочной фосфатазы в костной ткани Проявляет активность на стадии минерализации (рН 9,6) Катализирует реакцию дефосфорилирования
- 156. Ремоделирование костной ткани Каждые 10 лет костная ткань заменяется новой (ежегодно обновляется 5-10% скелета) Интенсивность обмена
- 157. Этапы цикла ремоделирования костной ткани 1. Активация: остеобласты под влиянием стимулирующих факторов секретируют фактор RANKL (receptor
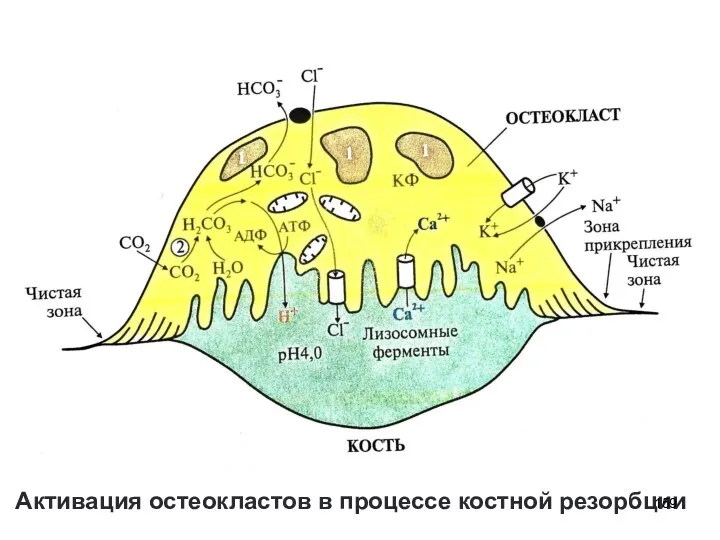
- 158. Этапы цикла ремоделирования костной ткани 2. Резорбция: «работа» остеокластов Прикрепление остеокласта к кости Карбоангидразная реакция и
- 159. Активация остеокластов в процессе костной резорбции
- 160. Этапы цикла ремоделирования костной ткани 3. Реверсия Действие локальных ростовых факторов на остеобласты приводит к синтезу
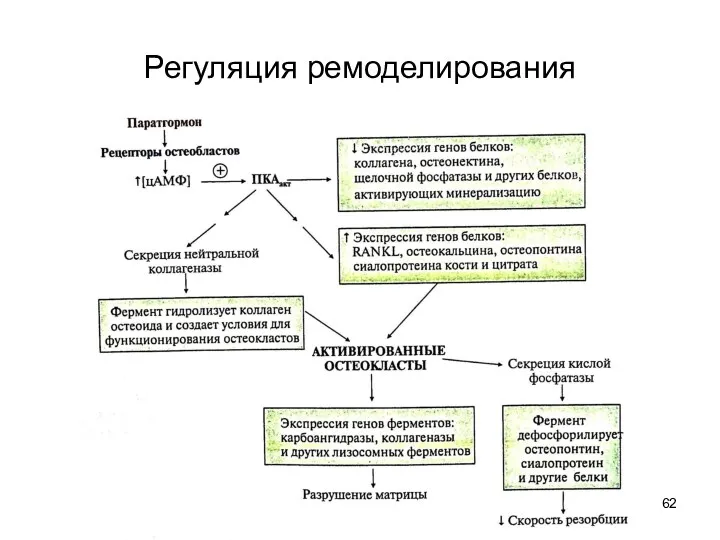
- 161. Регуляция ремоделирования Паракринно-аутокринная (местная) регуляция: цитокины, фаторы роста, простагландины костной ткани Системная регуляция Основные регуляторы: Паратгормон
- 162. Регуляция ремоделирования
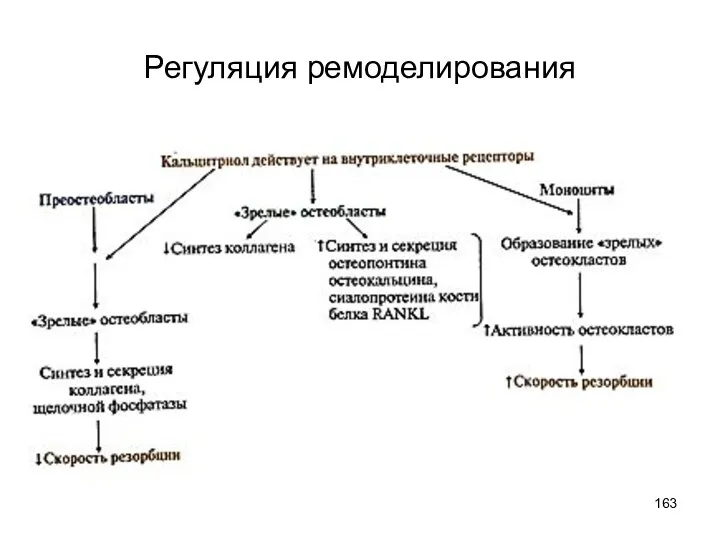
- 163. Регуляция ремоделирования
- 164. Регуляция ремоделирования ПК А фосфорилирует белок-переносчик Са2+, что приводит к поступлению Са2+ в цитозоль остеокласта из
- 165. Регуляция ремоделирования Кортизол замедляет костеобразование: подавляет пролиферацию остеобластов, синтез остеоколлагена, остеонектина, протеогликанов Кортизол стимулирует костную резорбцию:
- 166. Регуляция ремоделирования Гормон роста повышает активность остеобластов, которые стимулируют остеокласты, поэтому происходит очаговая деминерализация, затем увеличение
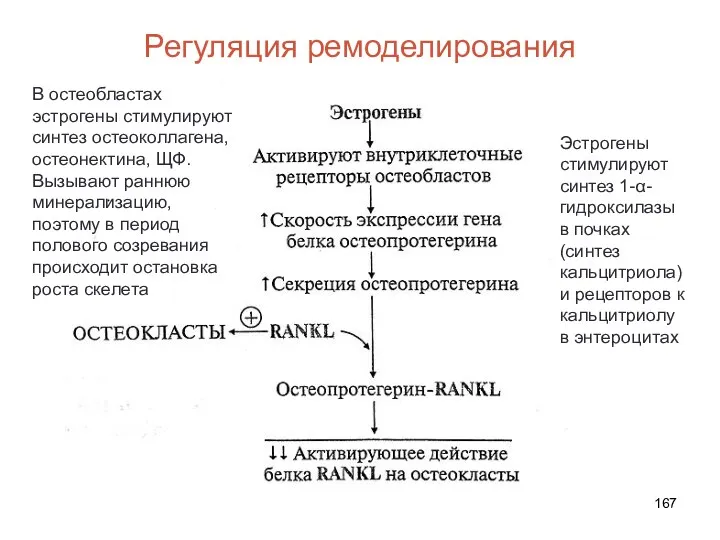
- 167. Регуляция ремоделирования В остеобластах эстрогены стимулируют синтез остеоколлагена, остеонектина, ЩФ. Вызывают раннюю минерализацию, поэтому в период
- 169. Скачать презентацию







































































































 Гели косметические
Гели косметические Популяциялық генетика негіздері. Генетикалық полиморфизм
Популяциялық генетика негіздері. Генетикалық полиморфизм Мембрана и органоиды клетки. 9 класс
Мембрана и органоиды клетки. 9 класс Класс Птицы
Класс Птицы Система инактивации лекарственных средств в организме человека
Система инактивации лекарственных средств в организме человека Формирование экологической компетентности школьников через интеграцию общего и дополнительного образования
Формирование экологической компетентности школьников через интеграцию общего и дополнительного образования Презентация по биологии Отдел Плауновидные и отдел Хвощевидные.
Презентация по биологии Отдел Плауновидные и отдел Хвощевидные. Приспособились ли потомки древних обитателей Земли – бактерии – к жизни на современной планете?
Приспособились ли потомки древних обитателей Земли – бактерии – к жизни на современной планете? Внутриутробное развитие плода. Развитие плода с первых дней беременности
Внутриутробное развитие плода. Развитие плода с первых дней беременности Витамины. Определение, классификация
Витамины. Определение, классификация Плесневые грибы и дрожжи. Грибы-паразиты
Плесневые грибы и дрожжи. Грибы-паразиты Общая спланхнология
Общая спланхнология Слуховой анализатор
Слуховой анализатор Методы цитологии. Клеточная теория
Методы цитологии. Клеточная теория Презентация по биологии для учащихся 8-го класса на тему: Эволюция человека
Презентация по биологии для учащихся 8-го класса на тему: Эволюция человека Размножение организмов
Размножение организмов Растительные сообщества городской системы
Растительные сообщества городской системы Простые и сложные углеводы. Гликемический индекс
Простые и сложные углеводы. Гликемический индекс Антропогенез. Расы. Расизм. Часть 9
Антропогенез. Расы. Расизм. Часть 9 Энергообразующие органоиды (лекция 7)
Энергообразующие органоиды (лекция 7) Приспособленность организмов к условиям внешней среды
Приспособленность организмов к условиям внешней среды Постэмбриональное развитие животных
Постэмбриональное развитие животных Человек как уникальный вид живой природы
Человек как уникальный вид живой природы Открытия в области биологии в эпоху НТР
Открытия в области биологии в эпоху НТР Ткани растений и животных
Ткани растений и животных Отдел Покрытосеменные
Отдел Покрытосеменные Рыбы (7 класс)
Рыбы (7 класс) Тип Моллюски или мягкотелые
Тип Моллюски или мягкотелые