Содержание
- 2. Негізгі сұрақтар Жүйе, энергия, жұмыс, ішкі энергия, энтальпия. Термодинамиканың бірінші заңы. Биожүйелер үшін термодинамиканың бірінші заңы.
- 3. Биофизика – тірі жүйелердегі физико-химиялық құбылыстарды және оның қоршаған ортамен байланысы туралы ғылым. Биофизика – биологиялық
- 4. Ашық жүйелер күй заңдылықтарын ашып көрсету. Тіршіліктің термодинамикалық негізін теориялық тұрғыда түсіндіру. Жеке және эволюциялық даму,
- 6. ЮНЕСКО номенклатурасына сәйкес биофизиканың келесі тарауларын бөліп қарастырады: 2406.01 Биоакустика (су және әуе ортасындағы байланыс) 2406.02
- 7. Термодинамика – әртүрлі энергиялардың айналымдарын сапалық және сандық сипаттаумен айналысатын физика ғылымының бір бөлімі. Термодинамика –
- 8. Қазіргі таңда термодинамиканың екі негізгі бөлімі бар: Тепе-теңдік термодинамикасы (оқшауланған жүйелер термодинамикасы) Тепе-теңсіздік термодинамикасы (ашық жүйелер
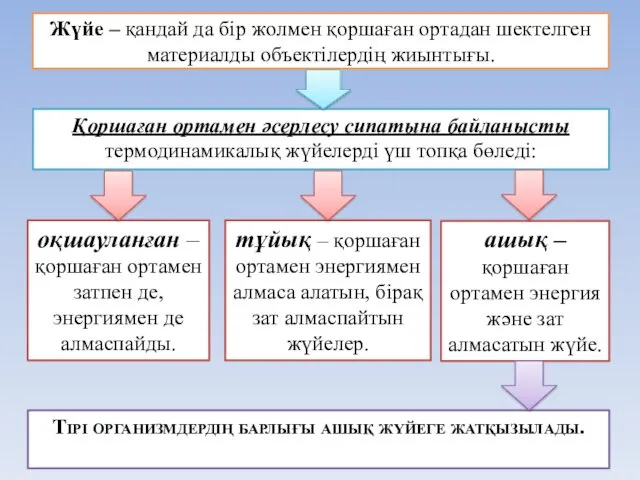
- 9. Жүйе – қандай да бір жолмен қоршаған ортадан шектелген материалды объектілердің жиынтығы. Қоршаған ортамен әсерлесу сипатына
- 10. Тірі материяға тән негізгі қасиеттер Қоректену Тыныс алу Тітіркенгіштік Қозғалу Сыртқа шығару Өсу
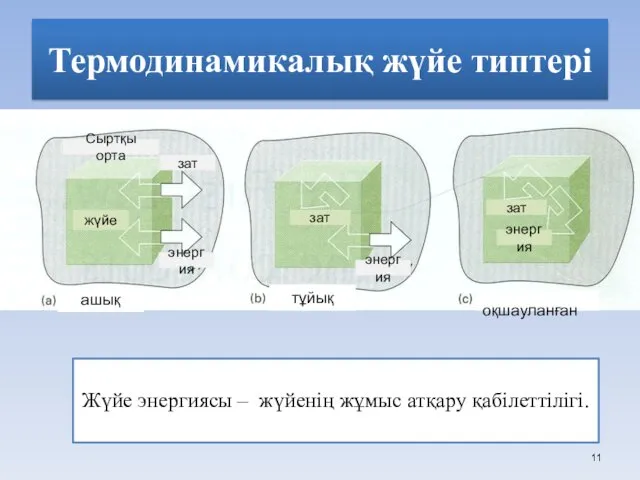
- 11. Термодинамикалық жүйе типтері Жүйе энергиясы – жүйенің жұмыс атқару қабілеттілігі. жүйе зат тұйық оқшауланған зат энергия
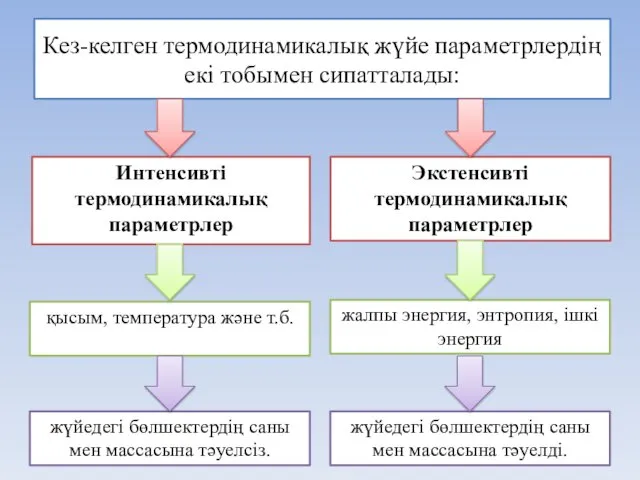
- 12. Кез-келген термодинамикалық жүйе параметрлердің екі тобымен сипатталады: Интенсивті термодинамикалық параметрлер Экстенсивті термодинамикалық параметрлер жалпы энергия, энтропия,
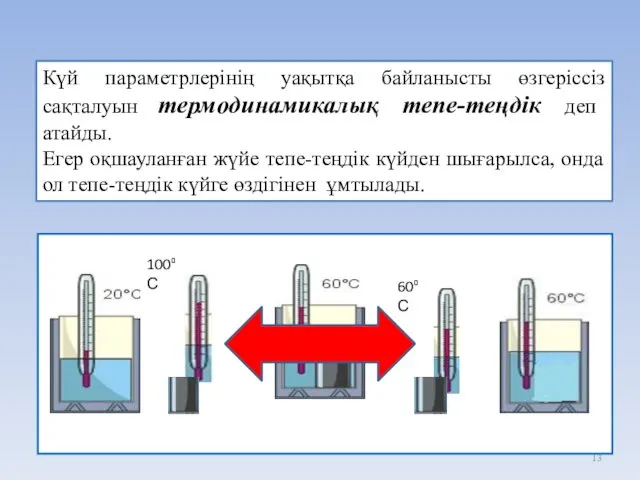
- 13. 100⁰ С 60⁰ С Күй параметрлерінің уақытқа байланысты өзгеріссіз сақталуын термодинамикалық тепе-теңдік деп атайды. Егер оқшауланған
- 14. Термодинамикалық процесс Термодинамикалық жүйеде параметрлерлердің өзгеруін термодинамикалық процесс деп атайды. Жүйе энергиясын (W) екі бөлшектін қосындысы
- 15. Ішкі энергия Ішкі энергияны өз кезегінде бос энергия және байланысқан энергия деп екіге бөледі. Бос энергия
- 16. Термодинамиканың бірінші заңы Материалды жүйедегі энергияның жалпы суммасы жүйеде жүріп жатқан өзгерістерге тәуелсіз тұрақты сақталады. Жүйедегі
- 17. Термодинамиканың бірінші заңы Жүйенің ішкі энергиясының өзгерісі ΔU жүйеге берілген жылудың ΔQ алгебралық суммасы мен атқарылған
- 18. Жүйенің жылу эффектісі – энтальпия (H, ΔH, dH) – қысым р тұрақты болған жағдайда жүйеге берілетін
- 19. Термодинамиканың бірінші заңын биологиялық жүйелер үшін қолдану Термодинамиканың бірінші заңын тірі жүйелер үшін қолдану мүмкіндігі туралы
- 20. Термодинамиканың бірінші заңының биожүйелер үшін тұжырымдамасы Тірі организмдерде жасалатын жұмыстың барлығы АТФ энергиясы есебінен атқарылады. АТФ
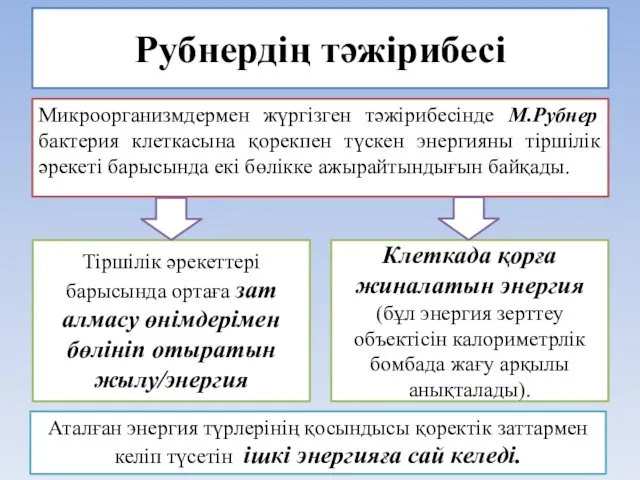
- 21. Рубнердің тәжірибесі Микроорганизмдермен жүргізген тәжірибесінде М.Рубнер бактерия клеткасына қорекпен түскен энергияны тіршілік әрекеті барысында екі бөлікке
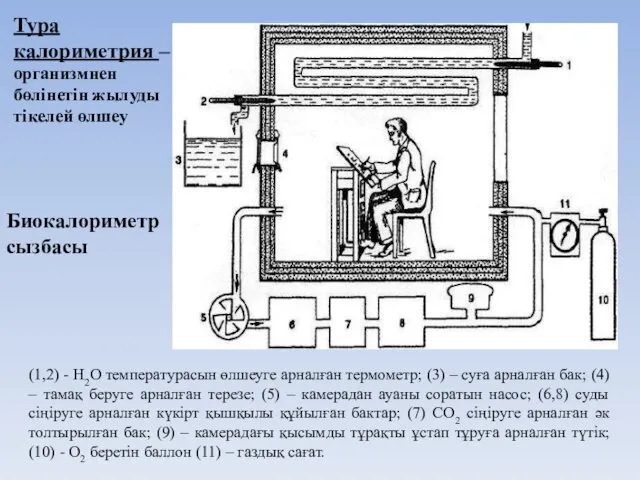
- 22. (1,2) - Н2О температурасын өлшеуге арналған термометр; (3) – суға арналған бак; (4) – тамақ беруге
- 23. К – камера; Б – оттегі баллоны; Н – камерадағы ауаны соратын мотор; З – жылантәрізді
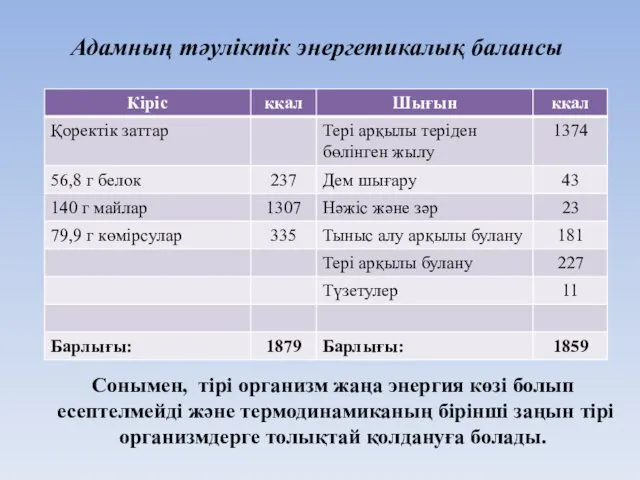
- 24. Адамның тәуліктік энергетикалық балансы Сонымен, тірі организм жаңа энергия көзі болып есептелмейді және термодинамиканың бірінші заңын
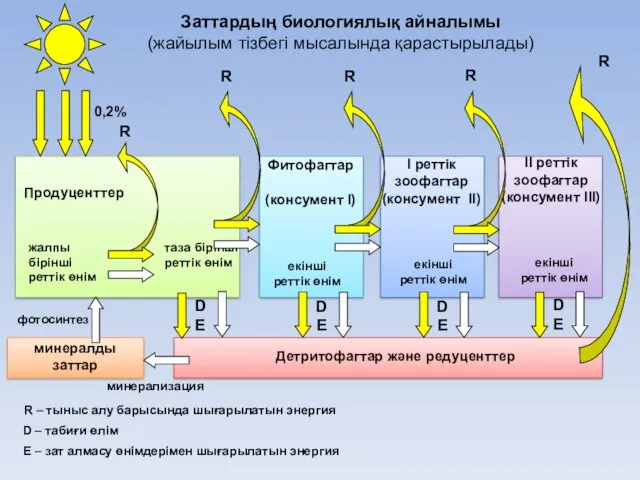
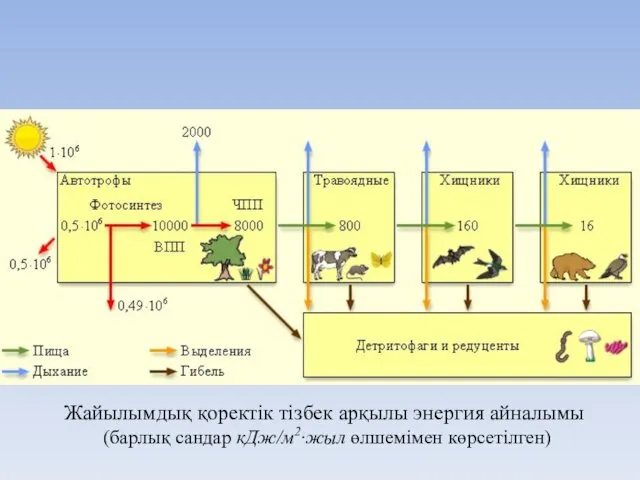
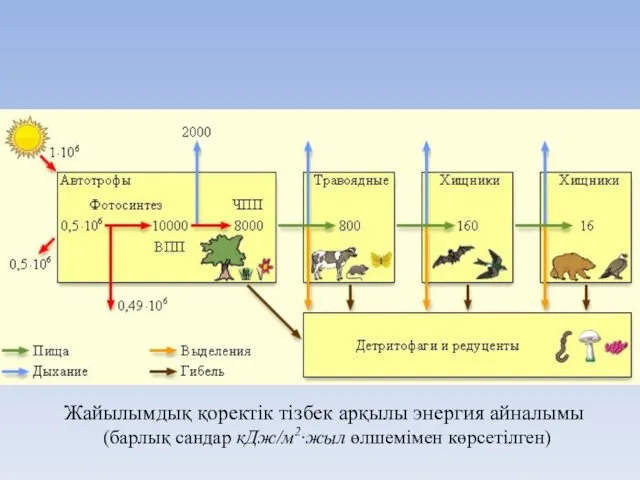
- 25. Продуценттер І реттік зоофагтар (консумент II) Фитофагтар (консумент І) ІІ реттік зоофагтар (консумент III) екінші реттік
- 26. Жайылымдық қоректік тізбек арқылы энергия айналымы (барлық сандар кДж/м2∙жыл өлшемімен көрсетілген)
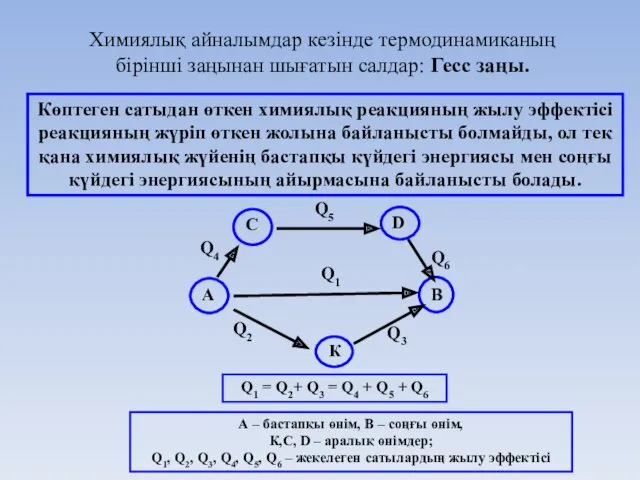
- 27. Химиялық айналымдар кезінде термодинамиканың бірінші заңынан шығатын салдар: Гесс заңы. Көптеген сатыдан өткен химиялық реакцияның жылу
- 28. Гесс заңы тағамның энергетикалық құндылығын (калориялылығын) анықтау үшін ветеринария мен медицинада қолданылады. Тағамның энергетикалық құндылығын анықтауда
- 29. Бос энергия G – жүйенің жұмыс істеу қабілеттілігі. Бос энергия мына формуламен анықталады: G = U
- 30. Қандай да бір параметрдің градиенті Г оның ΔI нүктесінің Δx нүктесінің арасындағы ара-қатынас ерекшелігін айтады. Г
- 31. Термодинамиканың екінші заңына сәйкес жүйенің күйі оның ерекше функциясы – энтропиямен S сипатталады. Энтропия берілген жағдайда
- 32. Яғни, қайтымды процестер кезінде энтропияның өзгерісі ΔS = 0, Ал қатымсыз процестерде энтропия оң мәнге ие:
- 33. Термодинамиканың екінші заңының жалпы анықтамасы: Оқшауланған жүйеде өздігінен жүретін процесс егер процесс қайтымсыз болса, бос энергияның
- 34. Энтропия – жүйедегі реттіліктің өлшемі S=klnW - Планк-Больцман теңдеуі мұндағы S - энтропия, k – Больцман
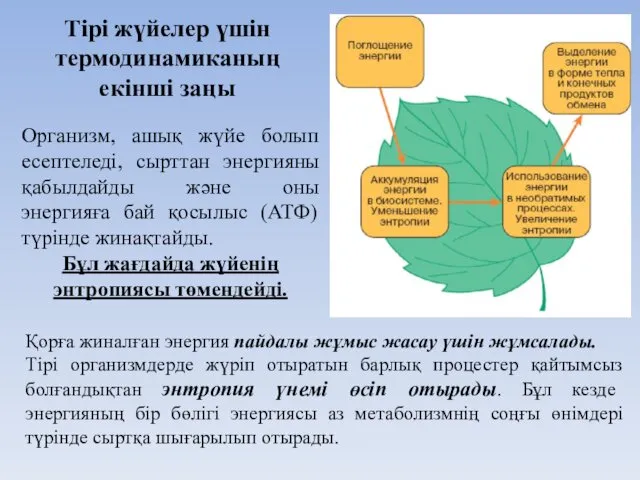
- 35. Организм, ашық жүйе болып есептеледі, сырттан энергияны қабылдайды және оны энергияға бай қосылыс (АТФ) түрінде жинақтайды.
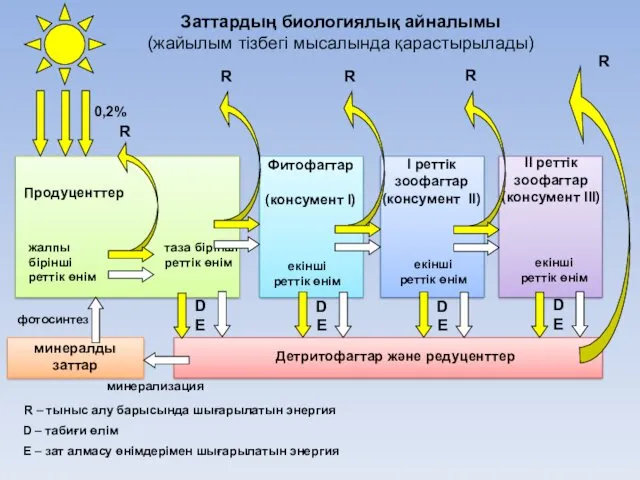
- 36. Продуценттер І реттік зоофагтар (консумент II) Фитофагтар (консумент І) ІІ реттік зоофагтар (консумент III) екінші реттік
- 37. Жайылымдық қоректік тізбек арқылы энергия айналымы (барлық сандар кДж/м2∙жыл өлшемімен көрсетілген)
- 38. Ашық жүйедегі энтропияның жалпы өзгерісі dS тәуелсіз. сыртқы ортамен зат және энергия алмасу есебінен (deS), немесе
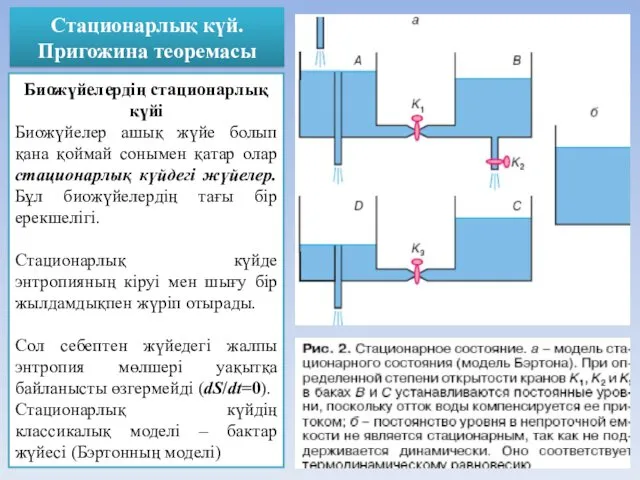
- 39. Стационарлық күй. Пригожина теоремасы Биожүйелердің стационарлық күйі Биожүйелер ашық жүйе болып қана қоймай сонымен қатар олар
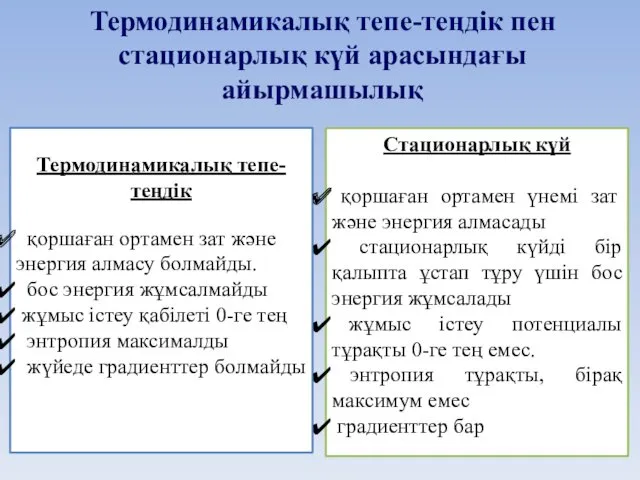
- 40. Термодинамикалық тепе-теңдік қоршаған ортамен зат және энергия алмасу болмайды. бос энергия жұмсалмайды жұмыс істеу қабілеті 0-ге
- 41. Тірі жүйелер үшін термодинамиканың екінші заңы Организмдегі энтропияның өзгеру жылдамдығы ΔS организмдегі энтропия өндірісі мен сырттан
- 42. Термодинамиканың үшінші бастамасы 1906 ж (Нернст жылулық заңы) В.Нерст тұжырымдалған термодинамика заңы, ол бойынша температураның (Т)
- 43. Термодинамиканың үшінші бастамасына сәйкес Т = 0 кезінде ΔS = 0 мәні. 1911 жылы Макс Планк
- 44. Семинар сұрақтары Термодинамика – ағзадағы энергия, жылу және зат алмасу процестері жөніндегі ілім. Биологиялық жүйелердің алуантүрлілігі.
- 45. Ақпарат көздері
- 47. Скачать презентацию




























 Центральная нервная система. Спинной мозг
Центральная нервная система. Спинной мозг Общая характеристика надкласса Рыбы. Хрящевые рыбы
Общая характеристика надкласса Рыбы. Хрящевые рыбы Ферменты. Специфические свойства
Ферменты. Специфические свойства Эволюция тканей и систем органов
Эволюция тканей и систем органов Мышцы туловища животных. Мультимедийный проект
Мышцы туловища животных. Мультимедийный проект Особливості живлення тварин
Особливості живлення тварин Презентация Строение растительной клетки
Презентация Строение растительной клетки Организация выращивания технического каннабиса и производства промышленных продуктов из него
Организация выращивания технического каннабиса и производства промышленных продуктов из него Эукариотическая клетка. Органоиды цитоплазмы
Эукариотическая клетка. Органоиды цитоплазмы Миология. Мышцы конечностей
Миология. Мышцы конечностей Болезни органов дыхания
Болезни органов дыхания Нервная ткань. Нервная система
Нервная ткань. Нервная система Хижі рослини
Хижі рослини ПРЕЗЕНТАЦИИ 5 КЛАСС 4 ЧЕТВЕРТЬ
ПРЕЗЕНТАЦИИ 5 КЛАСС 4 ЧЕТВЕРТЬ Отдел Голосеменные
Отдел Голосеменные Тип Членистоногие (Arthropoda)
Тип Членистоногие (Arthropoda) Різноманітність ссавців
Різноманітність ссавців Зоология позвоночных = хордовых. Литература для подготовки к занятиям и экзамену. ZooVert-1
Зоология позвоночных = хордовых. Литература для подготовки к занятиям и экзамену. ZooVert-1 Модели репликации мтДНК. Ферменты репликации мтДНК. Лекция 3
Модели репликации мтДНК. Ферменты репликации мтДНК. Лекция 3 Объект исследования: органы растений
Объект исследования: органы растений Земноводні (Amphibia)
Земноводні (Amphibia) Строение клетки
Строение клетки Гістологія. Вчення про тканини
Гістологія. Вчення про тканини Сложные эфиры глицерина и высших карбоновых кислот. (9 класс)
Сложные эфиры глицерина и высших карбоновых кислот. (9 класс) Исследовательский проект на тему: Исследование действия антибиотиков на микроорганизмы
Исследовательский проект на тему: Исследование действия антибиотиков на микроорганизмы Структура и функции клетки. Клеточная теория
Структура и функции клетки. Клеточная теория Прорастание семян
Прорастание семян Хищные и травоядные динозавры
Хищные и травоядные динозавры