Содержание
- 2. Современная биотехнология — это наука о генно-инженерных и клеточных методах создания и использования генетически трансформированных биологических
- 3. Разделы биотехнологии Промышленная биотехнология (биотехнологические производства, использующие преимущественно микроорганизмы). Клеточная инженерия (культивирование растительных и животных клеток).
- 4. Промышленная биотехнология Фармацевтическая биотехнология (вакцины, ферменты, инсулин, интерфероны, витамины, антибиотики, биодеградируемые пластмассы, биосовместимые материалы, тест-системы). Сельскохозяйственная
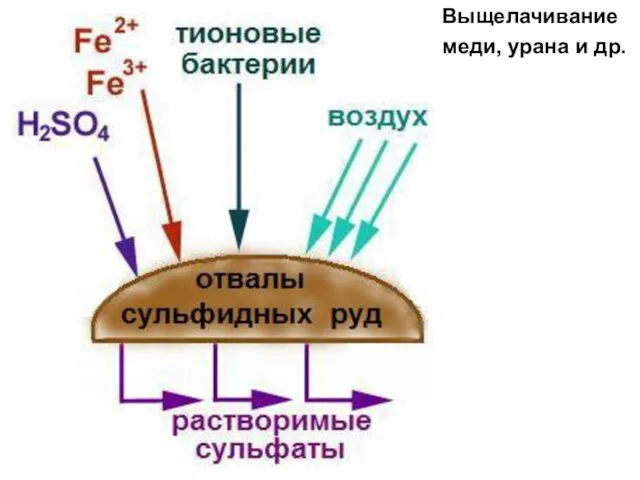
- 5. Выщелачивание меди, урана и др.
- 6. «Грибные» биотехнологические продукты Антибиотики (пенициллин и др.). Ферменты (амилазы, протеазы, целлюлаза и др.) Органические кислоты: лимонная,
- 7. Клеточная инженерия конструирование клеток нового типа; создание химер агрегационным или инъекционным методом (генетическая мозаичность химер не
- 8. Клонирование Растений, грибов и микроорганизмов – бесполое размножение зачатками многоклеточными или одноклеточными Животных – многоплодность за
- 9. Клон - точная копия? Точное воспроизведение растения, животного или человека невозможно. Новый организм обязательно будет отличаться
- 10. Клеточная инженерия растений Ускоренное клональное микроразмножение растений, позволяющее из одного экспланта получать до 1 млн. растений
- 11. Культуры растительных клеток в суспензиях Растения: женьшень, раувольфия змеиная, наперстянка шерстистая и пурпурная, диоскорея дельтовидная, воробейник,
- 12. Проблемы культивирования клеток в суспензии Клетки растений очень крупные, и их размеры меняются в процессе онтогенеза.
- 13. Успехи клонирования животных Овечка Долли (1996-2003) и Йен Уилмат - один из ученых, проводивших эксперимент.
- 14. Первые клонированные животные 1996 — овечка Долли 1997 — мышь 1998 — корова 1999 — козёл
- 15. Клеточная инженерия человека Экстракорпоральное оплодотворение; Криоконсервация эмбрионов; Многолетнее ведение культур клеток человека, например, HeLa, полученных от
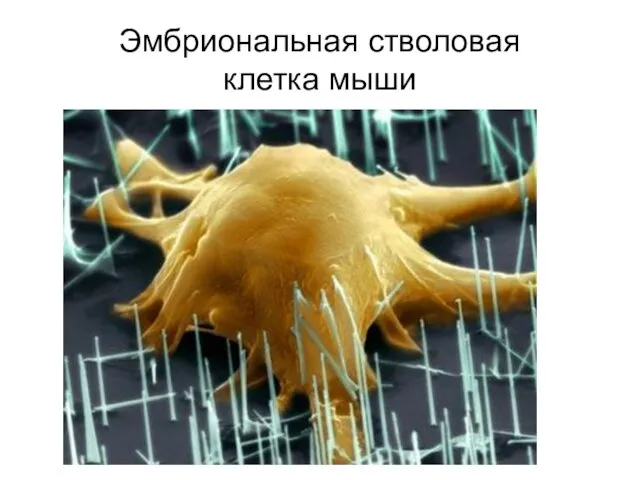
- 16. Эмбриональная стволовая клетка мыши
- 17. Достижения в области изучения и терапевтического использования стволовых клеток Испанские хирурги провели первую в мире трансплантацию
- 18. Трахея была выращена из стволовых клеток, полученных из костного мозга пациента.
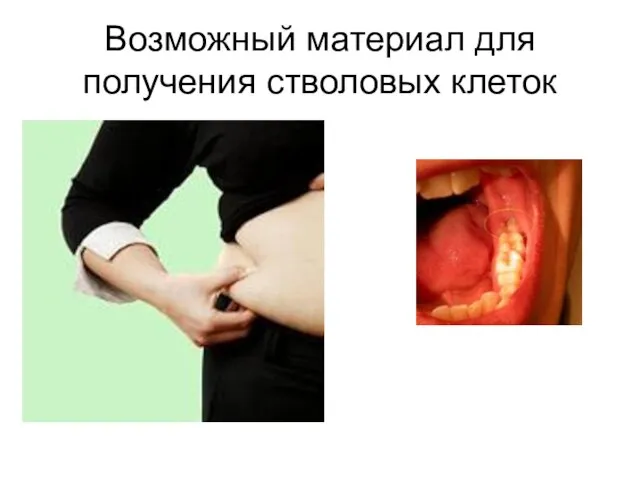
- 19. Возможный материал для получения стволовых клеток
- 20. Создание iPS-клеток iPS-клетки (Induced Pluripotent Stem cells)- индуцированные плюрипотентные стволовые клетки. Основной метод перепрограммирования для получения
- 21. Индуцированные плюрипотентные стволовые клетки впервые были получены командой Шинья Яманака в Университете Киото (Япония) в 2006
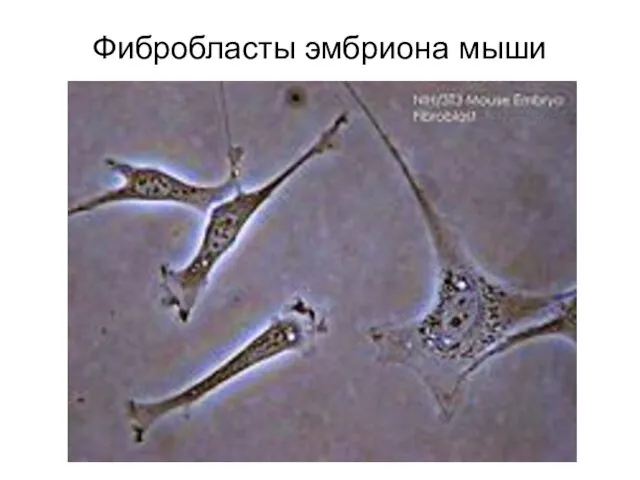
- 22. Фибробласты эмбриона мыши
- 23. Генная инженерия Конструирование рекомбинантных молекул ДНК, внедрение селективных и репортёрных генов; Генетическая паспортизация; Диагностика генетических заболеваний;
- 24. История становления генной инженерии конструирование специальных штаммов кишечной палочки для промышленного производства человеческих гормонов – инсулина
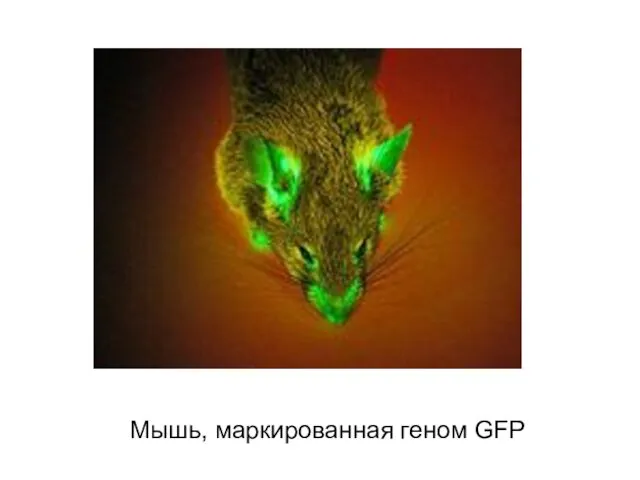
- 25. Мышь, маркированная геном GFP
- 26. Широко используются для прижизненного мечения белков, органелл и клеток генетические флуоресцирующие маркеры типа GFP (зелёные) и
- 27. Зелёный флуоресцентный белок (GFP) впервые был выделен из медуз Aequorea victoria в начале 60-х гг ХХ
- 28. «Светящиеся» ткани у трансгенных кур
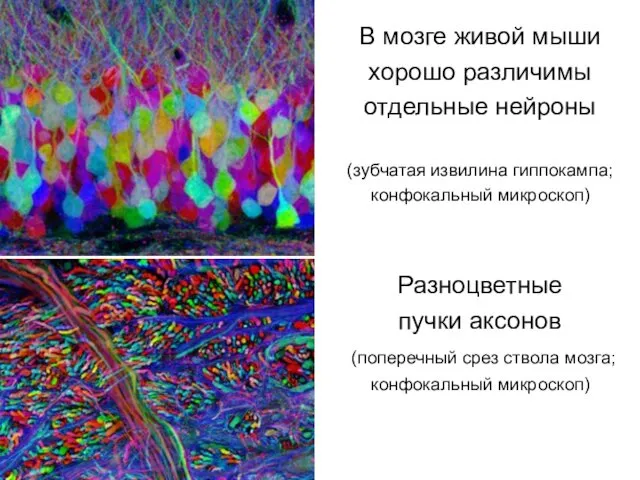
- 29. Мыши с «радужным мозгом» Комбинируя исходные гены (синий, желтый, красный), ученым удалось создать 100-цветную палитру «светящихся»
- 30. В мозге живой мыши хорошо различимы отдельные нейроны (зубчатая извилина гиппокампа; конфокальный микроскоп) Разноцветные пучки аксонов
- 31. «Светящиеся» рыбки данио рерио (GloFish) стали первым общедоступным генетически модифицирован-ным домашним животным.
- 32. Методы введения генов в клетку При помощи векторов (бактериальные плазмиды, вирусы, транспозоны и др.). Прямое введение
- 33. «Генная пушка» Метод биологической баллистики является одним из самых эффективных методов трансформации растений, особенно однодольных (кукуруза,
- 34. Генная пушка
- 35. Введение генов животным Лучшие векторы созданы на основе ретровирусов (вирус лейкоза мышей и др.). Ретровирусы обеспечивают
- 36. Фетальная генотерапия животных Лечение мышей с наследственным дефицитом гормона роста, наследственным дефицитом основного белка миелина и
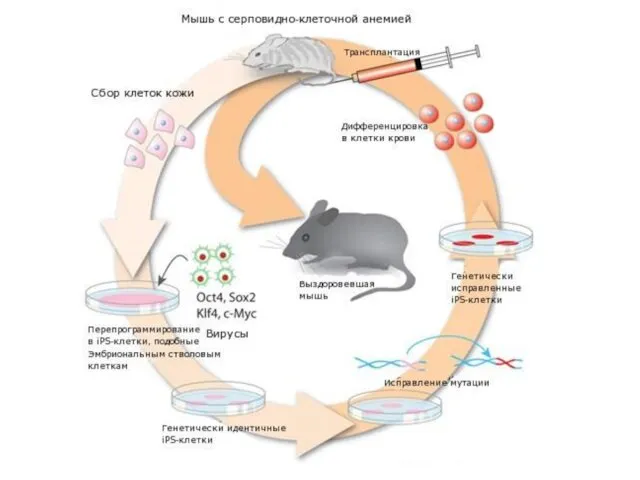
- 37. Соматическая генотерапия животных в 2007 г. мыши, больные человеческой серповидноклеточной анемией, были вылечены с помощью перепрограммированных
- 39. В 2008 г. биологи Гарвардского университета сумели перепрограммировать взрослые клетки в эмбриональные непосредственно в живом организме,
- 40. Успехи генетической инженерии в экспериментах над приматами Доказана возможность «вживления» искусственно модифицированного гена в ткани взрослых
- 41. Саймири в эксперименте по «вживлению» гена «длинноволнового» опсина в сетчатку глаз.
- 43. Через несколько недель после инъекции вектора (аденовируса с встроенным геном длинноволнового опсина) взрослые обезьяны из дальтоников
- 45. Соматическая генотерапия человека Амавроз Лебера - врождённая слепота. Инъекция вектора с геном, кодирующим светочувствительный пигмент, в
- 46. Начало применения генной инженерии в сельском хозяйстве Первые трансгенные растения (растения табака со встроенными генами из
- 47. Первые трансгенные продукты появились в продаже в США в 1994 г. томаты «Flavr Savr» с замедленным
- 48. Трансгенные томаты Переживание бактериоза: слева трансгенное растение томата, справа - обычное
- 49. Трансгенный хлопчатник В 1997 году в Китае начали выращивать трансгенный хлопчатник, в геном которого был вставлен
- 50. Гусеница хлопковой совки (Helicoverpa armigera)
- 51. В 1999 г. трансгенные растения были высажены на общей площади порядка 40 млн. га; В США
- 52. В XXI веке начала развиваться «метаболическая инженерия» - получение организмов, содержащих ценные белки, модифицированные полисахариды, съедобные
- 53. Успехи в выведении трансгенных животных В 1980-х гг. фирма «AquaBounty» (Массачусетс) ввела в икринки атлантического лосося
- 54. Трансгенные рыбы За год трансгенные лососи (а) вырастают в 10 - 11 раз крупнее обычных, тиляпии
- 55. Созданы трансгенные коровы, в молоке которых содержится человеческий белок лактоферрин, необходимый для питания грудных детей, больных
- 56. Трансгенные козы совместный российско-белорусский проект «БелРосТрансген», работа началась в 2002 году; цель проекта - промышленный выпуск
- 57. Лак-1 и Лак-2 (г. Жодино, 2007 г.)
- 58. Потомственный «лактоферриновый» козленок (Жодино, весна 2009 г.)
- 59. Трансгенные овцы В начале 90-х гг. в Институте биологии гена Российской академии наук созданы овцы с
- 60. Трансгенные свиньи В нашей стране были получены свиньи, несущие ген соматотропина (гормона роста). В отличие от
- 61. В 2005 г. фирма «Origen Therapeutics» (Калифорния) в куриных яйцах получила антитела к раку предстательной железы
- 62. В настоящее время биотехнологические продукты составляют около четверти всех товаров в мире.
- 64. Скачать презентацию






















































 Углеводы, липиды
Углеводы, липиды Передвижение веществ в организме растения
Передвижение веществ в организме растения Презентация к уроку биологии 9 кл.
Презентация к уроку биологии 9 кл.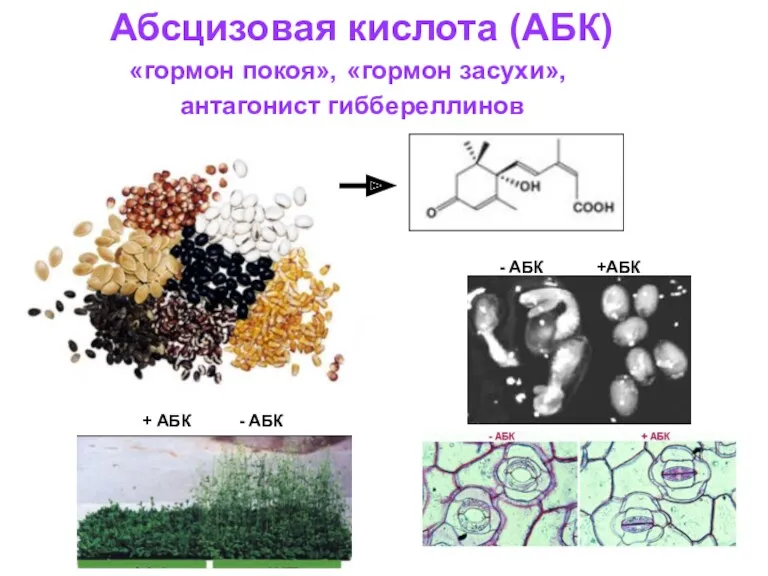 Абсцизовая кислота (АБК) - гормон покоя, гормон засухи, антагонист гиббереллинов
Абсцизовая кислота (АБК) - гормон покоя, гормон засухи, антагонист гиббереллинов Аудіолекція №2. Слуховий та шкірний аналізатори
Аудіолекція №2. Слуховий та шкірний аналізатори Столовые сорта винограда (районированные и перспективные)
Столовые сорта винограда (районированные и перспективные) Функциональные состояния человека. Физиология сна и бодрствования. Активирующие системы мозга
Функциональные состояния человека. Физиология сна и бодрствования. Активирующие системы мозга Дикорастущие растения и цветы
Дикорастущие растения и цветы Nepryamoy_ontogenez
Nepryamoy_ontogenez Бурый медведь
Бурый медведь Сравнительная характеристика клеток растений, животных и грибов. 10 класс
Сравнительная характеристика клеток растений, животных и грибов. 10 класс Тип Кишечнополостные
Тип Кишечнополостные Птахи нашої місцевості
Птахи нашої місцевості Типы кожи
Типы кожи Анатомия венозной системы
Анатомия венозной системы Микробиологическая лаборатория, устройство, оснащение, правила работы. Изучение морфологии бактерий
Микробиологическая лаборатория, устройство, оснащение, правила работы. Изучение морфологии бактерий Cердце
Cердце Чума 20-го века СПИД
Чума 20-го века СПИД Мышцы груди
Мышцы груди Характерные особенности растений семейства Розоцветных, растений семейств Крестоцветных, Пасленовых
Характерные особенности растений семейства Розоцветных, растений семейств Крестоцветных, Пасленовых Майшабақтәрізді балықтарды алуантүрлілігі,систематика ы,сипаттамасы,таралуы, маңызы
Майшабақтәрізді балықтарды алуантүрлілігі,систематика ы,сипаттамасы,таралуы, маңызы Способы размножения животных
Способы размножения животных Микроорганизмдер, антибиотиктер және биологиялық активті заттарды түзушілер
Микроорганизмдер, антибиотиктер және биологиялық активті заттарды түзушілер Обмен углеводов
Обмен углеводов Покровные и проводящие растительные ткани
Покровные и проводящие растительные ткани Строение и жизненные циклы червей класса cestoda
Строение и жизненные циклы червей класса cestoda Дальневосточный леопард
Дальневосточный леопард Внутренняя среда организма. Кровь, тканевая жидкость и лимфа
Внутренняя среда организма. Кровь, тканевая жидкость и лимфа