Содержание
- 2. Основные пути биотрансформации чужеродных соединений. 1. Окисление: а) микросомальное – алифатичекое или ароматическое гидроксилирование, – эпоксидирование,
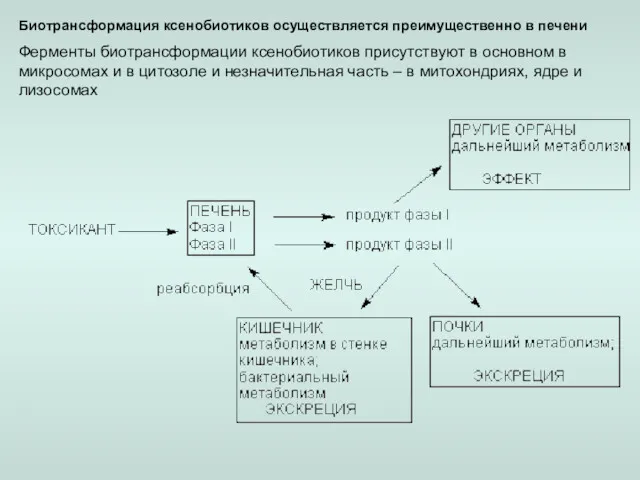
- 3. Биотрансформация ксенобиотиков осуществляется преимущественно в печени Ферменты биотрансформации ксенобиотиков присутствуют в основном в микросомах и в
- 4. Ферментативные реакции 1-й фазы биотрансформации ксенобиотиков карбоксилэстераза, ацетилхолинэстераза псевдохолинэстераза эпоксидная гидролаза 1. Гидролиз при биотрансформации X
- 5. 2. Восстановление при биотрансформации Некоторые металлы альдегиды, кетоны, дисульфиды, сульфоксиды, хиноны, алкены, азо- и нитросоединеня Коферменты
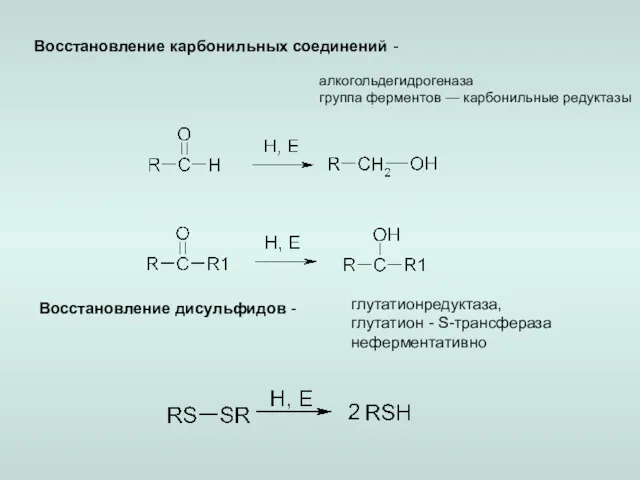
- 6. Восстановление карбонильных соединений - алкогольдегидрогеназа группа ферментов — карбонильные редуктазы Восстановление дисульфидов - глутатионредуктаза, глутатион -
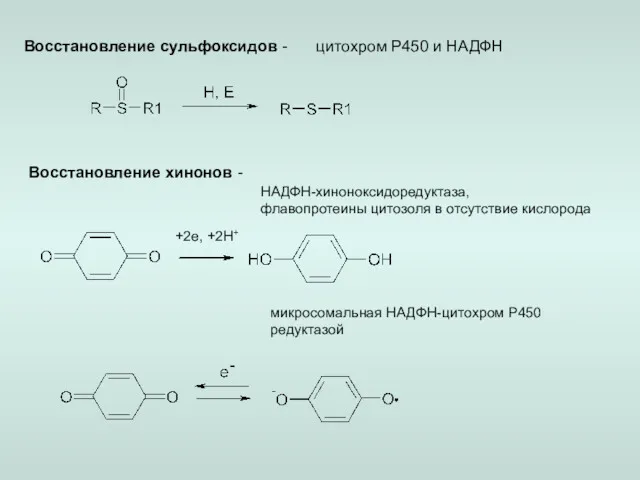
- 7. Восстановление сульфоксидов - цитохром Р450 и НАДФН Восстановление хинонов - +2e, +2H+ НАДФН-хиноноксидоредуктаза, флавопротеины цитозоля в
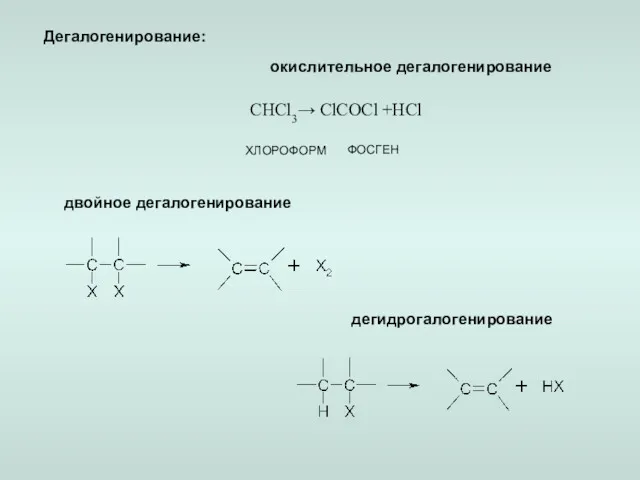
- 8. Дегалогенирование: окислительное дегалогенирование двойное дегалогенирование дегидрогалогенирование ХЛОРОФОРМ ФОСГЕН CHCl3→ ClCOCl +HCl
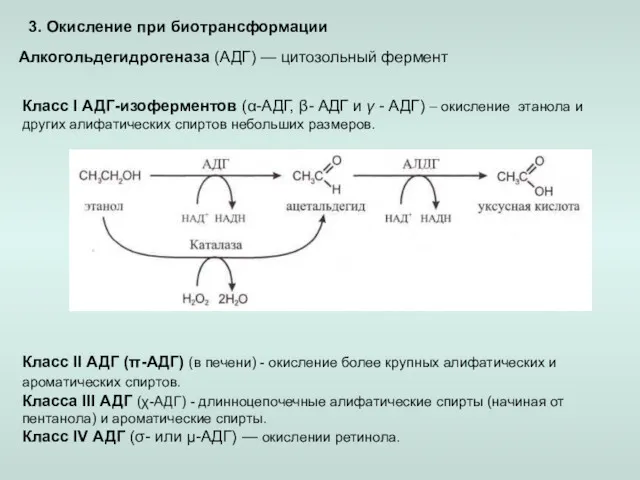
- 9. 3. Окисление при биотрансформации Алкогольдегидрогеназа (АДГ) — цитозольный фермент Класс I АДГ-изоферментов (α-АДГ, β- АДГ и
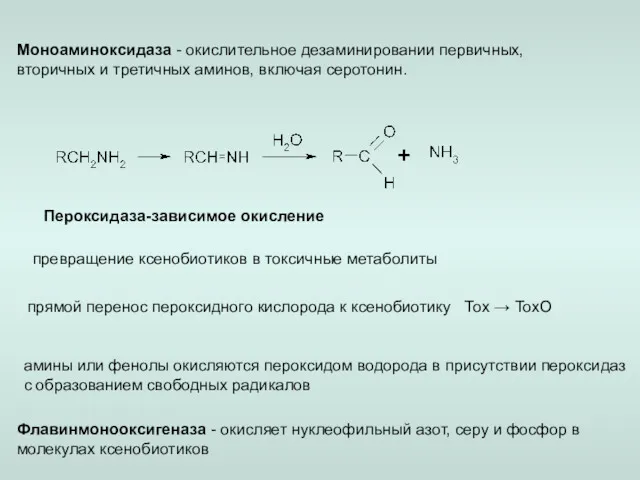
- 10. Альдегид-дегидрогеназа (АЛДГ) - окислении альдегидов до карбоновых кислот (кофактор НАД+). Дигидродиолдегидрогеназа - окисление полициклических ароматических углеводородов.
- 11. Пероксидаза-зависимое окисление превращение ксенобиотиков в токсичные метаболиты прямой перенос пероксидного кислорода к ксенобиотику Тох → ТохО
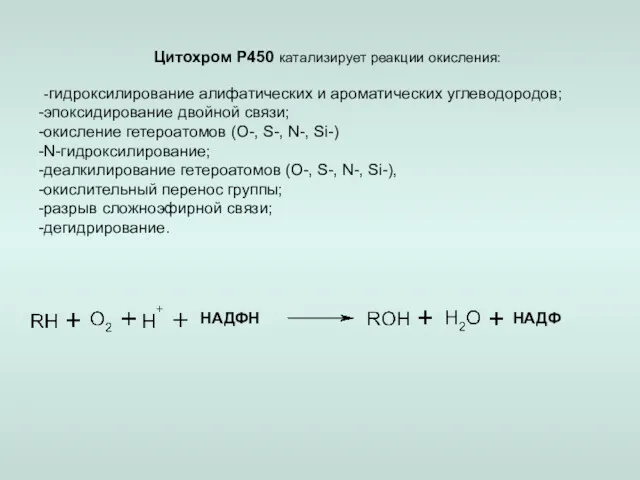
- 12. Цитохром Р450 катализирует реакции окисления: -гидроксилирование алифатических и ароматических углеводородов; эпоксидирование двойной связи; окисление гетероатомов (О-,
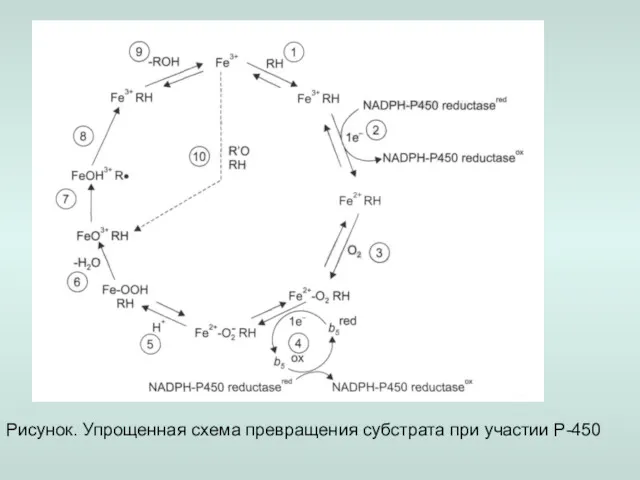
- 13. Рисунок. Упрощенная схема превращения субстрата при участии Р-450
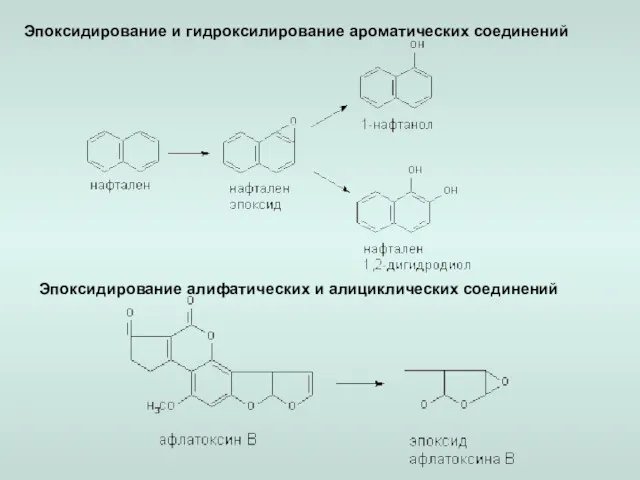
- 14. Эпоксидирование и гидроксилирование ароматических соединений Эпоксидирование алифатических и алициклических соединений
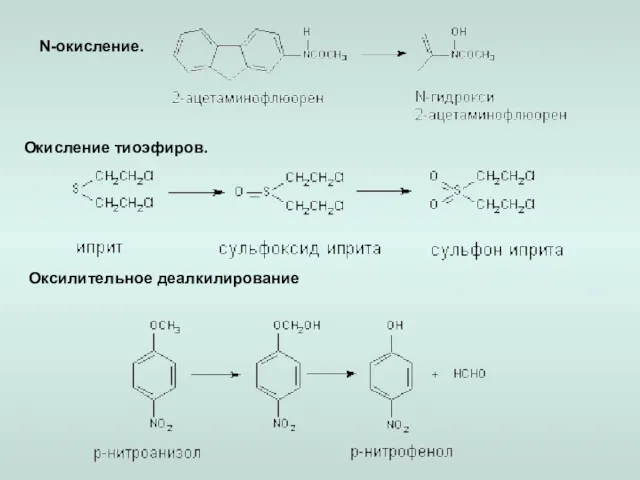
- 15. N-окисление. Оксилительное деалкилирование Окисление тиоэфиров.
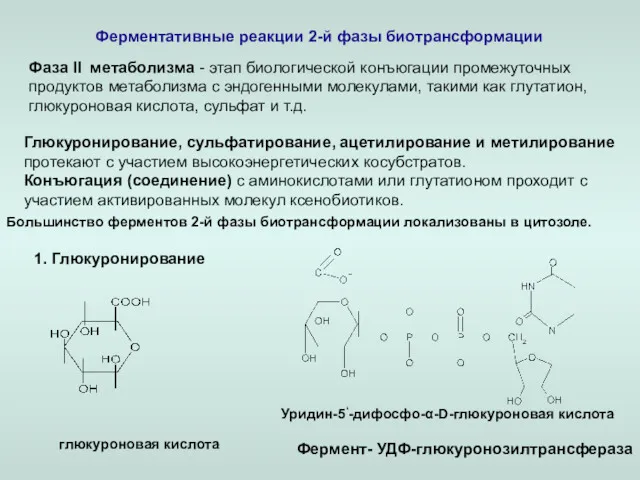
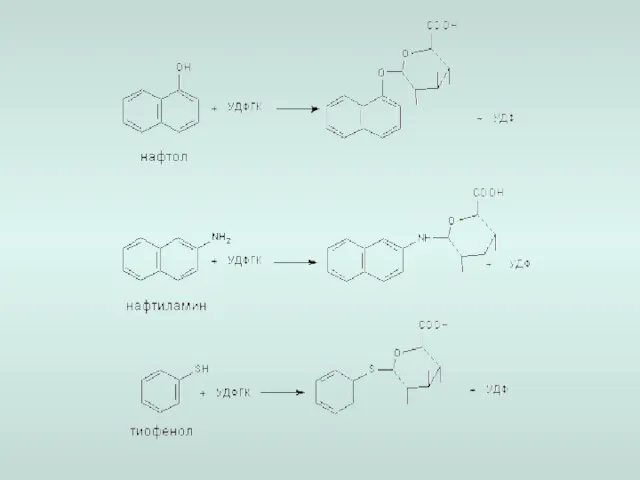
- 16. Ферментативные реакции 2-й фазы биотрансформации Фаза ll метаболизма - этап биологической конъюгации промежуточных продуктов метаболизма с
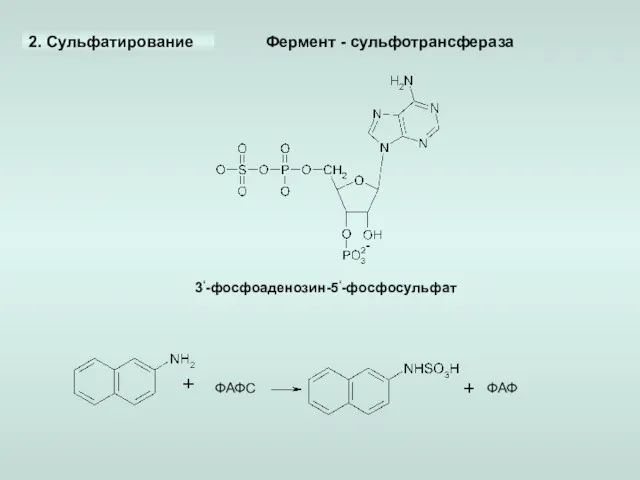
- 18. 2. Сульфатирование 3‘-фосфоаденозин-5‘-фосфосульфат ФАФС ФАФ Фермент - сульфотрансфераза
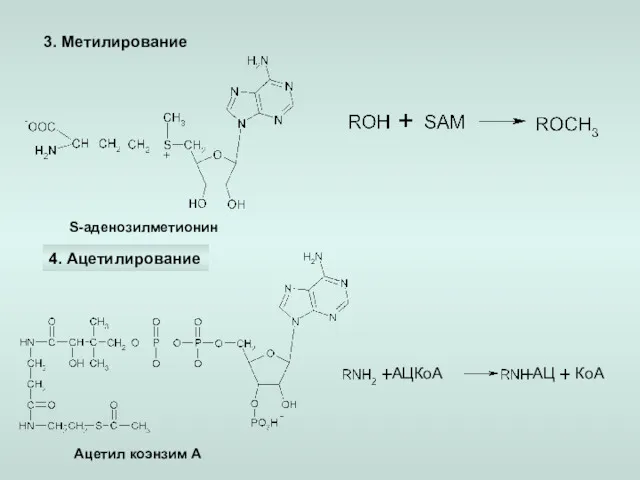
- 19. 3. Метилирование 4. Ацетилирование S-аденозилметионин Ацетил коэнзим А КоА АЦКоА -АЦ
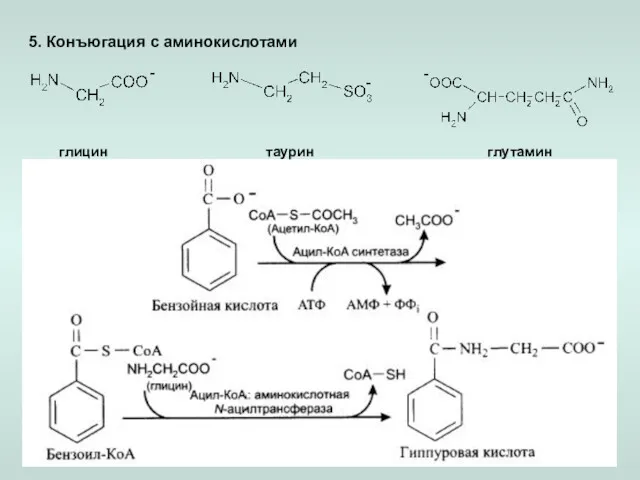
- 20. 5. Конъюгация с аминокислотами глицин таурин глутамин
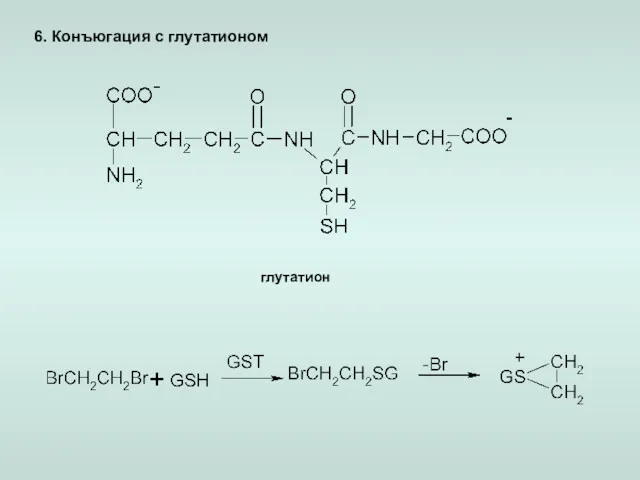
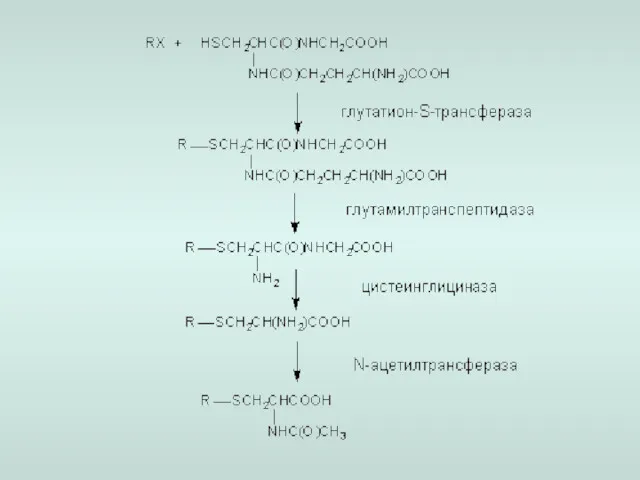
- 21. 6. Конъюгация с глутатионом глутатион
- 24. Скачать презентацию




 Будова рослинної і тваринної клітини
Будова рослинної і тваринної клітини Эволюция выделительной системы беспозвоночных
Эволюция выделительной системы беспозвоночных Эндокринная система: железы внешней, внутренней и смешанной секреции
Эндокринная система: железы внешней, внутренней и смешанной секреции Введение в медицинскую биологию. Структурно-функциональная организация клетки. (Лекция 1)
Введение в медицинскую биологию. Структурно-функциональная организация клетки. (Лекция 1) Механизм мышечного сокращения
Механизм мышечного сокращения Природный комплекс. Природные зоны
Природный комплекс. Природные зоны Мышцы шеи
Мышцы шеи Ядро. Строение ядра. Хромосомный набор клетки
Ядро. Строение ядра. Хромосомный набор клетки Урок 8 класса с учетом новых ФГОС
Урок 8 класса с учетом новых ФГОС Жүрек артерияларының вариантты анатомиясы, практикалық маңызы. Перикард және оның туындылары
Жүрек артерияларының вариантты анатомиясы, практикалық маңызы. Перикард және оның туындылары Парнокопытные и непарнокопытные животные
Парнокопытные и непарнокопытные животные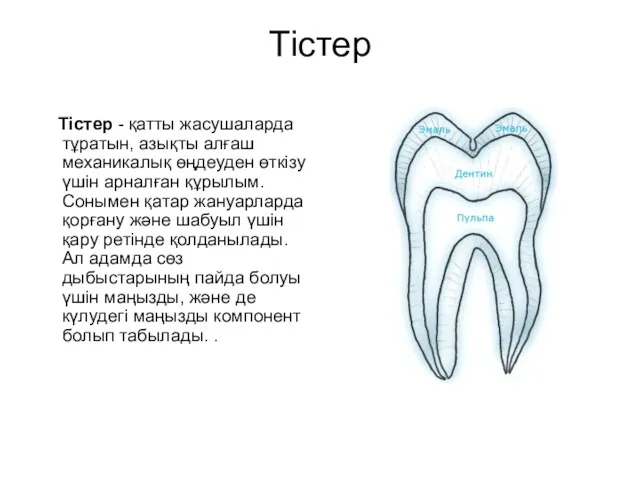 Тістер. Сүт тістер
Тістер. Сүт тістер Смешанные респираторные инфекции телят в ООО Центр-АгроИнвест
Смешанные респираторные инфекции телят в ООО Центр-АгроИнвест Водоросли. 6 класс
Водоросли. 6 класс Характеристика БГЦ
Характеристика БГЦ Строение и работа сердца
Строение и работа сердца Одомашненные животные
Одомашненные животные Круговорот кислорода в природе
Круговорот кислорода в природе Дикорастущие съедобные растения окрестностей деревни Бобылевские Выселки. Мини-атлас
Дикорастущие съедобные растения окрестностей деревни Бобылевские Выселки. Мини-атлас Игра Кто хочет стать отличником. Отборочный тур
Игра Кто хочет стать отличником. Отборочный тур О грибах и насекомых, о болезнях и повреждениях деревьев и кустарников в лесу и в городе
О грибах и насекомых, о болезнях и повреждениях деревьев и кустарников в лесу и в городе 20231111_organ_zreniya
20231111_organ_zreniya Растительные ткани
Растительные ткани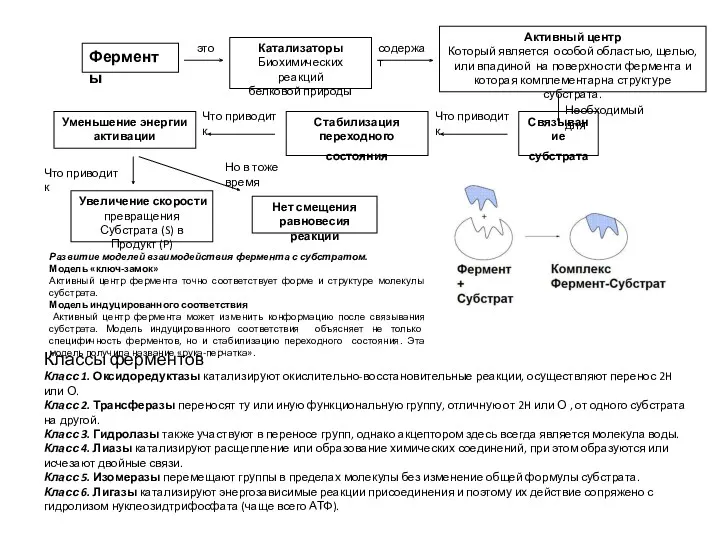 Ферменты. Тема 2.1
Ферменты. Тема 2.1 Ядовитые растения
Ядовитые растения Компоненты центральной нервной системы
Компоненты центральной нервной системы Проект на тему Кошки
Проект на тему Кошки Протеобактерии
Протеобактерии