Содержание
- 2. 10/25/2022
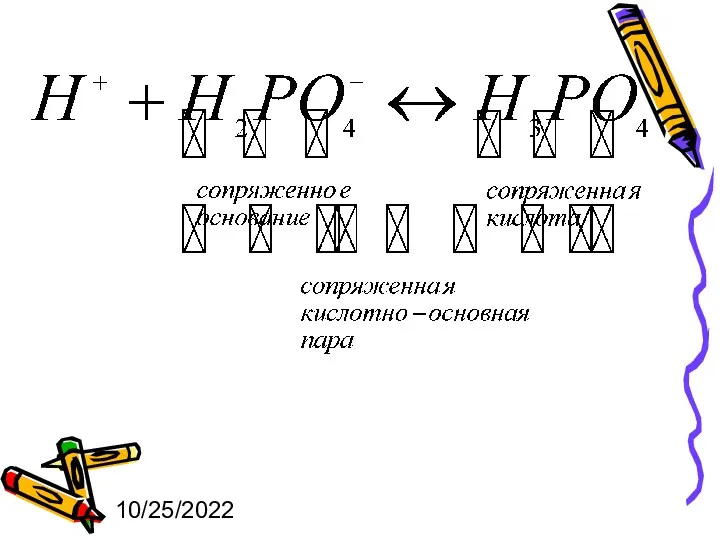
- 3. 10/25/2022 Буферный раствор – это раствор, содержащий сопряженную кислотно-основную пару (буферную систему), способную поддерживать практически постоянное
- 4. 10/25/2022 Классификация буферных растворов: 1. слабая кислота и ее соль - кислотная буферная система (СН3СООН+СН3СООNa, H2CO3+KHCO3)
- 5. 10/25/2022 3. кислая и средняя соли или две кислых соли - относят к кислотным буферным системам
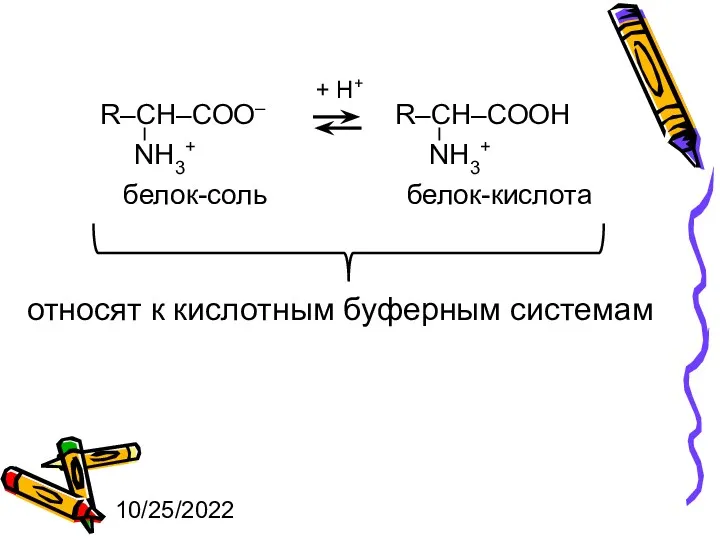
- 6. 10/25/2022 + Н+ белок-соль белок-кислота относят к кислотным буферным системам
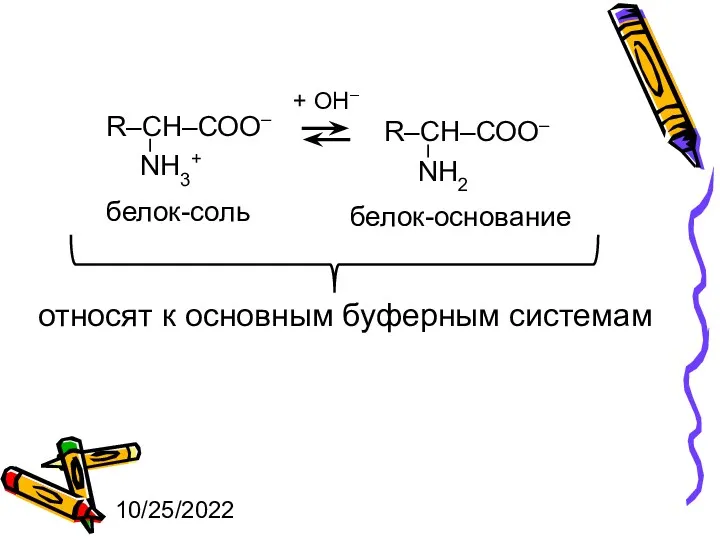
- 7. 10/25/2022 + ОН– белок-соль белок-основание относят к основным буферным системам
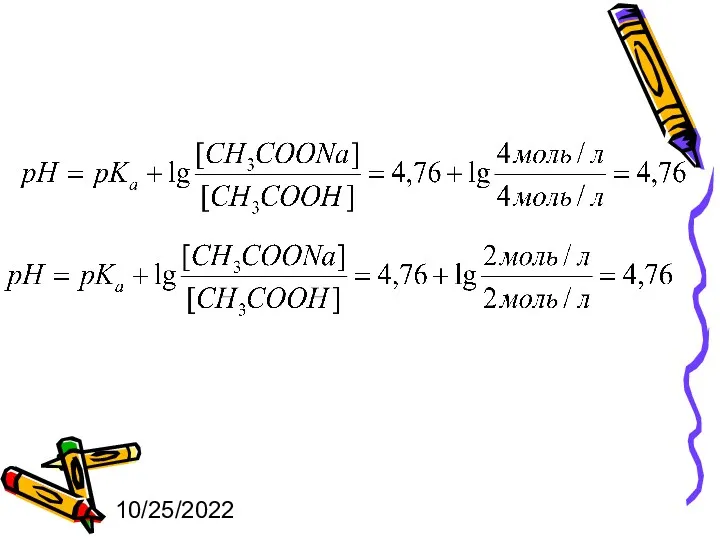
- 8. 10/25/2022 Расчет рН буферных растворов производят по уравнению Гендерсона-Гассельбаха
- 9. 10/25/2022 для кислотных буферных растворов:
- 10. 10/25/2022 где – показатель константы диссоциации кислоты , [соли] и [кислоты] – молярные равновесные концентрации соли
- 11. 10/25/2022 для основных буферных растворов:
- 12. 10/25/2022 где – показатель константы диссоциации кислоты , [соли] и [осн] – молярные равновесные концентрации соли
- 13. 10/25/2022 Буферные растворы, состоящие из двух солей, одна из которых (более кислая) выполняет роль сопряженной кислоты,
- 14. 10/25/2022 При разбавлении буферных растворов концентрации всех компонентов уменьшаются, но их соотношение остается прежним, поэтому согласно
- 15. 10/25/2022
- 16. 10/25/2022 Расчет рН при добавлении кислоты HAn: в кислотной буферной системе: в основной буферной системе:
- 17. 10/25/2022 Расчет рН при добавлении щелочи: в кислотной буферной системе: в основной буферной системе:
- 18. 10/25/2022 При добавлении небольшого количества кислоты, выделившиеся ионы водорода связываются сопряженным основанием буферной системы, при добавлении
- 19. 10/25/2022 при добавлении небольшого количества соляной кислоты к ацетатному буферному раствору ионы водорода связываются ацетат-ионами, образовавшимися
- 20. 10/25/2022 концентрация ацетата натрия уменьшается, а концентрация уксусной кислоты увеличивается, соотношение концентраций компонентов изменяется, но для
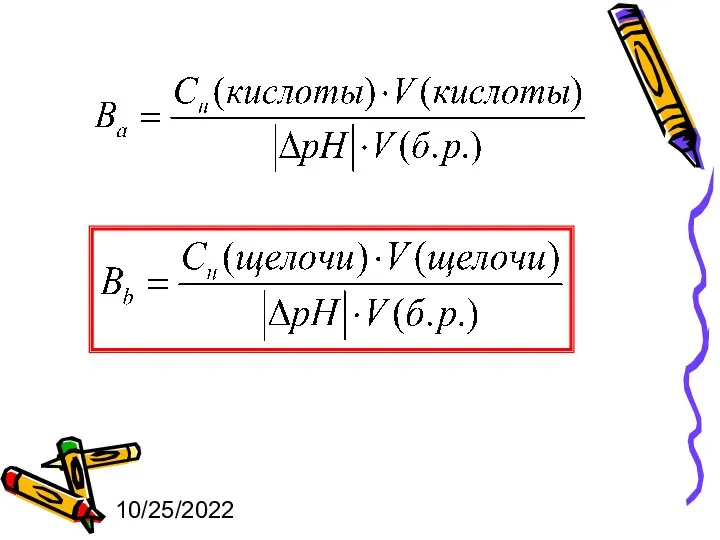
- 21. 10/25/2022 Число моль-эквивалентов сильной кислоты или щелочи, которое нужно добавить к 1 литру буферного раствора, чтобы
- 22. 10/25/2022
- 23. 10/25/2022 CН(кислоты) и CН(щелочи) – эквивалентные концентрации кислоты и щелочи соответственно; V(кислоты) и V(щелочи) – объемы
- 24. 10/25/2022 Буферная емкость зависит от: концентраций компонентов соотношения концентраций компонентов Максимального значения буферная емкость достигает при
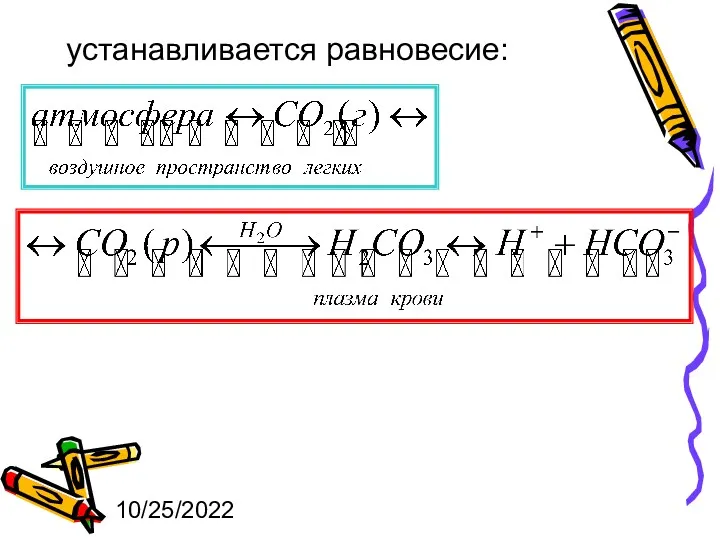
- 25. 10/25/2022 Кислотно-основный гомеостаз в организме обеспечивается несколькими буферными системами. 1. Гидрокарбонатная (бикарбонатная, водородкарбонатная) буферная система состоит
- 26. 10/25/2022 устанавливается равновесие:
- 27. 10/25/2022 Уравнение Гендерсона-Гассельбаха или рН=6,36+lg[НСО3–] – lg р(СО2), где р(СО2) – парциальное давление СО2 в альвеолах
- 28. 10/25/2022 - основная буферная система плазмы крови, обеспечивает ≈ 55 % от всей буферной емкости крови.
- 29. 10/25/2022 Гидрофосфатная буферная система в клетках представлена К2HPO4 и KH2PO4, а в плазме крови и в
- 30. 10/25/2022 Буферная емкость по кислоте больше, чем по основанию. Избыточные компоненты гидрофосфатной буферной системы выводятся почками,
- 31. 10/25/2022 Гемоглобиновая буферная система содержится в эритроцитах, представляет собой две сопряженные кислотно-основные пары: гемоглобин HHb и
- 32. 10/25/2022 Механизм действия этой системы основан на реакциях: HHb ↔ H+ + Hb– H+ + HbO2–
- 33. 10/25/2022 играет значительную роль в процессах дыхания, транспорта кислорода в ткани и поддержании постоянства рН внутри
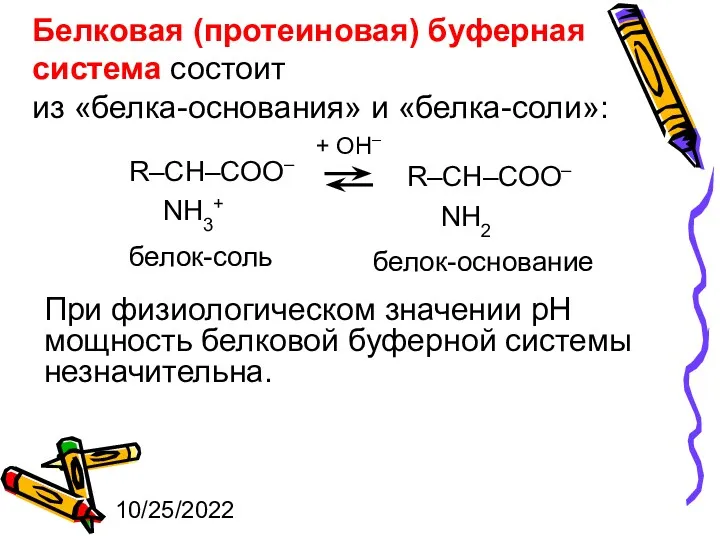
- 34. 10/25/2022 Белковая (протеиновая) буферная система состоит из «белка-основания» и «белка-соли»: + ОН– белок-соль белок-основание При физиологическом
- 35. 10/25/2022 Все буферные системы в организме взаимосвязаны и для всех них буферная емкость по кислоте больше,
- 36. 10/25/2022 Важным показателем для физиологических сред является кислотная буферная ёмкость. При различных заболеваниях, отравлениях, голодании и
- 37. 10/25/2022 Ацидоз – это уменьшение кислотной буферной ёмкости физиологической системы по сравнению с нормой и, как
- 38. 10/25/2022 Алкалоз – это увеличение кислотной буферной ёмкости физиологической системы по сравнению с нормой и, как
- 39. 10/25/2022 Ацидоз или алкалоз могут быть вызваны нарушением процессов дыхания (респираторный ацидоз или алкалоз) или процессов
- 40. 10/25/2022 при недостатке О2 или избытке СО2 в атмосфере, равновесие сдвигается вправо, появляется избыток Н+ в
- 42. Скачать презентацию





![10/25/2022 где – показатель константы диссоциации кислоты , [соли] и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/235880/slide-9.jpg)

![10/25/2022 где – показатель константы диссоциации кислоты , [соли] и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/235880/slide-11.jpg)











![10/25/2022 Уравнение Гендерсона-Гассельбаха или рН=6,36+lg[НСО3–] – lg р(СО2), где р(СО2)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/235880/slide-26.jpg)












 Физиология пищевода
Физиология пищевода презентация к уроку Органические молекулы - углеводы
презентация к уроку Органические молекулы - углеводы Единый государственный экзамен по биологии. Содержательные блоки курса биология
Единый государственный экзамен по биологии. Содержательные блоки курса биология Витамины. Какие манипуляции с продуктами позволяют сохранить в них витамины
Витамины. Какие манипуляции с продуктами позволяют сохранить в них витамины презентация на тему:Удивительные животные
презентация на тему:Удивительные животные Презентация Здоровье – ключ к успеху
Презентация Здоровье – ключ к успеху Презентация к уроку биологии в 8 классе транспортные системы организма
Презентация к уроку биологии в 8 классе транспортные системы организма Влияние сельского хозяйства на биосферу
Влияние сельского хозяйства на биосферу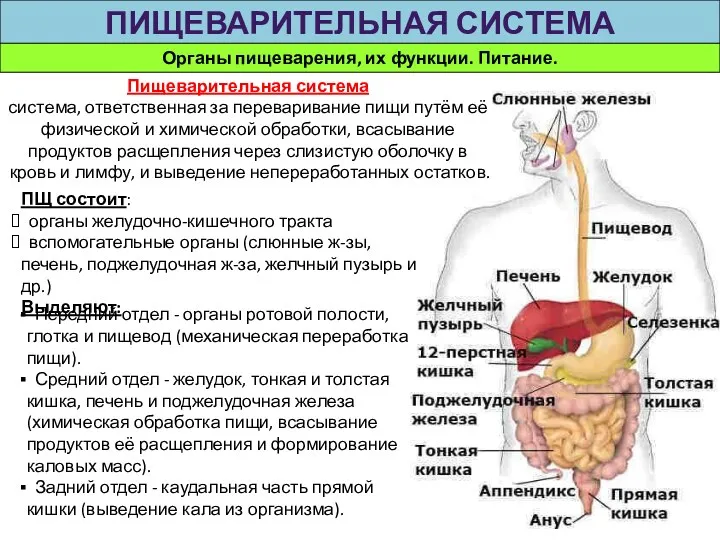 Органы пищеварения, их функции. Питание. Пищеварительная система
Органы пищеварения, их функции. Питание. Пищеварительная система Анатомия органа зрения
Анатомия органа зрения Северный олень
Северный олень Электромагниттік толқындардың адам ағзасына тигізер әсері
Электромагниттік толқындардың адам ағзасына тигізер әсері Половое размножение животных
Половое размножение животных Вредные привычки: курение
Вредные привычки: курение История коневодства в России
История коневодства в России Днқ репликациясы
Днқ репликациясы Мичурин Иван Владимирович
Мичурин Иван Владимирович Обмен веществ
Обмен веществ Целебное лукошко
Целебное лукошко Отряд неполнозубые (edentata)
Отряд неполнозубые (edentata) Неорганические соединения. Вода. Роль воды в клетке
Неорганические соединения. Вода. Роль воды в клетке Биологическое разнообразие
Биологическое разнообразие Витамины. Авитаминоз. Гиповитаминоз. Гипервитаминоз
Витамины. Авитаминоз. Гиповитаминоз. Гипервитаминоз Балықтардың қосымша тыныс алу мүшелері, олардың құрылысы мен тыныс алуда атқаратын орны
Балықтардың қосымша тыныс алу мүшелері, олардың құрылысы мен тыныс алуда атқаратын орны Патогенные грибы
Патогенные грибы Декоративные растения в интерьере
Декоративные растения в интерьере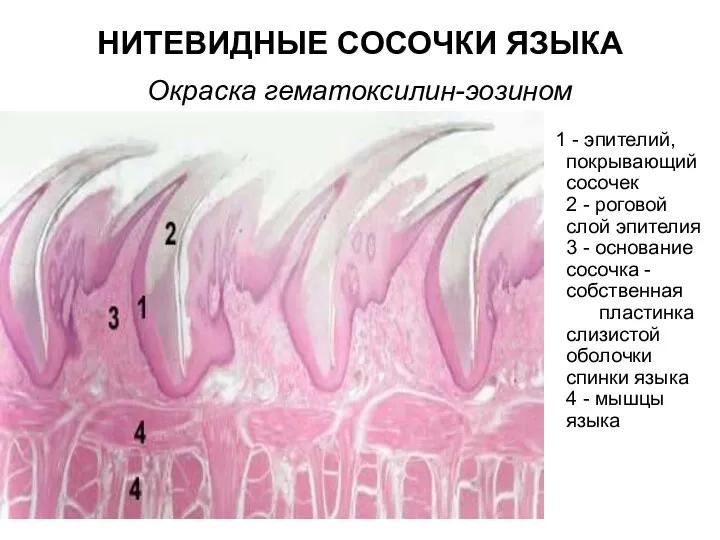 Нитевидные сосочки языка. Окраска гематоксилин-эозином
Нитевидные сосочки языка. Окраска гематоксилин-эозином Белки плазмы крови
Белки плазмы крови