Содержание
- 2. План ДНК – это… Смысл генетического кода Строение ДНК Синтез НК Свойства ДНК Прокариоты Эукариоты Удвоение
- 3. ДНК. Смысл Эволюция отбирает наиболее успешные гены. Гены существуют коллективом – генотипом. Вокруг которого, как правило,
- 4. ДНК. Строение Исторически сначала было выведено правило Чаргаффа (1950), но интерпретация была дана только Уотсоном и
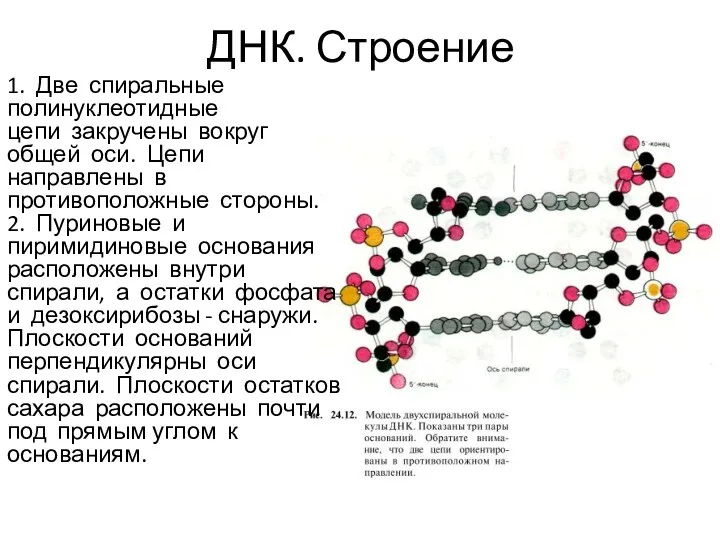
- 5. ДНК. Строение 1. Две спиральные полинуклеотидные цепи закручены вокруг общей оси. Цепи направлены в противоположные стороны.
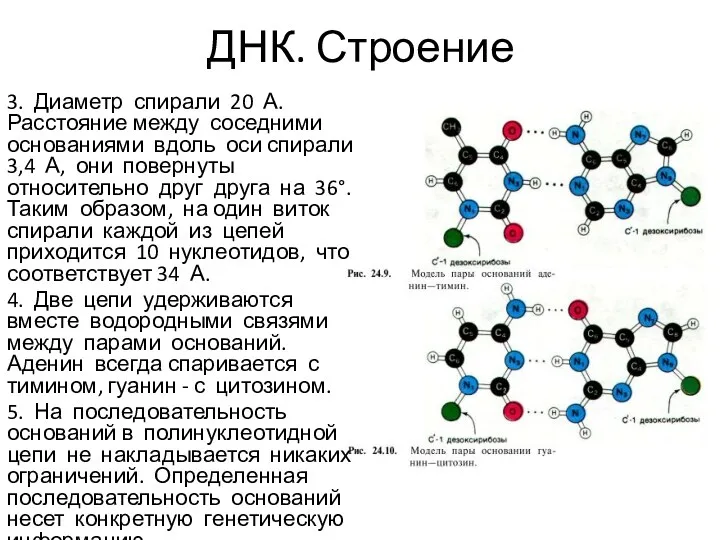
- 6. ДНК. Строение 3. Диаметр спирали 20 А. Расстояние между соседними основаниями вдоль оси спирали 3,4 А,
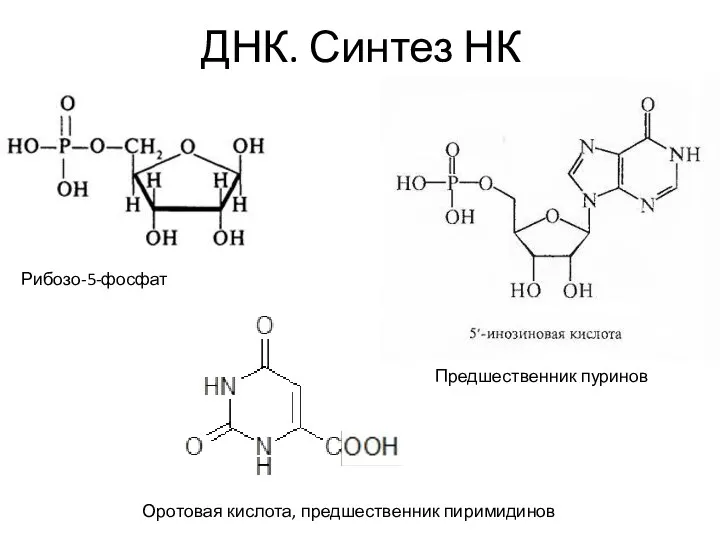
- 7. ДНК. Синтез НК Синтез пуриновых и пиримидиновых нуклеотидов происходит на основе рибозо-5-фосфата. Синтез путём присоединения глицина,
- 8. ДНК. Синтез НК Рибозо-5-фосфат Предшественник пуринов Оротовая кислота, предшественник пиримидинов
- 9. ДНК. Свойства Прокариоты ЕО работает на адекватности адаптации к ситуации. Для быстрого изменения поведения клетке необходим
- 10. ДНК. Свойства Прокариоты Регуляция экспрессии осуществляется: Различными сигма-субъединицами (специфическая часть ДНК-зависимой РНК-полимеразы, отвечающая за распознавание промоторов
- 11. ДНК. Свойства Сигма-субъединицы отвечают за распознавание особой области – промотора – некодирующей регуляторной области, состоящей из
- 12. ДНК. Свойства Транскрипционные факторы – регуляторы экспрессии генов (как активаторы, так и репрессоры) в зависимости от
- 13. ДНК. Свойства Топографическая регуляция – стерический процесс, основанный на недоступности тех или иных участков ДНК для
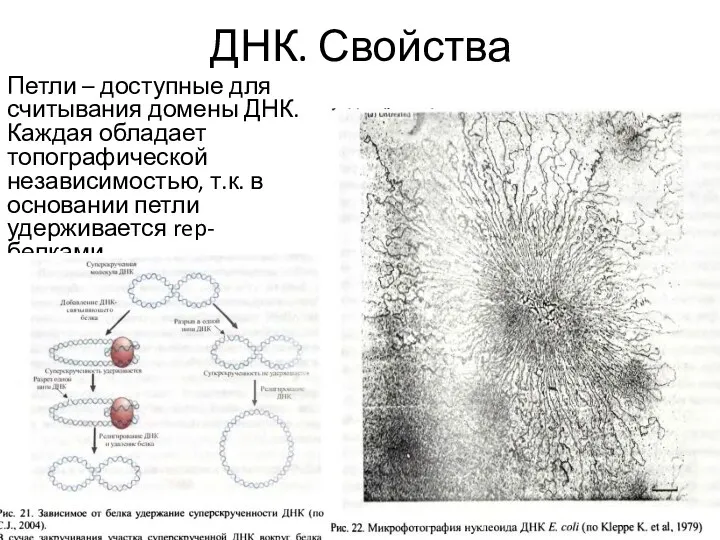
- 14. ДНК. Свойства Петли – доступные для считывания домены ДНК. Каждая обладает топографической независимостью, т.к. в основании
- 15. ДНК. Свойства Эукариоты Для эукариот возможно создание наследуемых экспрессионных профилей путём метилирования участков ДНК. Так же
- 16. ДНК. Репликация Я нарисоваль!
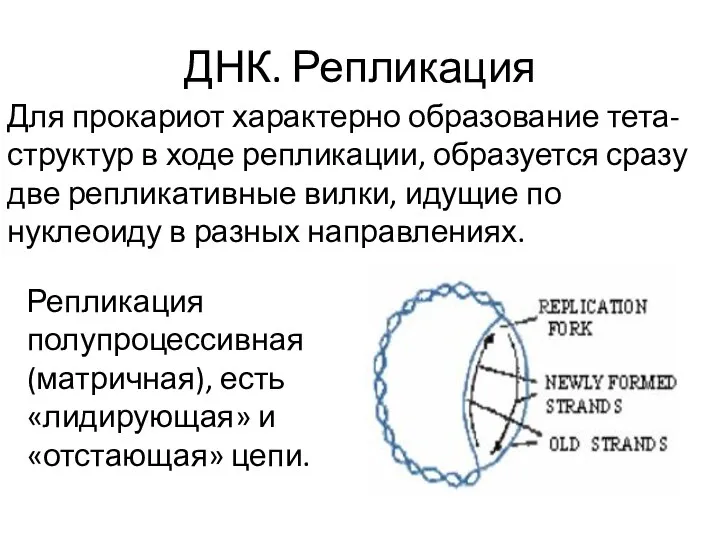
- 17. ДНК. Репликация Для прокариот характерно образование тета-структур в ходе репликации, образуется сразу две репликативные вилки, идущие
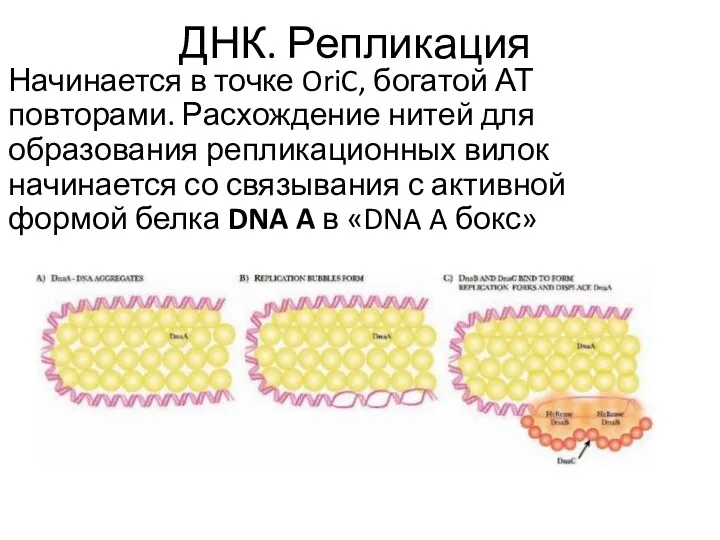
- 18. ДНК. Репликация Начинается в точке OriC, богатой АТ повторами. Расхождение нитей для образования репликационных вилок начинается
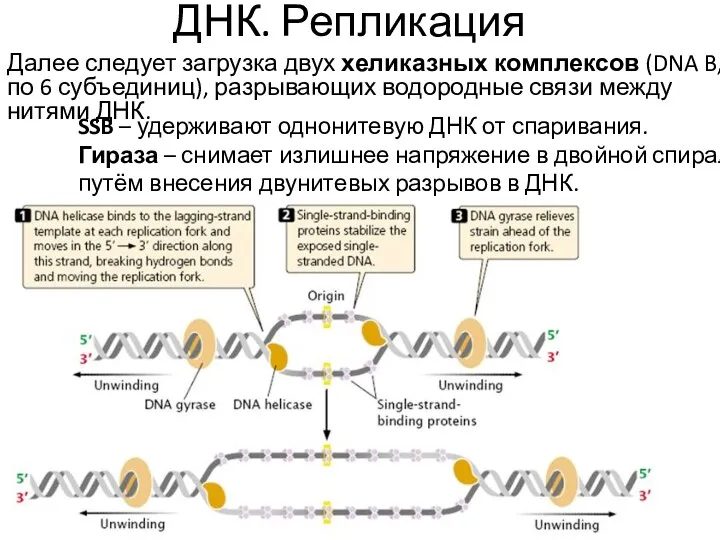
- 19. ДНК. Репликация Далее следует загрузка двух хеликазных комплексов (DNA B, по 6 субъединиц), разрывающих водородные связи
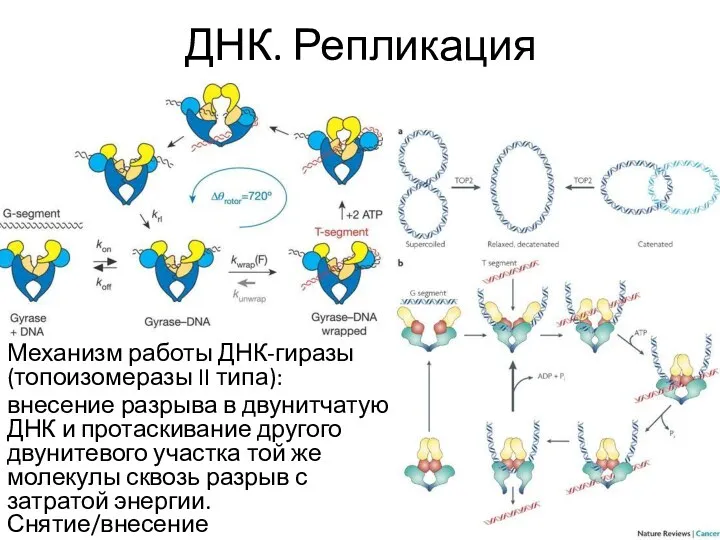
- 20. ДНК. Репликация Механизм работы ДНК-гиразы (топоизомеразы II типа): внесение разрыва в двунитчатую ДНК и протаскивание другого
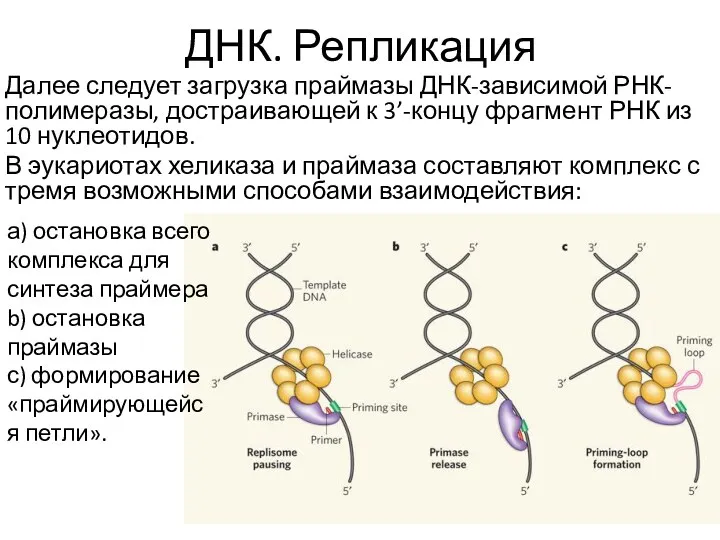
- 21. ДНК. Репликация Далее следует загрузка праймазы ДНК-зависимой РНК-полимеразы, достраивающей к 3’-концу фрагмент РНК из 10 нуклеотидов.
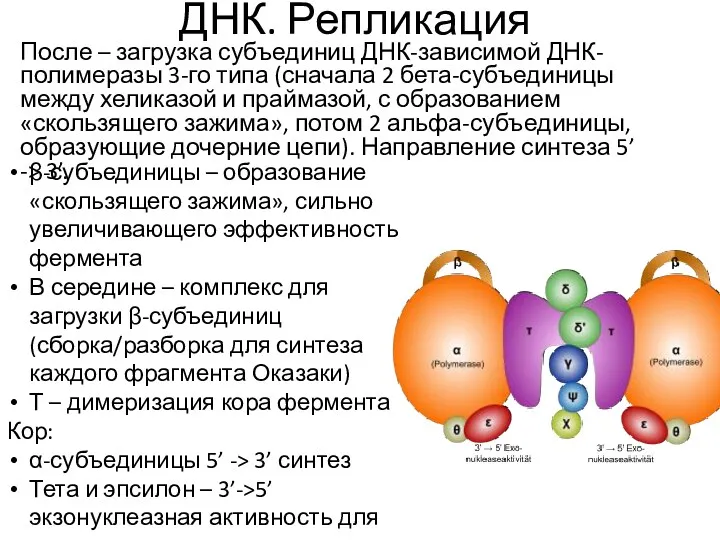
- 22. ДНК. Репликация После – загрузка субъединиц ДНК-зависимой ДНК-полимеразы 3-го типа (сначала 2 бета-субъединицы между хеликазой и
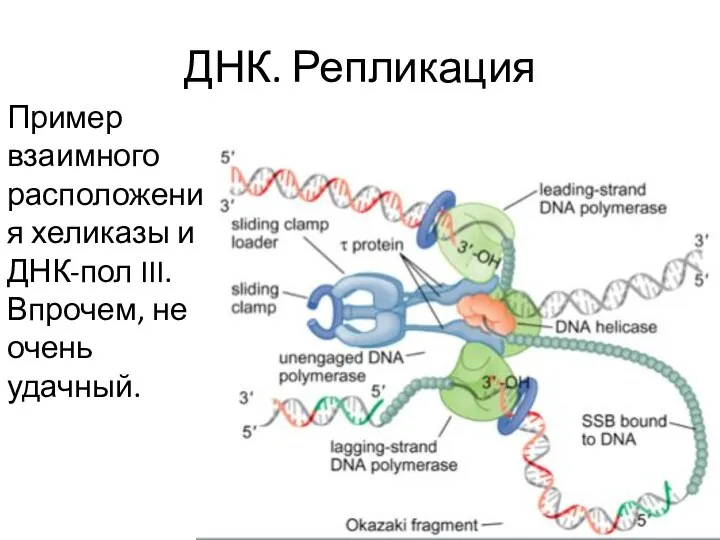
- 23. ДНК. Репликация Пример взаимного расположения хеликазы и ДНК-пол III. Впрочем, не очень удачный.
- 24. ДНК. Репликация На отстающей цепи направление синтеза то же, синтезируются фрагменты по 1000 п.н. (фрагменты Оказаки):
- 25. ДНК. Репликация Загрузка DNA A в Ori C Образование репл «глазка» Загрузка 2 коплексов хеликаз SSB
- 26. ДНК. Репарация Участвующие ферменты (задействованы так же в репликации ДНК): Хеликаза, (разрыв водородных связей, расхождение нитей);
- 27. ДНК. Репарация Типы: Прямая – непосредственное воздействие ферментов (навроде снятия метилирования); Эксцизионная – специфическое узнавание повреждённых
- 28. Нобелевскую премию по химии за 2015 год получат швед Томас Линдал (Tomas Lindahl), американец Пол Модрич
- 30. Скачать презентацию
















 Семейство Розоцветные – Rosaceae
Семейство Розоцветные – Rosaceae Строение клетки. Интегрированный урок (биология + информатика) в 9 классе
Строение клетки. Интегрированный урок (биология + информатика) в 9 классе Белки плазмы крови
Белки плазмы крови Нуклеиновые кислоты. ДНК, РНК
Нуклеиновые кислоты. ДНК, РНК презентация к уроку биологии по теме Клетка
презентация к уроку биологии по теме Клетка Микробиология, как наука. Основные методы микробиологических исследований
Микробиология, как наука. Основные методы микробиологических исследований Физиология сна. Эмоции и Мотивации
Физиология сна. Эмоции и Мотивации Презентация по теме: Развитие эволюционного учения
Презентация по теме: Развитие эволюционного учения Черепные нервы
Черепные нервы Презентация Строение и функции спинного мозга
Презентация Строение и функции спинного мозга Поле и его обитатели
Поле и его обитатели Класс земноводные
Класс земноводные Кустарники леса. (2 класс)
Кустарники леса. (2 класс) Генетическая информация. Центральная догма молекулярной биологии
Генетическая информация. Центральная догма молекулярной биологии Расовое многообразие человечества. Концепции расоведения. (Тема 5.2)
Расовое многообразие человечества. Концепции расоведения. (Тема 5.2) Микроскопические частицы вирусы
Микроскопические частицы вирусы Класс птицы
Класс птицы Гипотезы возникновения жизни на планете Земля
Гипотезы возникновения жизни на планете Земля Закономерности роста и развития различных периодов онтогенеза
Закономерности роста и развития различных периодов онтогенеза Бидайдың морфологиясы
Бидайдың морфологиясы Новейшие системы хранения и транспортировки плодов, ягод и овощей с использованием препарата ФИТОМАГ
Новейшие системы хранения и транспортировки плодов, ягод и овощей с использованием препарата ФИТОМАГ Роль соли для организма человека
Роль соли для организма человека Загрязнение окружающей среды. Воздействие последствий на человека
Загрязнение окружающей среды. Воздействие последствий на человека Необычное в природе
Необычное в природе Пезентация.
Пезентация. Презентация к уроку Движение крови по сосудам
Презентация к уроку Движение крови по сосудам История развития эволюционных идей. 11 класс. Урок 1
История развития эволюционных идей. 11 класс. Урок 1 Методы исследования клетки
Методы исследования клетки