Содержание
- 2. Один геном – разные протеомы Основа жизни – это белки и их взаимодействия
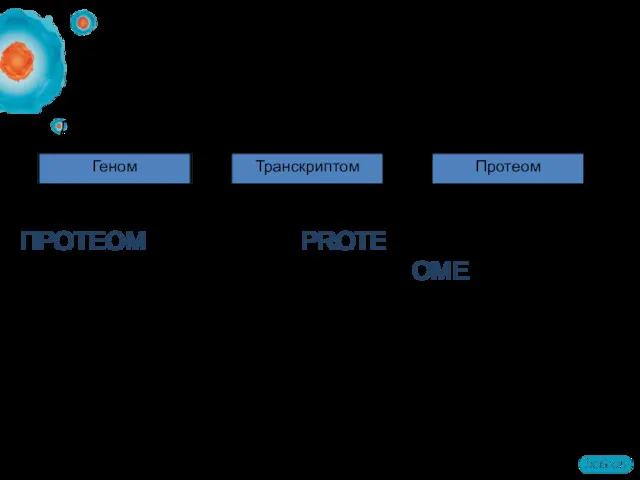
- 3. ПРОТЕОМ – все белки (PROTEin), экспрессированные геномом (genOME) клетки или организма Keith Williams, 1994 От генома
- 4. Характеристика и анализ совокупности белков (протеома) клетки, ткани, организма. Изучение структуры белков, их функций, количества и
- 5. Системная биология – понимание клеточных путей, комплексных белковых взаимодействий Биологические процессы – характеристика субпротеомов, белков органелл
- 6. Два направления – глобальная и таргетная протеомика Глобальная – попытка проанализировать все белки клетки, ткани или
- 7. Виды исследований Какие белки? Где? Когда? С чем? Белковый состав – идетификация всех компонентов макромолекулярного комплекса
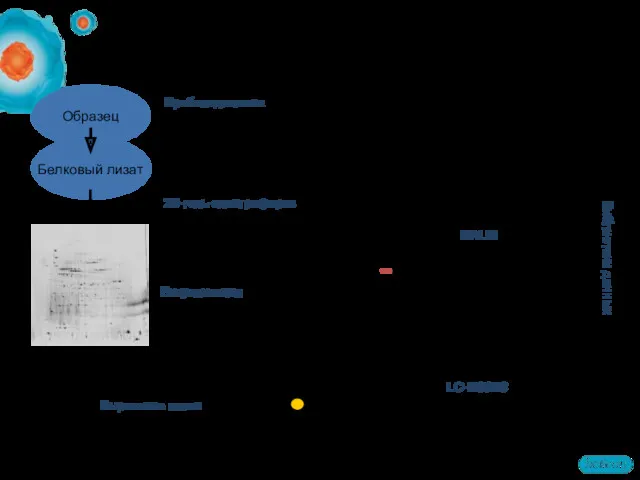
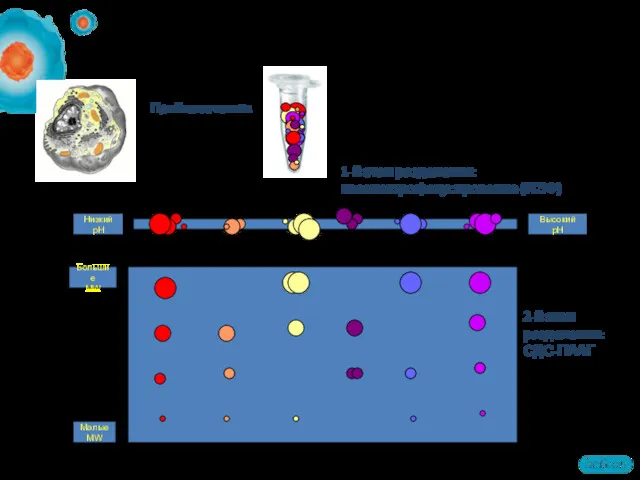
- 8. Белковый лизат MALDI Библиотеки данных Пробоподготовка экстракция белков очистка префракционирование Вырезание пятен 2D-электрофорез: рабочий процесс 2D-гель-электрофорез
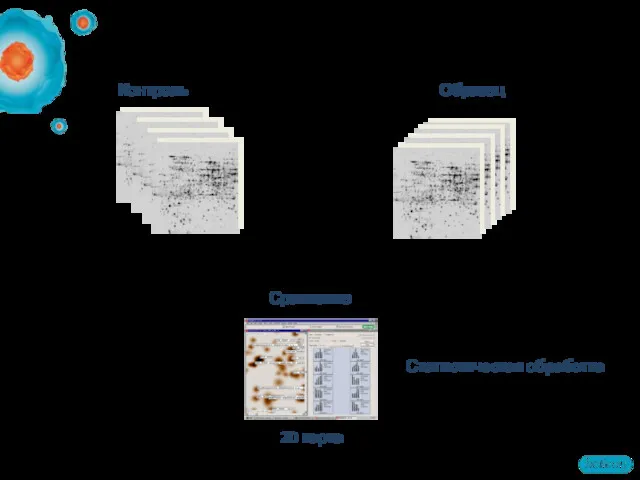
- 9. Контроль Образец ~3 повтора для каждого образца 2D карта Статистическая обработка Классический дифференциальный 2D-электрофорез Сравнение
- 10. Белки мозга человека Различия в уровне экспрессии фосфоглицератмутазы в таламусе Контроль Болезнь Альцгеймера
- 11. Хороший образец Подготовка Отличный 2D гель = Вклад пробоподготовки образцов
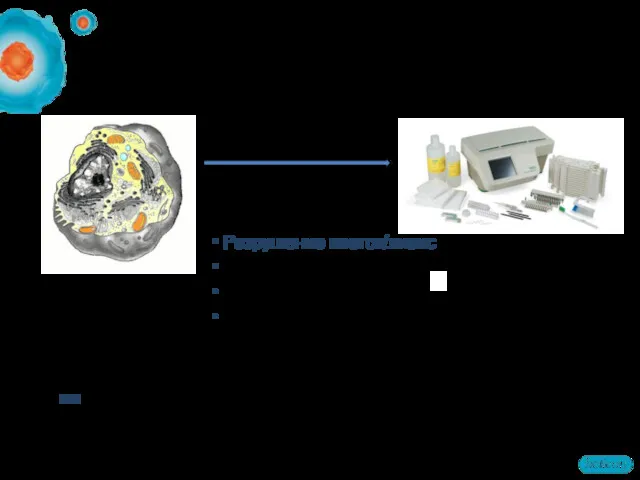
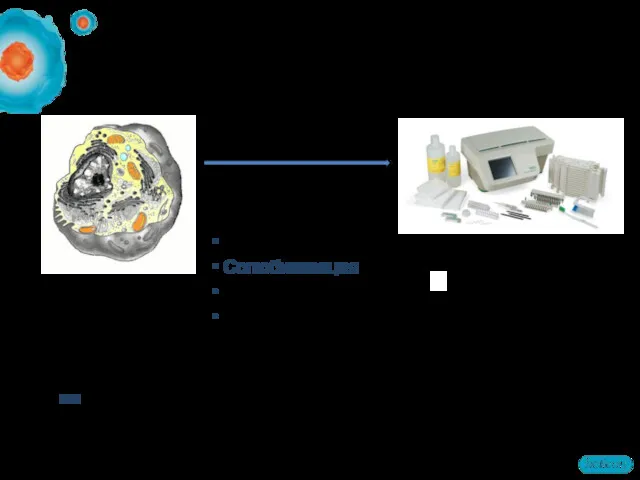
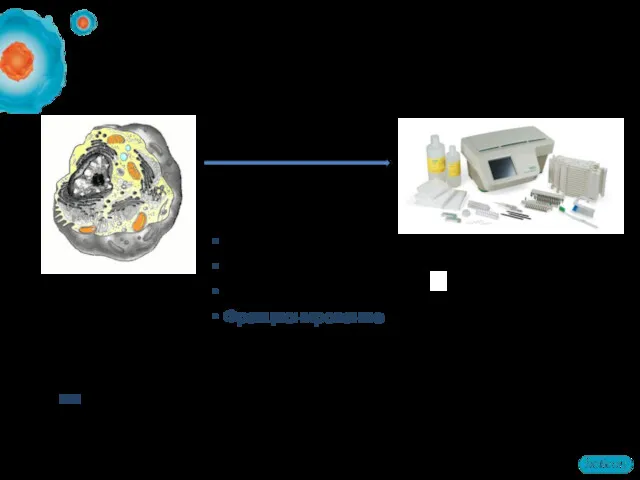
- 12. Этапы пробоподготовки образцов Разрушение клеток/лизис Солюбилизация Очистка образцов Фракционирование NB! Порядок может быть иной. Некоторые из
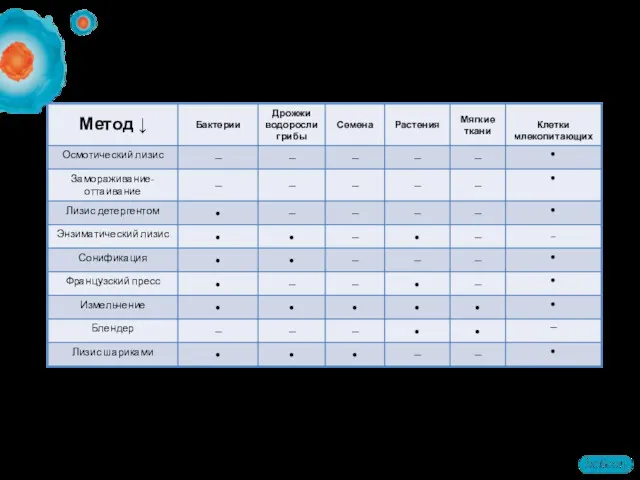
- 13. Методы лизиса клеток
- 14. Этапы пробоподготовки образцов Разрушение клеток/лизис Солюбилизация Очистка образцов Фракционирование 1D (IEF) NB! Порядок может быть иной.
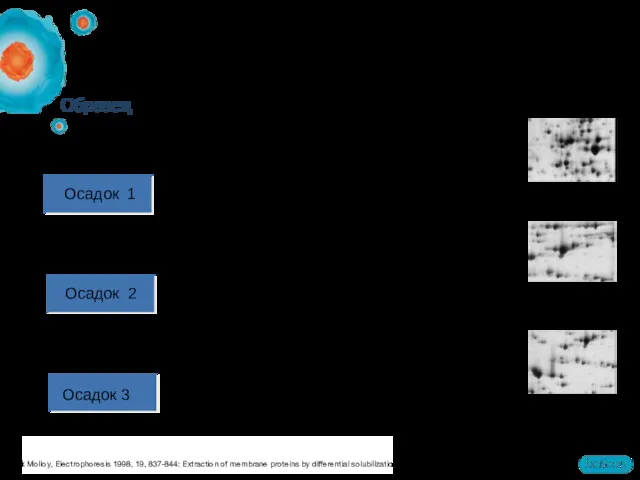
- 15. Последовательная экстракция 5–8% Mark Molloy, Electrophoresis 1998, 19, 837-844: Extraction of membrane proteins by differential solubilization
- 16. E.сoli (весь лизат) На каждом геле - 200 мкг лизата E.coli. Есть уникальные белки, а также
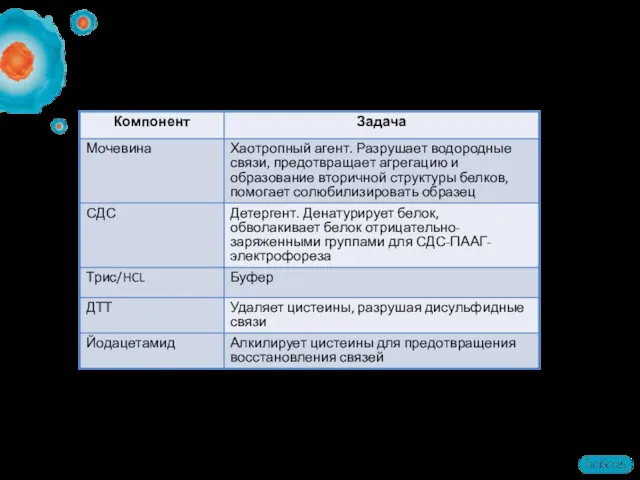
- 17. Компоненты солюбилизирующего буфера для 2D Хаотропные/денатурирующие агенты: 9M мочевина или 7M мочевина/2M тиомочевина Детергенты: 2-4% CHAPS
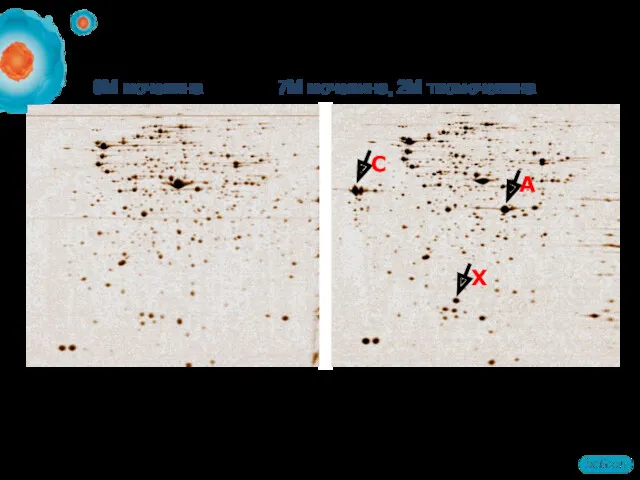
- 18. Солюбилизирующая сила тиомочевины 9M мочевина 7M мочевина, 2M тиомочевина E. coli; pH 4-7 IPG; стрелками показаны
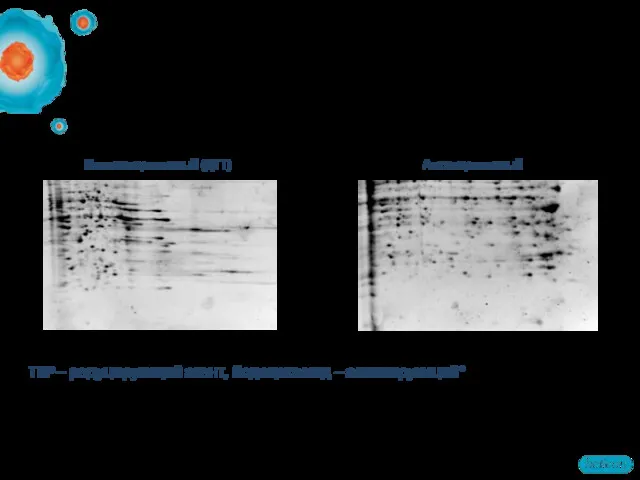
- 19. Альтернативы ДТТ TBP – редуцирующий агент, йодацетамид – алкилирующий* pH 3 Неалкилированный (ДТТ) pH 10 pH
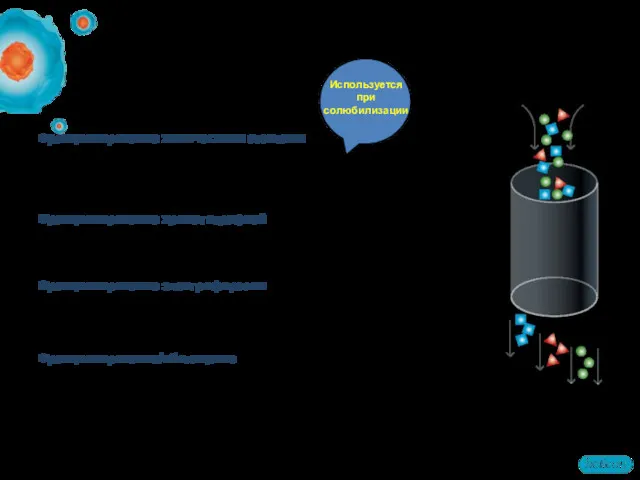
- 20. Этапы пробоподготовки образцов Разрушение клеток/лизис Солюбилизация Очистка образцов Фракционирование NB! Порядок может быть иной. Некоторые из
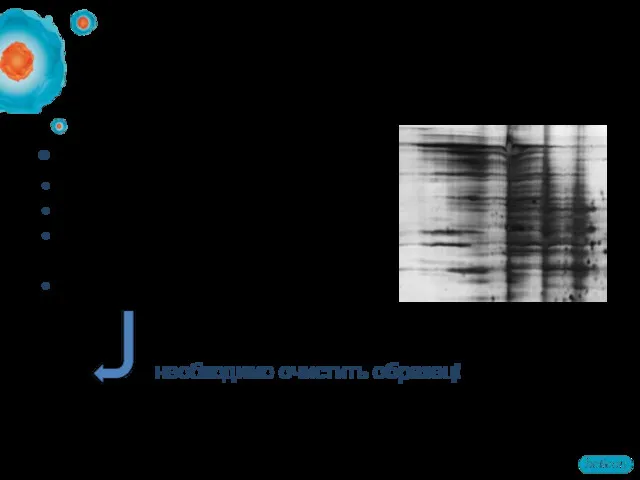
- 21. Соли Буферы Ионные детергенты (СДС) Нуклеиновые кислоты, липиды и полисахариды Полифенолы необходимо очистить образец! Что ещё
- 22. Варианты очистки образцов Преципитация ReadyPrep Cleanup kit SureBeads Гель-фильтрация Bio-Gel spin columns Диализ Ультрафильтрация
- 23. Этапы пробоподготовки образцов Разрушение клеток/лизис Солюбилизация Очистка образцов Фракционирование NB! Порядок может быть иной. Некоторые из
- 24. Основные методы фракционирования Фракционирование химическими агентами например, последовательная или специфическая экстракция белков различными буферами Фракционирование хроматографией
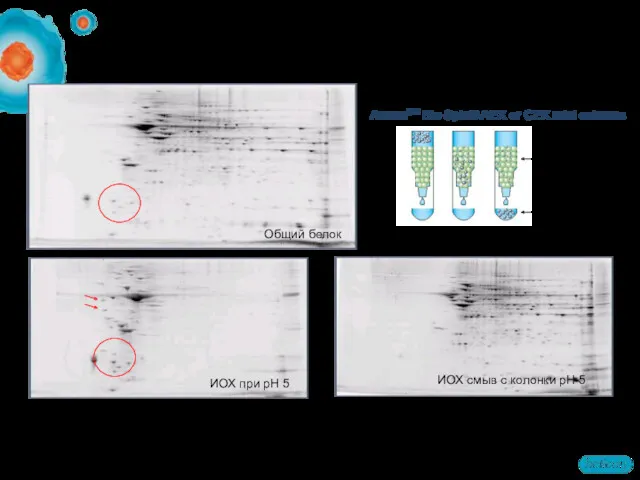
- 25. Фракционирование ионобменной хроматографией AurumTM Bio-Spin® AEX or CEX mini columns
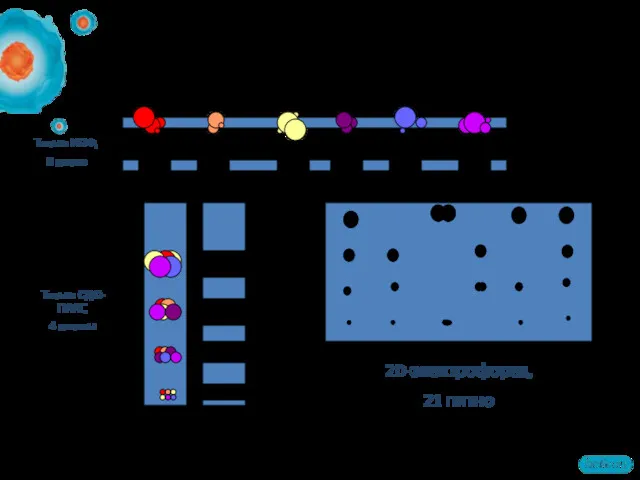
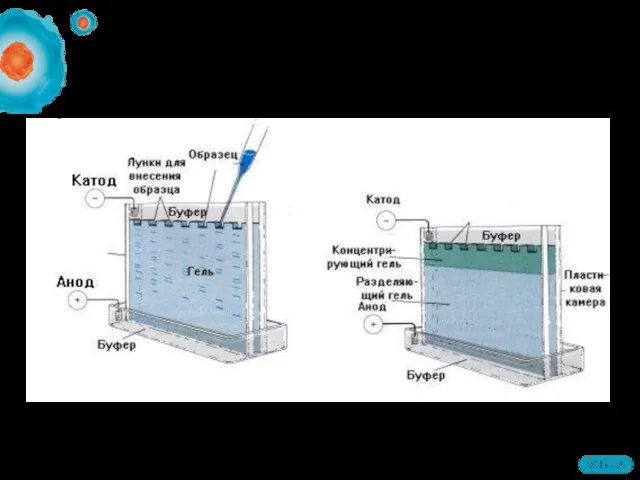
- 26. 2D электрофорез: 1-й и 2-й этап разделения
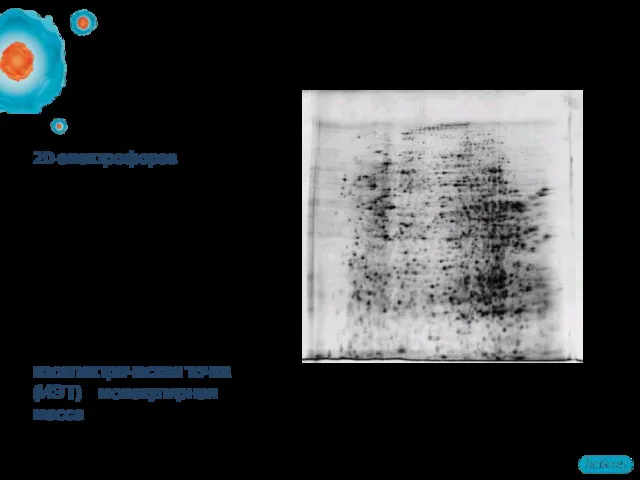
- 27. 2D-электрофорез – это метод разделения тысячи белковых компонентов в одном геле. Это многоступенчатая техника, основанная на
- 28. Большие MW Малые MW Высокий pH Низкий pH Как протекает 2D-электрофорез? Пробоподготовка 1-й этап разделения: изоэлектрофокусирование
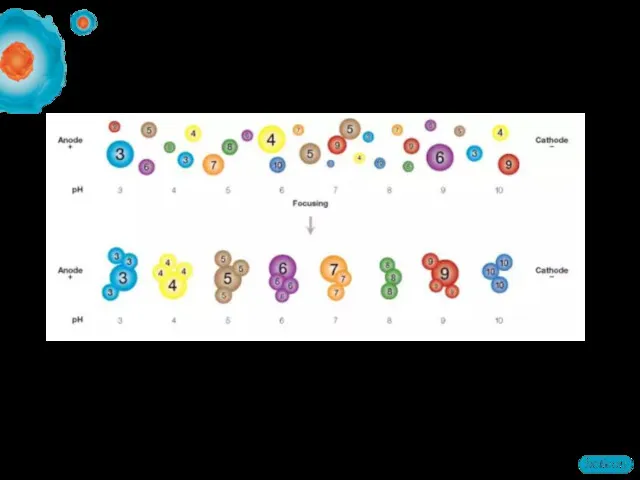
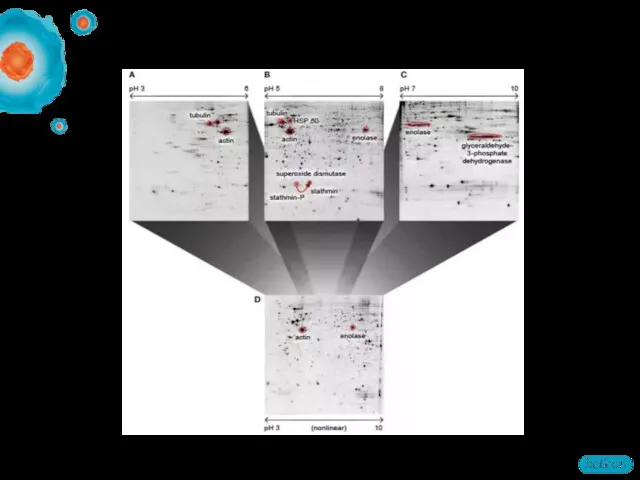
- 29. Только ИЭФ, 6 полос 2D-электрофорез, 21 пятно В чем преимущества 2D-электрофореза? Только СДС-ПААГ, 4 полосы
- 30. Чтобы визуализировать комплекс белков для: Профилирования белков Сравнение образцов с контролями Открытие биомаркеров Мониторинг различных процессов
- 31. Этапы 2D-электрофореза
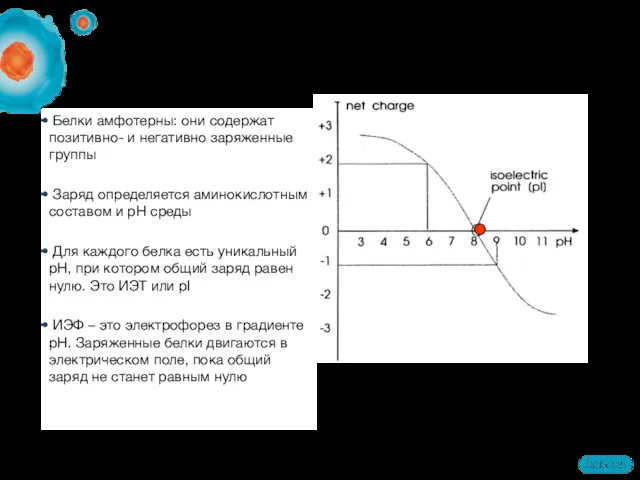
- 32. Белки амфотерны: они содержат позитивно- и негативно заряженные группы Заряд определяется аминокислотным составом и pH среды
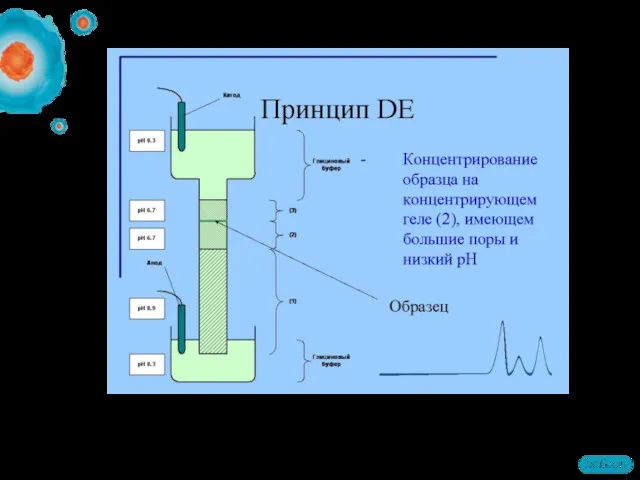
- 33. Белки движутся в градиенте pH пока их общий заряд не станет равен нулю (ИЭТ). 1-й этап
- 34. Инструменты для ИЭФ Среда для ИЭФ: IPG стрипы Инструмент: ИЭФ ячейка
- 35. IPG стрипы Имеют иммобилизованный градиент pH Пластиковую подложку заполняют акриламидным гелем с градиентом pH, нарезают стрипы
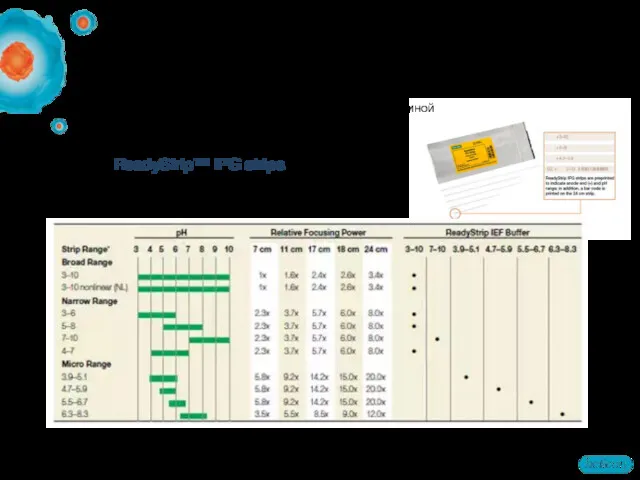
- 36. IPG стрипы доступны с различным градиентом pH и длиной IPG стрипы ReadyStrip™ IPG strips
- 37. Выбор IPG стрипа
- 38. IPG стрипы поставляются в регидратированном виде на гибкой пластиковой подложке Они должны быть регидратированы до их
- 39. Буфер для регидратации образцов
- 40. Пассивная регидратация: без напряжения, образец в буфере для регидратации Активная регидратация: низкое напряжение, образец в буфере
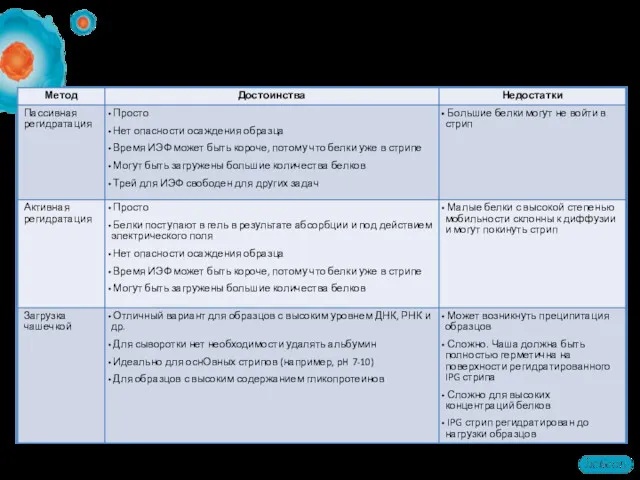
- 41. Регидратация IPG стрипов и нагрузка образцов: плюсы и минусы
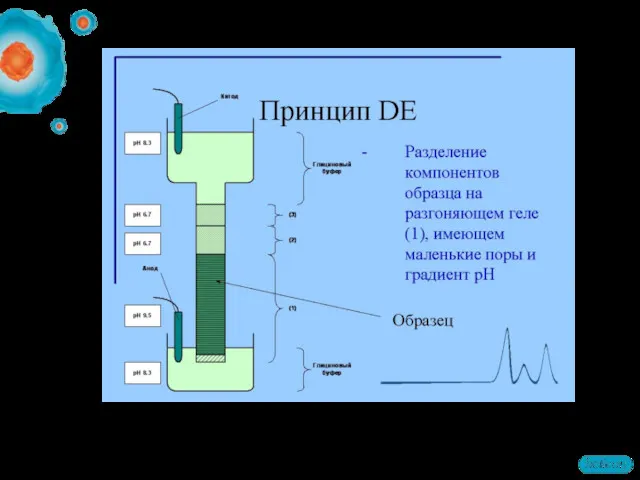
- 42. 2-й этап 2D-электрофореза Белки мигрируют пропорционально своей массе 250 кДа 5 кДа pH 10 pH 3
- 43. Электрофорез Электрофорез (от электро- и греч. φορέω — переносить) — электрокинетическое явление перемещения частиц дисперсной фазы
- 44. История электрофореза Arne Tizelius Ф.Ф. Рейсс, 1807 Движение коллоидных частиц в электрическом поле A.Tizelius, 1937 «A
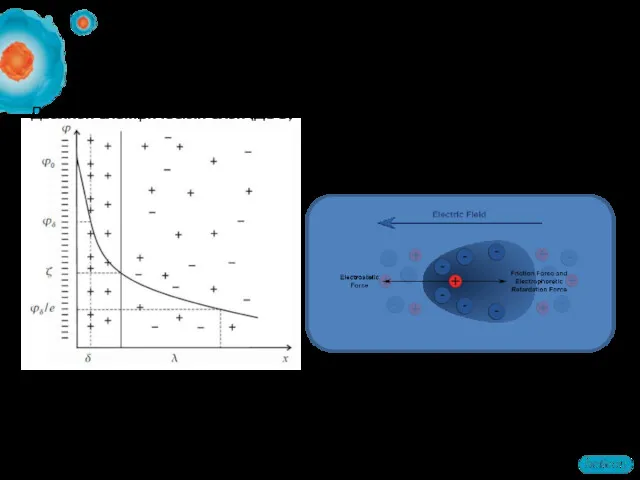
- 45. Теория электрофореза Двойной электрический слой (ДЭС) Строение ДЭС: Слой Гельмгольца (адсорбционный) Слой Гуи (диффузный) Характеристические потенциалы
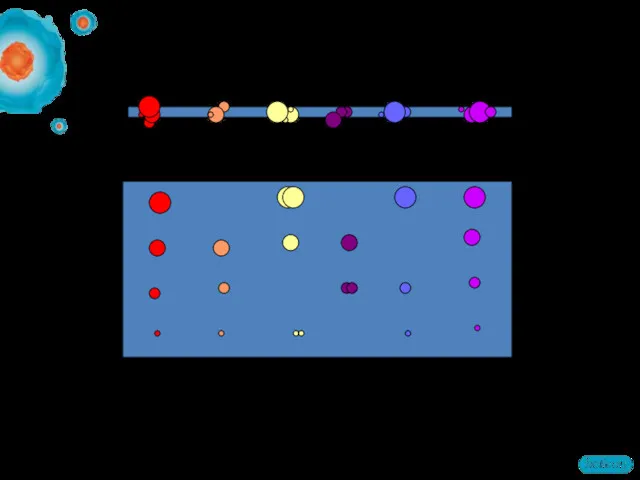
- 46. Виды электрофореза Зональный электрофорез Гомогенная буферная система Изотахофорез Негомогенная буферная система Изоэлектрическое фокусирование Градиентная буферная система
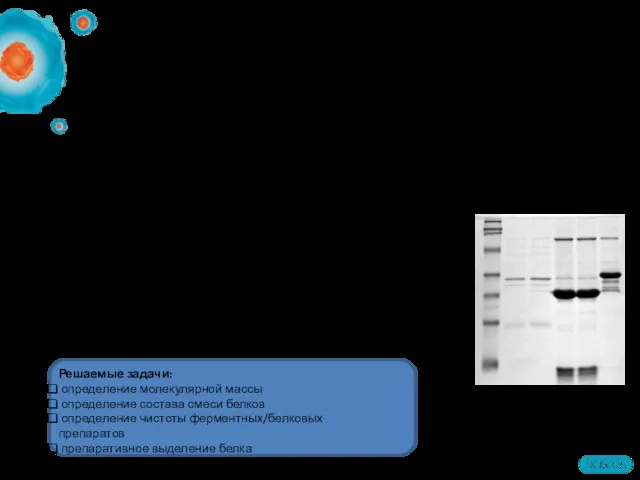
- 47. SDS-PAGE Электрофорез белков в полиакриламидном геле — метод разделения смесей белков в полиакриламидном геле в соответствии
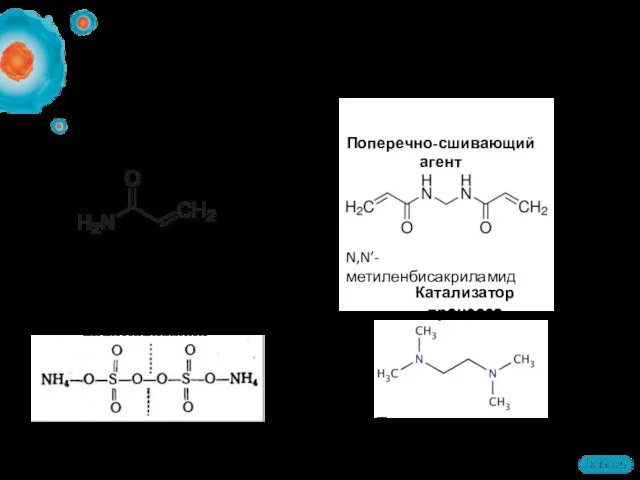
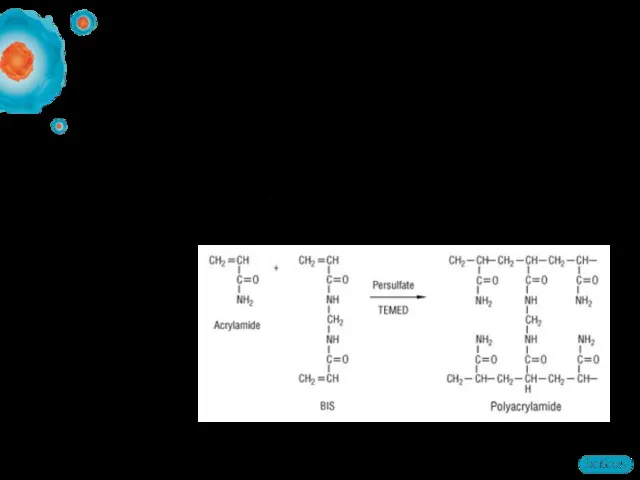
- 48. Гели для электрофореза (ПААГ) Исходные материалы Акриламид N,N’-метиленбисакриламид Персульфат аммония Тетраметилэтилендиамин Инициатор процесса полимеризации Катализатор процесса
- 49. Структура геля (ПААГ)
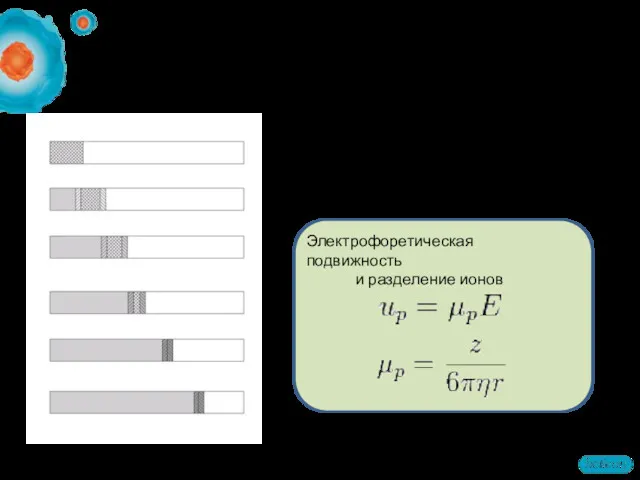
- 50. Изотахофорез Основные термины Ведущий электролит Замыкающий электролит Анализируемая смесь Электрофоретическая подвижность и разделение ионов
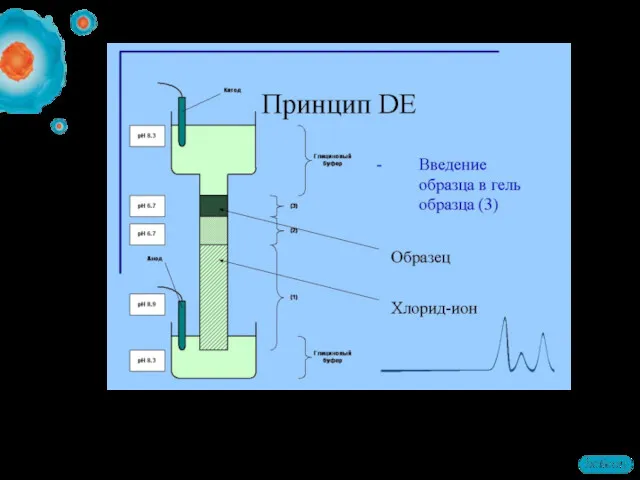
- 51. Диск-электрофорез Гель, состоит из двух частей. Все буферы не содержат неорганических солей, основным переносчиком тока в
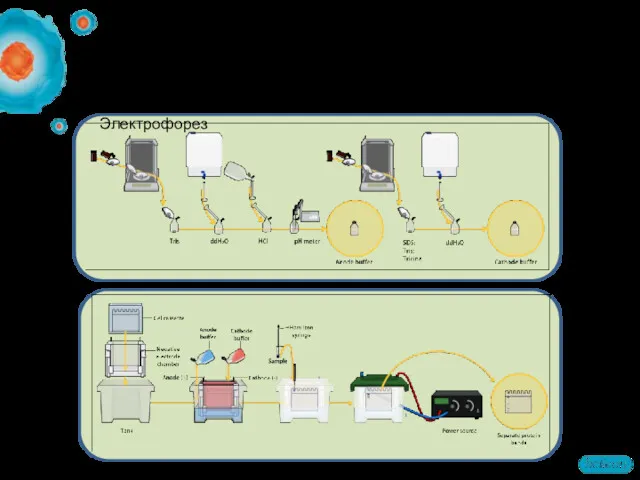
- 55. Схема аппарата для электрофореза
- 56. Аппараты для электрофореза
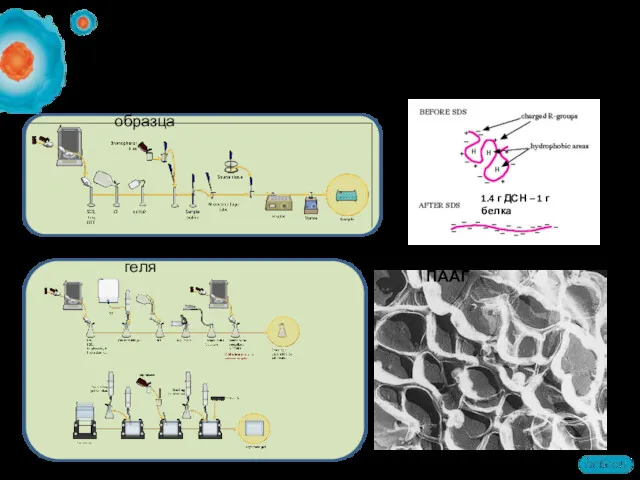
- 57. Процедура SDS-PAAG 1. Подготовка образца 2. Подготовка геля Структура ПААГ 1.4 г ДСН – 1 г
- 58. Процедура SDS-PAAG 3. Электрофорез
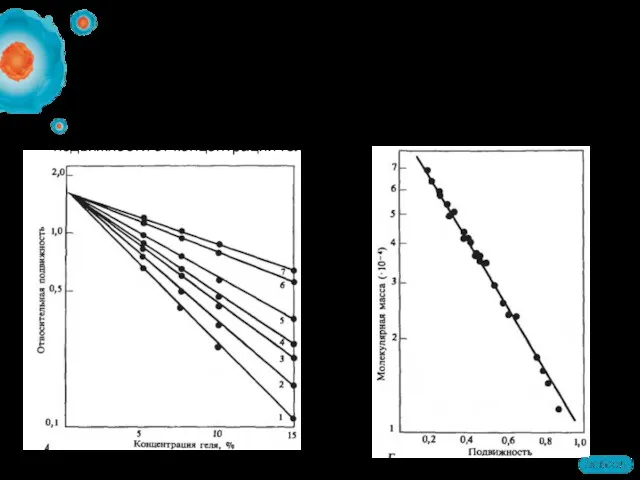
- 59. Интерпретация Зависимость относительной подвижности от концентрации геля Относительная подвижность белков в 10 % ПААГ как функция
- 60. Перед разделением в СДС-ПААГ белки должны быть уравновешены в СДС-буфере Уравновешивание I – с DTT, для
- 61. Уравновешивание образцов после ИЭФ
- 62. IPG стрип располагается в лунке в верхней части геля Лунка заполняется нагретой агарозой Между стрипом и
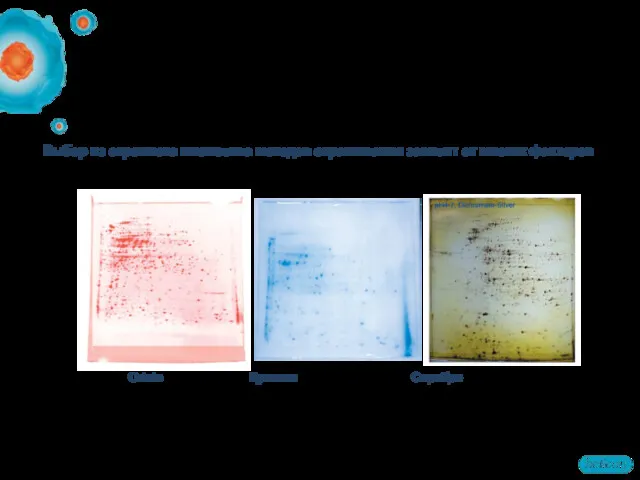
- 63. Выбор из огромного множества методов окрашивания зависит от многих факторов Окрашивание гелей и визуализация результатов
- 64. Скорость От 5 мин (Stain-Free) до 24 ч (коллоидное Кумасси) Простота Без реагентов (Stain Free), смена
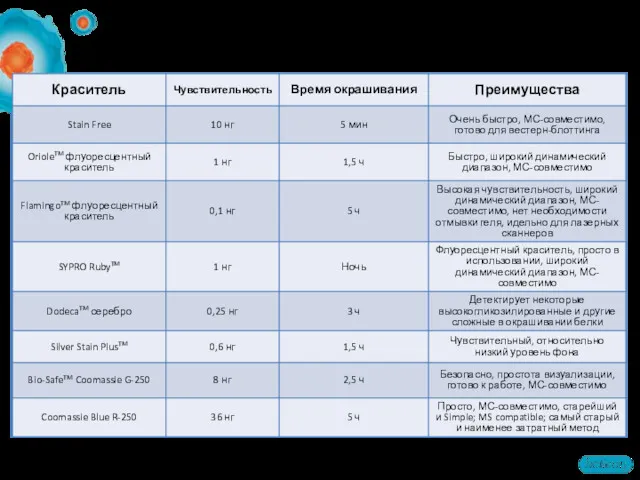
- 65. Выбор метода окрашивания
- 66. Для превосходных 2D-результатов лучше использовать меньшую концентрацию образца и более чувствительный краситель С другой стороны, чувствительность
- 69. Скачать презентацию






















 Биология в мире современных профессий
Биология в мире современных профессий Пищеварение беспозвоночных
Пищеварение беспозвоночных Дигибридное скрещивание
Дигибридное скрещивание Многообразие и происхождение культурных растений
Многообразие и происхождение культурных растений Каталог цветов
Каталог цветов Биология, ее задачи и разделы. Основные этапы формирования биологии. Методы биологических исследований
Биология, ее задачи и разделы. Основные этапы формирования биологии. Методы биологических исследований Скелет опора организма.Биология. Живой организм. 6 класс., учебник Н.И, Сонин
Скелет опора организма.Биология. Живой организм. 6 класс., учебник Н.И, Сонин Физиология дыхания
Физиология дыхания Виртуальная выставка Во саду ли в огороде
Виртуальная выставка Во саду ли в огороде 3c57d4db65194731b010a474653bcc81
3c57d4db65194731b010a474653bcc81 Витамины. Классификация, источники, значение
Витамины. Классификация, источники, значение Систематика найпростіших. Тип microspora
Систематика найпростіших. Тип microspora Городские птицы
Городские птицы Самые умные животные!
Самые умные животные! Постэмбриональное развитие организма
Постэмбриональное развитие организма Тип: моллюски. Класс: двустворчатые. Устрица
Тип: моллюски. Класс: двустворчатые. Устрица Перелетные птицы весной
Перелетные птицы весной Голосовой аппарат
Голосовой аппарат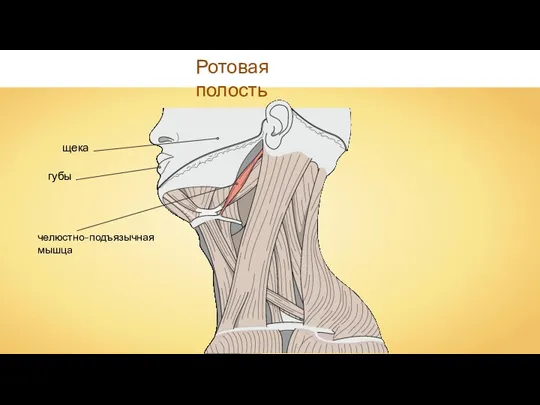 Ротовая полость
Ротовая полость Нейромедиаторы. Нейротрансмиттеры
Нейромедиаторы. Нейротрансмиттеры Вегетативная нервная система
Вегетативная нервная система Внутренняя среда организма человека
Внутренняя среда организма человека Строение гена
Строение гена Ядовитые обитатели Красного моря
Ядовитые обитатели Красного моря Нуклеиновые кислоты и белки. Генетический код
Нуклеиновые кислоты и белки. Генетический код Сердечно-сосудистая система. Сердце. Кровеносные сосуды. Лимфатическая система
Сердечно-сосудистая система. Сердце. Кровеносные сосуды. Лимфатическая система Цитология – наука о клетке
Цитология – наука о клетке Итог производственной практики
Итог производственной практики