Содержание
- 2. ЭЛЕКТРОФОРЕЗ Электрофорез (от электро- и др.-греч. φορέω — «переношу») — это электрокинетическое явление перемещения частиц дисперсной
- 3. ПРИНЦИП МЕТОДА В растворе белки находятся в виде заряженных частиц. Заряд на поверхности белков возникает в
- 4. ПРИНЦИП МЕТОДА Для каждого белка существует такое значение рН среды (обозначаемое как рI – изоэлектрическая точка)
- 5. НЕМНОГО ТЕОРИИ ☹ При проведении электрофореза электрическое поле создают с помощью источника питания – стабилизированного выпрямителя,
- 6. НЕМНОГО ТЕОРИИ ☹ Электрофорез проводят в однородном электрическом поле, то есть поле, напряженность E которого во
- 7. НЕМНОГО ТЕОРИИ ☹ Именно различия в электрофоретической подвижности белков, содержащихся в анализируемой смеси, делают возможным разделить
- 8. НЕМНОГО ТЕОРИИ ☹ Основная проблема заключается в описании сил, действующих на частицу или большую молекулу, плавающую
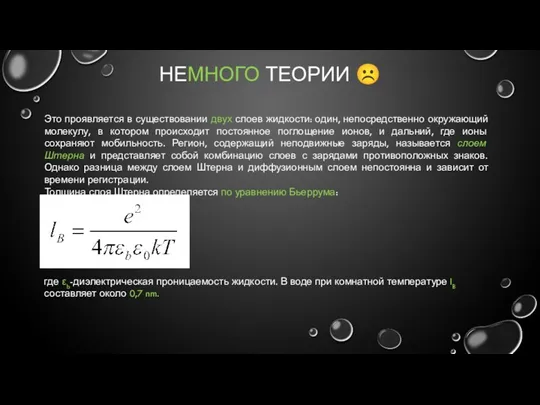
- 9. НЕМНОГО ТЕОРИИ ☹ Это проявляется в существовании двух слоев жидкости: один, непосредственно окружающий молекулу, в котором
- 10. НЕМНОГО ТЕОРИИ ☹ Теория поля определяет равновесие в распределении подвижных ионов по уравнению Поиссона-Больцмана: здесь, ezk
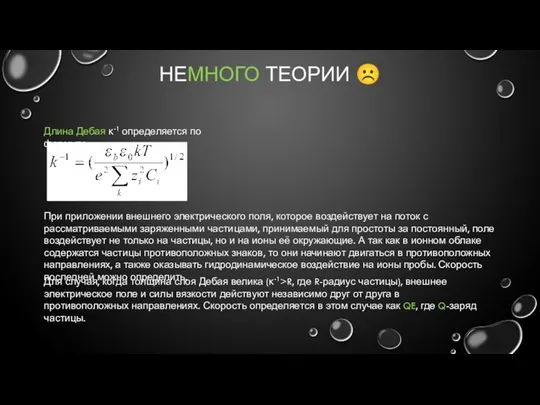
- 11. НЕМНОГО ТЕОРИИ ☹ Длина Дебая κ-1 определяется по формуле: При приложении внешнего электрического поля, которое воздействует
- 12. НЕМНОГО ТЕОРИИ ☹ Подвижность этой частицы в случае её сферичности определяется по уравнению Хюккеля В противном
- 13. НЕМНОГО ТЕОРИИ ☹ РЕЗЮМЕ Электрофоретическая подвижность белка зависит: от самой молекулы: ее размера (молекулярной массы), формы,
- 14. ПААГ ЭЛЕКТРОФОРЕЗ Полиакриламидный гель (ПААГ) обладает многими качествами идеального носителя (Химически инертен, можно кипятить. Можно задать
- 15. ПААГ ЭЛЕКТРОФОРЕЗ Меняя концентрацию акриламида от 2 до 50% можно задать определенную пористость геля. Например, диаметр
- 16. ПААГ ЭЛЕКТРОФОРЕЗ В результате сополимеризации образуется трехмерная сетка геля. Каждый второй углеродный атом линейной цепи содержит
- 17. НАЗАД
- 18. ПААГ ЭЛЕКТРОФОРЕЗ Для сополимеризации нужны инициаторы и катализаторы (окислительно-восстановительные системы - источники свободных радикалов). Чаще всегоиспользуют
- 19. При разрыве связи О-О образуются два свободных радикала, каждый из которых стимулирует разрыв двойной связи в
- 20. ПААГ ЭЛЕКТРОФОРЕЗ В полиакриламидном геле можно проводить как нативный электрофорез, так и электрофорез в денатурирующих условиях.
- 21. ПААГ ЭЛЕКТРОФОРЕЗ Денатурирующие условия достигаются путем обработки пробы трехкратным избытком додецилсульфата натрия (SDS). Анион SDS несет
- 22. СПРОСОБЫ ПРОЯВЛЕНИЯ ЭЛЕКТРОФОРЕГРАММ Зоны разделившихся белков удобно анализировать, если их проявить – сделать видимыми невооруженным глазом.
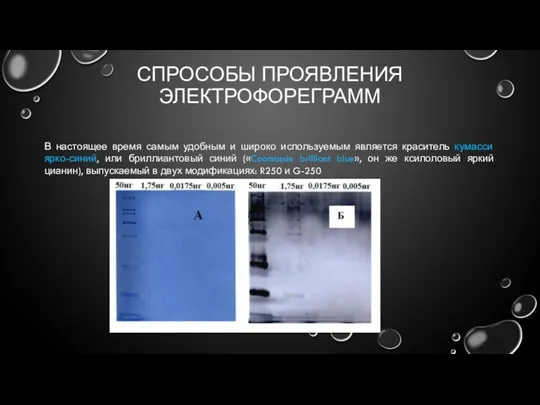
- 23. СПРОСОБЫ ПРОЯВЛЕНИЯ ЭЛЕКТРОФОРЕГРАММ В настоящее время самым удобным и широко используемым является краситель кумасси ярко-синий, или
- 25. Скачать презентацию


















 Общая гистология. Эпителиальные ткани
Общая гистология. Эпителиальные ткани Полимеразная цепная реакция
Полимеразная цепная реакция Краткая история развития биологии. Методы исследования биологии
Краткая история развития биологии. Методы исследования биологии Тварини Червоної книги України
Тварини Червоної книги України Певчие птицы
Певчие птицы Тест по теме млекопитающие
Тест по теме млекопитающие Модификационная изменчивость. Построение диаграмм
Модификационная изменчивость. Построение диаграмм Основы теории регулирования биологических систем
Основы теории регулирования биологических систем Клеточный цикл и все, что может быть с ним связано
Клеточный цикл и все, что может быть с ним связано Evolution – Speciation
Evolution – Speciation Витамины
Витамины Пищеварительная система человека
Пищеварительная система человека Викторина по биологии Что? Где? Когда?
Викторина по биологии Что? Где? Когда? Жизнедеятельность клетки
Жизнедеятельность клетки Красивая осанка
Красивая осанка Форменные элементы крови. Кровотворение
Форменные элементы крови. Кровотворение Тип Хордовые
Тип Хордовые Декоративные растения. Основы ландшафтной композиции
Декоративные растения. Основы ландшафтной композиции Антропогенез. Эволюция человека
Антропогенез. Эволюция человека Физиология нервной системы
Физиология нервной системы Видоизменения корней
Видоизменения корней Важность охраны живого мира.
Важность охраны живого мира. Общие признаки для всех живых организмов
Общие признаки для всех живых организмов Птицы красной книги
Птицы красной книги Исследование качества воды и состояния естественной кормовой базы для зарыбления рисовых чеков белым амуром и пиленгасом
Исследование качества воды и состояния естественной кормовой базы для зарыбления рисовых чеков белым амуром и пиленгасом Сосуды большого круга кровообращения. Лимфатическая система
Сосуды большого круга кровообращения. Лимфатическая система Питание и пищеварение
Питание и пищеварение ВИТАМИНЫ
ВИТАМИНЫ