Энергетика мышечного сокращения. Ферменты в толстых нитях поперечно-полосатых мышц позвоночных презентация
Содержание
- 2. 1. Что такое электромеханическое сопряжение (ЭМС)? 2. Какая концентрация ионов кальция в покоящихся мышечных клетках? Вопросы
- 3. 7. Какова длительность ПД в скелетных мышцах, сердечной и гладких мышцах? 8. Что такое EF-hand белки?
- 4. Энергетика сокращения Источником энергии для сокращения и расслабления служит АТФ. На головках миозина есть каталитические центры,
- 5. Запасы АТФ в мышечном волокне ограничены, они обеспечивают выполнение физической нагрузки не более 1-2 с. При
- 6. 1. Фосфагенная энергосистема – первый энергетический резерв мышечного волокна. К фосфагенам относятся АТФ и КрФ (креатинфосфат).
- 7. Фосфагенная система обеспечивает мышечные усилия «взрывного» характера (спринтерский бег, прыжки, метание, подъем штанги и т.д.). Емкость
- 8. 2. гликолитическая энергосистема. В основе ее лежит расщепление анаэробно глюкозы или гликогена до молочной кислоты (выход
- 9. Высокий уровень молочной кислоты и несостоятельность щелочного резерва крови является ведущим звеном в периферических механизмах утомления:
- 10. Реакции, происходящие с участием кислорода, получили название аэробных. Окисление – аэробный путь ресинтеза АТФ протекает в
- 11. При окислении 1 молекулы глюкозы до конечных продуктов (воды и углекислого газа) ресинтезируется 36 молекул АТФ,
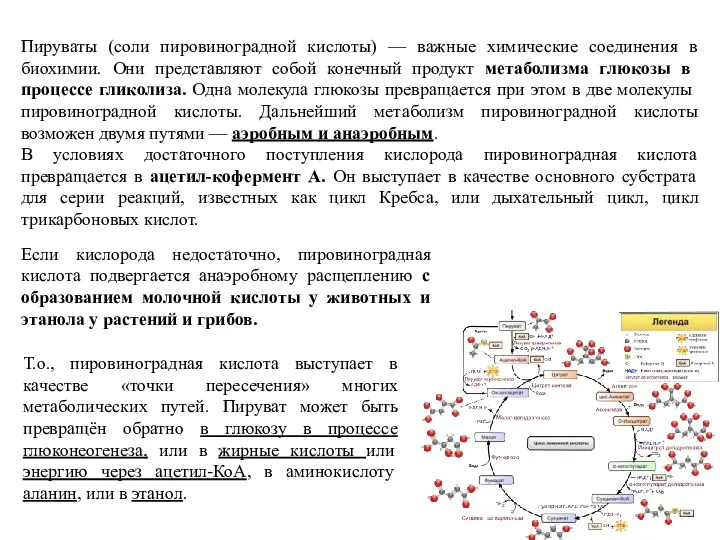
- 12. Пируваты (соли пировиноградной кислоты) — важные химические соединения в биохимии. Они представляют собой конечный продукт метаболизма
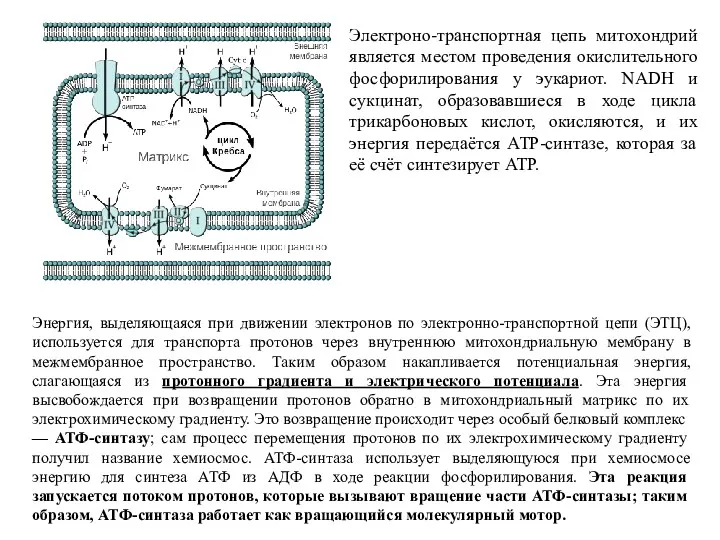
- 13. Электроно-транспортная цепь митохондрий является местом проведения окислительного фосфорилирования у эукариот. NADH и сукцинат, образовавшиеся в ходе
- 14. После смерти содержание АТФ в клетках быстро снижается и когда становится ниже критического, поперечные мостики миозина
- 15. Ферменты в толстых нитях поперечно-полосатых мышц позвоночных Известно, что толстая (миозиновая) нить поперечно-полосатых мышц позвоночных помимо
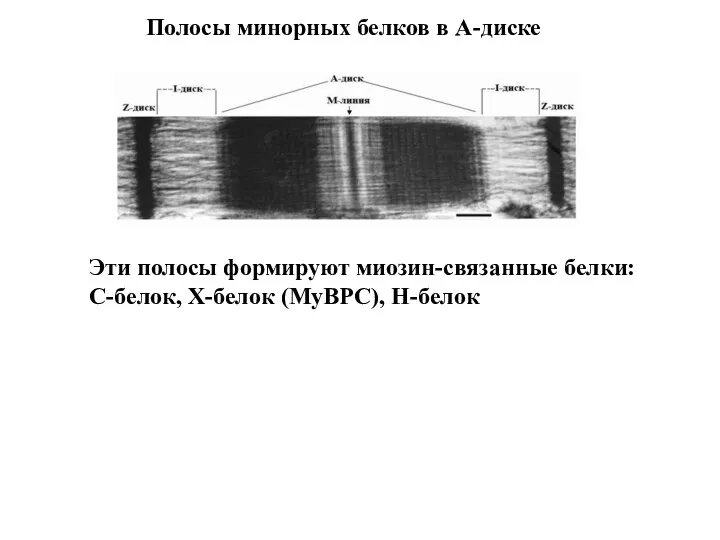
- 16. Полосы минорных белков в А-диске Эти полосы формируют миозин-связанные белки: С-белок, Х-белок (MyBPC), Н-белок
- 17. ЭМ исследование формы и размеров молекул С-белка Подлубная, 1990.
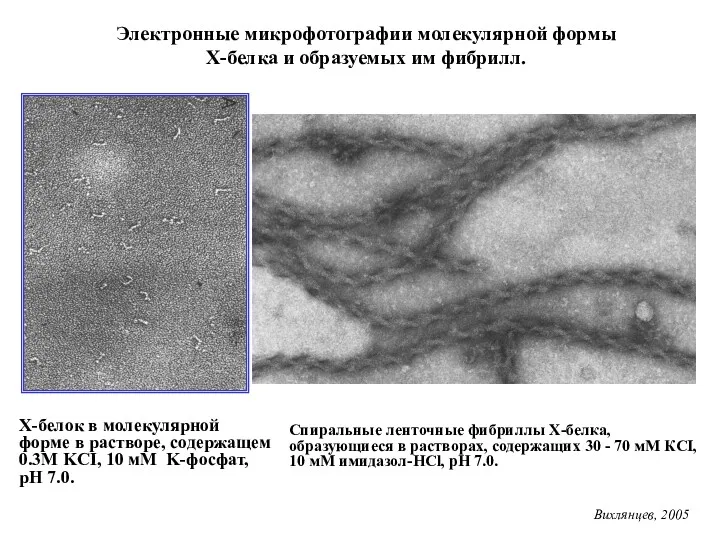
- 18. Х-белок в молекулярной форме в растворе, содержащем 0.3М KCI, 10 мМ K-фосфат, pH 7.0. Электронные микрофотографии
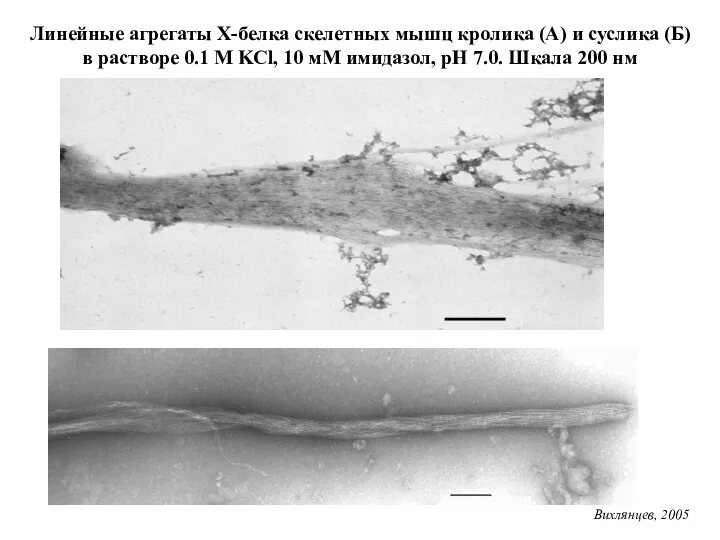
- 19. Линейные агрегаты Х-белка скелетных мышц кролика (А) и суслика (Б) в растворе 0.1 М KCl, 10
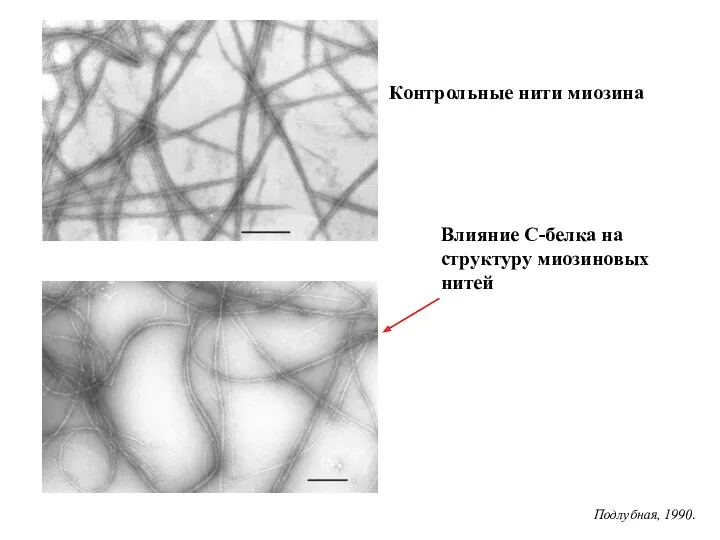
- 20. Влияние С-белка на структуру миозиновых нитей Контрольные нити миозина Подлубная, 1990.
- 21. Ферменты, связанные с толстыми нитями Как оказалось, толстые нити - это биологическая подложка для ферментативных систем,
- 22. Первый фермент – Креатинкиназа Фермент, катализирующий реакцию переноса фосфорильного остатка с креатинфосфата на ADP, в результате
- 23. Локализация креатинкиназы: в цитоплазме и М-линии саркомера. предполагается, что фермент может связываться по всей длине толстых
- 24. Функции креатинкиназы: Структурная (в М-линии) Ферментативная, заключающаяся в обеспечении быстрого ресинтеза АТФ. Активация креатинкиназы начинается после
- 25. Второй фермент – АМФ-дезаминаза (тоже ambiquitous фермент) Катализирует реакцию дезаминирования (процесс удаления аминогрупп NH2) адениловой кислоты
- 26. Функциональное значение АМФ-дезаминазы не ясно. Возможно этот фермент участвует в цикле пуриновых нуклеотидов (АТФ, АДФ, АМФ,
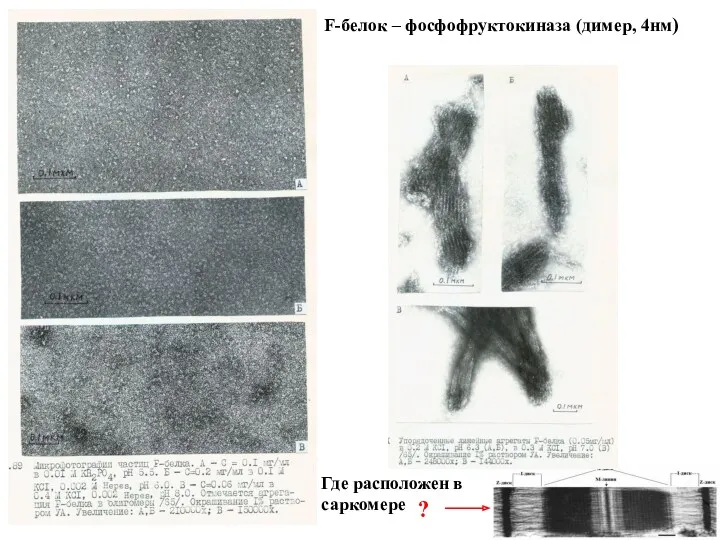
- 27. Третий фермент – фосфофруктокиназа или F-белок (тоже ambiquitous фермент). Фермент, катализирующий центральную реакцию гликолиза: Ф6Ф +
- 28. F-белок – фосфофруктокиназа (димер, 4нм) Где расположен в саркомере ?
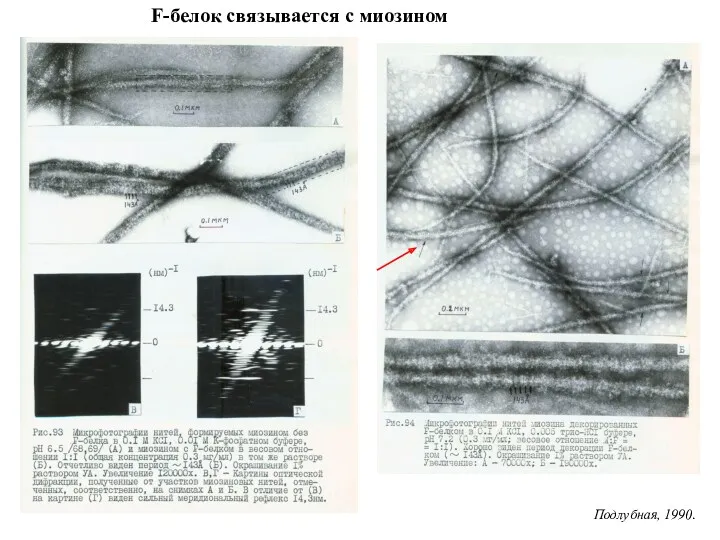
- 29. F-белок связывается с миозином Подлубная, 1990.
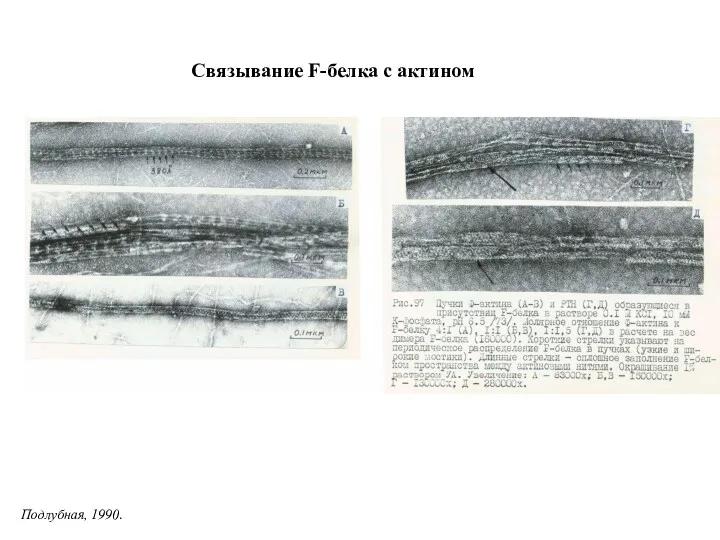
- 30. Связывание F-белка с актином Подлубная, 1990.
- 31. Связывание F-белка в саркомере – в районе первых 2-х поперечных полос из 11-ти. Но! Возможно фермент
- 32. Итак, резюме: Значение адсорбции ферментов, участвующих в метаболизме энергии (т.е., не только трёх вышеупомянутых), на толстых
- 33. Благодарю за внимание!
- 35. Скачать презентацию























 Соединительная ткань и ее виды
Соединительная ткань и ее виды Моллюски: общая характеристика типа
Моллюски: общая характеристика типа Учение об анализаторах. Орган зрения
Учение об анализаторах. Орган зрения Цветок адениум
Цветок адениум Патрин А
Патрин А Задания линии 2 и 22 по экспериментам в КИМ ЕГЭ по биологии 2022
Задания линии 2 и 22 по экспериментам в КИМ ЕГЭ по биологии 2022 Лимфатическая система
Лимфатическая система Психология и социобиология половых различий
Психология и социобиология половых различий Презентация ц.бактерии 6кл
Презентация ц.бактерии 6кл Опасное растение борщевик
Опасное растение борщевик Внутривидовые и межвидовые взаимодействия у грибов, водорослей, высших растений. (Часть 4)
Внутривидовые и межвидовые взаимодействия у грибов, водорослей, высших растений. (Часть 4) Главные направления эволюции органического мира
Главные направления эволюции органического мира Тварина Південної Америки - вікунья
Тварина Південної Америки - вікунья Презентация по биологии на тему Класс Пресмыкающиеся. Особенности внешнего и внутреннего строения. Многообразие. Происхождение
Презентация по биологии на тему Класс Пресмыкающиеся. Особенности внешнего и внутреннего строения. Многообразие. Происхождение Черепные нервы. Обонятельные нервы
Черепные нервы. Обонятельные нервы Дезоксирибонуклеиновая кислота (ДНК)
Дезоксирибонуклеиновая кислота (ДНК) Строение клетки. Ткани
Строение клетки. Ткани Красная книга Белгородской области
Красная книга Белгородской области Физиология вегетативной нервной системы
Физиология вегетативной нервной системы Види сполучних тканин
Види сполучних тканин Эволюционная теория Ч. Дарвина
Эволюционная теория Ч. Дарвина Методы изучения наследственности человека
Методы изучения наследственности человека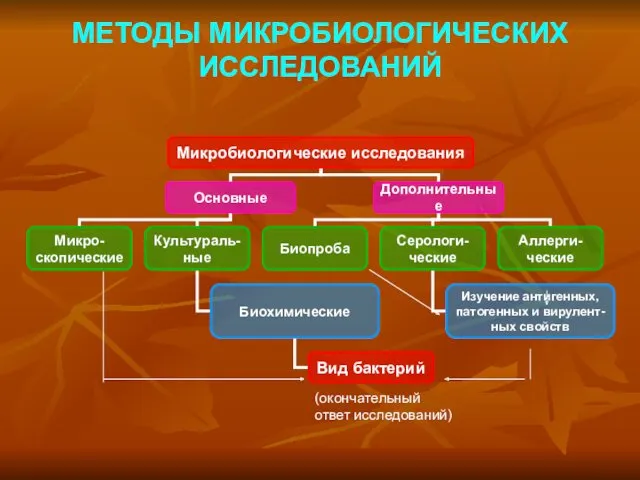 Методы микробиологических исследований
Методы микробиологических исследований Мужская половая система
Мужская половая система Действия и взаимодействия в системе Я и другой: нейробиологические аспекты
Действия и взаимодействия в системе Я и другой: нейробиологические аспекты Электрические свойства тканей организма. (Лекция 6)
Электрические свойства тканей организма. (Лекция 6) Кожа – наружный покровный орган. 8 класс
Кожа – наружный покровный орган. 8 класс В мире животных
В мире животных