Внутривидовые и межвидовые взаимодействия у грибов, водорослей, высших растений. (Часть 4) презентация
Содержание
- 2. ВНУТРИВИДОВЫЕ И МЕЖВИДОВЫЕ ВЗАИМОДЕЙСТВИЯ У ГРИБОВ, ВОДОРОСЛЕЙ, ВЫСШИХ РАСТЕНИЙ Внутривидовые взаимодействия у грибов и водорослей необходимы
- 3. Классификация взаимодействий основана на системном принципе иерархической организации: вначале выделяются внутривидовые взаимодействия; затем межвидовые; затем внутри
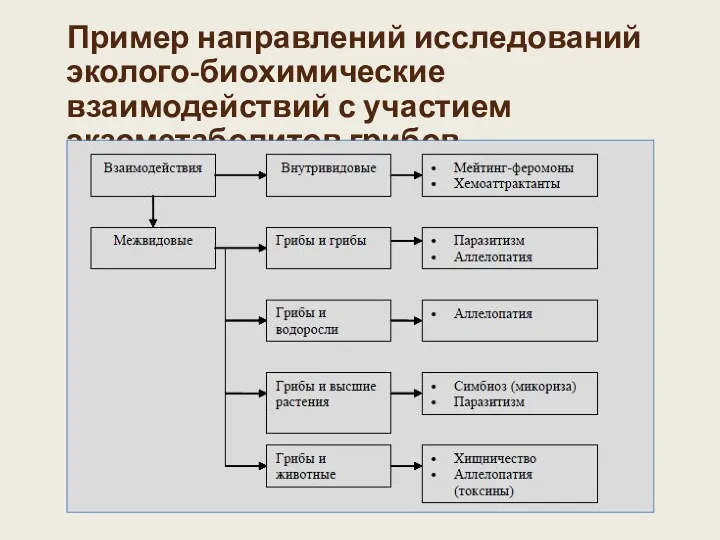
- 4. Пример направлений исследований эколого-биохимические взаимодействий с участием экзометаболитов грибов
- 5. Среди хемомедиаторов грибов лучше исследованы половые феромоны и хемо-аттрактанты. Рассмотрим на примере миксомицетов. Для взаимодействия гамет
- 6. Факт существования мейтинг-феромонов установлен для ряда представителей классов хитридиомицетов, базидиомицетов и аскомицетов. Например, женские гаметы гриба
- 7. У гаплоидных клеток дрожжей Saccharomyses cerevisiae существует два мейтинг типа (mating types): тип а и тип
- 8. Было показано [Hagen, Spraguer 1984], что а-фактор индуцирует быстрое увеличение экспрессии гена STE 3 в клетках
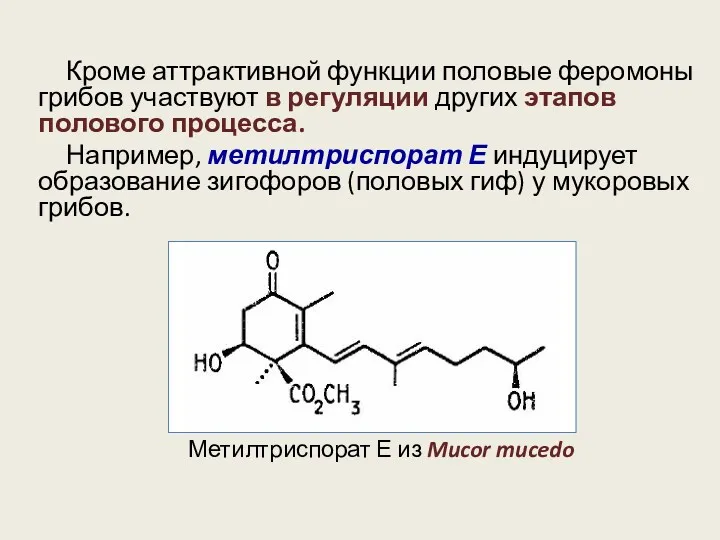
- 9. Кроме аттрактивной функции половые феромоны грибов участвуют в регуляции других этапов полового процесса. Например, метилтриспорат Е
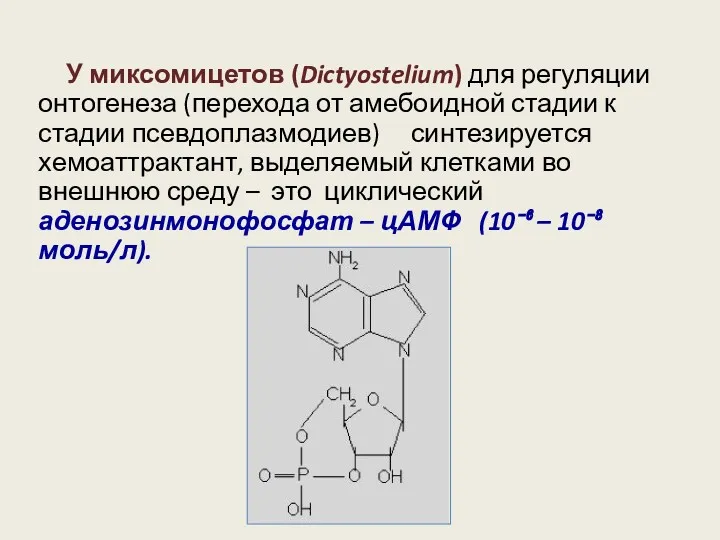
- 10. У миксомицетов (Dictyostelium) для регуляции онтогенеза (перехода от амебоидной стадии к стадии псевдоплазмодиев) синтезируется хемоаттрактант, выделяемый
- 11. Примеры ауторегуляторов грибов и слизевиков (по данным А. С. Хохлова [1988]; и др.)
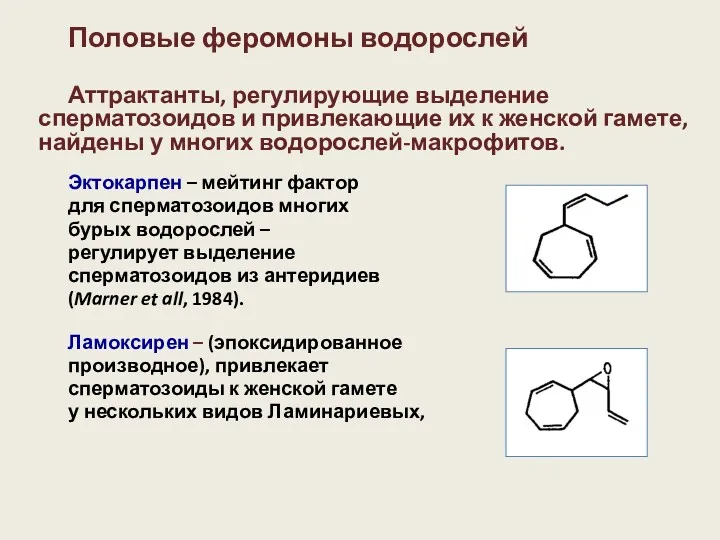
- 12. Половые феромоны водорослей Аттрактанты, регулирующие выделение сперматозоидов и привлекающие их к женской гамете, найдены у многих
- 13. Порог чувствительности андрогамет бурых водорослей к хемомедиаторам весьма низок. Для андрогамет Ectocarpus siliculosus порог чувствительности к
- 14. Некоторые половые аттрактанты водорослей
- 15. Вещества–аутоингибиторы Некоторые виды фитопланктона выделяют аутингибиторы, подавляющие рост своих сородичей. Для регистрации действия аутоингибитора определяют скорость
- 16. Аутоингибиторы – могут угнетать рост и других видов. Попарно выращивали 5 видов водорослей из 5 родов:
- 17. При исследовании подавления роста фитопланктона водными многоклеточными водорослями или макрофитами установлены аллелопатические взаимодействия. Например, 5-метилтио-1,2,3-тритиан, выделяемый
- 18. Невыясненная проблема – это химические взаимодействия между различными видами водорослей в результате частичного перекрывания феромонных «букетов»
- 19. Эколого-биохимические взаимодействия грибов и других видов часто связаны с явлением паразитизма. У микофильных грибов выделены две
- 20. ХИМИЧЕСКИЕ СРЕДСТВА НАПАДЕНИЯ ГРИБОВ НА РАСТЕНИЯ 1. Патотоксины. Токсин гриба Цератоцистис вязовый (относится к Эуаскомицетам), вызывает
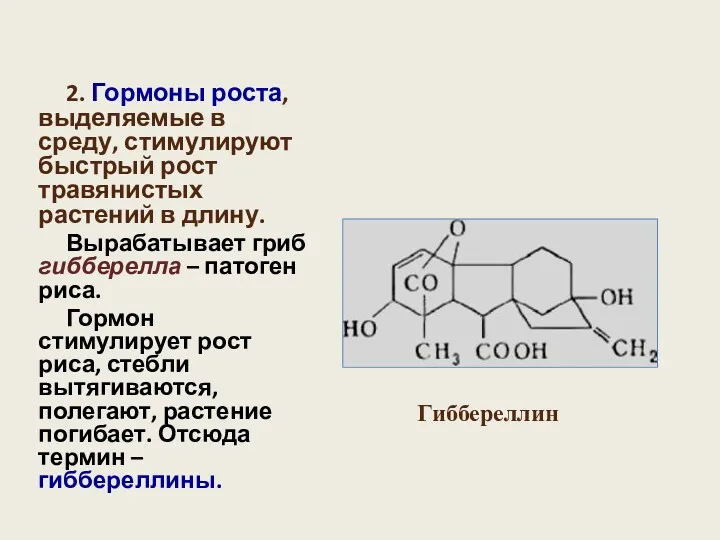
- 21. 2. Гормоны роста, выделяемые в среду, стимулируют быстрый рост травянистых растений в длину. Вырабатывает гриб гибберелла
- 22. 3. Ферменты: 1) пектиназы (отделяют микрофибриллы целлюлозы от матрикса клеточной стенки); 2) целлюлазы и гемицеллюлазы (расщепляют
- 23. 4. Вещества, влияющие на сосудистую проводимость растений. Полисахаридные клеи и др. вещества. Гриб фузариум оксиспорум вырабатывает
- 24. 5. Вещества, влияющие на накопление растением первичных метаболитов. Гриб ризопус (кл. Зигомицеты), воздействуя на метаболизм, вызывает
- 25. 6. Хеморегуляторы направления роста гифов. Грибы паразиты используют метаболиты, выделяемые организмом хозяина, как сигнал-стимулятор роста гифов
- 26. Интересные факты! Японский биолог и физик Тошиюки Никагаки взял лабиринт, у одного входа он положил желтый
- 27. Physarum polycephalum – гриб из отряда слизистых миксомицетов, тело которого представляет собой гигантскую клетку с многоядерной
- 28. На следующем этапе эксперимента ученый взял фрагмент того же самого Physarum polycephalum, который принимал участие в
- 29. В своем третьем эксперименте Тошиюки Никагаки положил гриб на объемную карту Японии – на то место,
- 30. С грибами-паразитами приходится бороться грибам других видов, растениям и животным. Средства защиты – антифунгальные вещества и
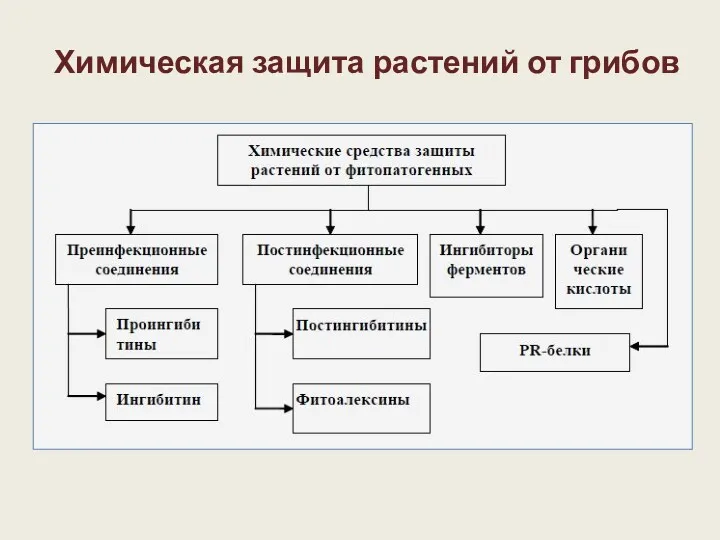
- 31. Химическая защита растений от грибов
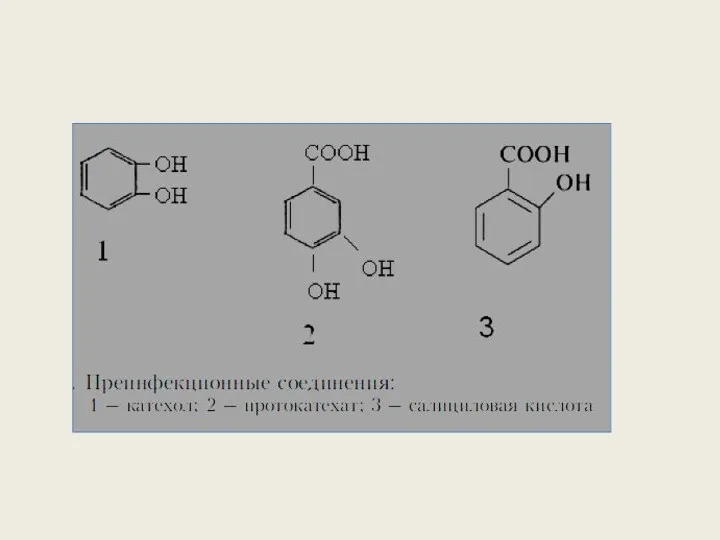
- 32. Средства защиты делят на 2 группы: 1. Преинфекционные вещества. Имеются в растении независимо от того, будет
- 33. Роль преинфекционных веществ выходит за рамки индивидуальной устойчивости растений к патогену. Они также участвуют в аллелопатическом
- 35. 2. Постинфекционные вещества. Отсутствуют в здоровом растении и вырабатываются после внедрения патогена. а) Постингибитины (образуются после
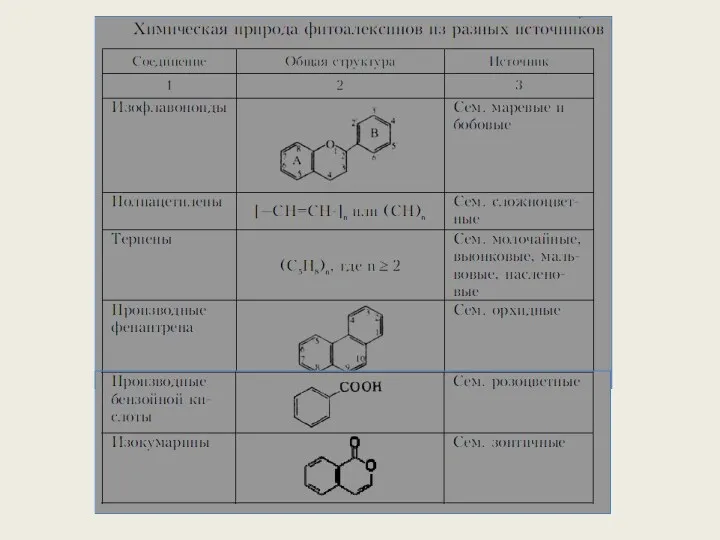
- 36. б) Фитоалексины (синтезируются de novo, например, в результате активации латентной ферментной системы веществами патогена. Известны фитоалексины
- 38. Синтез фитоалексинов в растениях может активироваться веществами, вырабатываемыми грибом. Эти вещества называются элиситорами. Установлены элиситорные свойства
- 39. Элиситоры также являются сигналом запуска биосинтеза так называемых PR-белков (англ. pathogenesis related), которые участвуют в формировании
- 40. Правила, которые необходимо соблюдать для индукции устойчивости растений к болезням с помощью биотических элиситоров: 1. Индуцирование
- 41. Эффективность применения элиситоров характеризуется: • более высокой экологической безопасностью, так как основана на активизации природных механизмов
- 42. Рассмотрим некоторые биогенные элиситоры, перспективные для иммунизации растений. Липиды. Элиситорными свойствами в отношении картофеля обладают ненасыщенные
- 43. Хитозан, образуя комплексы с анионными пероксидазами, вызывает утолщение и лигнификацию клеточных стенок, а, соединяясь с нуклеиновыми
- 44. Харпины. В последние годы началось коммерческое использование и бактериальных элиситоров. Один из них messenger в качестве
- 45. Обольщаться не следует, обработка элиситорами имеет свои недостатки: многие из веществ с элиситорным действием фитотоксичны, на
- 46. ЭКОЛОГИЧЕСКАЯ РОЛЬ ЗАЩИТНЫХ ВЕЩЕСТВ РАСТЕНИЙ И ХИМИЧЕСКИХ СРЕДСТВ АГРЕССИИ ГРИБОВ. Использование средств защиты и нападения грибов
- 47. Практическое значение защитных веществ растений Умелое использование и активация природных биохимических механизмов защиты растений от грибов
- 48. В результате обработки растений элиситорами: слабо вирулентными штаммами грибов, препаратами клеточных стенок и глюканами из грибов,
- 49. ЭКОЛОГО-БИОХИМИЧЕСКИЕ ВЗАИМОДЕЙСТВИЯ С УЧАСТИЕМ ВЫСШИХ РАСТЕНИЙ Химические взаимодействия, в которых участвуют высшие растения, с точки зрения
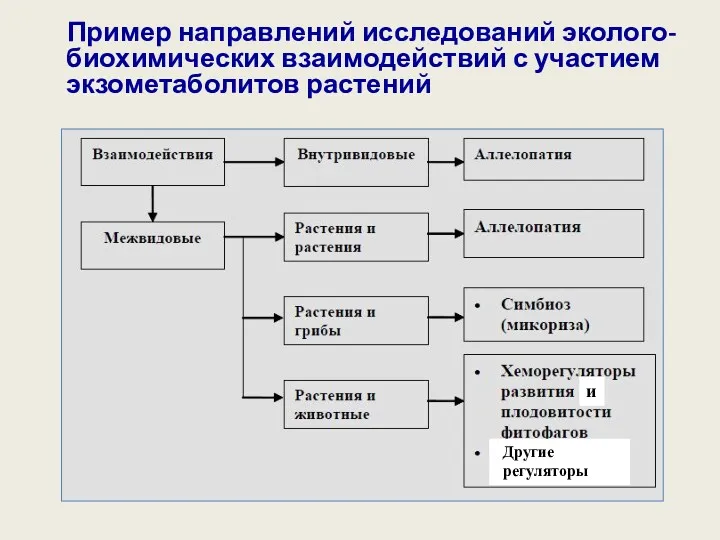
- 50. Пример направлений исследований эколого-биохимических взаимодействий с участием экзометаболитов растений Другие регуляторы и
- 51. Взаимодействия между высшими растениями Эколого-биохимические взаимодействия между высшими растениями являются, по своей сути, аллелопатией. Термин был
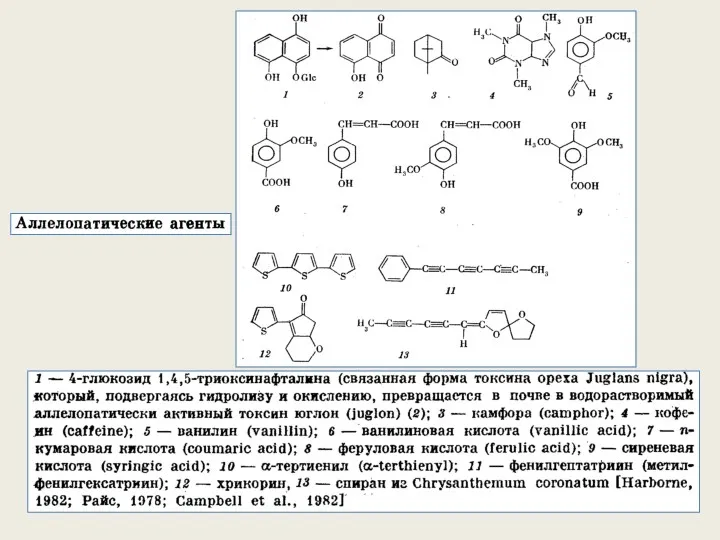
- 53. Примеры проявления аллелопатии Аллелопатический экзометаболит, продуцируемый определенными видами растений, может оказывать губительное действие на одни виды
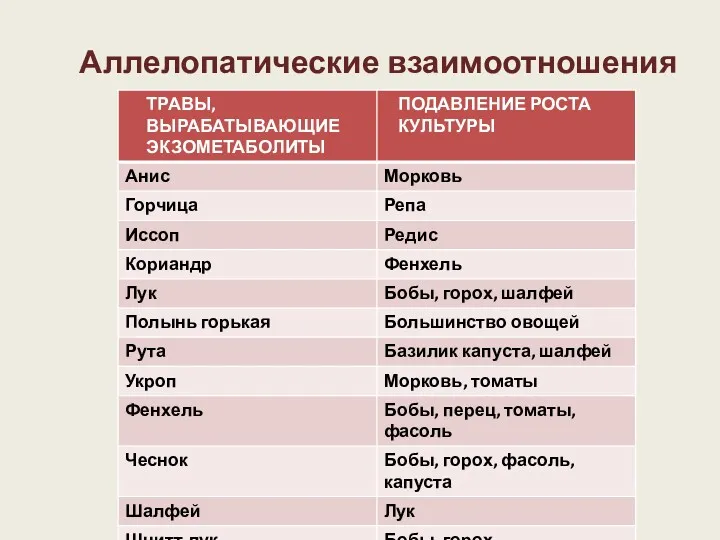
- 54. Аллелопатические взаимоотношения
- 55. Проявление аллелопатии может определяться условиями произрастания. Так, эвкалипты, акклиматизированные в США, подавляют рост подлеска в местах
- 56. Аллелопатические взаимодействия между растениями могут опосредоваться животными. Пример – эвкалиптовые леса. Хемотаксины листьев Eucalyptus globules, подавляют
- 57. Например, на заброшенных полях в центральных штатах США выделяют 3 стадии сукцессии: 1-я – представлена мощными
- 58. Большинство пионерных видов аллелопатически подавляют рост друг друга, но практически не влияют на аристиду, что позволяет
- 60. Скачать презентацию





![Было показано [Hagen, Spraguer 1984], что а-фактор индуцирует быстрое увеличение](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/251212/slide-7.jpg)
![Примеры ауторегуляторов грибов и слизевиков (по данным А. С. Хохлова [1988]; и др.)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/251212/slide-10.jpg)







































 Ферменты сыворотки и плазмы крови
Ферменты сыворотки и плазмы крови Голонасінні. Загальна характеристика
Голонасінні. Загальна характеристика Витамины в жизни человека. Понятия авитаминоз, гиповитаминоз
Витамины в жизни человека. Понятия авитаминоз, гиповитаминоз Эволюция. Чарльз Дарвин о причинах эволюции животного мира
Эволюция. Чарльз Дарвин о причинах эволюции животного мира Генная инженерия животных. Получение зигот
Генная инженерия животных. Получение зигот Происхождение многоклеточных животных. (Лекция 4)
Происхождение многоклеточных животных. (Лекция 4) Неклеточные формы жизни. Вирусы и бактериофаги
Неклеточные формы жизни. Вирусы и бактериофаги Почему в лесу будем соблюдать тишину
Почему в лесу будем соблюдать тишину Интерактивная игра ЭКО-ЯR
Интерактивная игра ЭКО-ЯR Биотехнологиядағы процестерді модельдеу теориясы. Жылулық процестер және аппараттар
Биотехнологиядағы процестерді модельдеу теориясы. Жылулық процестер және аппараттар Интересное о грибах
Интересное о грибах Особенности поперечно-полосатых и гладких мышц. Титин (тайтин/коннектин)
Особенности поперечно-полосатых и гладких мышц. Титин (тайтин/коннектин) Как звери ухаживают за детенышами
Как звери ухаживают за детенышами Выступление на районном методическом объединении Здоровесберегающие технологии в школе
Выступление на районном методическом объединении Здоровесберегающие технологии в школе Молочнокислые бактерии
Молочнокислые бактерии Сравнительная характеристика царств живой природы
Сравнительная характеристика царств живой природы Бактерии. Формы бактериальной клетки. Строение клетки бактерии. Размножение бактерий
Бактерии. Формы бактериальной клетки. Строение клетки бактерии. Размножение бактерий Спиной мозг. Позвоночник
Спиной мозг. Позвоночник Мышечная система. Строение мышц. Биология, 8 класс
Мышечная система. Строение мышц. Биология, 8 класс Смертность. Факторы, влияющие на смертность
Смертность. Факторы, влияющие на смертность Жануар және өсімдік майлары
Жануар және өсімдік майлары Презентация урока на тему Кровь и кровообращение. Состав крови
Презентация урока на тему Кровь и кровообращение. Состав крови Цветковые растения
Цветковые растения Тип Плоские Черви
Тип Плоские Черви Анатомия органов дыхания
Анатомия органов дыхания Мозг: как он устроен и работает
Мозг: как он устроен и работает Биомембраны. Пассивный и активный транспорт веществ
Биомембраны. Пассивный и активный транспорт веществ Водоросли. 5 класс
Водоросли. 5 класс