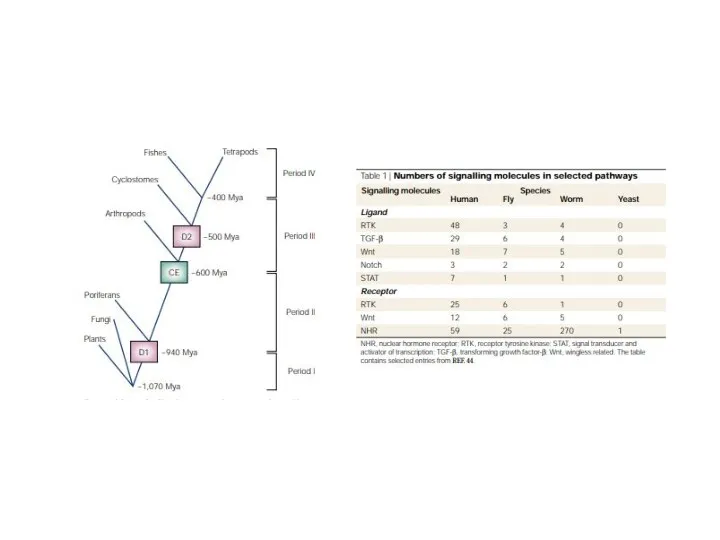
Содержание
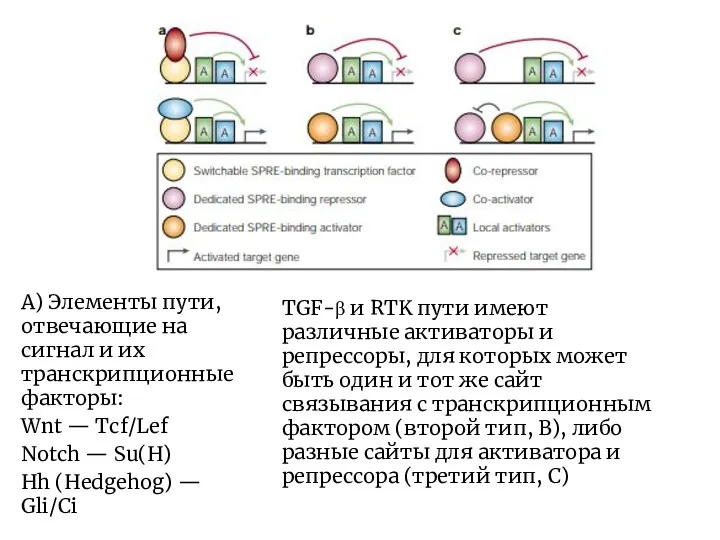
- 3. А) Элементы пути, отвечающие на сигнал и их транскрипционные факторы: Wnt — Tcf/Lef Notch — Su(H)
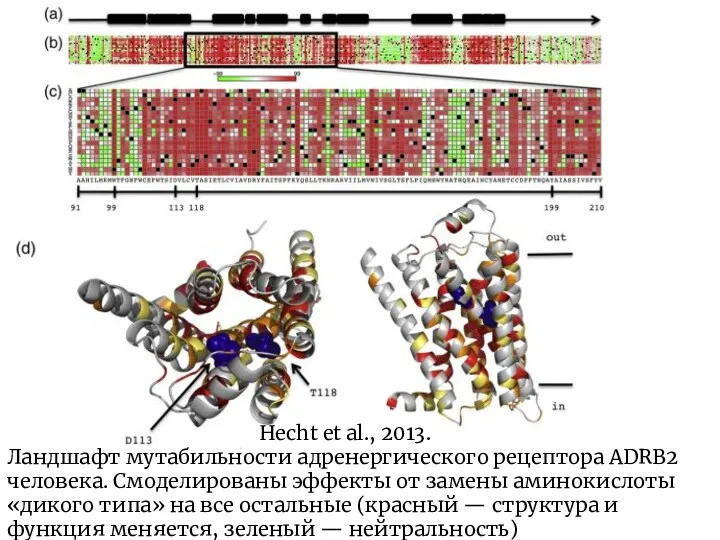
- 4. Hecht et al., 2013. Ландшафт мутабильности адренергического рецептора ADRB2 человека. Смоделированы эффекты от замены аминокислоты «дикого
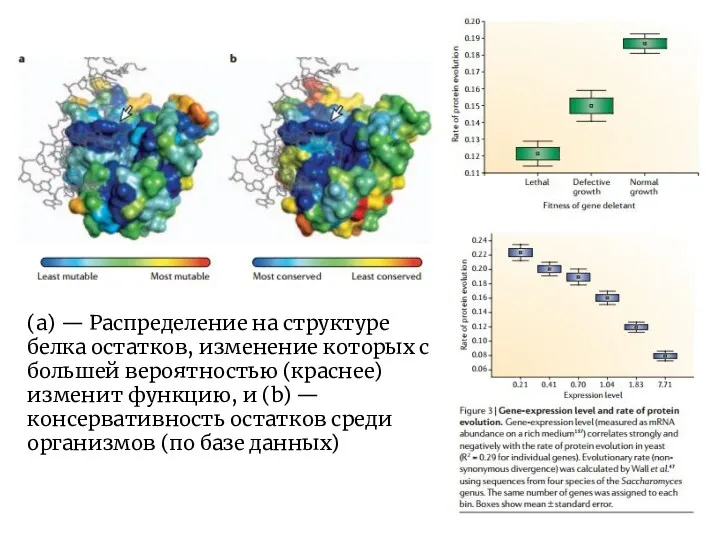
- 5. (a) — Распределение на структуре белка остатков, изменение которых с большей вероятностью (краснее) изменит функцию, и
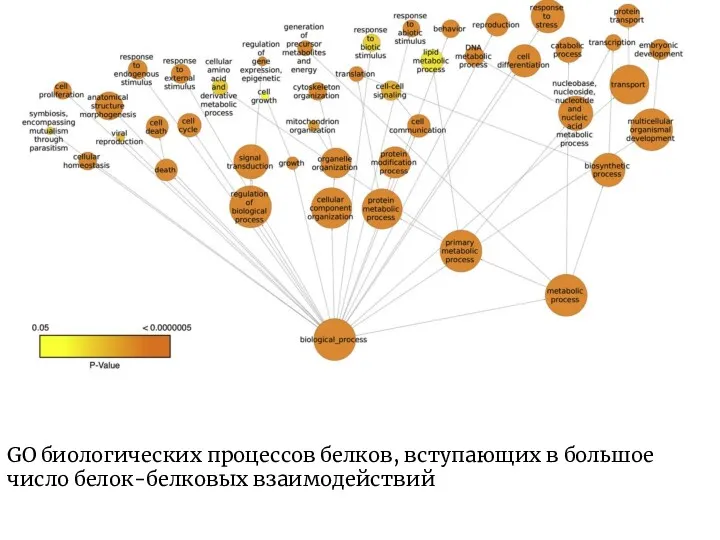
- 6. GO биологических процессов белков, вступающих в большое число белок-белковых взаимодействий
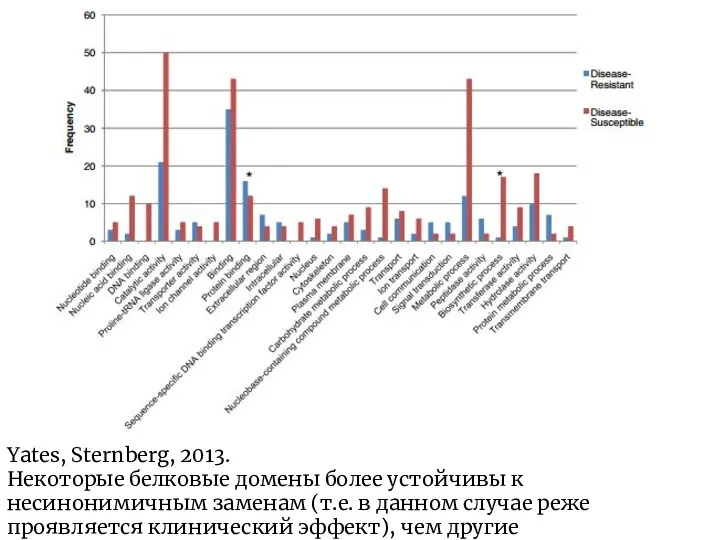
- 7. Yates, Sternberg, 2013. Некоторые белковые домены более устойчивы к несинонимичным заменам (т.е. в данном случае реже
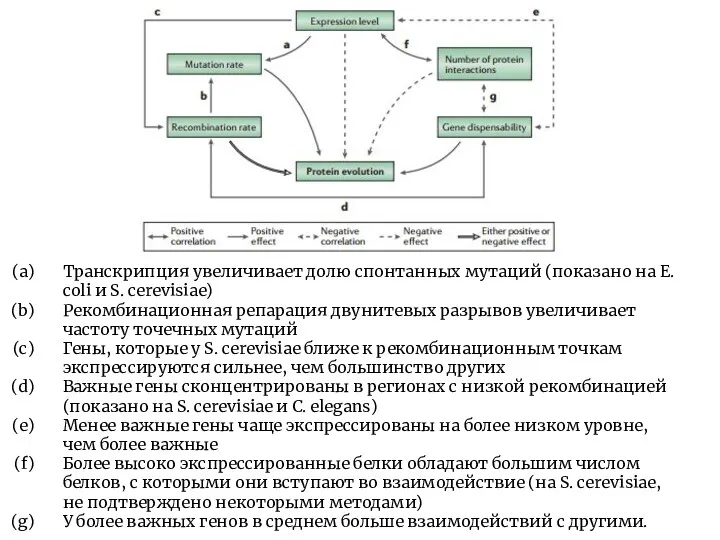
- 8. Транскрипция увеличивает долю спонтанных мутаций (показано на E. coli и S. cerevisiae) Рекомбинационная репарация двунитевых разрывов
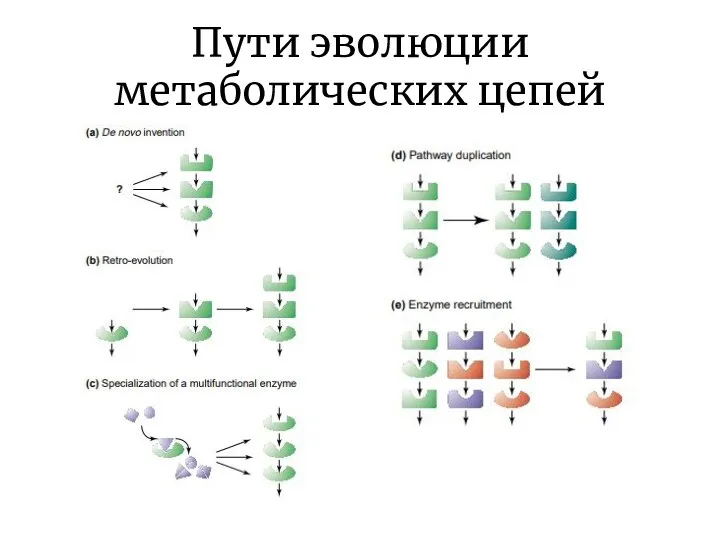
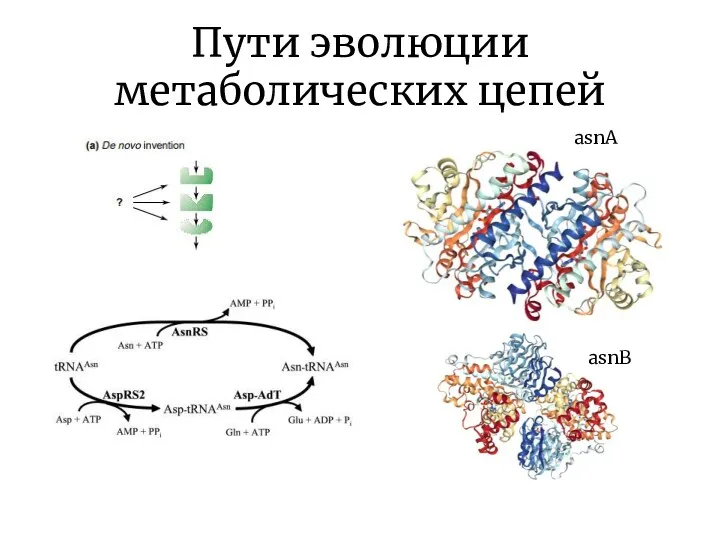
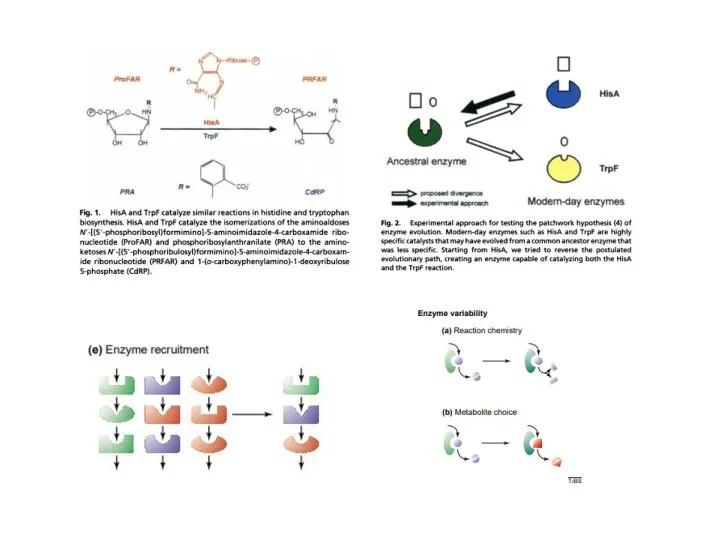
- 9. Пути эволюции метаболических цепей
- 10. Пути эволюции метаболических цепей asnA asnB
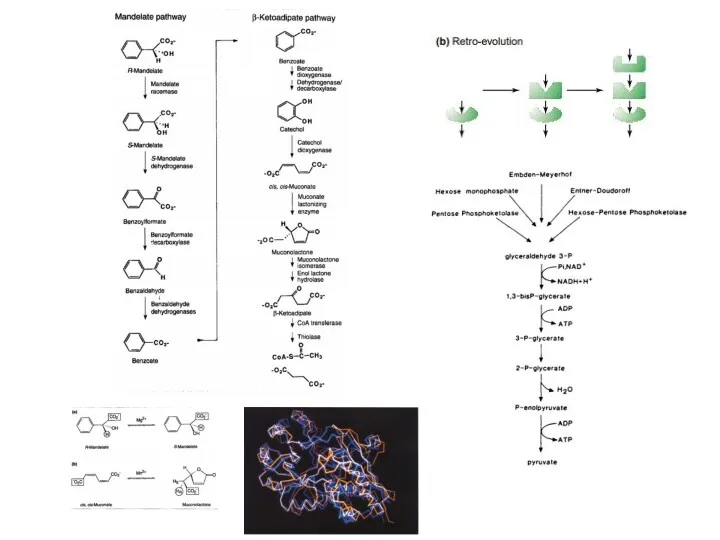
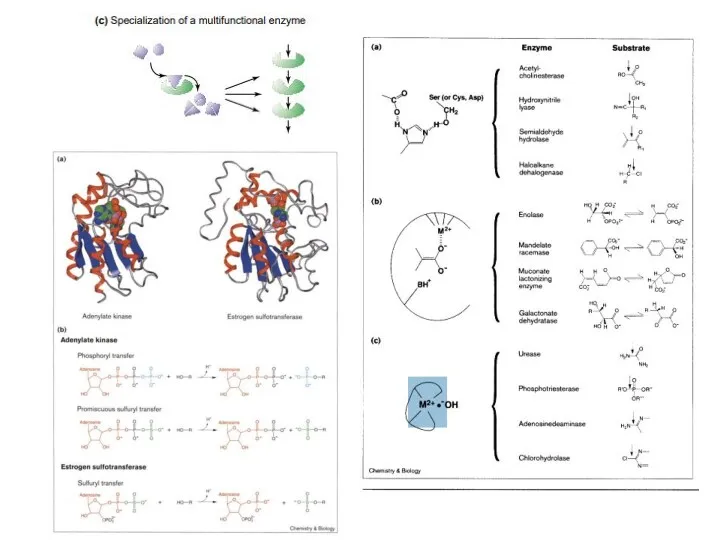
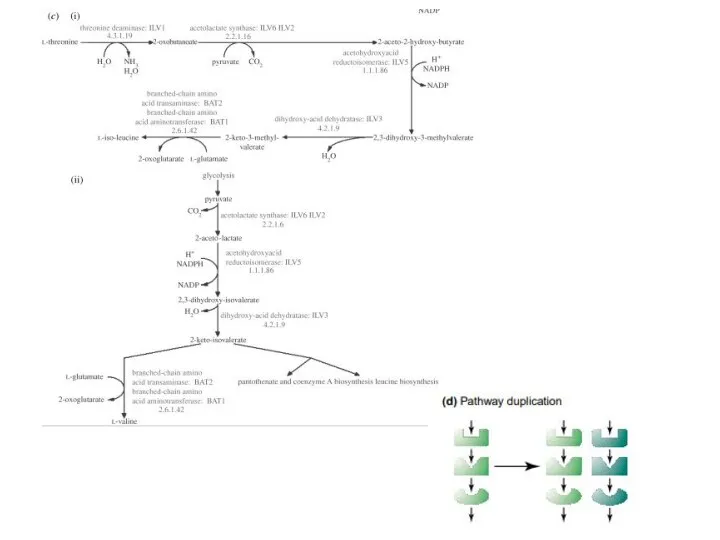
- 11. Пути эволюции метаболических цепей Модель «ретро-эволюции» предполагает, что отбор действует, в основном, на выход конечного продукта
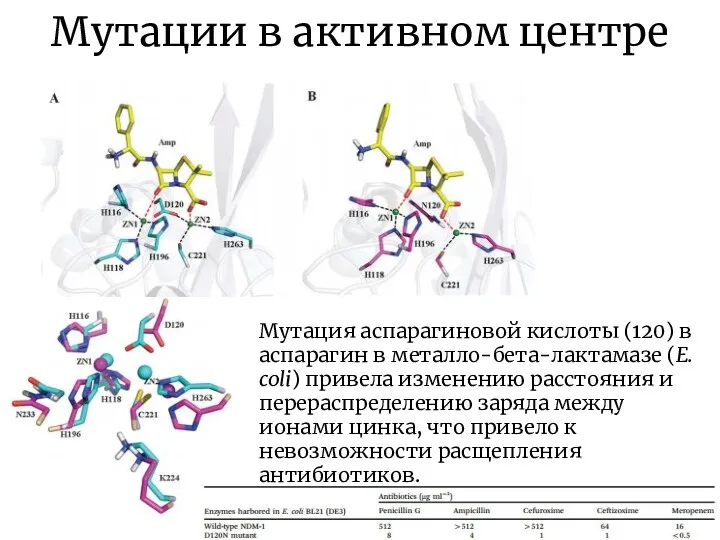
- 16. Мутации в активном центре Мутация аспарагиновой кислоты (120) в аспарагин в металло-бета-лактамазе (E. coli) привела изменению
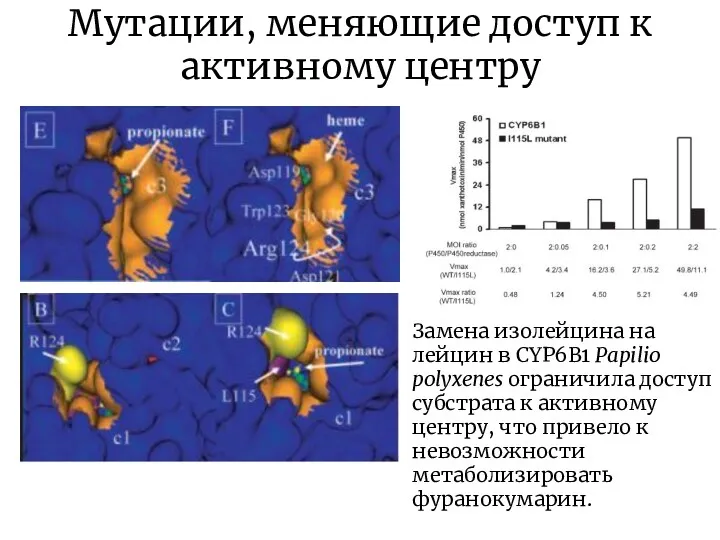
- 17. Мутации, меняющие доступ к активному центру Замена изолейцина на лейцин в CYP6B1 Papilio polyxenes ограничила доступ
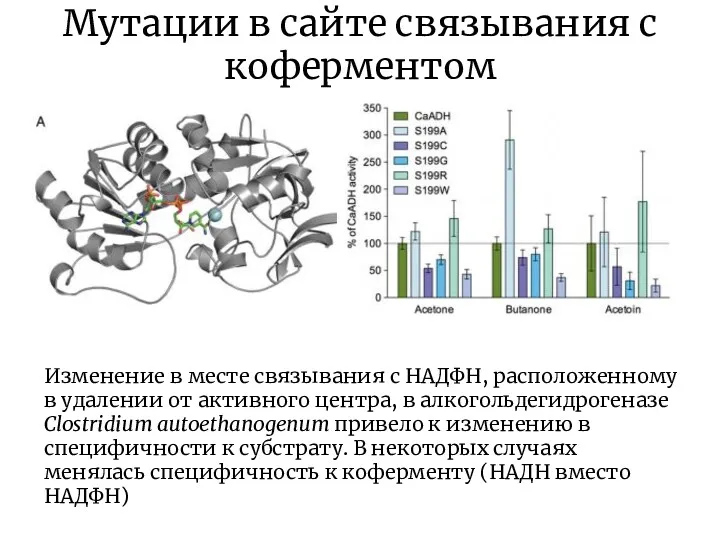
- 18. Мутации в сайте связывания с коферментом Изменение в месте связывания с НАДФН, расположенному в удалении от
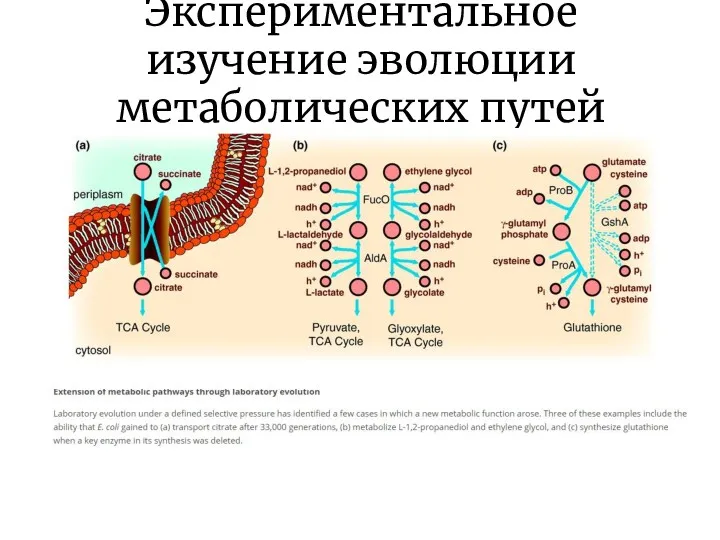
- 19. Экспериментальное изучение эволюции метаболических путей
- 20. Цена за аминокислоту У высоко экспрессированных белков E. coli отбираются те аминокислоты, чья энергетическая цена синтеза
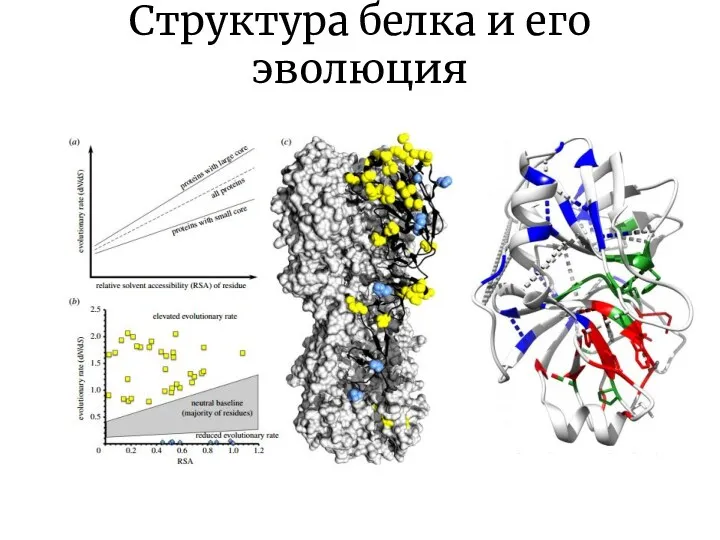
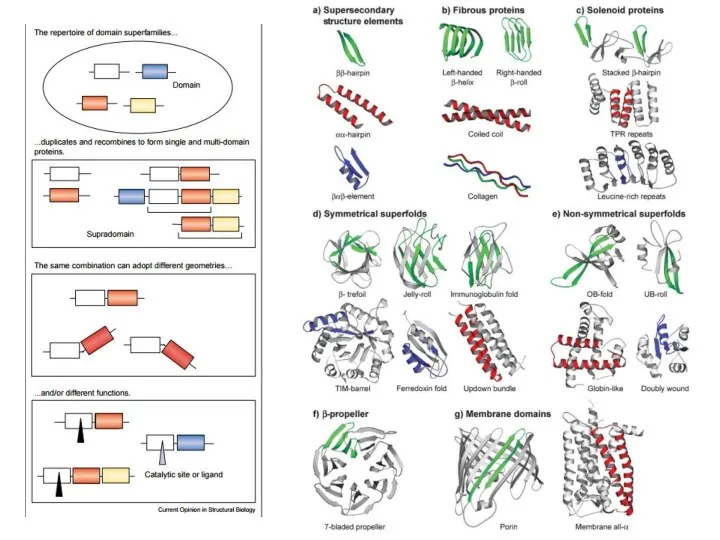
- 21. Структура белка и его эволюция
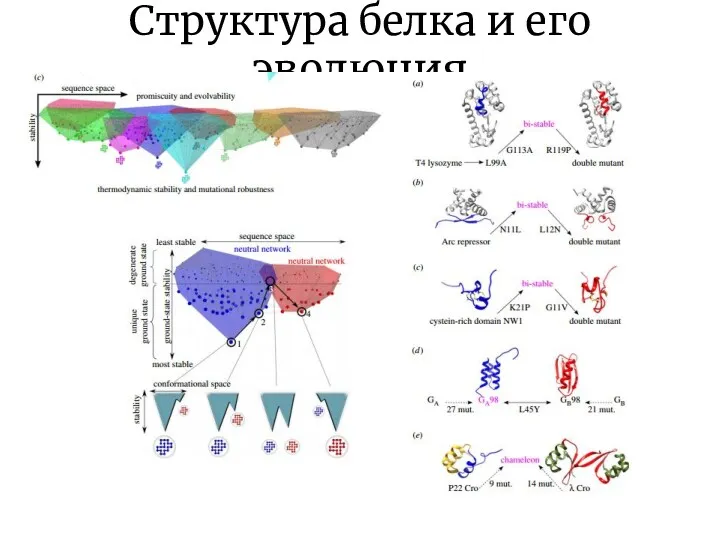
- 23. Структура белка и его эволюция
- 25. Скачать презентацию


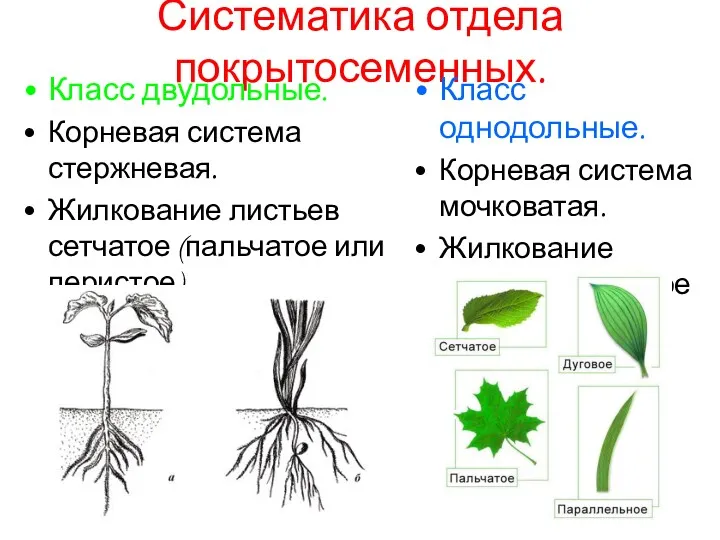 Систематика отдела покрытосеменных
Систематика отдела покрытосеменных Организменный уровень
Организменный уровень Гистология органов пищеварения
Гистология органов пищеварения Лекарственные растения
Лекарственные растения Класс Насекомые
Класс Насекомые Капуста
Капуста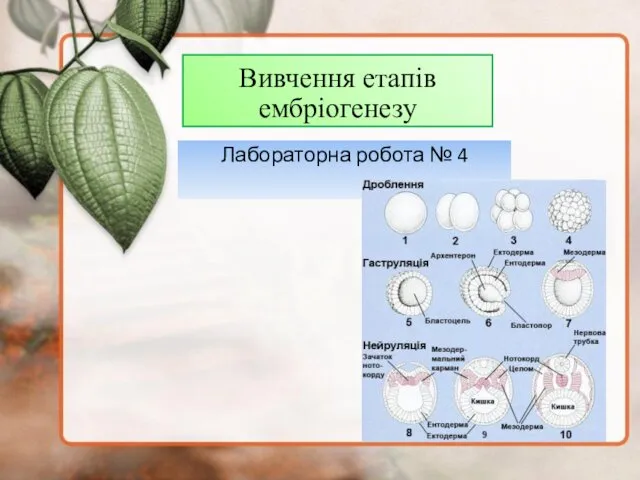 Вивчення етапів ембріогенезу
Вивчення етапів ембріогенезу Многообразие млекопитающих. Отряд китообразные
Многообразие млекопитающих. Отряд китообразные Эпителиальные ткани
Эпителиальные ткани Описание результатов исследования. Тема 8. Биология. 5 класс
Описание результатов исследования. Тема 8. Биология. 5 класс Продолговатый мозг. Черепно-мозговые нервы (IX - XII)
Продолговатый мозг. Черепно-мозговые нервы (IX - XII) Понимание биологии. (Часть 2)
Понимание биологии. (Часть 2) Улитка Ахатина идеальный домашний питомец
Улитка Ахатина идеальный домашний питомец Размножение. Мейоз
Размножение. Мейоз Рослини влітку. Урок №95. Я досліджую світ
Рослини влітку. Урок №95. Я досліджую світ Экстерьер головы
Экстерьер головы Тип голкошкірі
Тип голкошкірі Презентация-тренажёр Формула цветка
Презентация-тренажёр Формула цветка Тварини та рослини Червоної книги України
Тварини та рослини Червоної книги України Тест. Жизнедеятельность клетки. Метаболизм: энергетический и пластический обмен. Фотосинтез
Тест. Жизнедеятельность клетки. Метаболизм: энергетический и пластический обмен. Фотосинтез Кровеносная система
Кровеносная система Популяции
Популяции Людина розумна – біологічний вид
Людина розумна – біологічний вид Красная книга Карелии
Красная книга Карелии Регуляция матричных синтезов. Ингибиторы матричных синтезов
Регуляция матричных синтезов. Ингибиторы матричных синтезов Үздікті (үзілісті) қосылыстар, буындар Буын биомеханикасы
Үздікті (үзілісті) қосылыстар, буындар Буын биомеханикасы Кожа и её производные
Кожа и её производные Класс Птицы
Класс Птицы