Содержание
- 2. План лекции Кинетика ферментативных реакций. Регуляция скорости ферментативных реакций. Клеточная сигнализация
- 3. 1. Кинетика ферментативных реакций Кинетика ферментативных реакций -направление энзимологии, исследующее влияния реагирующих веществ (субстраты, продукты, ингибиторы,
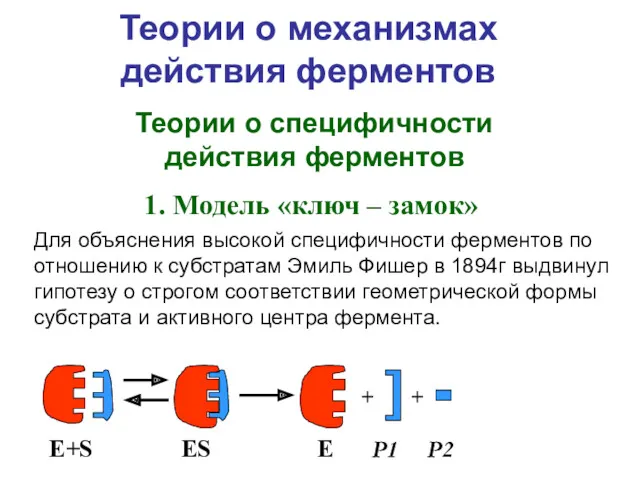
- 4. Теории о механизмах действия ферментов Для объяснения высокой специфичности ферментов по отношению к субстратам Эмиль Фишер
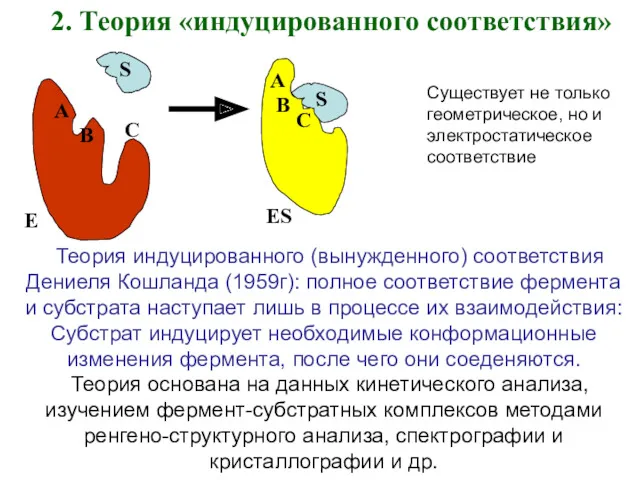
- 5. 2. Теория «индуцированного соответствия» A B C S E B A C ES Теория индуцированного (вынужденного)
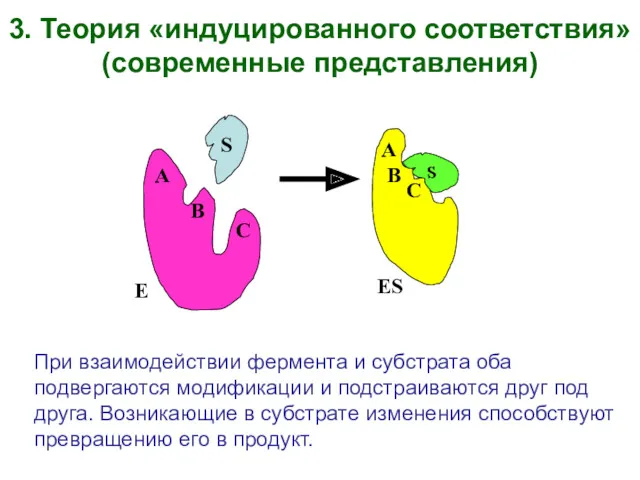
- 6. При взаимодействии фермента и субстрата оба подвергаются модификации и подстраиваются друг под друга. Возникающие в субстрате
- 7. S E ES при взаимодействии фермента E с субстратом S образует комплекс ES*, в котором реакционная
- 8. Механизмы ферментативных реакции Кислотно-основные реакции –в активном центре фермента находятся группы -СОО- и -NН3+, которые способны
- 9. Энергетика ферментативных реакций Ферменты снижают энергию активации Скорость химической реакции зависит от концентрации реагирующих веществ В
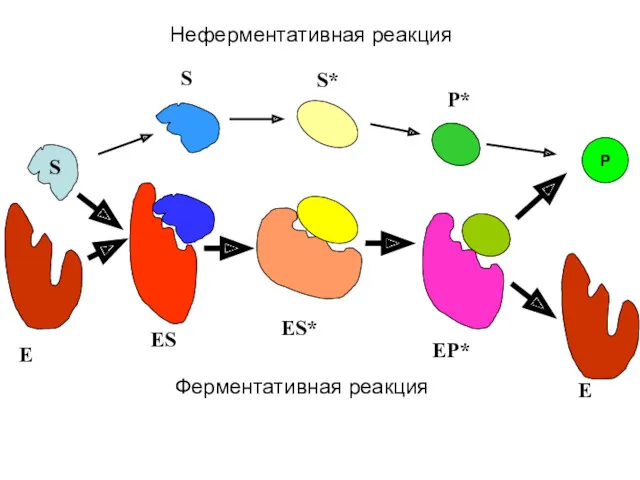
- 10. S E ES ES* P E EP* S S* P* Ферментативная реакция Неферментативная реакция
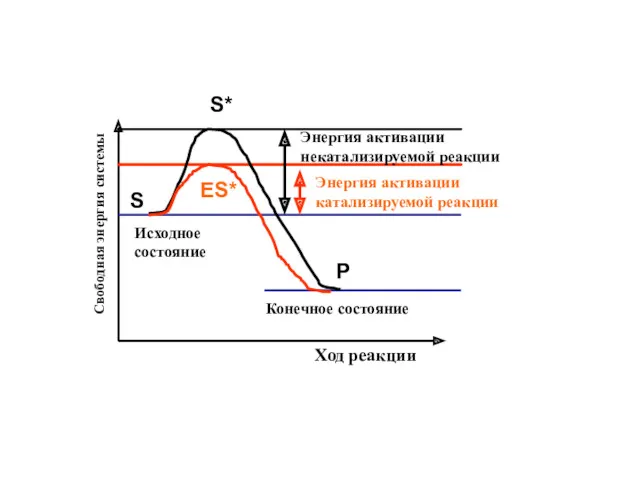
- 11. ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР РЕАКЦИИ – кол-во энергии, которое необходимо молекуле, чтобы вступить в химическую реакцию. ЭНЕРГИЯ АКТИВАЦИИ
- 12. Свободная энергия системы Ход реакции Исходное состояние Конечное состояние Энергия активации катализируемой реакции Энергия активации некатализируемой
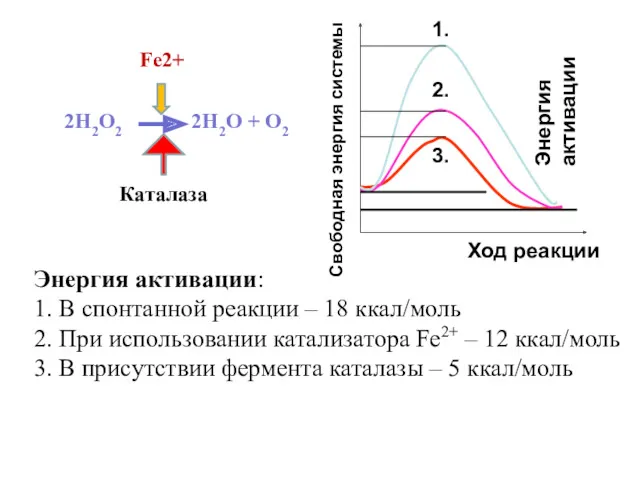
- 13. 2Н2О2 2Н2О + О2 Каталаза Энергия активации: 1. В спонтанной реакции – 18 ккал/моль 2. При
- 14. Зависимость скорости реакции от концентрации субстрата [S] Vmax Концентрация фермента - константа Кинетика ферментативных реакций
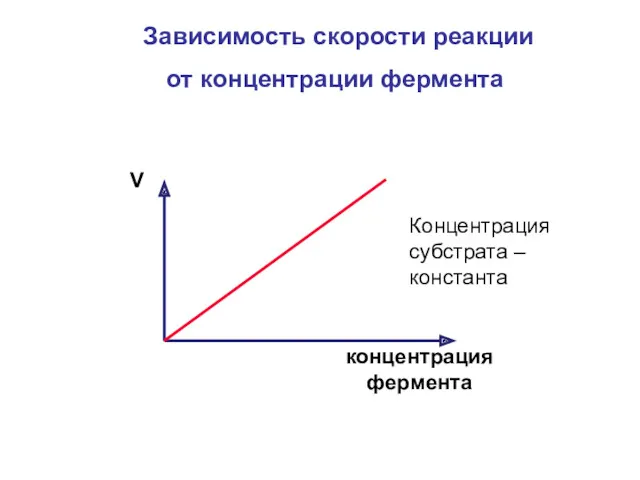
- 15. Зависимость скорости реакции от концентрации фермента концентрация фермента V Концентрация субстрата – константа
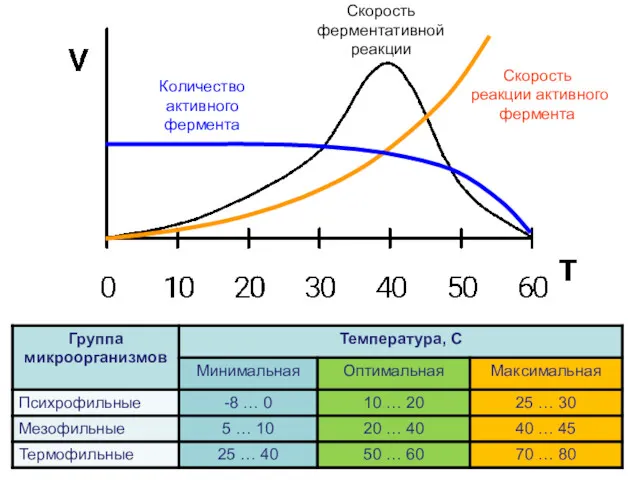
- 16. Влияние температуры на скорость ферментативной реакции Повышение температуры на 10 градусов повышает скорость химической реакции в
- 17. Количество активного фермента Скорость ферментативной реакции Скорость реакции активного фермента
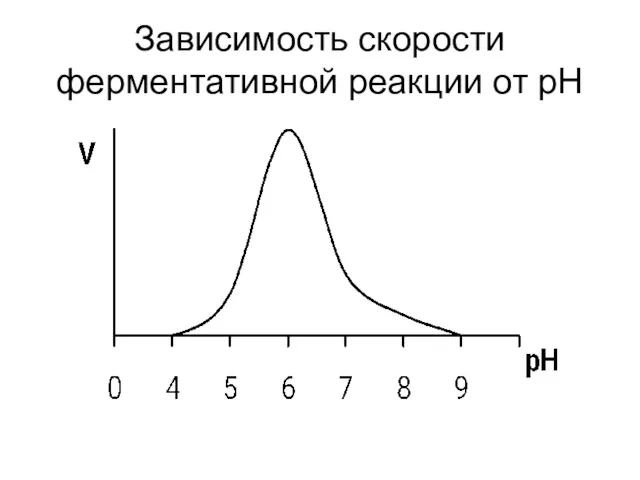
- 18. Влияние рН на скорость ферментативной реакции Изменение концентрации Н+ меняет химический состав фермента, его строение и
- 19. Зависимость скорости ферментативной реакции от рН
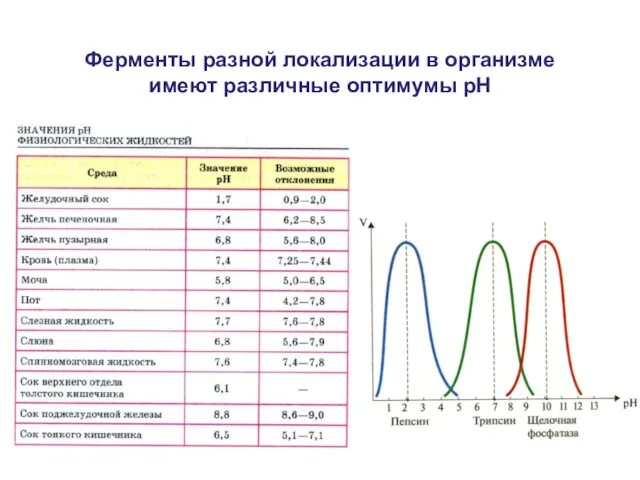
- 20. Ферменты разной локализации в организме имеют различные оптимумы рН
- 21. Константа Михаэлиса-Ментона Km – концентрация субстрата [S], при которой скорость ферментативной реакции V равна половине от
- 22. Vmax [S] V = —————- Km + [S] V – скорость реакции Vmax – максимальная скорость
- 23. Влияние активаторов и ингибиторов на скорость ферментативных реакций
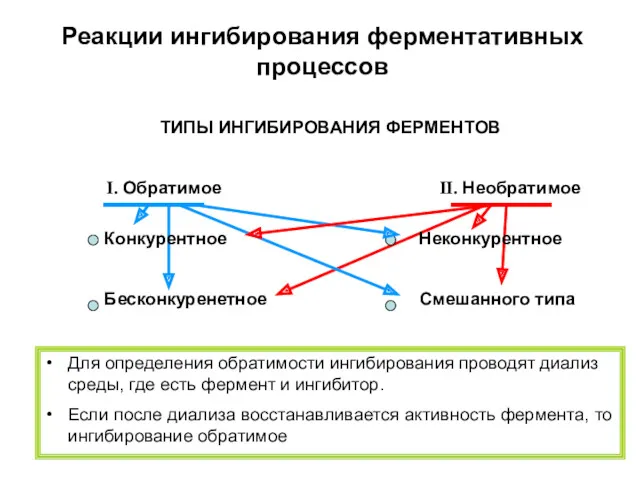
- 24. Реакции ингибирования ферментативных процессов ТИПЫ ИНГИБИРОВАНИЯ ФЕРМЕНТОВ I. Обратимое II. Необратимое Конкурентное Неконкурентное Бесконкуренетное Смешанного типа
- 25. Варианты взаимодействия ингибитора с ферментом Блокируют активный центр фермента Меняют четвертичную структуру фермента Соединяются с коферментом,
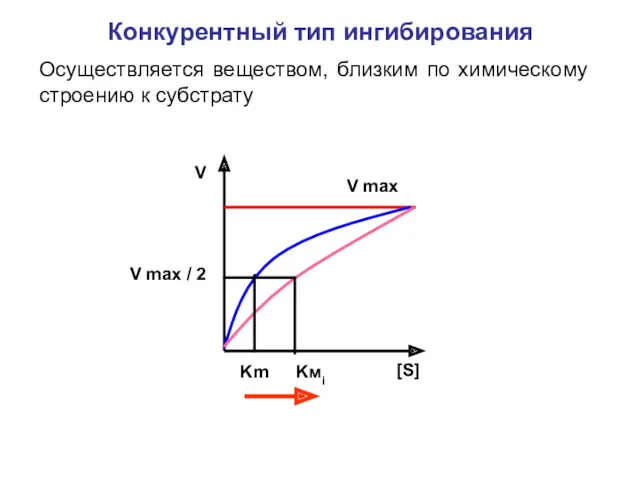
- 26. Конкурентный тип ингибирования Осуществляется веществом, близким по химическому строению к субстрату V max V [S] V
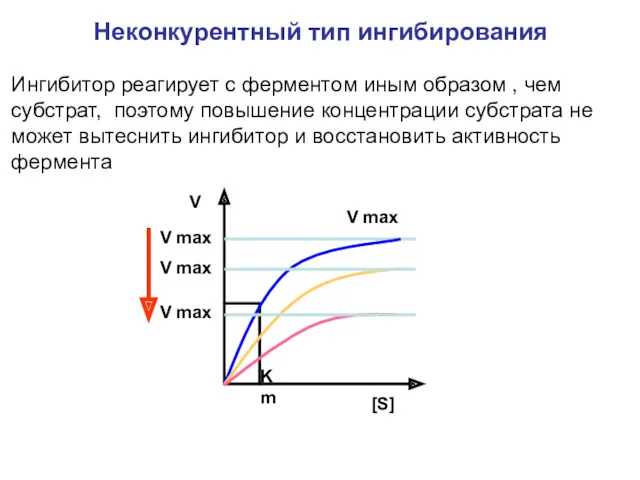
- 27. Ингибитор реагирует с ферментом иным образом , чем субстрат, поэтому повышение концентрации субстрата не может вытеснить
- 28. 2. Регуляция скорости ферментативных реакций в организме
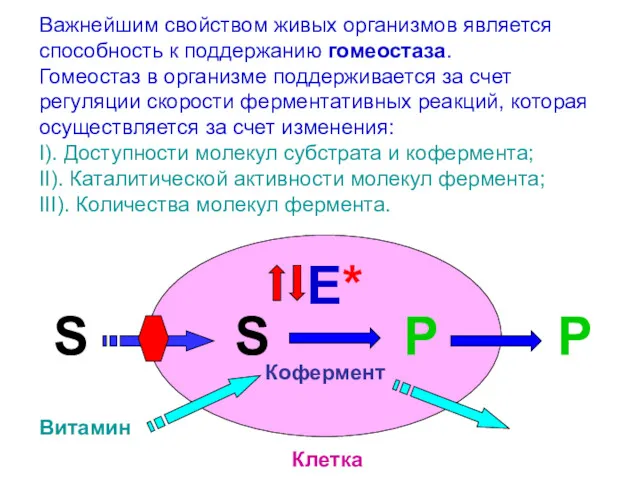
- 29. Важнейшим свойством живых организмов является способность к поддержанию гомеостаза. Гомеостаз в организме поддерживается за счет регуляции
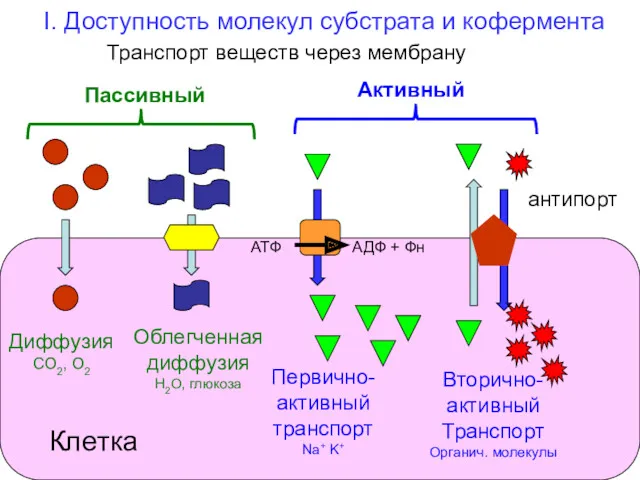
- 30. I. Доступность молекул субстрата и кофермента Транспорт веществ через мембрану Диффузия СО2, О2 Облегченная диффузия Н2О,
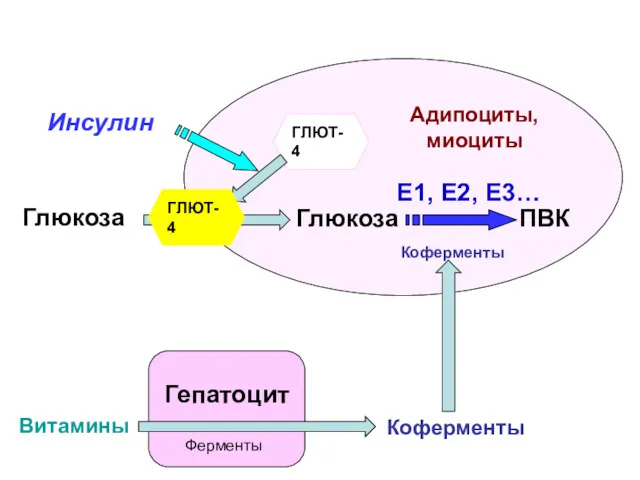
- 31. Гепатоцит Глюкоза Коферменты Витамины Адипоциты, миоциты Глюкоза ГЛЮТ-4 Инсулин Ферменты ГЛЮТ-4 ПВК Коферменты E1, Е2, Е3…
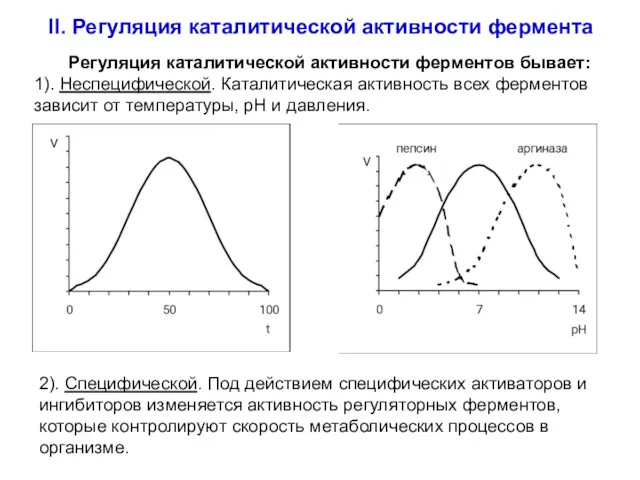
- 32. II. Регуляция каталитической активности фермента Регуляция каталитической активности ферментов бывает: 1). Неспецифической. Каталитическая активность всех ферментов
- 33. Механизмы специфической регуляции каталитической активности ферментов: 1). Аллостерическая регуляция; 2). Регуляция с помощью белок-белковых взаимодействий; 3).
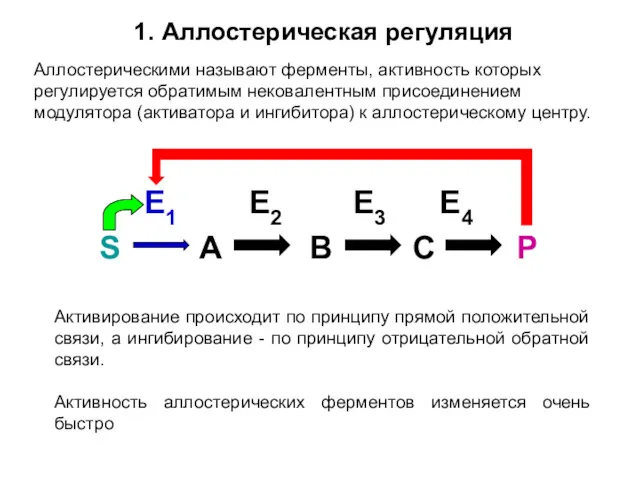
- 34. 1. Аллостерическая регуляция Аллостерическими называют ферменты, активность которых регулируется обратимым нековалентным присоединением модулятора (активатора и ингибитора)
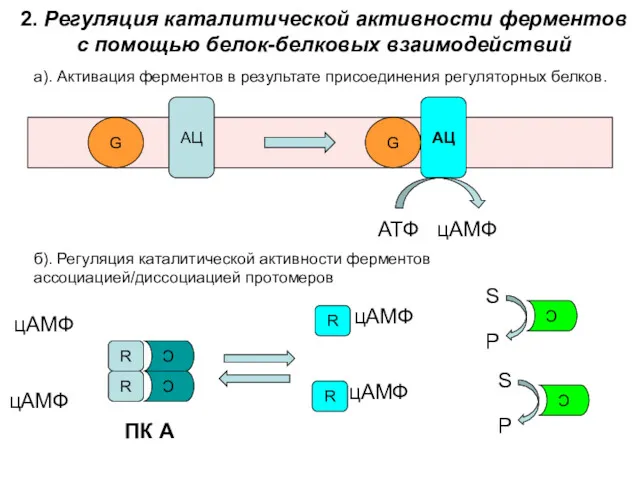
- 35. 2. Регуляция каталитической активности ферментов с помощью белок-белковых взаимодействий а). Активация ферментов в результате присоединения регуляторных
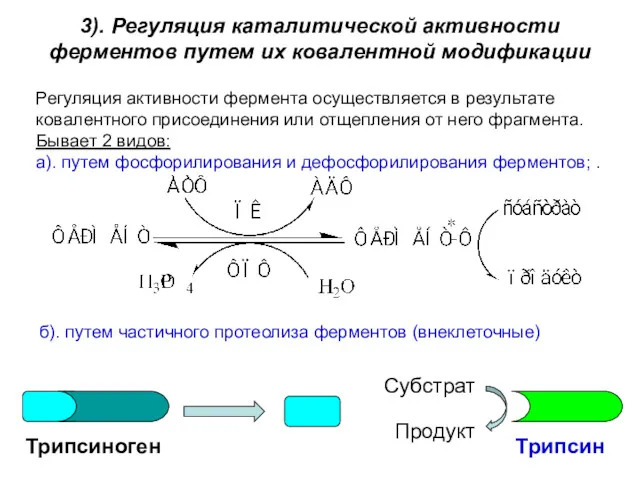
- 36. 3). Регуляция каталитической активности ферментов путем их ковалентной модификации Регуляция активности фермента осуществляется в результате ковалентного
- 37. III. Механизмы регуляции количества ферментов Индукторы - это вещества которые запускают синтез ферментов Процесс запуска синтеза
- 38. Репрессоры (точнее корепрессоры) - вещества, которые останавливают синтез ферментов. Процесс остановки синтеза ферментов называется репрессией. Дерепрессией
- 39. 3. Клеточная сигнализация
- 40. В многоклеточных организмах поддержание гомеостаза обеспечивают 3 системы: 1). Нервная 2). Гуморальная 3). Иммунная Регуляторные системы
- 41. Гормоны - это сигнальные молекулы беспроводного системного действия Истинные гормоны в отличии от других сигнальных молекул:
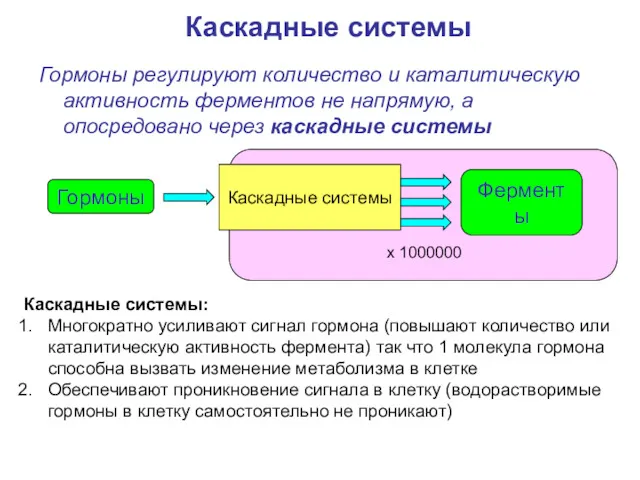
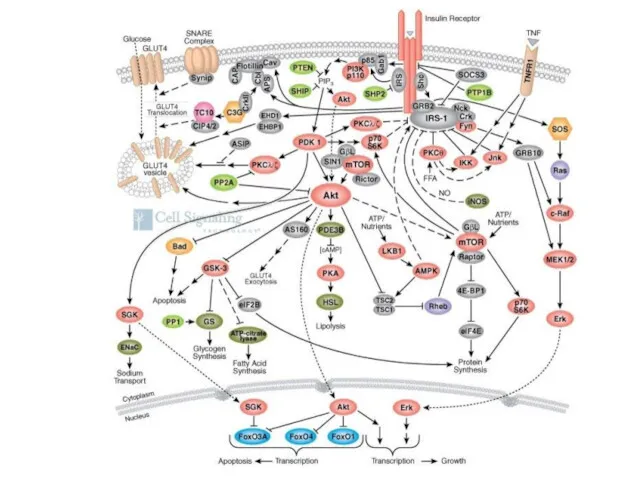
- 42. Гормоны регулируют количество и каталитическую активность ферментов не напрямую, а опосредовано через каскадные системы Каскадные системы
- 43. каскадные системы состоят из: рецепторов; регуляторных белков (G-белки, IRS, Shc, STAT и т.д.). вторичных посредников (messenger
- 44. Рецепторы По эффекту рецепторы делятся на: активаторные (активируют каскадные системы) ингибиторные (блокируют каскадные системы). Рецепторы -
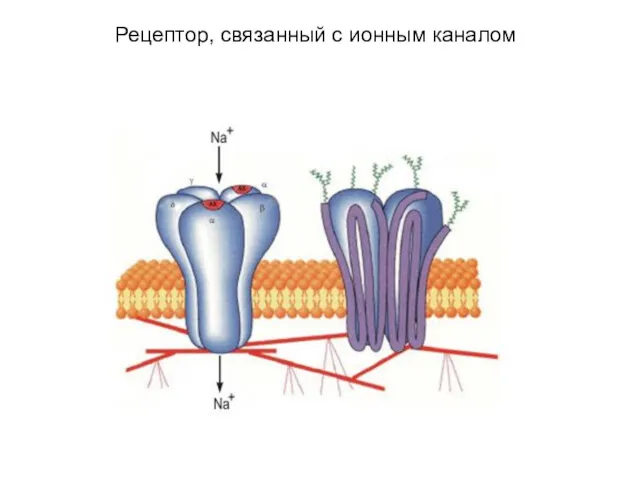
- 45. Рецептор, связанный с ионным каналом
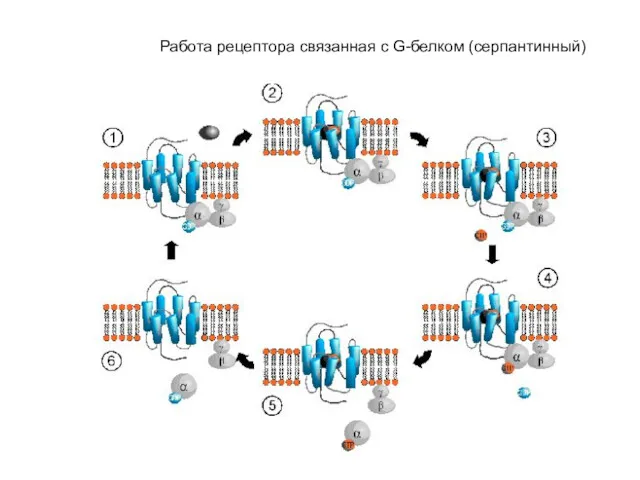
- 46. Работа рецептора связанная с G-белком (серпантинный)
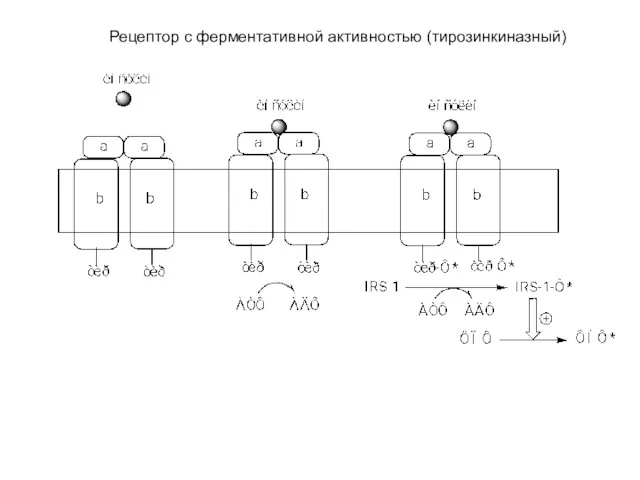
- 47. Рецептор с ферментативной активностью (тирозинкиназный)
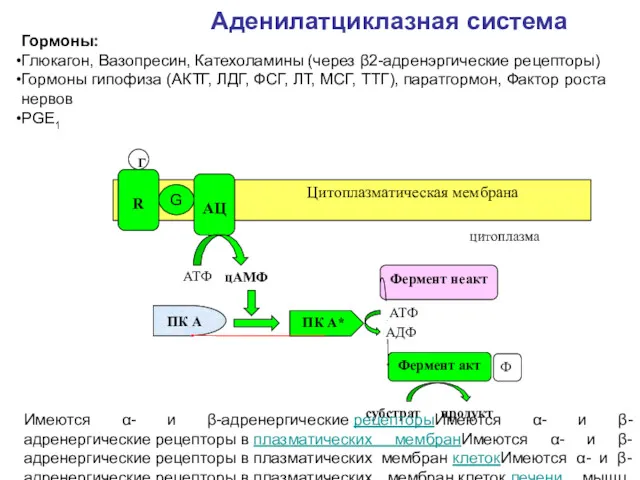
- 49. Аденилатциклазная система ПК А Фермент неакт Фермент акт АТФ АДФ Ф субстрат продукт Цитоплазматическая мембрана AЦ
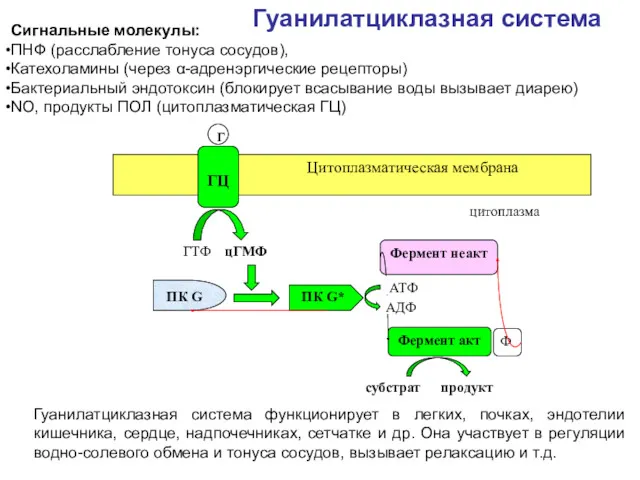
- 50. Гуанилатциклазная система Сигнальные молекулы: ПНФ (расслабление тонуса сосудов), Катехоламины (через α-адренэргические рецепторы) Бактериальный эндотоксин (блокирует всасывание
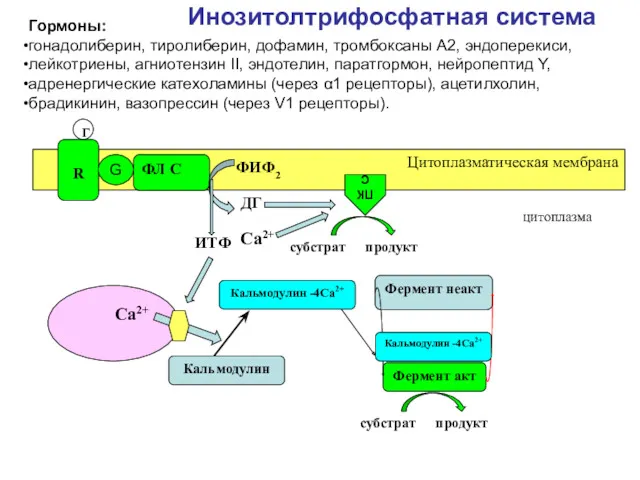
- 51. Инозитолтрифосфатная система Фермент неакт Фермент акт субстрат продукт Цитоплазматическая мембрана ФЛ С Г ФИФ2 ПК С
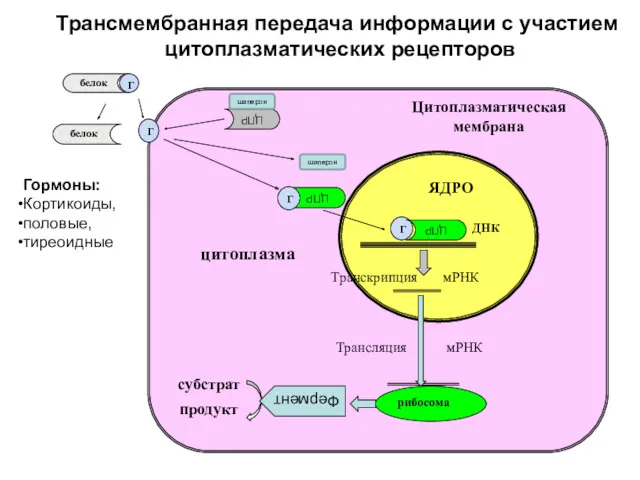
- 52. Г белок белок Транскрипция мРНК ДНК Трансляция мРНК ЯДРО Цитоплазматическая мембрана субстрат продукт цитоплазма ЦПР ЦПР
- 54. Скачать презентацию






![Зависимость скорости реакции от концентрации субстрата [S] Vmax Концентрация фермента - константа Кинетика ферментативных реакций](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/155236/slide-13.jpg)


![Константа Михаэлиса-Ментона Km – концентрация субстрата [S], при которой скорость](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/155236/slide-20.jpg)
![Vmax [S] V = —————- Km + [S] V –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/155236/slide-21.jpg)











 Фотосинтез
Фотосинтез Общая характеристика царства Растения
Общая характеристика царства Растения Высшая нервная деятельность человека
Высшая нервная деятельность человека Пищеварение в ротовой полости
Пищеварение в ротовой полости Личностно-ориентированная технология на уроках биологии
Личностно-ориентированная технология на уроках биологии Нервная система
Нервная система Вид. Критерии вида
Вид. Критерии вида Внутрішнє середовище організму. Кров, її склад та функції
Внутрішнє середовище організму. Кров, її склад та функції Размножение многоклеточных животных
Размножение многоклеточных животных Презентация к уроку биологии по теме Классификация животных. Влияние человека на животных - 7 класс, линия Пономарёвой.
Презентация к уроку биологии по теме Классификация животных. Влияние человека на животных - 7 класс, линия Пономарёвой. Лес - наше богатство
Лес - наше богатство Органы чувств
Органы чувств Родина бобові Fabaceae Lindl
Родина бобові Fabaceae Lindl Невидимые нити в весеннем лесу
Невидимые нити в весеннем лесу Витаминные, ферментные, антиферментные препараты. Понятие о биологически активных добавках к пище
Витаминные, ферментные, антиферментные препараты. Понятие о биологически активных добавках к пище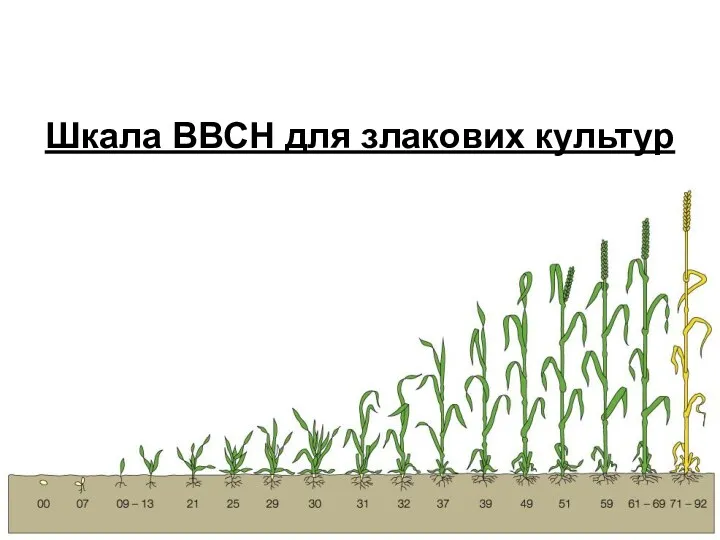 Шкала ВВСН для злакових культур. Етапи розвитку злаків
Шкала ВВСН для злакових культур. Етапи розвитку злаків Презентация к уроку по биологии 8 класс по теме Глаз как орган зрения и оптическая система Урок по биологии в 8 классе Глаз как орган зрения и оптическая система
Презентация к уроку по биологии 8 класс по теме Глаз как орган зрения и оптическая система Урок по биологии в 8 классе Глаз как орган зрения и оптическая система Голоса птиц
Голоса птиц Фармакогнозия. Краткая история фармакогностических исследований. Развитие европейской фармакогнозии
Фармакогнозия. Краткая история фармакогностических исследований. Развитие европейской фармакогнозии Насекомые
Насекомые Презентация по биологии 8 класс темы Внутренняя среда организма
Презентация по биологии 8 класс темы Внутренняя среда организма Ленточные черви (Cestoda) – паразиты человека и животных
Ленточные черви (Cestoda) – паразиты человека и животных Гены, геномы и хромосомы
Гены, геномы и хромосомы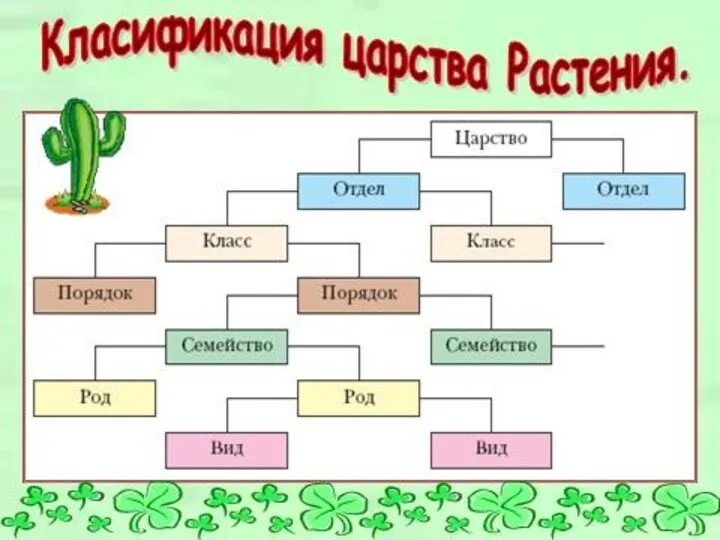 Классификация царства Растения
Классификация царства Растения Борьба за существование и естественный отбор
Борьба за существование и естественный отбор Весеннее пробуждение растений
Весеннее пробуждение растений Интерактивный плакат по теме Эволюция скелетных систем
Интерактивный плакат по теме Эволюция скелетных систем Глюкоза. Строение. Физические и химические свойства
Глюкоза. Строение. Физические и химические свойства