Содержание
- 2. ПЛАН ЛЕКЦИИ 1. Определение. Структура ферментов. 2. Изоферменты. Значение в медицине. 3. Классификация ферментов. 4. Свойства
- 3. ОПРЕДЕЛЕНИЕ Ферменты – это вещества белковой природы, действующие как специфические высокоэффективные катализаторы химических реакций, протекающих в
- 4. ЭНЗИМОЛОГИЯ Наука о ферментах – энзимология рассматривает болезни как результат нарушения структуры и функции ферментов. ЭНЗИМОПАТИИ
- 5. ФЕРМЕНТЫ ИМЕЮТ БЕЛКОВУЮ ПРИРОДУ Все ферменты являются белками и обладают свойствами белков. Классификация ферментов ПРОСТЫЕ ФЕРМЕНТЫ
- 6. СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ ФЕРМЕНТОВ В составе фермента выделяют области, выполняющие различную функцию: Активный центр – комбинация аминокислотных
- 7. ИЗОФЕРМЕНТЫ Изоферменты – это молекулярные формы одного и того же фермента, возникающие в результате генетических различий
- 8. МУЛЬТИФЕРМЕНТНЫЕ КОМПЛЕКСЫ В мультиферментном комплексе несколько ферментов связаны между собой в единый комплекс и осуществляют ряд
- 9. КЛАССИФИКАЦИЯ ФЕРМЕНТОВ Выделяют 6 классов ферментов: I – ОКСИДОРЕДУКТАЗЫ – катализируют окислительно-восстановительные реакции, лежащие в основе
- 10. КЛАССИФИКАЦИЯ ФЕРМЕНТОВ IV – ЛИАЗЫ – катализируют разрыв С-О, С-С, C-N и других связей, а также
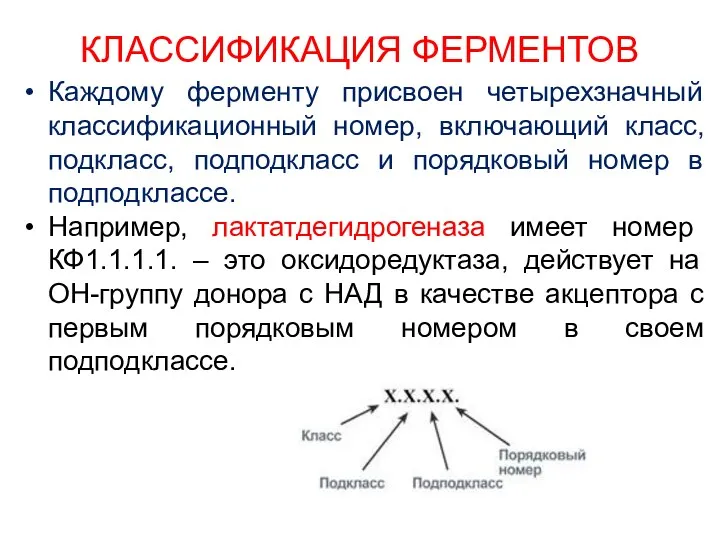
- 11. КЛАССИФИКАЦИЯ ФЕРМЕНТОВ Каждому ферменту присвоен четырехзначный классификационный номер, включающий класс, подкласс, подподкласс и порядковый номер в
- 12. ФЕРМЕНТЫ ВОСТРЕБОВАНЫ В МЕДИЦИНЕ ЭНЗИМОДИАГНОСТИКА – это исследование активности ферментов плазмы крови, мочи, слюны с целью
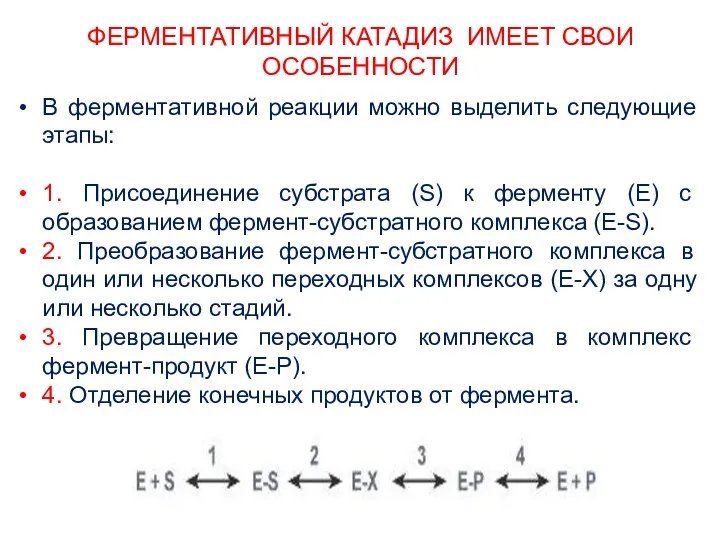
- 13. ФЕРМЕНТАТИВНЫЙ КАТАДИЗ ИМЕЕТ СВОИ ОСОБЕННОСТИ В ферментативной реакции можно выделить следующие этапы: 1. Присоединение субстрата (S)
- 14. СВОЙСТВА ФЕРМЕНТОВ
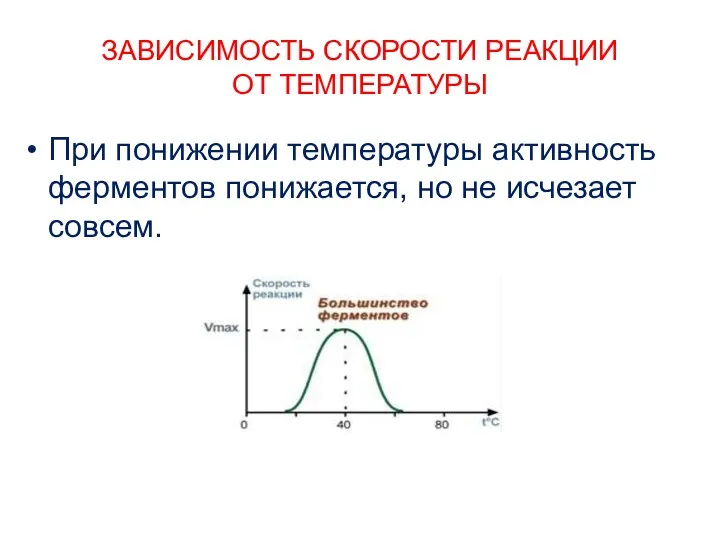
- 15. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ При понижении температуры активность ферментов понижается, но не исчезает совсем.
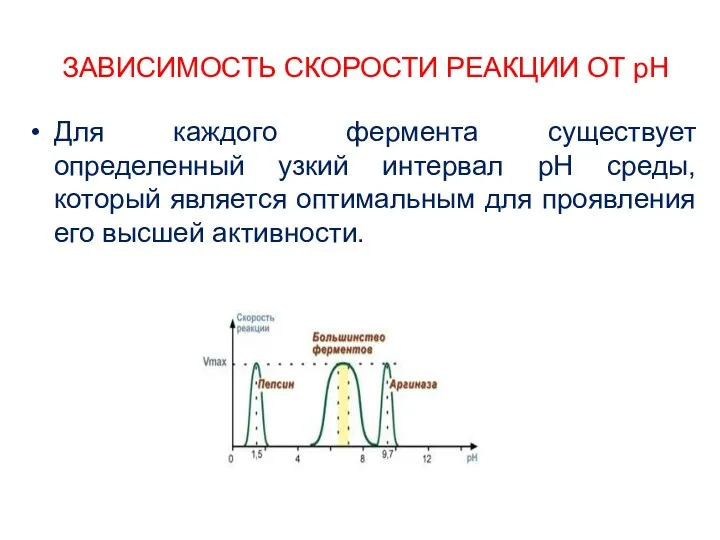
- 16. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ рН Для каждого фермента существует определенный узкий интервал рН среды, который является
- 17. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ СУБСТРАТА При увеличении концентрации субстрата скорость реакции сначала возрастает соответственно присоединению
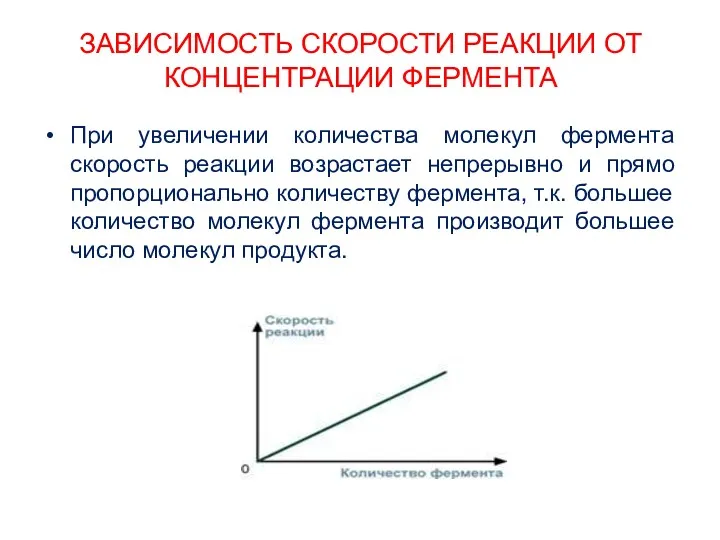
- 18. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ ФЕРМЕНТА При увеличении количества молекул фермента скорость реакции возрастает непрерывно и
- 19. ФЕРМЕНТЫ ПРОЯВЛЯЮТ СПЕЦИФИЧНОСТЬ Специфичность, т.е. высокая избирательность действия ферментов, основана на комплементарности структуры субстрата и активного
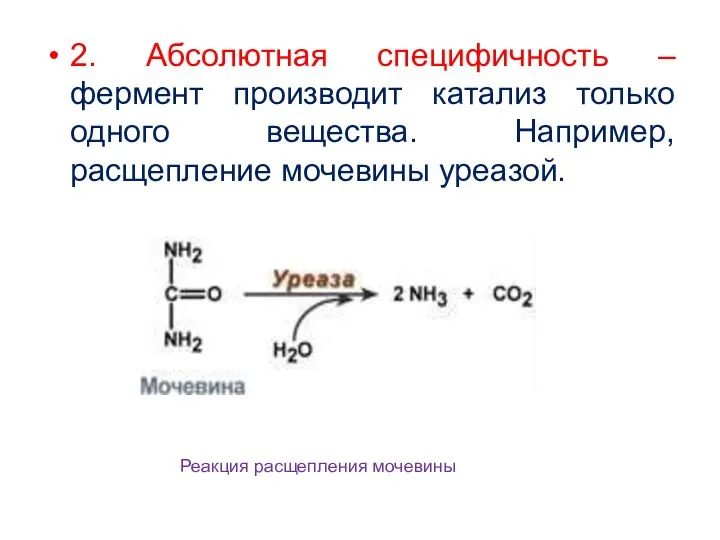
- 20. 2. Абсолютная специфичность – фермент производит катализ только одного вещества. Например, расщепление мочевины уреазой. Реакция расщепления
- 21. 3. Групповая специфичность – катализ субстратов с общими струтктурными особенностями, т.е. при наличии определенной связи или
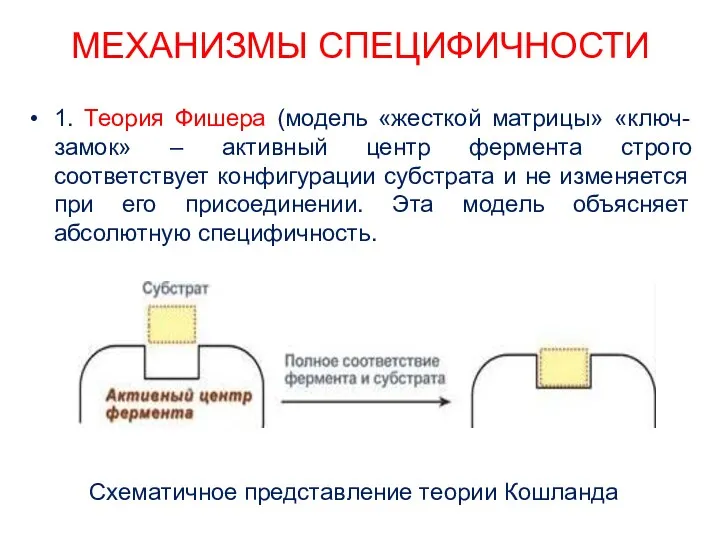
- 22. МЕХАНИЗМЫ СПЕЦИФИЧНОСТИ 1. Теория Фишера (модель «жесткой матрицы» «ключ-замок» – активный центр фермента строго соответствует конфигурации
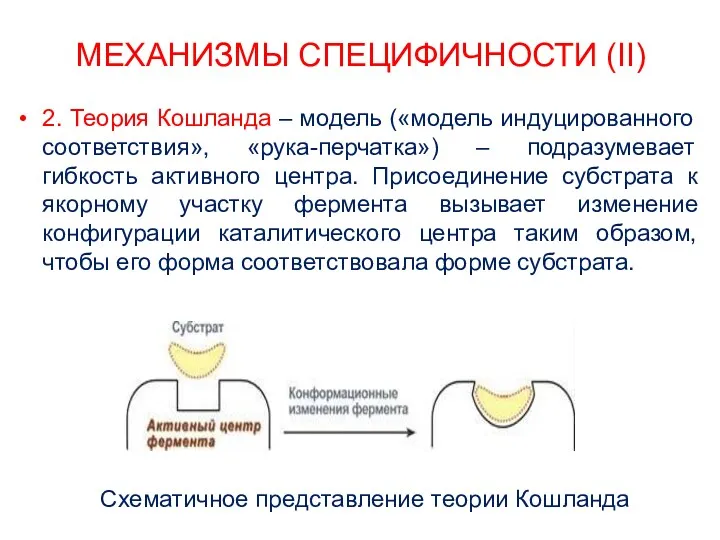
- 23. МЕХАНИЗМЫ СПЕЦИФИЧНОСТИ (II) 2. Теория Кошланда – модель («модель индуцированного соответствия», «рука-перчатка») – подразумевает гибкость активного
- 24. МЕХАНИЗМЫ РЕГУЛЯЦИИ АКТИВНОСТИ ФЕРМЕНТОВ В КЛЕТКЕ (I) 1. ДОСТУПНОСТЬ СУБСТРАТА ИЛИ КОФЕРМЕНТА. При постоянной температуре скорость
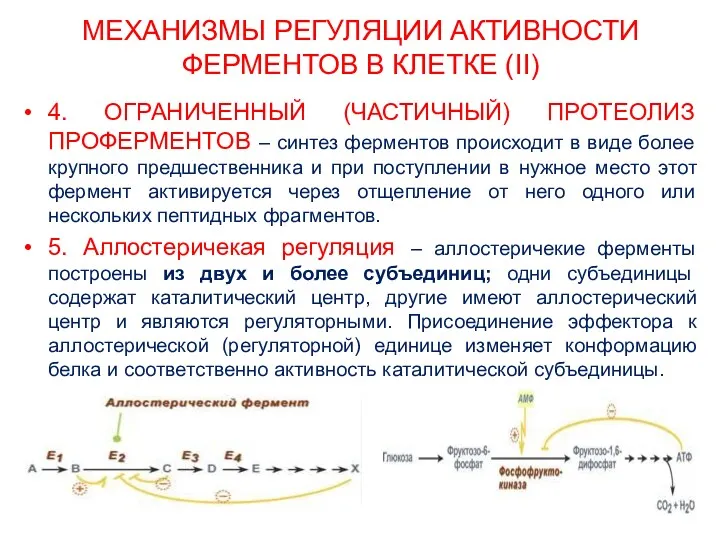
- 25. МЕХАНИЗМЫ РЕГУЛЯЦИИ АКТИВНОСТИ ФЕРМЕНТОВ В КЛЕТКЕ (II) 4. ОГРАНИЧЕННЫЙ (ЧАСТИЧНЫЙ) ПРОТЕОЛИЗ ПРОФЕРМЕНТОВ – синтез ферментов происходит
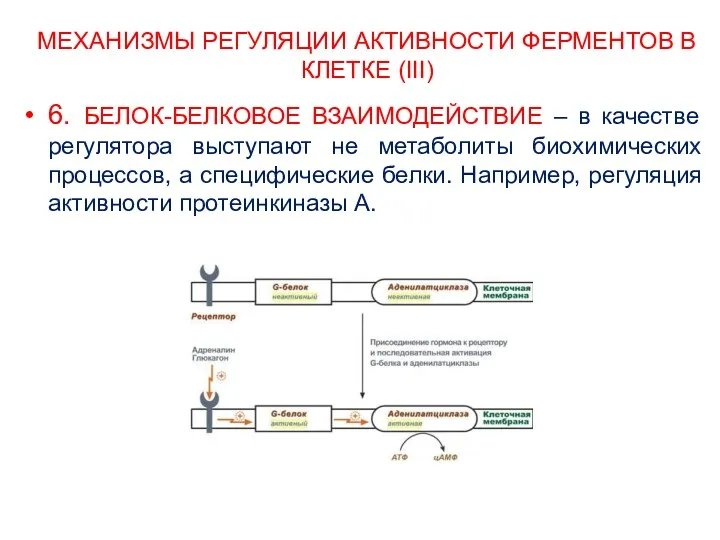
- 26. МЕХАНИЗМЫ РЕГУЛЯЦИИ АКТИВНОСТИ ФЕРМЕНТОВ В КЛЕТКЕ (III) 6. БЕЛОК-БЕЛКОВОЕ ВЗАИМОДЕЙСТВИЕ – в качестве регулятора выступают не
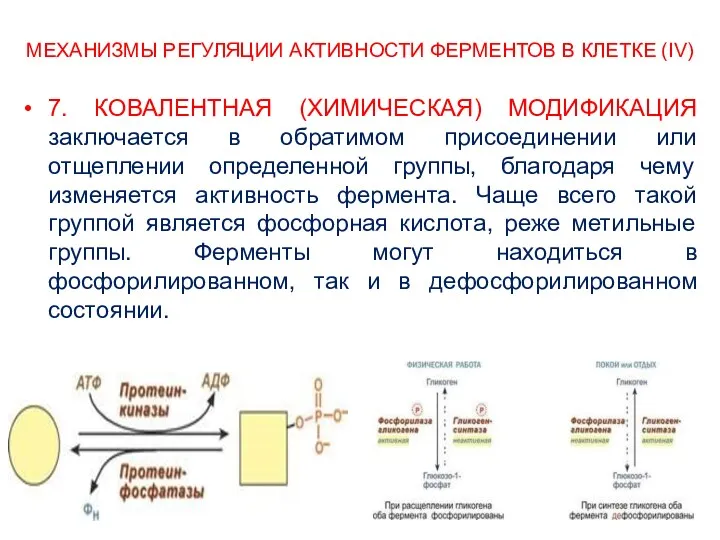
- 27. МЕХАНИЗМЫ РЕГУЛЯЦИИ АКТИВНОСТИ ФЕРМЕНТОВ В КЛЕТКЕ (IV) 7. КОВАЛЕНТНАЯ (ХИМИЧЕСКАЯ) МОДИФИКАЦИЯ заключается в обратимом присоединении или
- 28. ЛЕКАРСТВА ПОДАВЛЯЮТ АКТИВНОСТЬ ФЕРМЕНТОВ Подавление активности ферментов называют ингибированием. Ингибитором называется вещество, вызывающее специфическое снижение активности
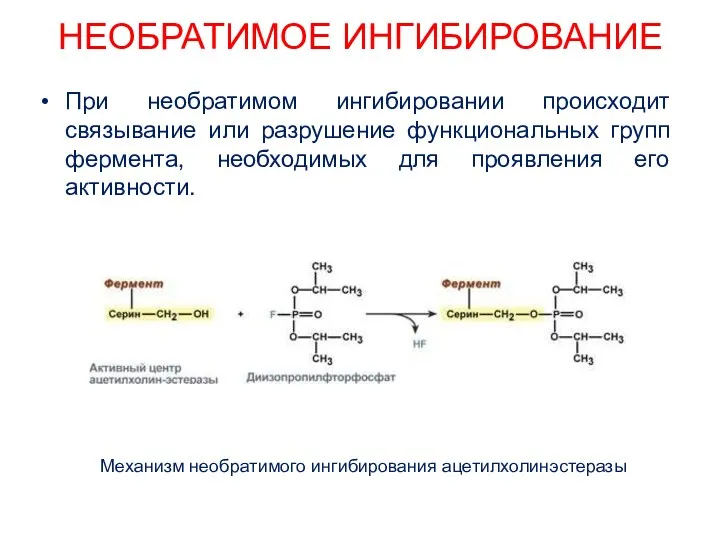
- 29. НЕОБРАТИМОЕ ИНГИБИРОВАНИЕ При необратимом ингибировании происходит связывание или разрушение функциональных групп фермента, необходимых для проявления его
- 30. ОБРАТИМОЕ ИНГИБИРОВАНИЕ При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента, вследствие чего активность
- 31. КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ При таком виде ингибирования ингибитор по своей структуре похож на субстрат фермента. Поэтому он
- 32. НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ Данный вид ингибирования связан с присоединением ингибитора не в активном центре, а в другом
- 34. Скачать презентацию



















 Среды обитания организмов
Среды обитания организмов Определение хронобиотипа учащихся
Определение хронобиотипа учащихся Человек, как фактор развития природы. Ноосфера и антропоцен
Человек, как фактор развития природы. Ноосфера и антропоцен Многообразие пресмыкающихся
Многообразие пресмыкающихся Ткани, органы, системы органов
Ткани, органы, системы органов Нормы питания
Нормы питания туберкулез
туберкулез Climatic requirements of plants
Climatic requirements of plants Biology. Biology course
Biology. Biology course Эволюционное развитие головного мозга у хордовых животных
Эволюционное развитие головного мозга у хордовых животных Органы чувств человека
Органы чувств человека Педагогические идеи Аристотеля
Педагогические идеи Аристотеля ДНК и её роль для организмов
ДНК и её роль для организмов Биосинтез белка
Биосинтез белка Ткани растений
Ткани растений Этапы развития жизни на Земле
Этапы развития жизни на Земле Дисциплина Ботаника. Введение в дисциплину
Дисциплина Ботаника. Введение в дисциплину Развитие эволюционной теории. (Лекция 3)
Развитие эволюционной теории. (Лекция 3) Кошки, кошки, коты
Кошки, кошки, коты Водно-минеральный обмен. Электролитный баланс
Водно-минеральный обмен. Электролитный баланс Видообразование. Результаты микроэволюции
Видообразование. Результаты микроэволюции Препараты гормонов, их синтетические аналоги и антагонисты
Препараты гормонов, их синтетические аналоги и антагонисты Презентация по биологии для учащихся 8 класса на тему: Гигиена пищеарения
Презентация по биологии для учащихся 8 класса на тему: Гигиена пищеарения Птицы-наши пернатые друзья
Птицы-наши пернатые друзья Северный олень
Северный олень Жизнедеятельность клетки
Жизнедеятельность клетки Презентация к уроку биологии в 8 классе Гигиена органов дыхания
Презентация к уроку биологии в 8 классе Гигиена органов дыхания Общие принципы анатомического строения и закономерности регуляции функциональных систем организма
Общие принципы анатомического строения и закономерности регуляции функциональных систем организма