Содержание
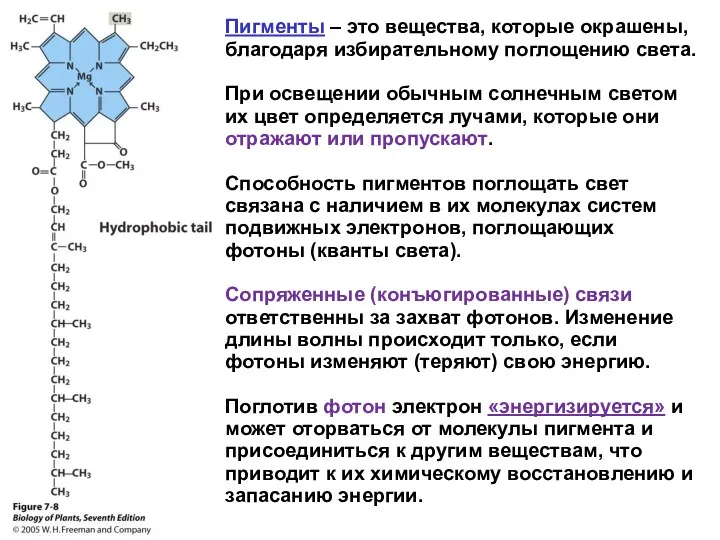
- 2. Пигменты – это вещества, которые окрашены, благодаря избирательному поглощению света. При освещении обычным солнечным светом их
- 3. Кванты некоторых полей имеют специальные названия: фотон — квант электромагнитного поля глюон — квант векторного (глюонного)
- 4. В 1818 г. французы Ж. Пелтье и Ж. Ковенту выделили из листа зеленое вещество и назвали
- 5. В 1860 г. француз Э. Фреми разделил зеленый экстракт, полученный из листа, на две части: голубовато-зеленую
- 6. Изучением желтых пигментов занимались А. Арно (1885–1887 гг., Франция), Г. Молиш (1894–1896 гг., Австрия). Большой вклад
- 7. Сейчас известно, что высшие растения содержат две формы зеленых пигментов: хлорофиллы а и b и две
- 8. Хлорофилл – сложное органическое вещество. Одной из главных трудностей для выявления точного химического состава хлорофилла является
- 9. остаток хлорофиллина По химической природе хлорофилл а представляет собой сложный эфир дикарбоновой кислоты хлорофиллина, в одном
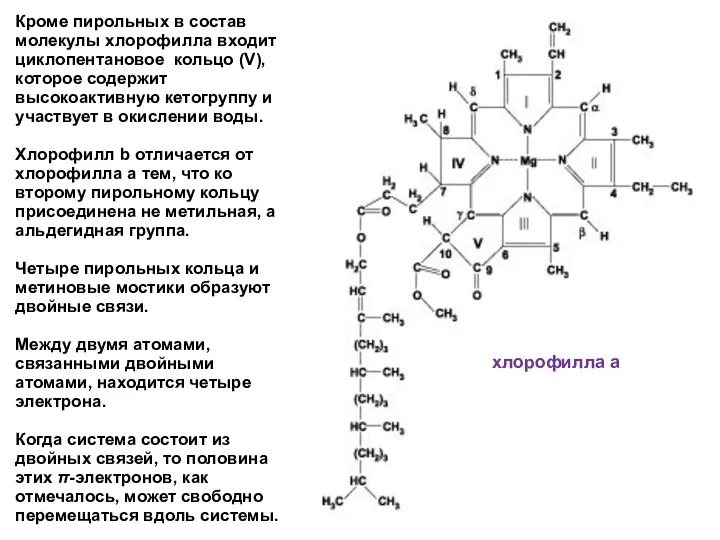
- 10. Кроме пирольных в состав молекулы хлорофилла входит циклопентановое кольцо (V), которое содержит высокоактивную кетогруппу и участвует
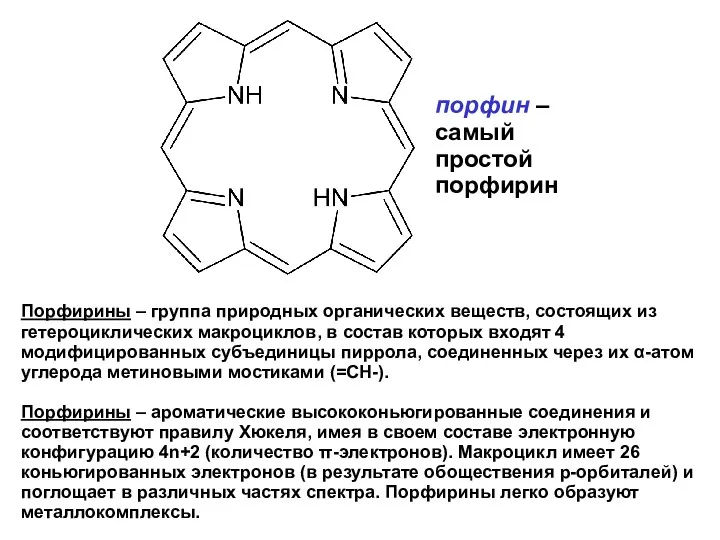
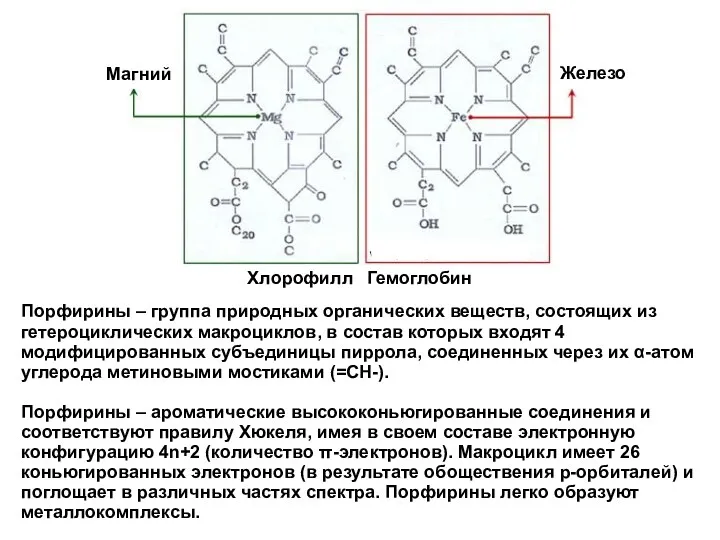
- 11. Порфирины – группа природных органических веществ, состоящих из гетероциклических макроциклов, в состав которых входят 4 модифицированных
- 12. Порфирины – группа природных органических веществ, состоящих из гетероциклических макроциклов, в состав которых входят 4 модифицированных
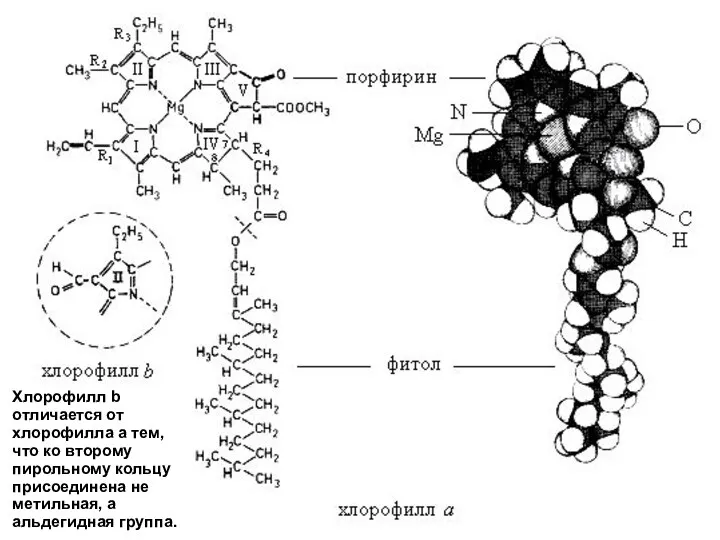
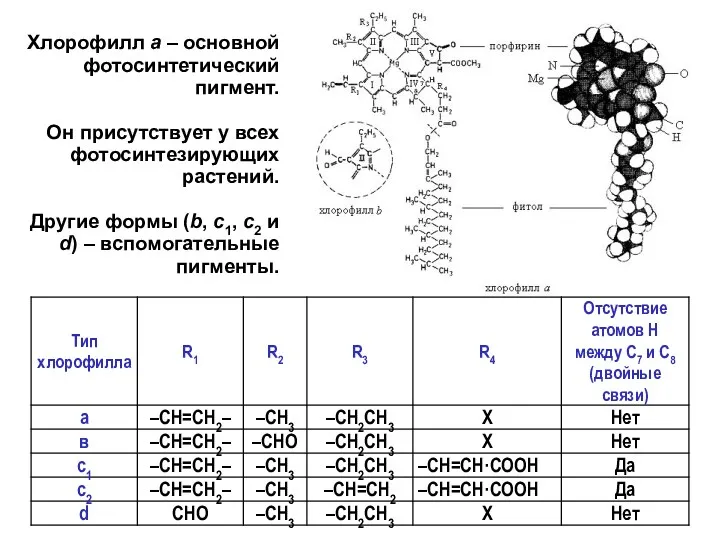
- 13. Хлорофилл b отличается от хлорофилла а тем, что ко второму пирольному кольцу присоединена не метильная, а
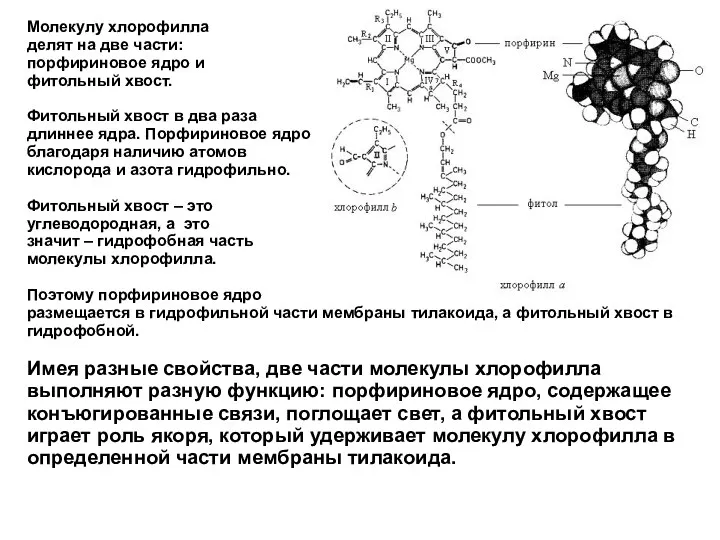
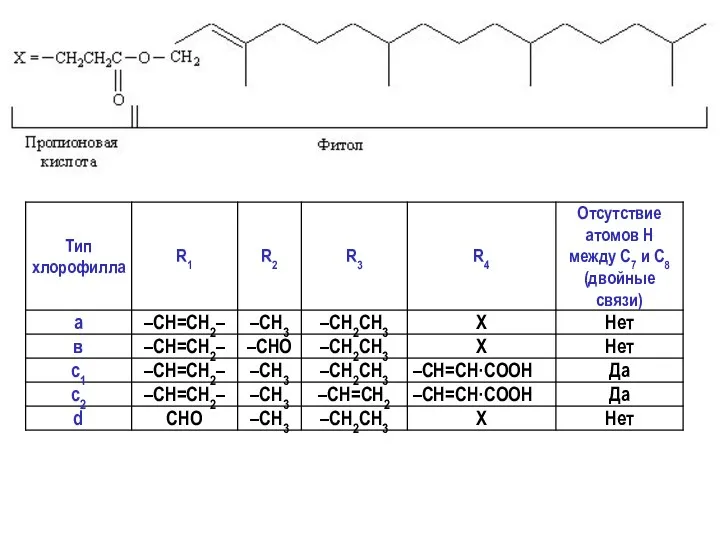
- 14. Молекулу хлорофилла делят на две части: порфириновое ядро и фитольный хвост. Фитольный хвост в два раза
- 15. Доказать, что свет поглощается порфириновым ядром молекулы хлорофилла, можно с помощью реакции хлорофилла со щелочью, в
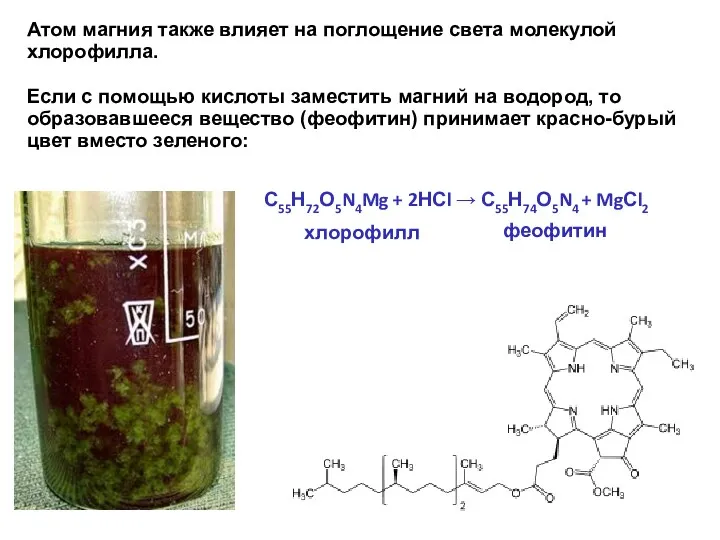
- 16. Атом магния также влияет на поглощение света молекулой хлорофилла. Если с помощью кислоты заместить магний на
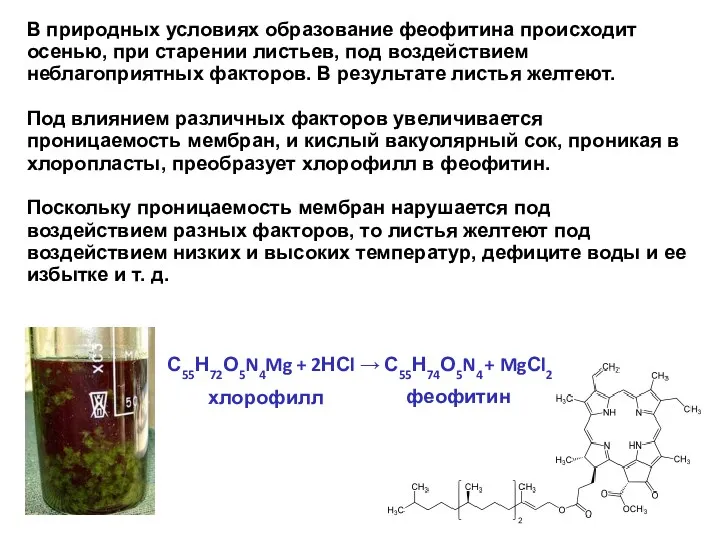
- 17. В природных условиях образование феофитина происходит осенью, при старении листьев, под воздействием неблагоприятных факторов. В результате
- 18. В настоящее время считают, что роль Mg в поглощении света связана с тем, что он, во-первых,
- 19. Хлорофилл а – основной фотосинтетический пигмент. Он присутствует у всех фотосинтезирующих растений. Другие формы (b, с1,
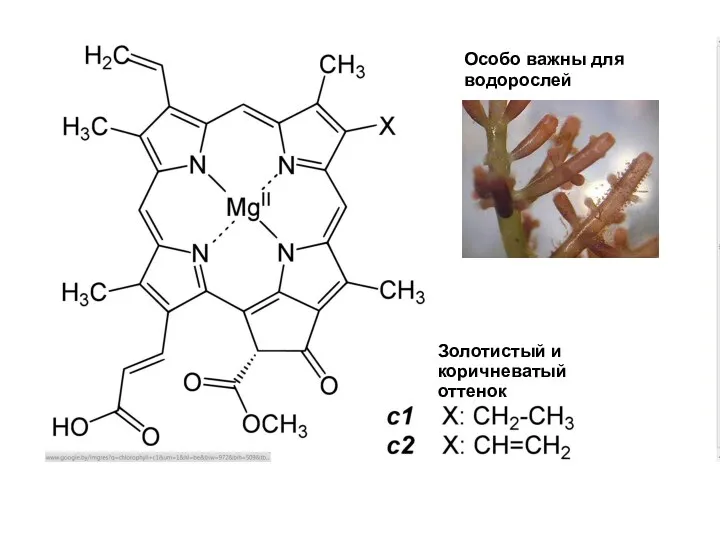
- 21. Золотистый и коричневатый оттенок Особо важны для водорослей
- 22. Измерения поглощения света пигментами является сложной задачей, так как на свойства пигмента влияет растворитель и условия.
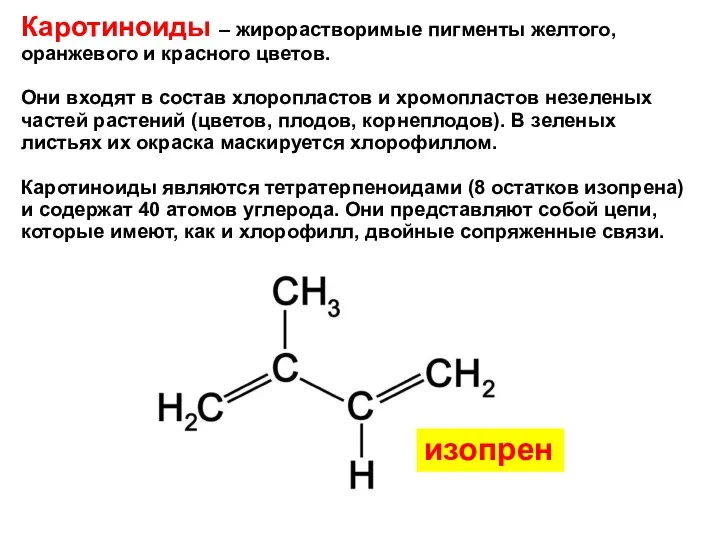
- 23. Каротиноиды – жирорастворимые пигменты желтого, оранжевого и красного цветов. Они входят в состав хлоропластов и хромопластов
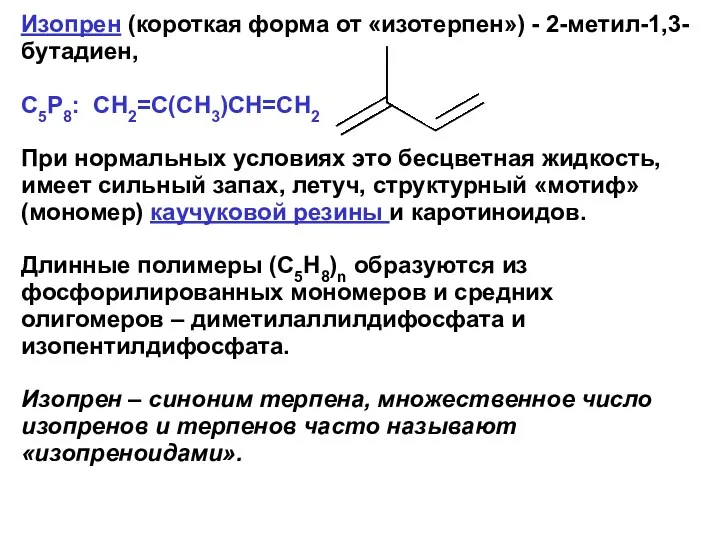
- 24. Изопрен (короткая форма от «изотерпен») - 2-метил-1,3-бутадиен, С5Р8: CH2=C(CH3)CH=CH2 При нормальных условиях это бесцветная жидкость, имеет
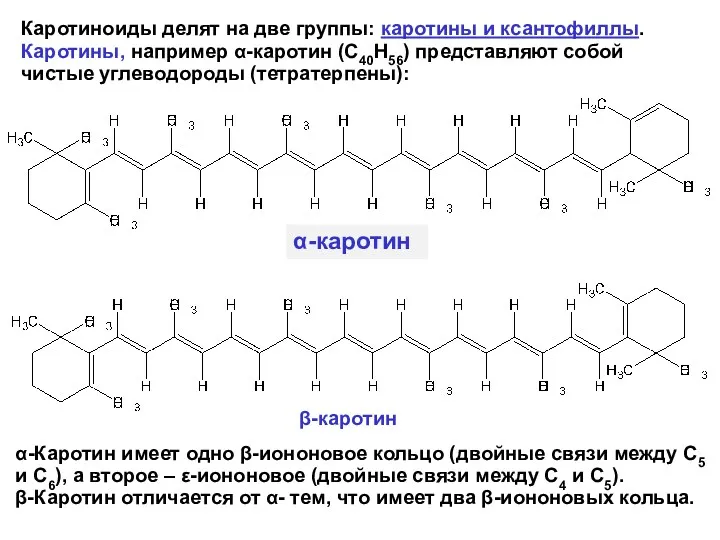
- 25. Каротиноиды делят на две группы: каротины и ксантофиллы. Каротины, например α-каротин (С40Н56) представляют собой чистые углеводороды
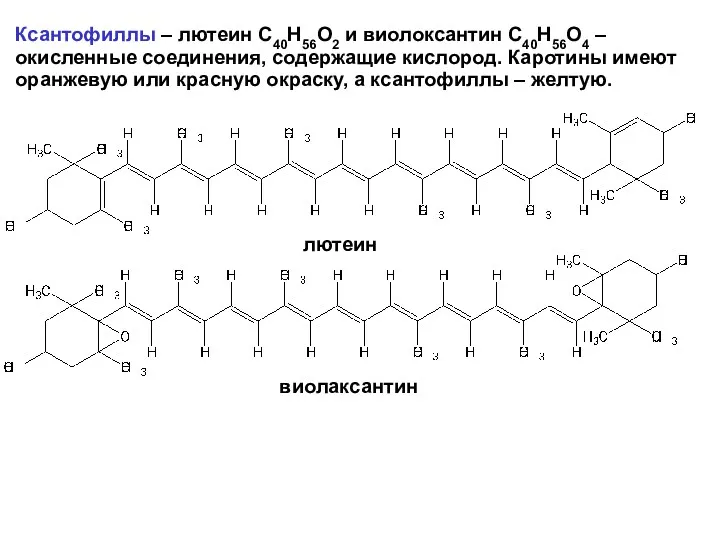
- 26. Ксантофиллы – лютеин С40Н56О2 и виолоксантин С40Н56О4 –окисленные соединения, содержащие кислород. Каротины имеют оранжевую или красную
- 27. Ксантофиллы отличаются большим разнообразием, чем каротины, поскольку входящие в их состав кислородосодержащие группы могут быть самыми
- 28. Относительная распространенность хлорофилла и каротиноидов в высших растениях составляет 4,5 : 1 (по некоторым расчетам квантосомы
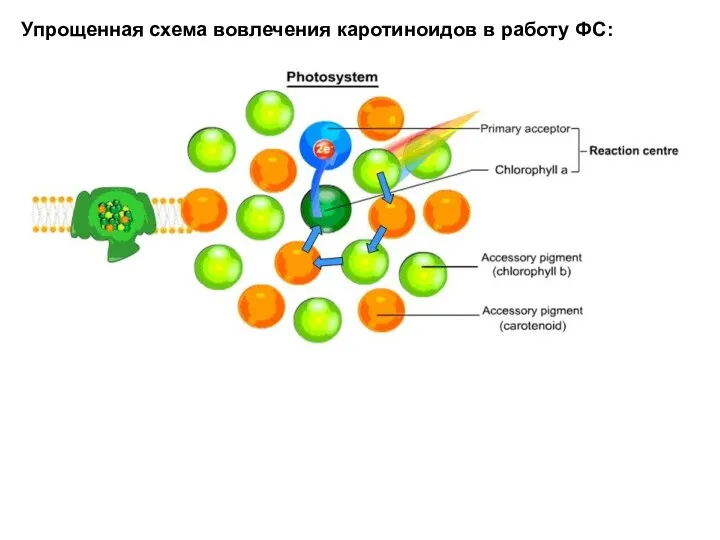
- 29. Упрощенная схема вовлечения каротиноидов в работу ФС:
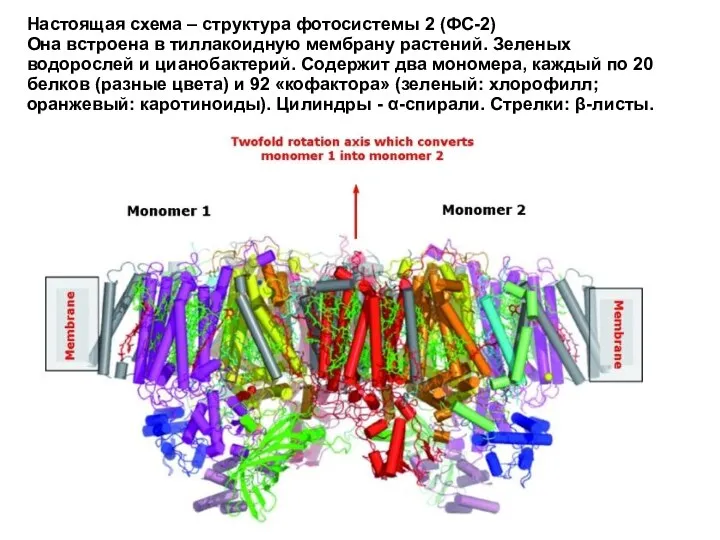
- 30. Настоящая схема – структура фотосистемы 2 (ФС-2) Она встроена в тиллакоидную мембрану растений. Зеленых водорослей и
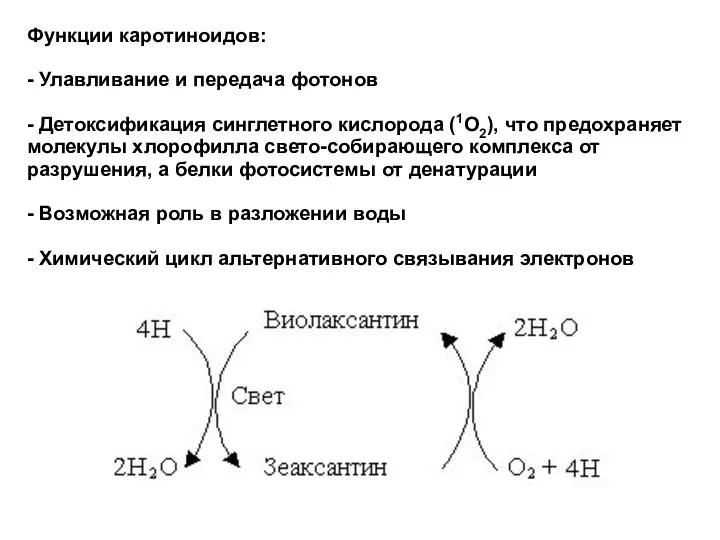
- 31. Функции каротиноидов: - Улавливание и передача фотонов - Детоксификация синглетного кислорода (1О2), что предохраняет молекулы хлорофилла
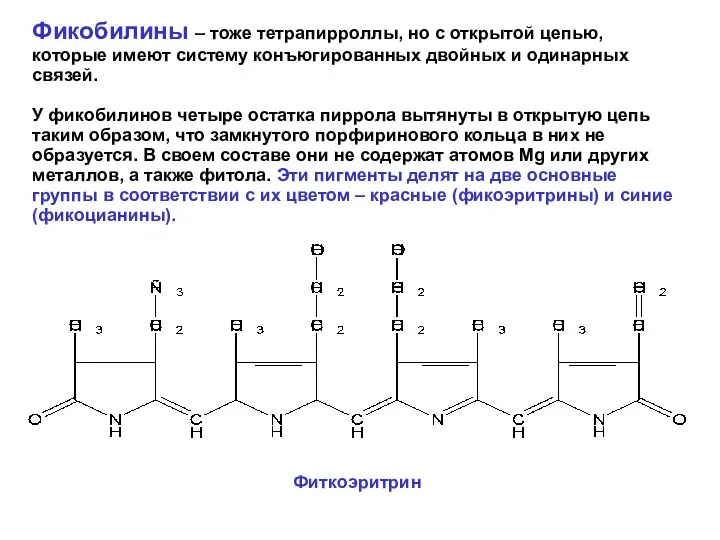
- 32. Фикобилины – тоже тетрапирроллы, но с открытой цепью, которые имеют систему конъюгированных двойных и одинарных связей.
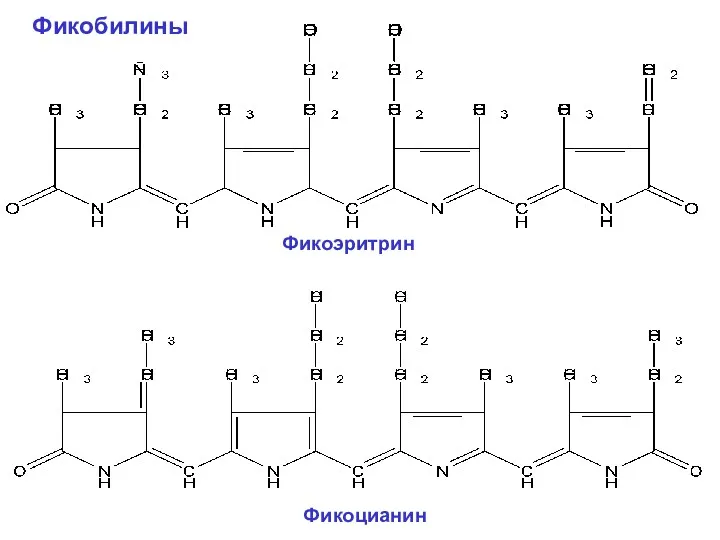
- 33. Фикобилины Фикоцианин Фикоэритрин
- 34. Фикоэритрин и фикоцианин состоят из двух разных белковых субъединиц: α (молекулярная масса ~ 19 кД) и
- 35. Все фотосинтетические пигменты (хлорофиллы, каротиноиды и фикобилины) входят в состав пигментных систем в виде хромпротеинов, т.
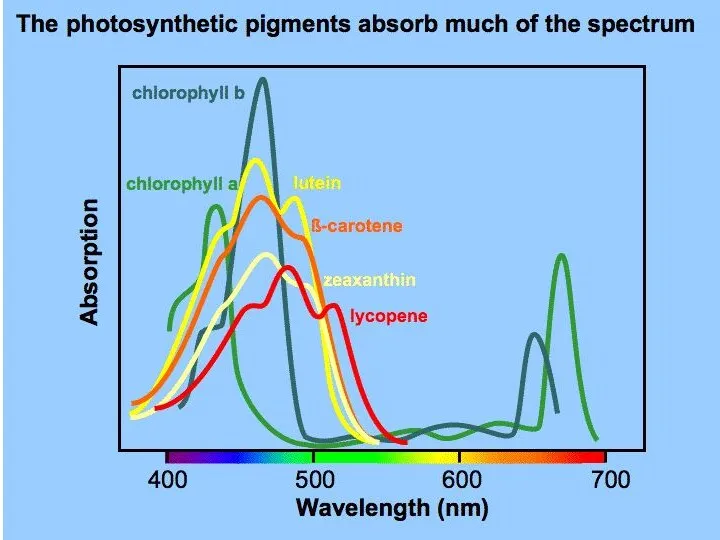
- 37. Спектры полгощения фотосинтетических пигментов
- 38. Спектры поглощения фотосинтетических пигментов Какие длины волн будет поглощать пигмент, зависит от количества и расположения двойных
- 41. Скачать презентацию

















 Загадка человека Урок 2
Загадка человека Урок 2 Охрана животных
Охрана животных Цепи питания и пищевые сети
Цепи питания и пищевые сети Методы исследования в биологии
Методы исследования в биологии Водоросли
Водоросли Урок по ФГОС Свойства живых организмов их проявление у растений, животных, грибов и бактерий.
Урок по ФГОС Свойства живых организмов их проявление у растений, животных, грибов и бактерий. Отряды млекопитающих
Отряды млекопитающих Decoupling mutational processes in human germline
Decoupling mutational processes in human germline Биохимия как наука
Биохимия как наука Гладкие мышцы. Особенности строения, сократимости и возбудимости
Гладкие мышцы. Особенности строения, сократимости и возбудимости Лосиный остров
Лосиный остров Класс птицы
Класс птицы Бактерии. Биологическая роль бактерий
Бактерии. Биологическая роль бактерий Урок-презентация. Плоды, их строение, значение, распространение в природе
Урок-презентация. Плоды, их строение, значение, распространение в природе Методическая разработка урока биологии по теме Обмен веществ 6 класс
Методическая разработка урока биологии по теме Обмен веществ 6 класс Лицевой нерв – п. facialis (VII пара)
Лицевой нерв – п. facialis (VII пара) Дрессировка собак-проводников
Дрессировка собак-проводников Урок по ФГОС 5 класс Папоротникообразные
Урок по ФГОС 5 класс Папоротникообразные Нервная система
Нервная система Классификация и многообразие представителей надкласса Шестиногие
Классификация и многообразие представителей надкласса Шестиногие Как называются деревья?
Как называются деревья? Анализирующее скрещивание. Дигибридное скрещивание. Третий закон Менделя
Анализирующее скрещивание. Дигибридное скрещивание. Третий закон Менделя Як між собою спілкуються тварини
Як між собою спілкуються тварини Animals zoo
Animals zoo презентация по биологии Регенерация
презентация по биологии Регенерация Царство грибы
Царство грибы Викопні рослини та тварини
Викопні рослини та тварини Неїстівні та небезпечні гриби України
Неїстівні та небезпечні гриби України