Содержание
- 2. Геном – это вся совокупность нуклеотидных последовательностей ДНК клетки, или организма. Размеры генома оцениваются по весу
- 3. Физический размер генома кишечная палочка 4*106 Дрозофила 1,4*108 Эукариоты 106 - 1011 п.н. Прокариоты - до
- 4. двунитевой прерывистый ДНК-геном; содержит 3 млрд. пар оснований, 24-26 тыс. генов; только 1% приходится на долю
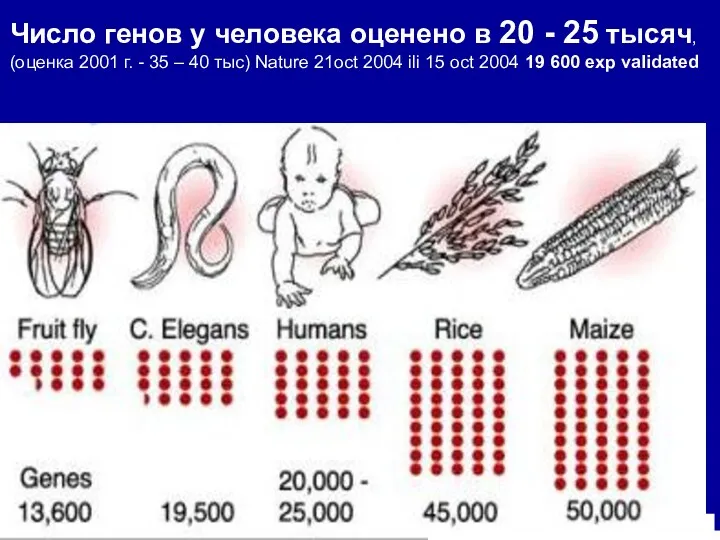
- 5. Число генов у человека оценено в 20 - 25 тысяч, (оценка 2001 г. - 35 –
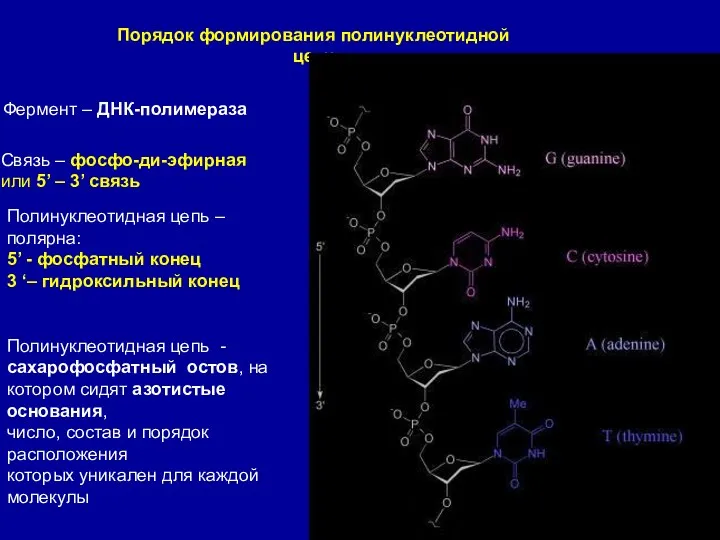
- 6. Порядок формирования полинуклеотидной цепи Фермент – ДНК-полимераза Связь – фосфо-ди-эфирная или 5’ – 3’ связь Полинуклеотидная
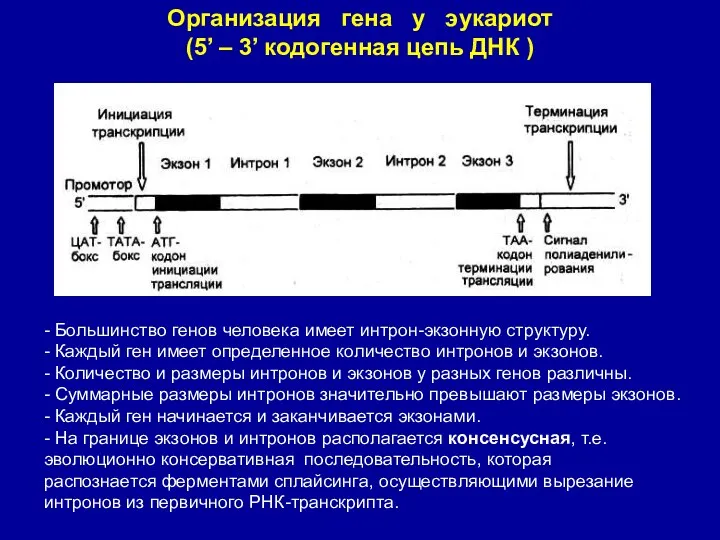
- 7. Организация гена у эукариот (5’ – 3’ кодогенная цепь ДНК ) - Большинство генов человека имеет
- 8. Классификация генов человека 1. По структуре: Содержащие интроны Не содержащие интронов 2. По размерам: Малые Средние
- 9. 4. По числу копий и значимости генного продукта: Гены «домашнего хозяйства» Гены «роскоши» «house keeping gens»
- 10. 6. По функции: Структурные Регуляторные Гены тРНК Регуляторы активности других генов Гены рРНК (промоторы, энхарсеры, сайленсеры)
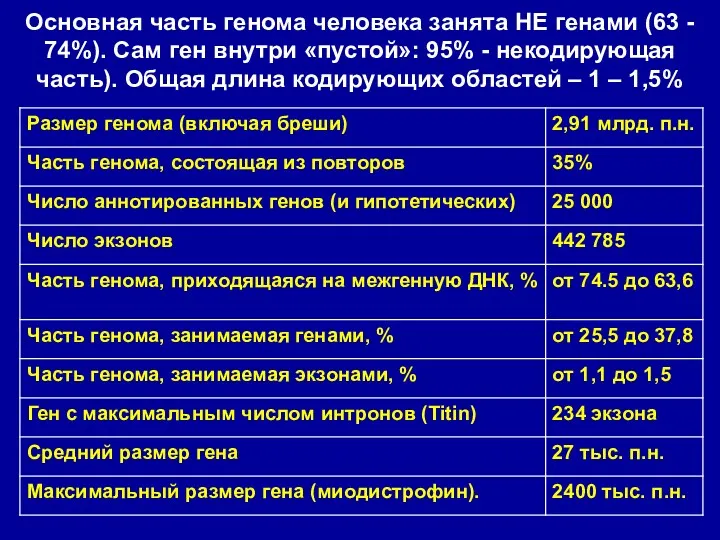
- 11. Основная часть генома человека занята НЕ генами (63 - 74%). Сам ген внутри «пустой»: 95% -
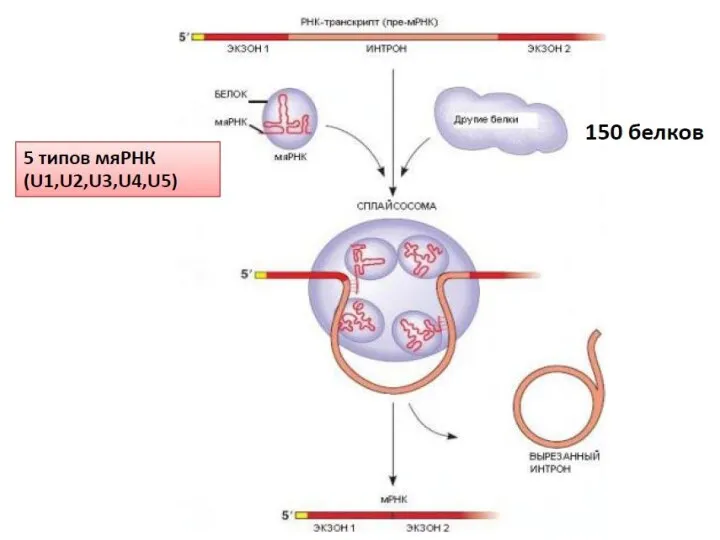
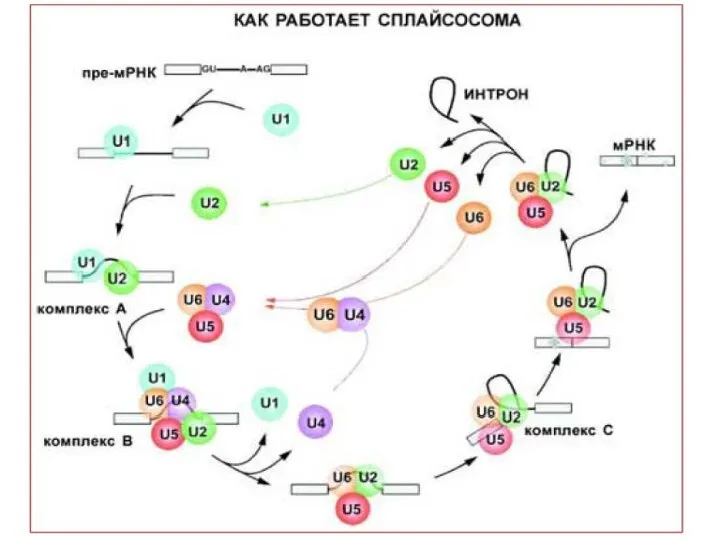
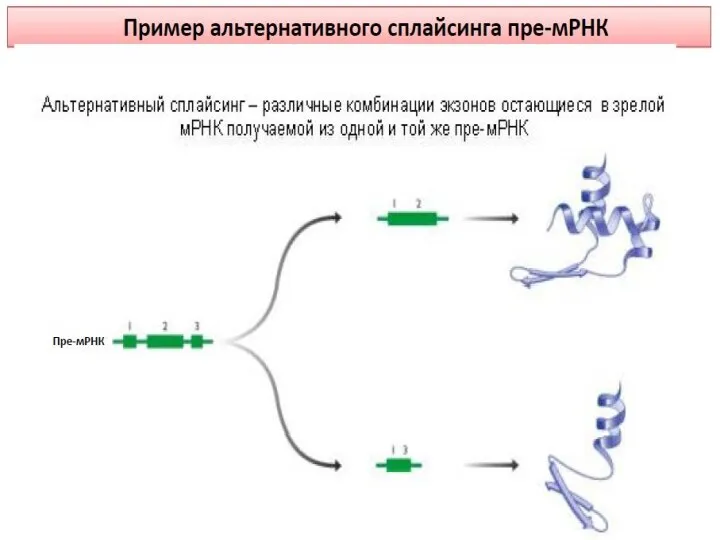
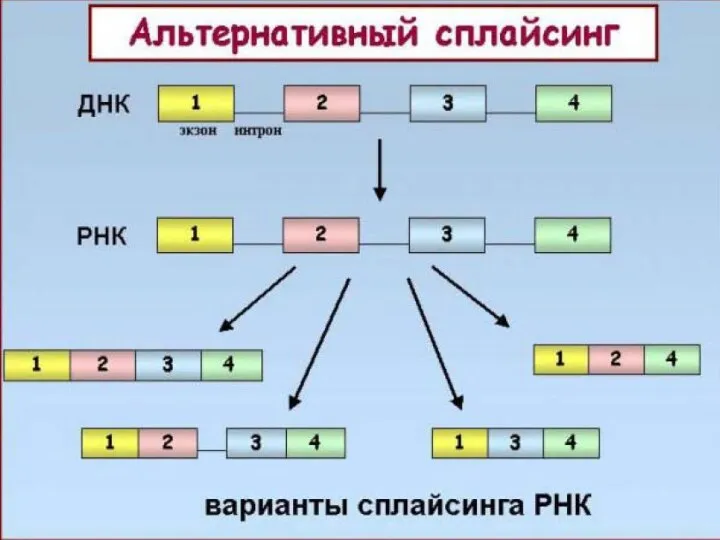
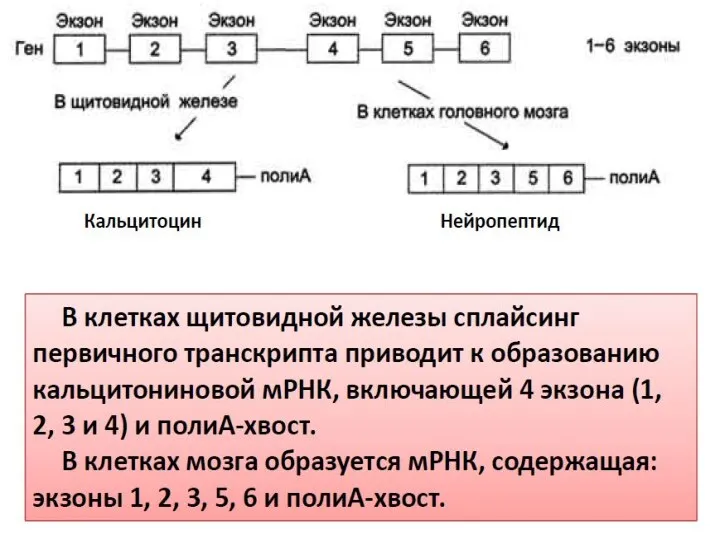
- 12. Тысячи изоформ нейрексина генерируется с трех генов за счет альтернативных промоторов и альтернативного сплайсинга. Эти изоформы
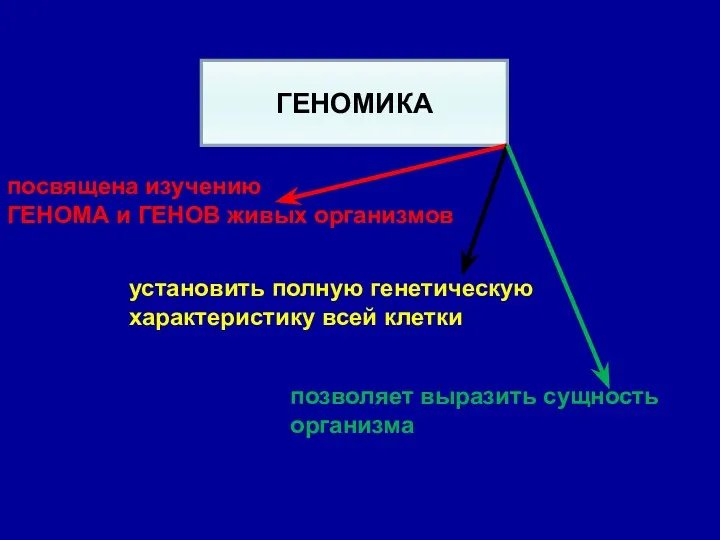
- 24. ГЕНОМИКА посвящена изучению ГЕНОМА и ГЕНОВ живых организмов установить полную генетическую характеристику всей клетки позволяет выразить
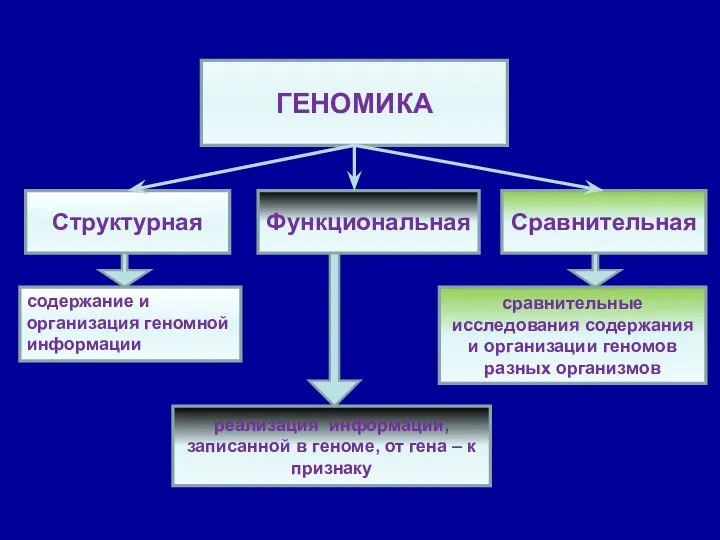
- 25. ГЕНОМИКА Структурная Функциональная Сравнительная содержание и организация геномной информации реализация информации, записанной в геноме, от гена
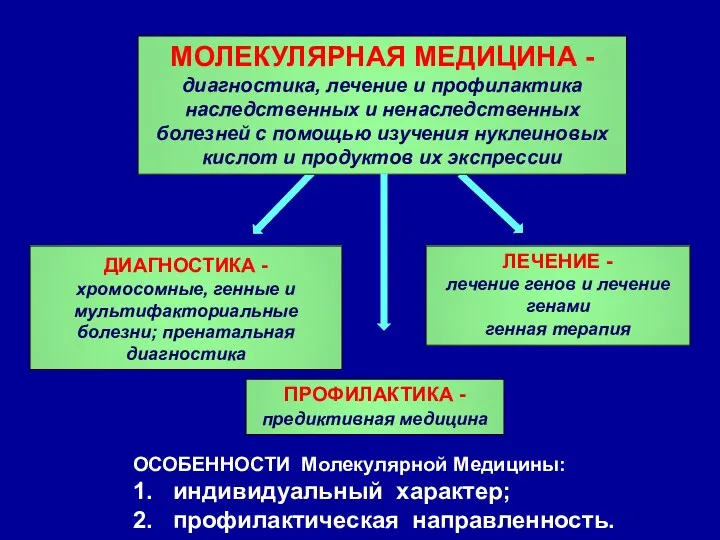
- 26. ПРОФИЛАКТИКА -предиктивная медицина МОЛЕКУЛЯРНАЯ МЕДИЦИНА -диагностика, лечение и профилактика наследственных и ненаследственных болезней с помощью изучения
- 27. Новая парадигма медицины в XXI веке Основные принципы 7Р Medicine Предиктивная (предсказательная) – предсказание особенностей здоровья
- 28. Новая парадигма медицины в XXI веке Основные принципы 7Р Medicine медицина обеспечивающая - providing, подготовка новых
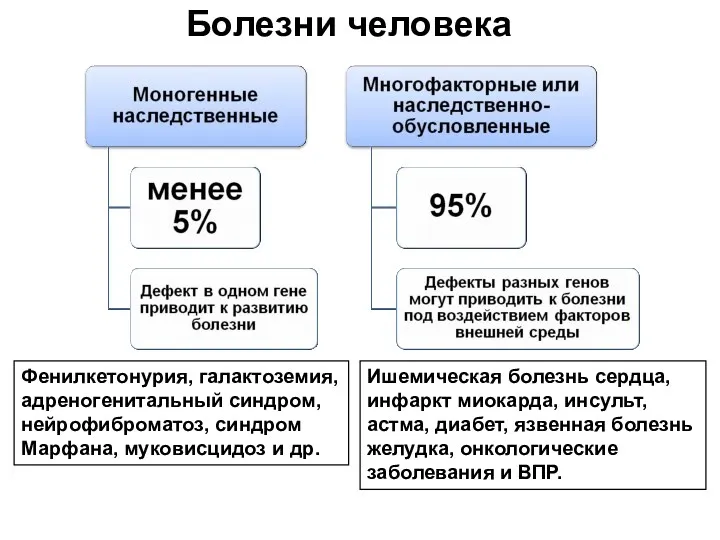
- 29. Болезни человека Ишемическая болезнь сердца, инфаркт миокарда, инсульт, астма, диабет, язвенная болезнь желудка, онкологические заболевания и
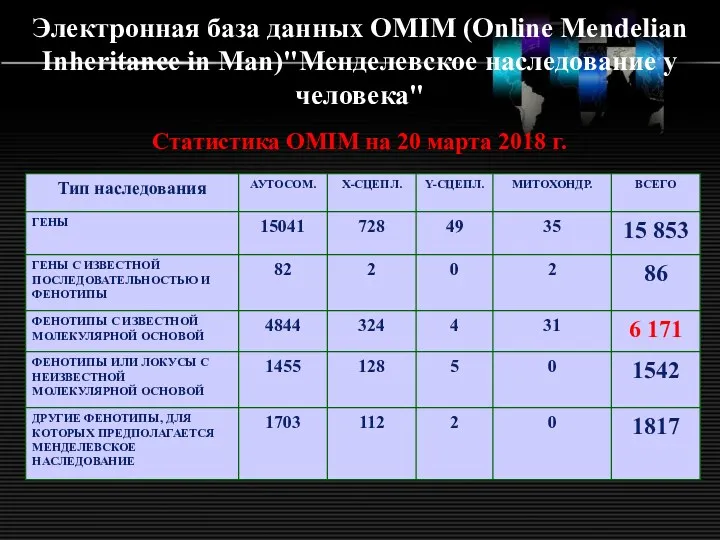
- 30. Электронная база данных OMIM (Online Mendelian Inheritance in Man)"Менделевское наследование у человека" Статистика OMIM на 20
- 32. Мультифакториальные заболевания: являются результатом совместного действия многих генетических факторов в сочетании с факторами внешней среды и
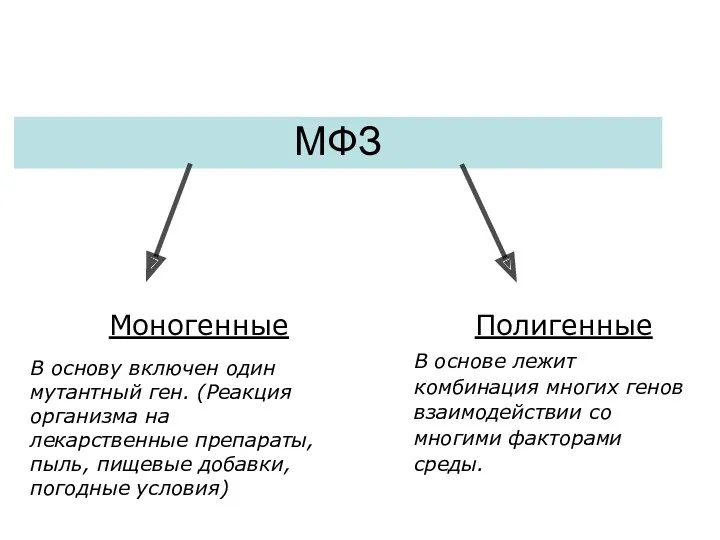
- 33. МФЗ Моногенные Полигенные В основу включен один мутантный ген. (Реакция организма на лекарственные препараты, пыль, пищевые
- 34. Полигенная природа болезней с наследственной предрасположенностью подтверждается с помощью молекулярно-генетического, клинико-генеалогического, близнецового и популяционно-статистического методов. Достаточно
- 35. МФЗ – патология, связанная как с суммарным (аддитивным) действием генетических и средовых факторов. ВПР: пороки невральной
- 36. Частота встречаемости МФЗ ВПР на 1000 новорожденных: Косолапость = 5, гипоспадия = 3, вывих бедра =
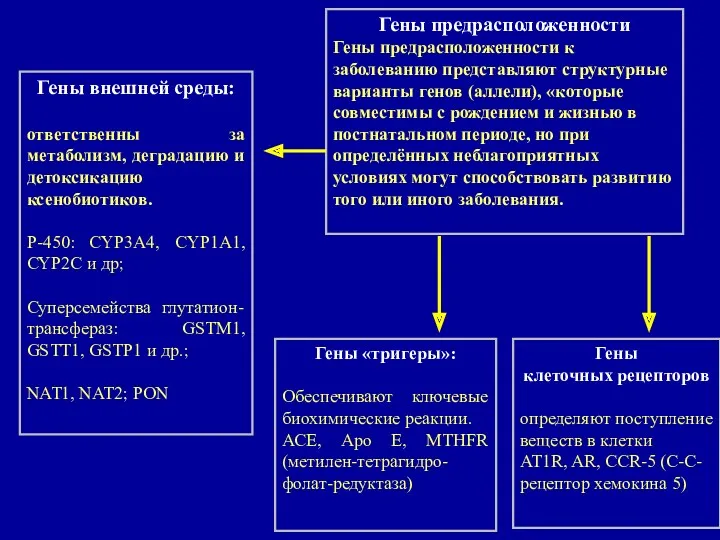
- 37. Гены предрасположенности Гены предрасположенности к заболеванию представляют структурные варианты генов (аллели), «которые совместимы с рождением и
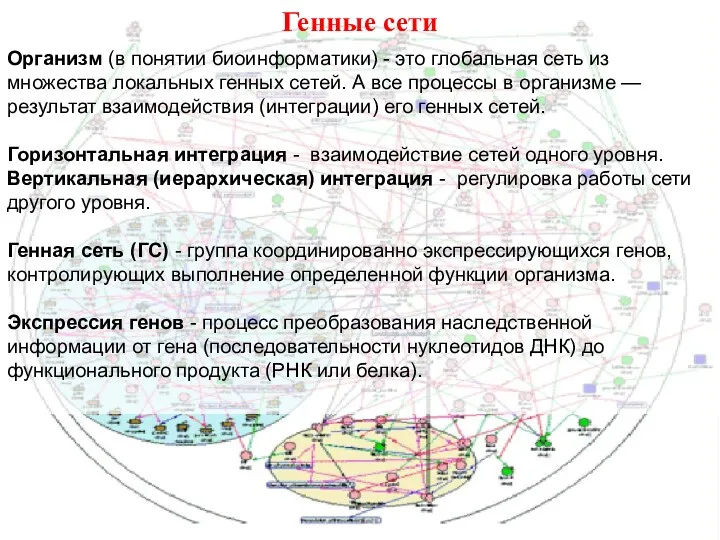
- 38. Генные сети Организм (в понятии биоинформатики) - это глобальная сеть из множества локальных генных сетей. А
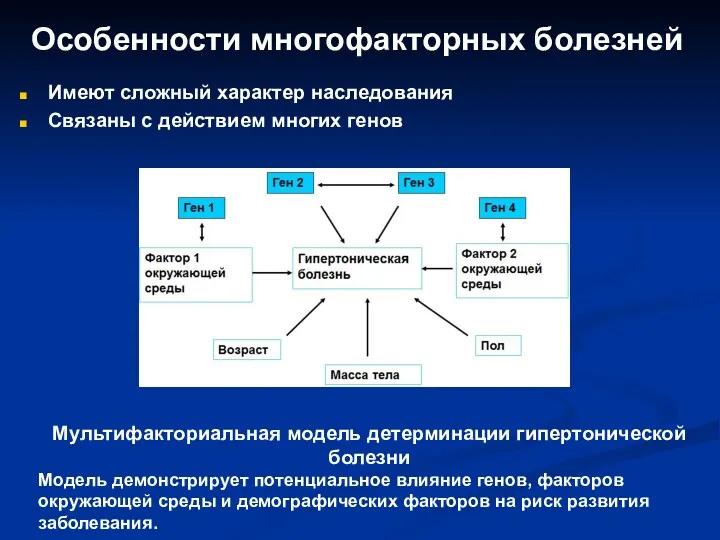
- 39. Особенности многофакторных болезней Имеют сложный характер наследования Связаны с действием многих генов Мультифакториальная модель детерминации гипертонической
- 40. Особенности МФЗ: Высокая частота встречаемости в популяции. Несоответствие наследования законам Менделя. Выраженная аллельная и межаллельная генетическая
- 41. НАСЛЕДСТВЕННАЯ ПРЕДРАСПОЛОЖЕННОСТЬ - это преобладающий генетический компонент, от вклада которого зависит результат суммарного эффекта генетических и
- 42. ПРИ ИЗУЧЕНИИ МФЗ ОПРЕДЕЛЯЮТ: Вклад распространенных SNP (single nucleotide polymorphism) генов в развитие болезни. Роль полиморфных
- 43. Для поиска генетических причин предрасположенности к МФЗ исследуется ассоциация с полиморфными генами. АССОЦИАЦИЯ – более высокая
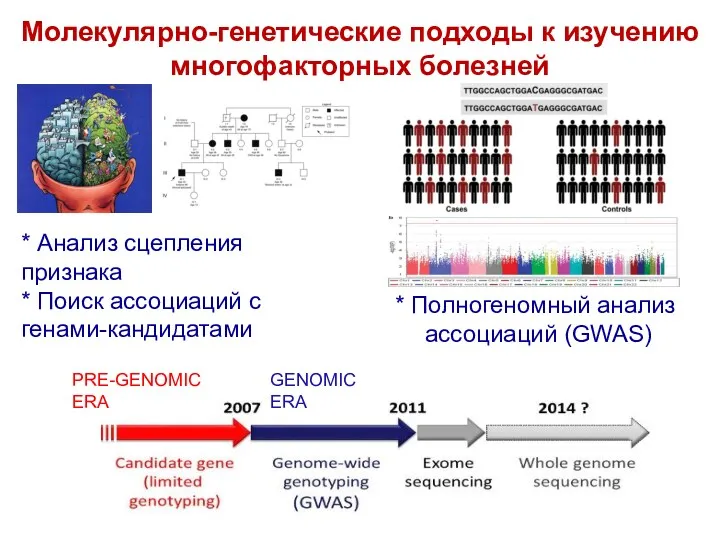
- 44. Молекулярно-генетические подходы к изучению многофакторных болезней * Анализ сцепления признака * Поиск ассоциаций с генами-кандидатами *
- 45. Молекулярно-генетические технологии Кариотипирование, 1950-е ПДРФ, 1980-е Секвенирование по Сэнгеру, 1970-е FISH, 1990-е Микрочипы, 2000-е NGS (MPS),
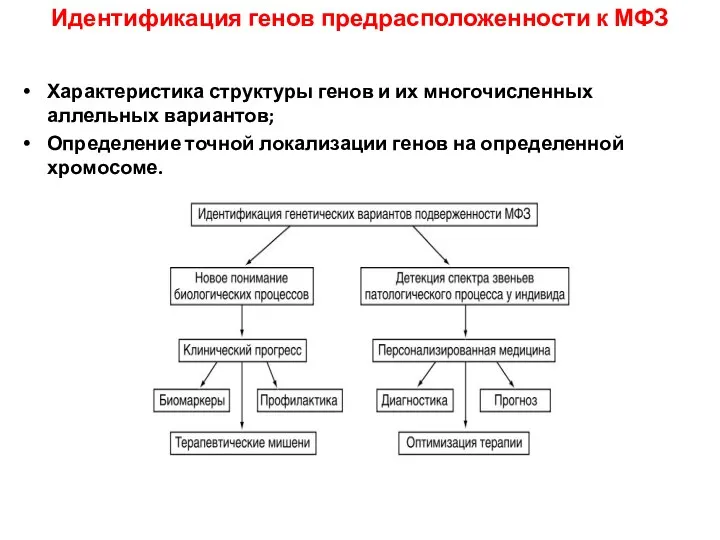
- 46. Идентификация генов предрасположенности к МФЗ Характеристика структуры генов и их многочисленных аллельных вариантов; Определение точной локализации
- 47. Идентификация генов предрасположенности к МФЗ Анализ сцепления - метод генетического картирования, основанный на прослеживании косегрегации генов
- 48. Идентификация генов предрасположенности к МФЗ Метод идентичных по происхождению аллелей (IBD – identical by descent) –
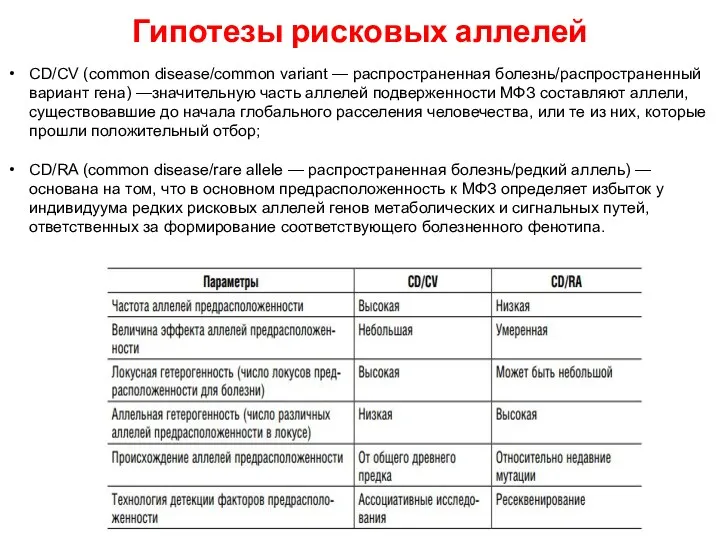
- 49. Гипотезы рисковых аллелей CD/CV (common disease/common variant — распространенная болезнь/распространенный вариант гена) —значительную часть аллелей подверженности
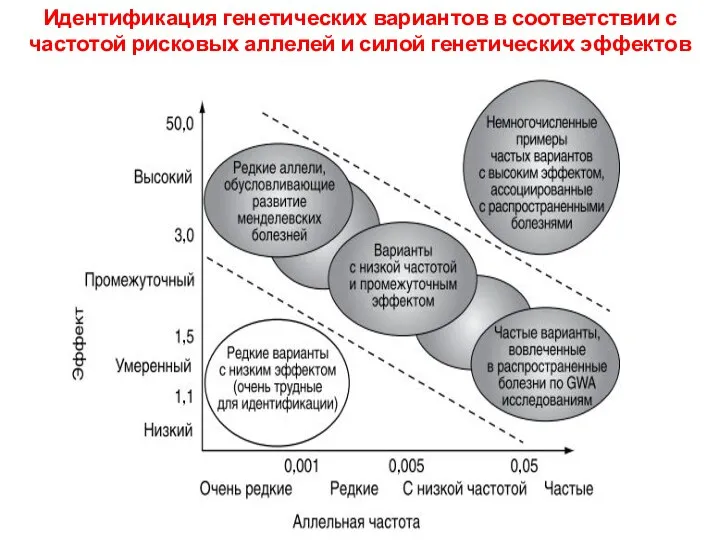
- 50. Идентификация генетических вариантов в соответствии с частотой рисковых аллелей и силой генетических эффектов Частота генетического варианта
- 51. Сначала формируется гипотеза о связи какого-либо гена с признаком. В ассоциативных исследованиях сопоставляется встречаемость определенного аллеля
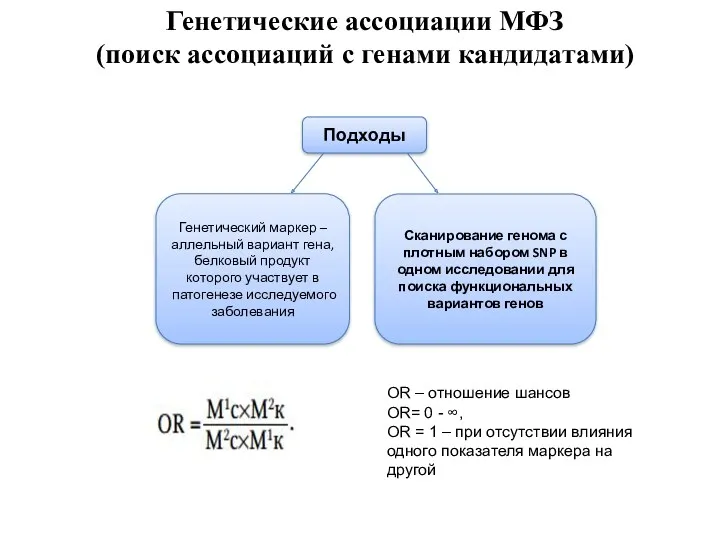
- 52. Генетические ассоциации МФЗ (поиск ассоциаций с генами кандидатами) OR – отношение шансов OR= 0 - ∞,
- 53. Отношение шансов (OR – odds ratio) – используют в исследованиях «случай-контроль». OR получают путем сравнения частот
- 54. ПОЛНОГЕНОМНЫЙ АНАЛИЗ АССОЦИАЦИЙ МНОГОФАКТОРНЫХ ЗАБОЛЕВАНИЙ (GWAS – genome-wide assotiation study) Проводят поиск связей между различными SNP
- 55. САХАРНЫЙ ДИАБЕТ 1 ТИПА Ассоциация с изменениями в различных генах (IDDM – insulin-dependent diabetes mutations), главным
- 56. БРОНХИАЛЬНАЯ АСТМА Ассоциация с генами, расположенными на 5q23-24 – кластер генов семества интерлейкинов 3, 4, 5,
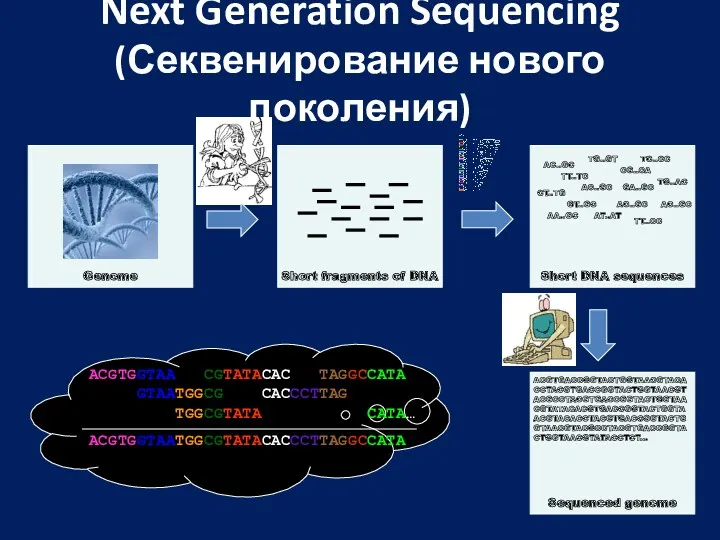
- 57. Next Generation Sequencing (Секвенирование нового поколения) Short fragments of DNA Genome
- 58. Основные преимущества NGS Возможность идентификации новых вариантов Высокая производительность Возможно тестирование сразу нескольких генетических заболеваний у
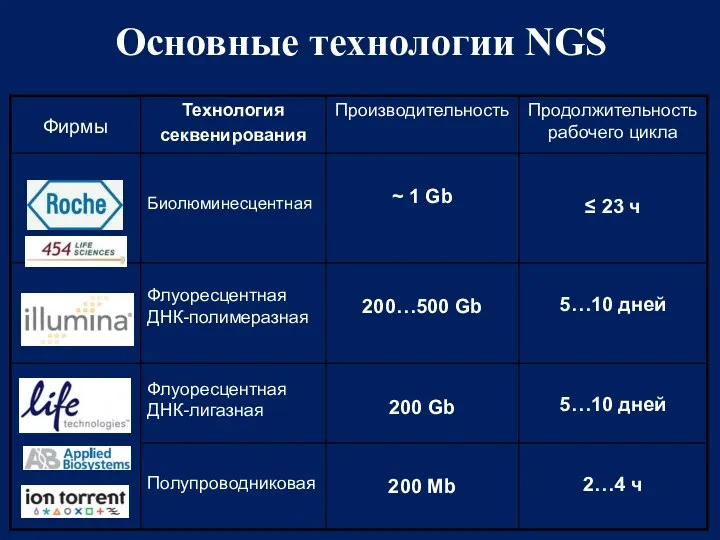
- 59. Основные технологии NGS
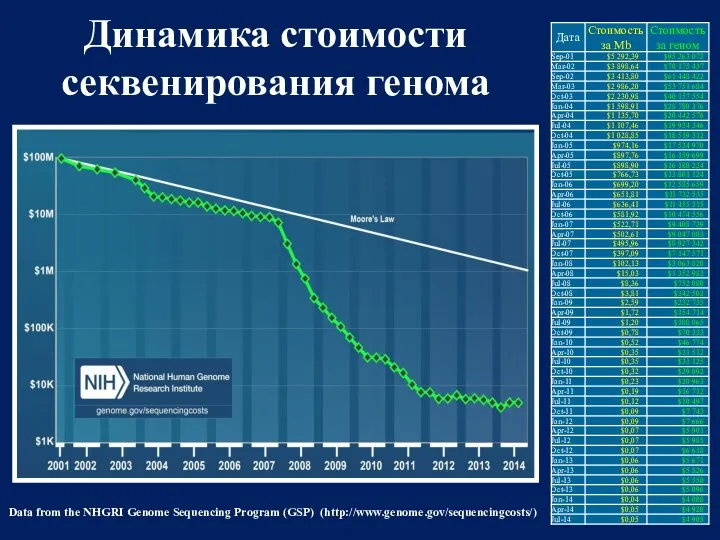
- 60. Data from the NHGRI Genome Sequencing Program (GSP) (http://www.genome.gov/sequencingcosts/) Динамика стоимости секвенирования генома
- 61. Подходы для открытия новых генов многофакторных болезней: Экзом — часть генома, представляющая экзоны, т. е. последовательности,
- 62. Близнецовый метод введен в медицинскую практику Ф. Гальтоном в 1875г. основан на явлении многоплодной беременности у
- 63. Процент сходства близнецов по изучаемому признаку называется конкордантностью, а процент различия - дискордантностью. При сопоставлении монозиготных
- 64. Для количественной оценки роли наследственности и среды в развитии того или иного признака обычно используется коэффициент
- 65. БЛИЗНЕЦОВЫЕ ИССЛЕДОВАНИЯ Конкордантность МЗБ (Кмб) по болезням: Для мультифакториальных = 10 – 60% (Ревматизм и ГБ=26%,
- 66. Семейное накопление МФЗ Метод случай-контроль: сравнивают частоту, с которой болезнь обнаруживают в родословной больных, с таковой
- 67. Семейное накопление МФЗ
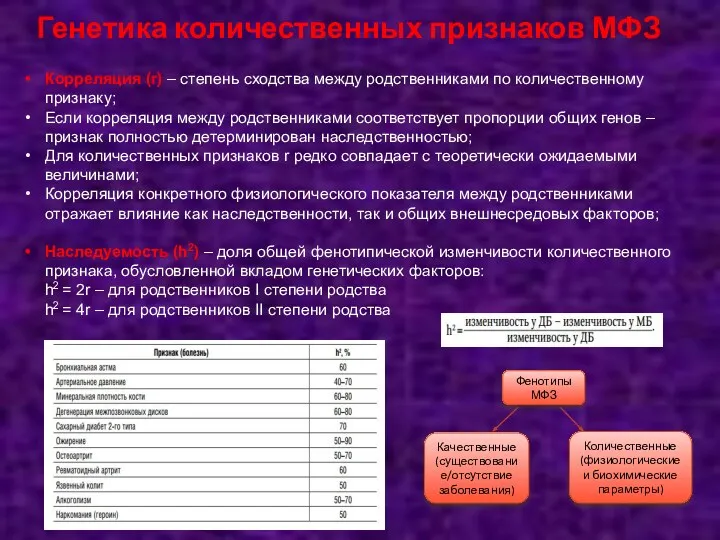
- 68. Генетика количественных признаков МФЗ Корреляция (r) – степень сходства между родственниками по количественному признаку; Если корреляция
- 69. ГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ МФЗ ПОЗВОЛЯЮТ: Использовать генетические маркеры в дифференцальной диагностики разных заболеваний и их форм. Разрабатывать
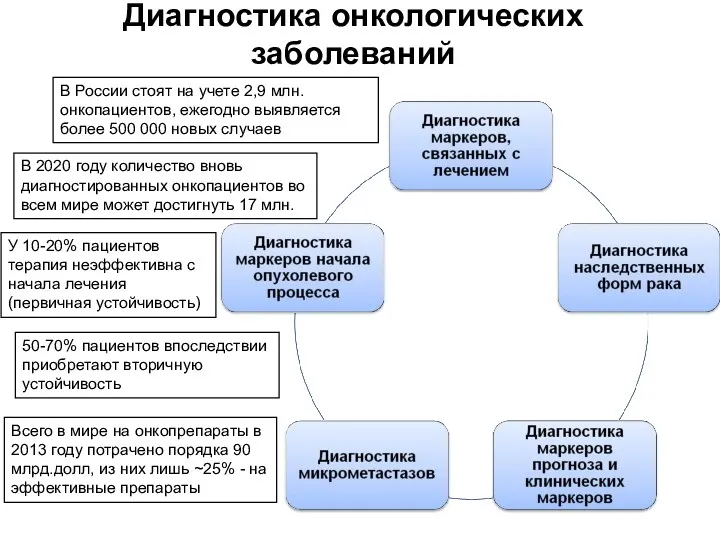
- 70. Диагностика онкологических заболеваний В России стоят на учете 2,9 млн. онкопациентов, ежегодно выявляется более 500 000
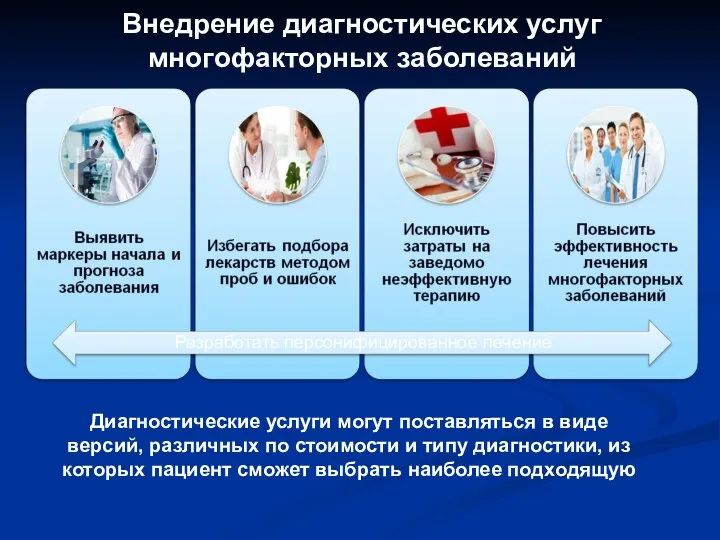
- 71. Внедрение диагностических услуг многофакторных заболеваний Диагностические услуги могут поставляться в виде версий, различных по стоимости и
- 73. Скачать презентацию




































 Почему нужно есть много овощей и фруктов (1 класс)
Почему нужно есть много овощей и фруктов (1 класс) Презентация по биологии для учащихся 7 класса по теме Класс Пресмыкающиеся
Презентация по биологии для учащихся 7 класса по теме Класс Пресмыкающиеся Тварини-будівельники
Тварини-будівельники Что такое онтогенез? Представления об онтогенезе: эпигенез, преформизм, современное
Что такое онтогенез? Представления об онтогенезе: эпигенез, преформизм, современное Внешнее строение птиц
Внешнее строение птиц кишечнополостные
кишечнополостные Занимательное путешествие в мир насекомых
Занимательное путешествие в мир насекомых Сценарий выступления агитбригады Не рвите цветы
Сценарий выступления агитбригады Не рвите цветы Как питается растение? Урок природоведения в 5 классе
Как питается растение? Урок природоведения в 5 классе Ағза қызметтерін реттеудегі гипоталамды - гипофизарлы бүйрек үсті жүйесінің ролі
Ағза қызметтерін реттеудегі гипоталамды - гипофизарлы бүйрек үсті жүйесінің ролі Биохимия клеточной поверхности микроорганизмов
Биохимия клеточной поверхности микроорганизмов Семинар учителей биологии. Решение генетических задач
Семинар учителей биологии. Решение генетических задач Клас Павукоподібні
Клас Павукоподібні Жыныс гормондарының түзілуі және маңызы
Жыныс гормондарының түзілуі және маңызы Межвидовое взаимодействие. Сообщество человек-собака
Межвидовое взаимодействие. Сообщество человек-собака Жизненный цикл голосеменных и покрытосеменных растений
Жизненный цикл голосеменных и покрытосеменных растений Презентация к уроку биологии в 10 классе Вирусы
Презентация к уроку биологии в 10 классе Вирусы Красная книга России
Красная книга России Животные. Систематика
Животные. Систематика Эпителиальная, мышечная, соединительная и нервная ткани
Эпителиальная, мышечная, соединительная и нервная ткани Одноклітинні бактерії. Шкідливі бактерії
Одноклітинні бактерії. Шкідливі бактерії Как питаются разные животные
Как питаются разные животные Классификация животных по способу питания (часть 2)
Классификация животных по способу питания (часть 2) Подпороговое восприятие. Психофизические закономерности ощущений. Изменение чувствительности анализаторов
Подпороговое восприятие. Психофизические закономерности ощущений. Изменение чувствительности анализаторов Основные классы Типа Иглокожих. Биология 7 класс
Основные классы Типа Иглокожих. Биология 7 класс Анатомия и симптомы поражения тройничного нерва
Анатомия и симптомы поражения тройничного нерва 20190304_kletochnaya_teoriya
20190304_kletochnaya_teoriya Рефлексы
Рефлексы