Содержание
- 2. 2 ПЛАН ЛЕКЦИИ 1. Строение гетероароматических соединений. Концепция π-избыточности и π-дефицитности. π-Амфотерные гетероциклы (азолы). 2. Пятичленные
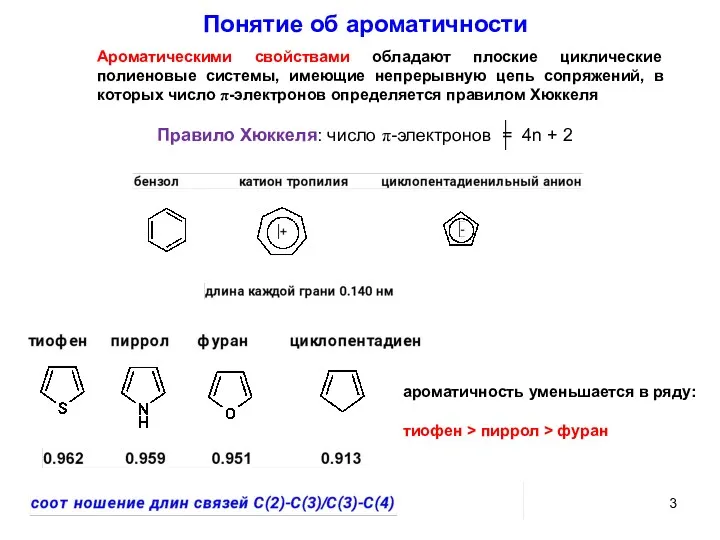
- 3. ароматичность уменьшается в ряду: тиофен > пиррол > фуран Понятие об ароматичности Ароматическими свойствами обладают плоские
- 4. Относительная ароматичность карбоциклических и гетероциклических соединений
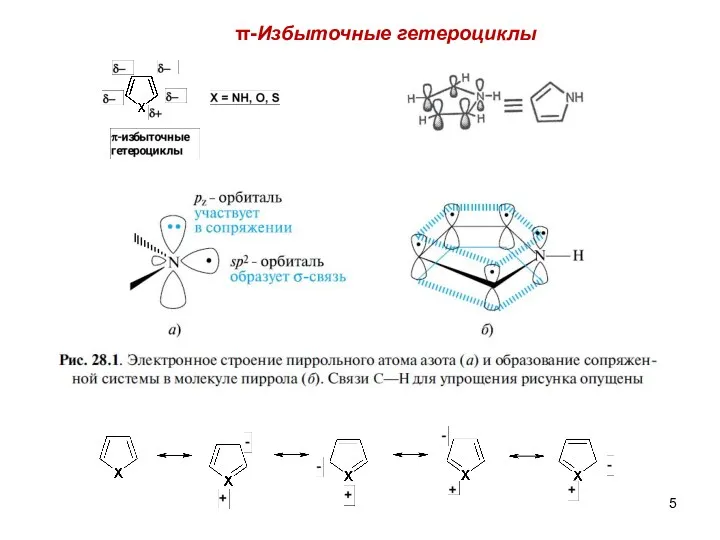
- 5. π-Избыточные гетероциклы
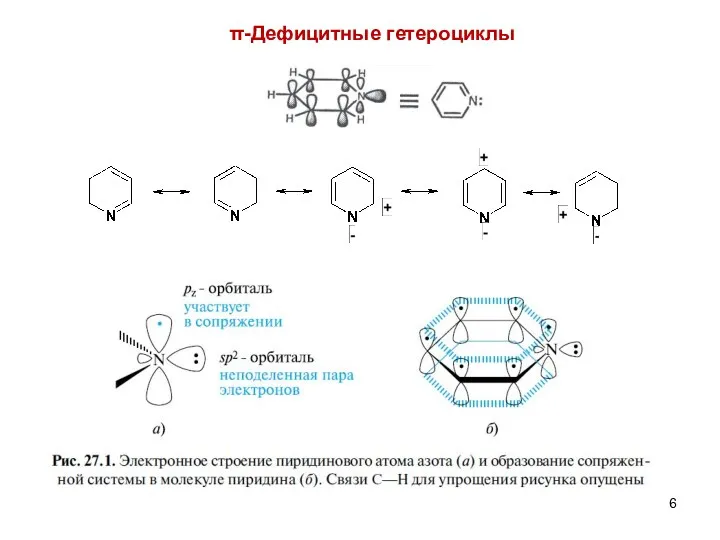
- 6. π-Дефицитные гетероциклы
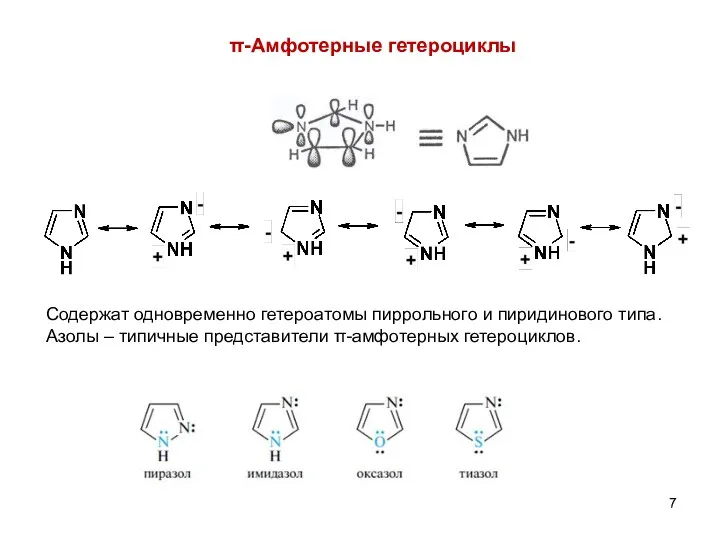
- 7. π-Амфотерные гетероциклы Содержат одновременно гетероатомы пиррольного и пиридинового типа. Азолы – типичные представители π-амфотерных гетероциклов.
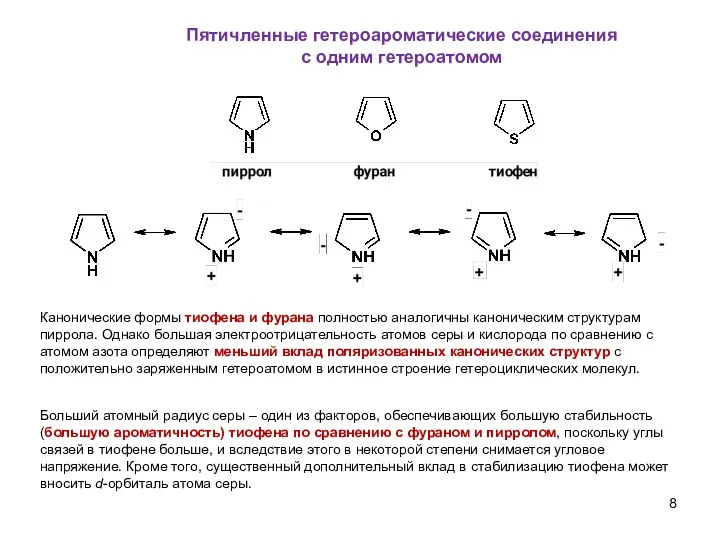
- 8. Пятичленные гетероароматические соединения с одним гетероатомом Больший атомный радиус серы – один из факторов, обеспечивающих большую
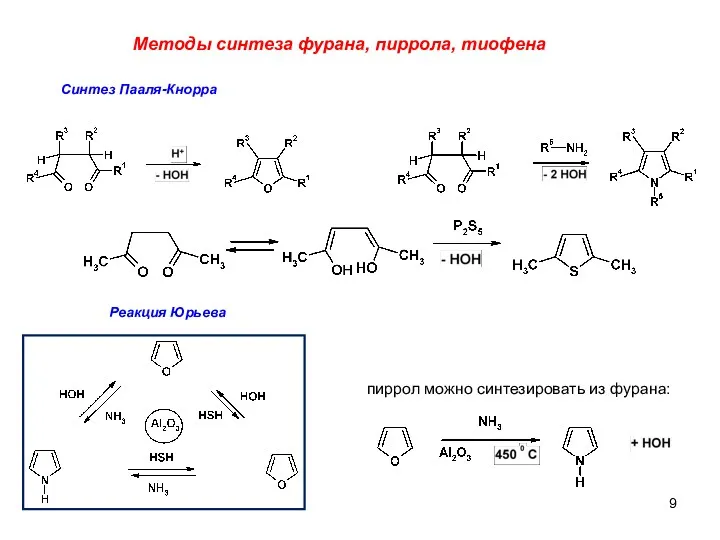
- 9. Методы синтеза фурана, пиррола, тиофена Синтез Пааля-Кнорра Реакция Юрьева пиррол можно синтезировать из фурана:
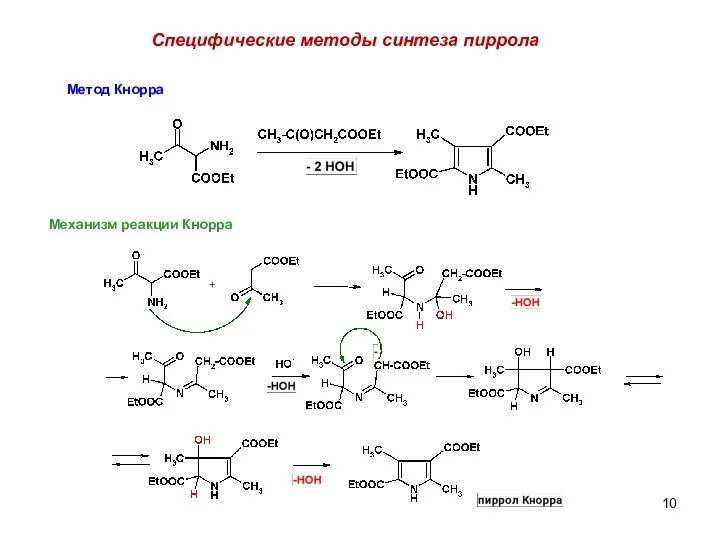
- 10. Специфические методы синтеза пиррола Метод Кнорра Механизм реакции Кнорра
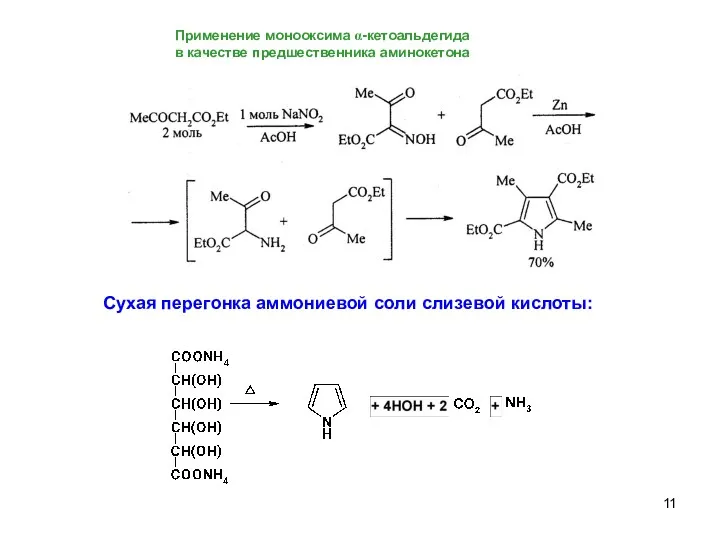
- 11. Применение монооксима α-кетоальдегида в качестве предшественника аминокетона Сухая перегонка аммониевой соли слизевой кислоты:
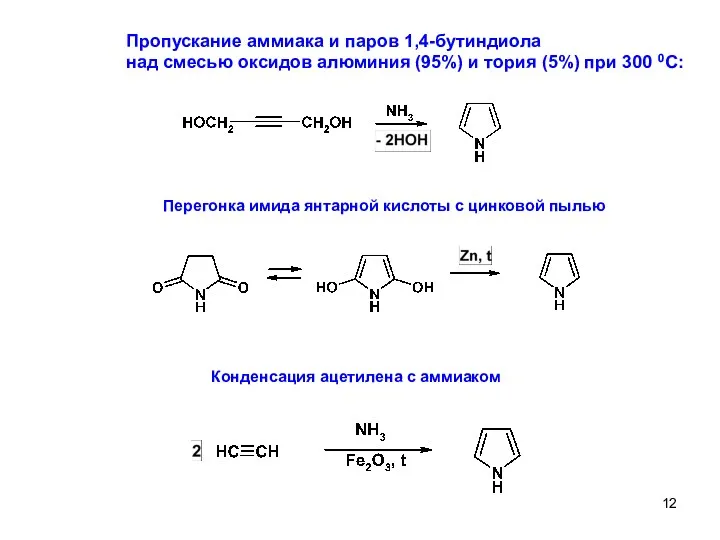
- 12. Пропускание аммиака и паров 1,4-бутиндиола над смесью оксидов алюминия (95%) и тория (5%) при 300 0С:
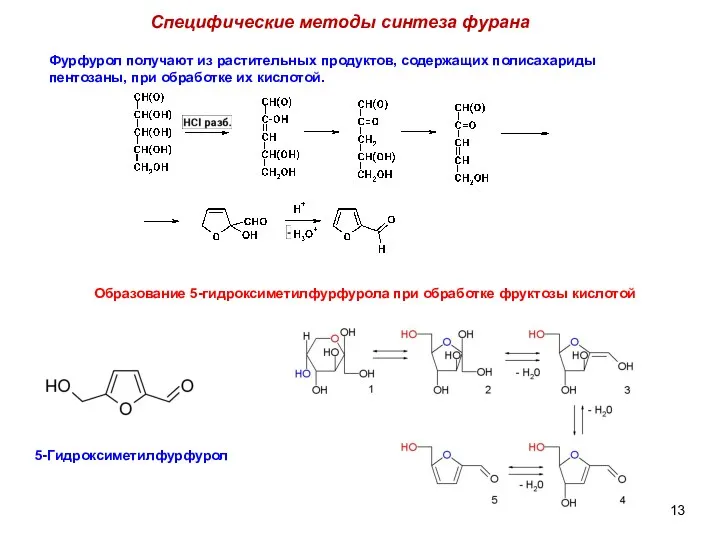
- 13. Специфические методы синтеза фурана Фурфурол получают из растительных продуктов, содержащих полисахариды пентозаны, при обработке их кислотой.
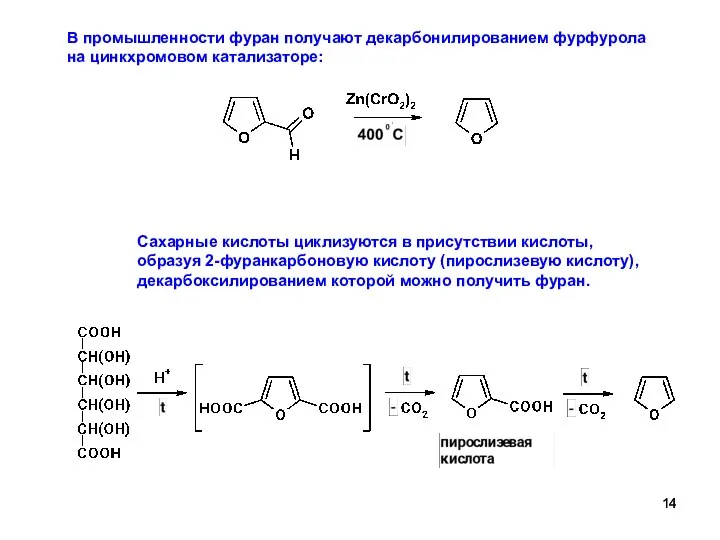
- 14. В промышленности фуран получают декарбонилированием фурфурола на цинкхромовом катализаторе: Сахарные кислоты циклизуются в присутствии кислоты, образуя
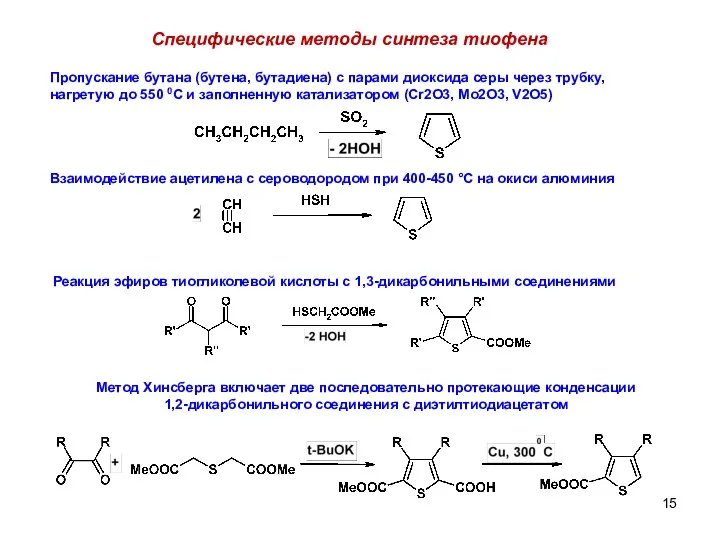
- 15. Специфические методы синтеза тиофена Пропускание бутана (бутена, бутадиена) с парами диоксида серы через трубку, нагретую до
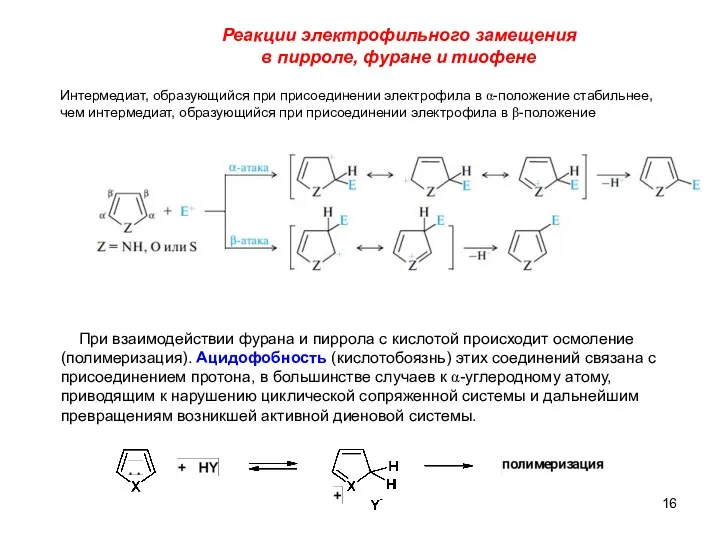
- 16. Реакции электрофильного замещения в пирроле, фуране и тиофене Интермедиат, образующийся при присоединении электрофила в α-положение стабильнее,
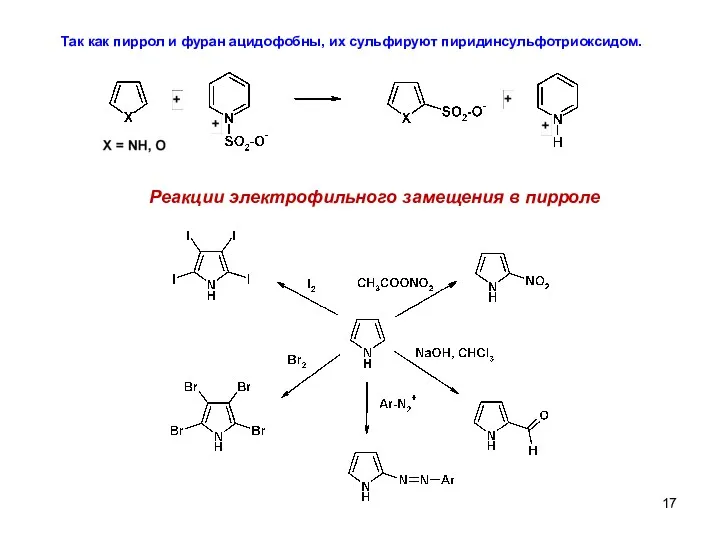
- 17. Так как пиррол и фуран ацидофобны, их сульфируют пиридинсульфотриоксидом. Реакции электрофильного замещения в пирроле
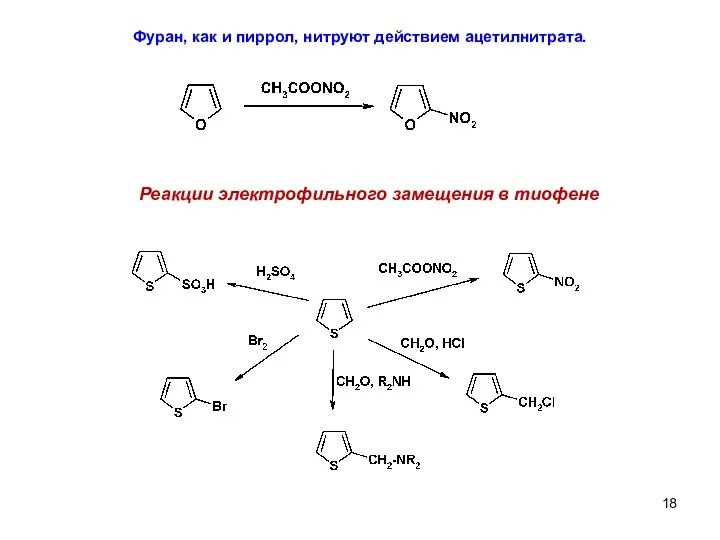
- 18. Фуран, как и пиррол, нитруют действием ацетилнитрата. Реакции электрофильного замещения в тиофене
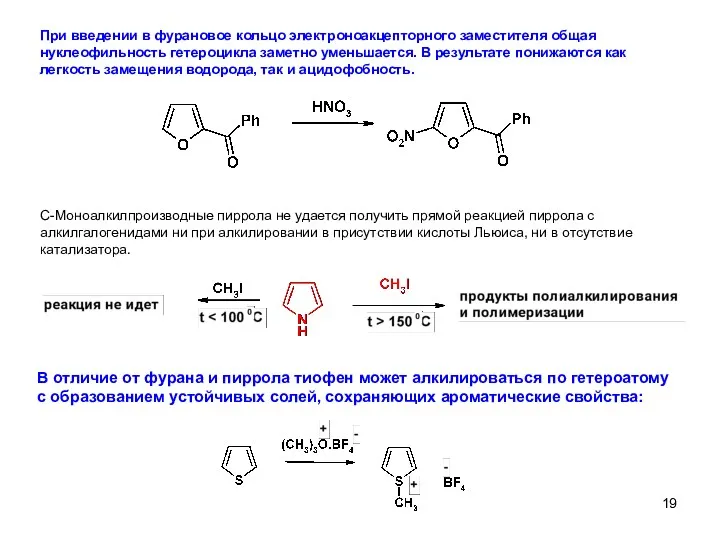
- 19. При введении в фурановое кольцо электроноакцепторного заместителя общая нуклеофильность гетероцикла заметно уменьшается. В результате понижаются как
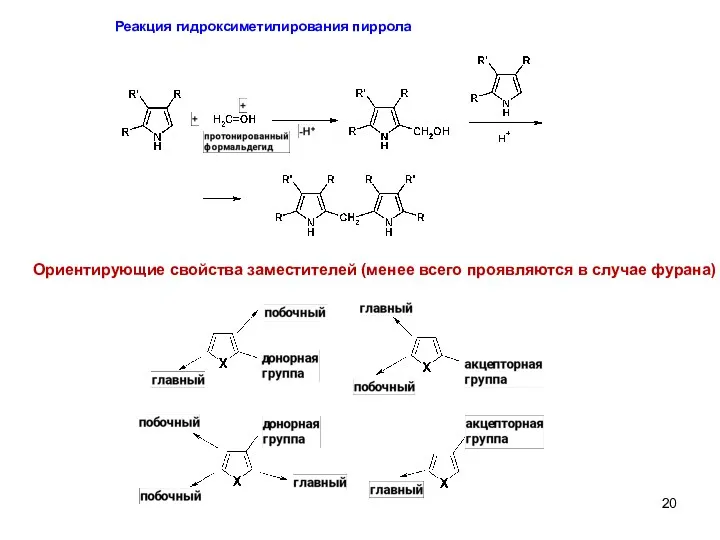
- 20. Реакция гидроксиметилирования пиррола Ориентирующие свойства заместителей (менее всего проявляются в случае фурана)
- 22. Скачать презентацию


 Удивительные грибы - 2
Удивительные грибы - 2 Ткани растений
Ткани растений Цитология. Химический состав клетки
Цитология. Химический состав клетки Собака домашняя
Собака домашняя Плоды. Строение плода
Плоды. Строение плода Онтогенез 11 класс
Онтогенез 11 класс Отряд Насекомоядные
Отряд Насекомоядные Оплодотворение
Оплодотворение Необычные рыбы
Необычные рыбы Отчет по производственной практике. Создание рекомбинантной бактерии Bacillus subtilis с геном рекомбинантного белка Cri
Отчет по производственной практике. Создание рекомбинантной бактерии Bacillus subtilis с геном рекомбинантного белка Cri Жизнедеятельность организмов
Жизнедеятельность организмов Кто такие рыбы?
Кто такие рыбы? Нуклеиновые кислоты
Нуклеиновые кислоты Черепные нервы I-VI
Черепные нервы I-VI Ряд общебиологических обобщений имеет прямое отношение к становлению и развитию современных представлений об ЭБР
Ряд общебиологических обобщений имеет прямое отношение к становлению и развитию современных представлений об ЭБР Создание новых пород и типов племенного скота
Создание новых пород и типов племенного скота презентация к классному часу для учащихся 5 класса Игра Интеллект-2007 Вопросы о животных
презентация к классному часу для учащихся 5 класса Игра Интеллект-2007 Вопросы о животных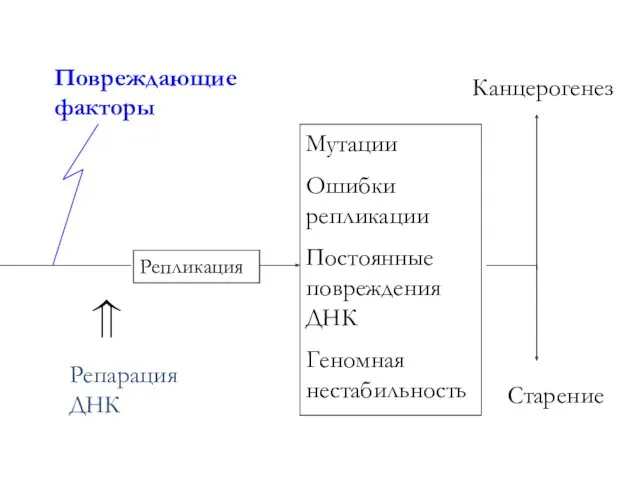 Репарация ДНК
Репарация ДНК Формы размножения организмов. Бесполое размножение. Митоз
Формы размножения организмов. Бесполое размножение. Митоз Сообщество. Экосистема. Биогеоценоз.
Сообщество. Экосистема. Биогеоценоз. Концепция экосистемы
Концепция экосистемы Сравнительно-анатомические доказательства эволюции
Сравнительно-анатомические доказательства эволюции Теория стационарного состояния
Теория стационарного состояния Умники и умницы по биологии 6 класс
Умники и умницы по биологии 6 класс Botanika. Organizace předmětu
Botanika. Organizace předmětu Презентация Фотосинтез. Необыкновенные приключения хлорофилла
Презентация Фотосинтез. Необыкновенные приключения хлорофилла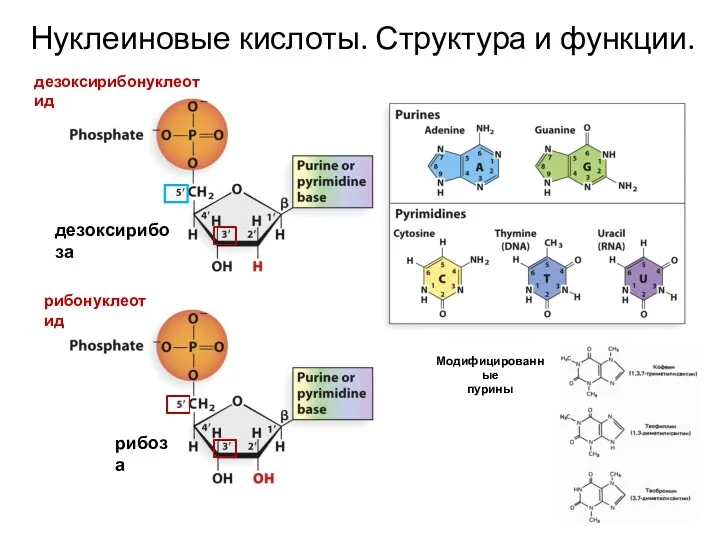 Нуклеиновые кислоты. Структура и функции
Нуклеиновые кислоты. Структура и функции Экологические группы растений
Экологические группы растений