Содержание
- 2. Иммуноферментный анализ (сокращённо ИФА, англ. enzyme-linked immunosorbent assay, ELISA) — лабораторный иммунологический метод качественного или количественного
- 3. ИФА появился в середине 60-х годов и первоначально был разработан как метод для идентификации антигена в
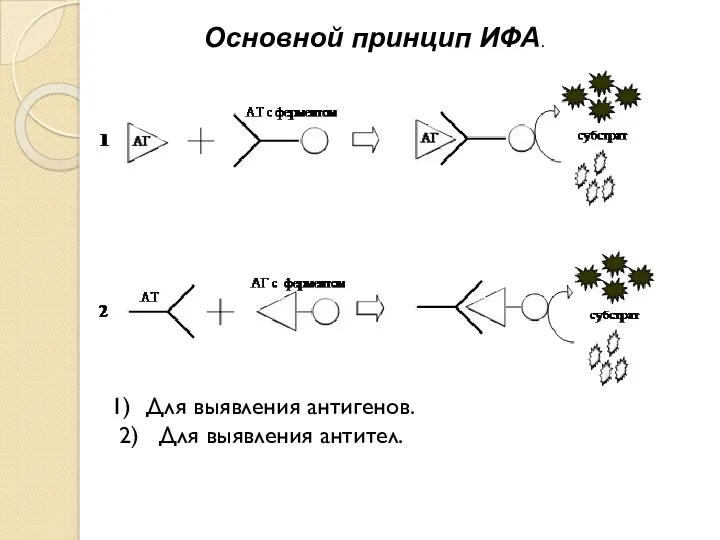
- 4. Основной принцип ИФА. Для выявления антигенов. 2) Для выявления антител.
- 5. Метод основан на специфическом связывании антитела с антигеном, при этом один из компонентов коңюгирован с ферментом,
- 6. Теоретически ИФА основывается на данных современной иммунохимии и химической энзимологии, знании физико-химических закономерностей реакции антиген-антитело, а
- 7. 96 ячеечный микропланшет, используемый для постановки ИФА.
- 8. Любой вариант ИФА содержит 3 обязательные стадии: 1. стадия узнавания тестируемого соединения специфическим к нему антителом,
- 9. Сущность и классификация Из-за разнообразия объектов исследования — от низкомолекулярных соединений до вирусов и бактерий, и
- 10. Примером неконкурентного формата ИФА является «сэндвич»-метод. К носителю с иммобилизованными антителами добавляют раствор, содержащий анализируемый антиген.
- 11. Среди конкурентных схем твердофазного ИФА существует два основных формата: Прямой конкурентный формат ИФА использует иммобилизованые на
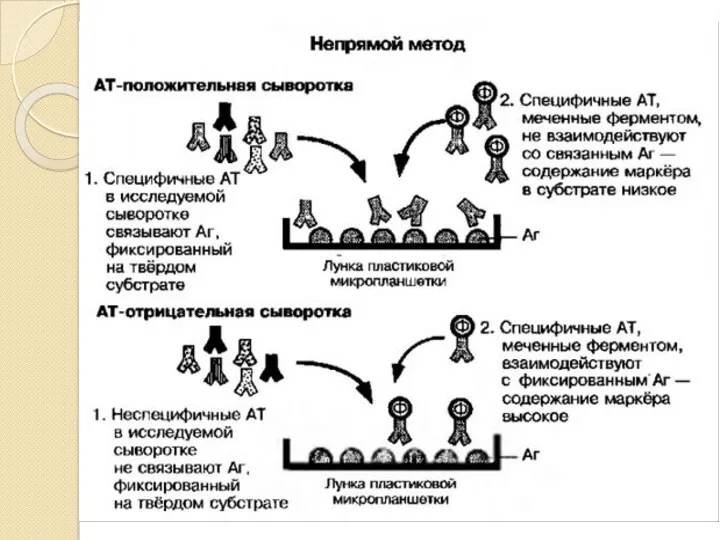
- 13. В непрямом конкурентном формате ИФА используются меченные ферментом антитела (специфические или вторичные) и иммобилизованный на твердой
- 15. Если все три стадии ИФА проходят в растворе и между основными стадиями нет дополнительных этапов разделения
- 16. Для гетерогенных методов характерно проведение анализа в двухфазной системе с участием твердой фазы – носителя, и
- 17. Как любые иммунохимические методы анализа, ИФА может давать ложноположительные и ложноотрицательные результаты. Например, ложноположительные результаты при
- 18. Ферменты Ферментные метки обладают чрезвычайно мощным каталитическим действием, одна молекула фермента может реагировать с большим количеством
- 19. Ферментные маркеры, используемые в ИФА, должны обладать следующими свойствами: – высокая активность и стабильность фермента в
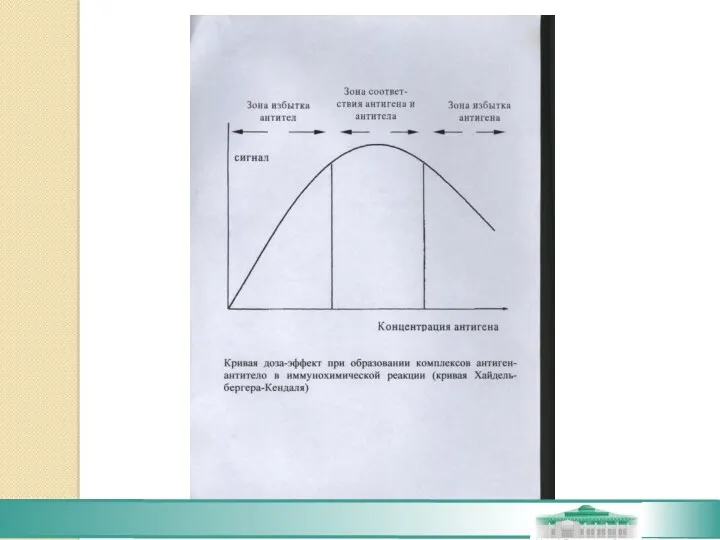
- 20. Субстраты Выбор субстрата в первую очередь определяется используемым в качестве метки ферментом, так как реакция фермент-субстрат
- 21. Ферменты и их субстраты наиболее широко используемые в ИФА.
- 22. преимущества иммуноферментного анализа — высокая чувствительность, позволяющая выявлять концентрации до 0, 05 нг/мл. Такая чувствительность метода
- 23. Основные типы тест-систем в зависимости от используемых антигенов В зависимости от того, какие антигены используются, иммуноферментные
- 24. История развития иммуно-химических методов анализа 60-е: радиоизотопные методы (высокая чувствительность и специфичность); 70-е: иммуноферментные методы (улучшенная
- 25. Иммунохимические методы При взаимодействии антигена и специфического иммуноглобулина (АТ) образуется высокомолекулярный комплекс . Можно определять АТ
- 26. Гетерогенный анализ отличается от гомогенного тем, что в реакционной смеси имеются две фазы- твердая( осадок, суспензия)
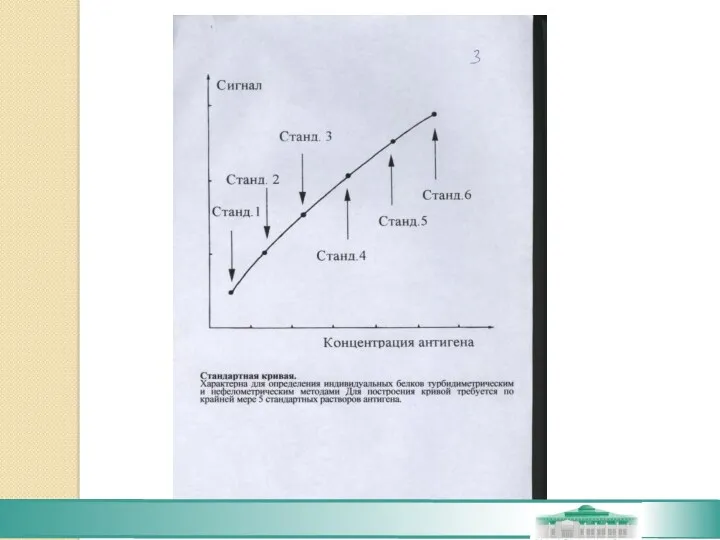
- 27. Определение индивидуальных белков на основе реакции взаимодействия антиген-антитело. При взаимодействии АГ с АТ образуется иммунный комплекс,
- 28. Реакция между АГ и АТ в жидкой фазе. Метод турбидиметрии и нефелометрии. Реакция АГ-АТ прявляется в
- 31. Лигандный анализ. специфическое связывание с лигандами как аналитический метод начинается с работы Ялоу и Берсон, предложивших
- 32. В лигандном анализе выделяют три компонента: 1) АНАЛИТ- определяемое вещество. Оно может содержаться в анализируемом материале,
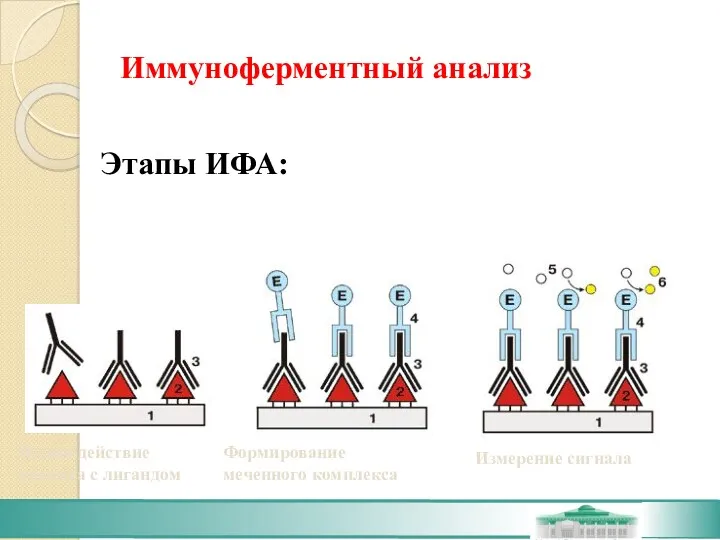
- 33. ЭТАПЫ: Взаимодействие аналита с лигандом. Формирование меченного комплекса. Измерение сигнала (определение количества метки).
- 34. ОСНОВНЫЕ АНАЛИТИЧЕСКИЕ ВАРИАНТЫ: 1.Прямые- определяется количество комплекса аналит- лиганд. При увеличении концентрации аналита сигнал возрастает. 2.
- 35. Иммуноферментный анализ Метод выявления антигенов и антител, основанный на определении комплекса антиген-антитело за счет введения в
- 36. Иммуноферментный анализ Существует множество вариантов постановки ИФА, из которых наибольшее практическое значение получил гетерогенный твердофазный иммуноферментный
- 37. Иммуноферментный анализ Для ферментативной метки коньюгата могут быть применены разнообразные ферменты: пероксидаза хрена, щелочная фосфотаза, бета-галактозидаза,
- 38. Иммуноферментный анализ Этапы ИФА: Взаимодействие аналита с лигандом Формирование меченного комплекса Измерение сигнала
- 39. Конкурентный ИФА для определения антигенов Искомый антиген(1) и меченый ферментом антиген(2) конкурируют друг с другом за
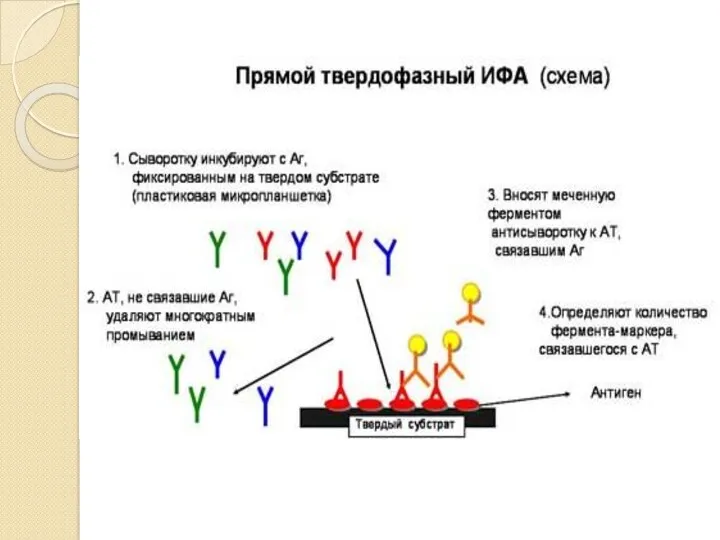
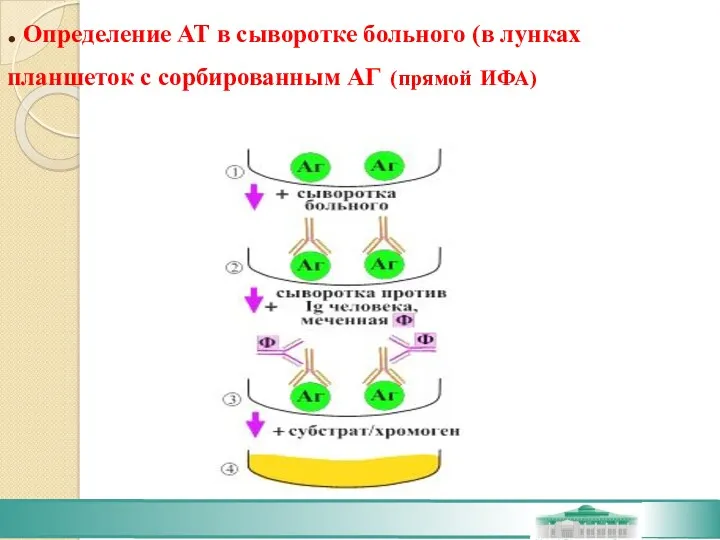
- 40. . Определение АТ в сыворотке больного (в лунках планшеток с сорбированным АГ (прямой ИФА)
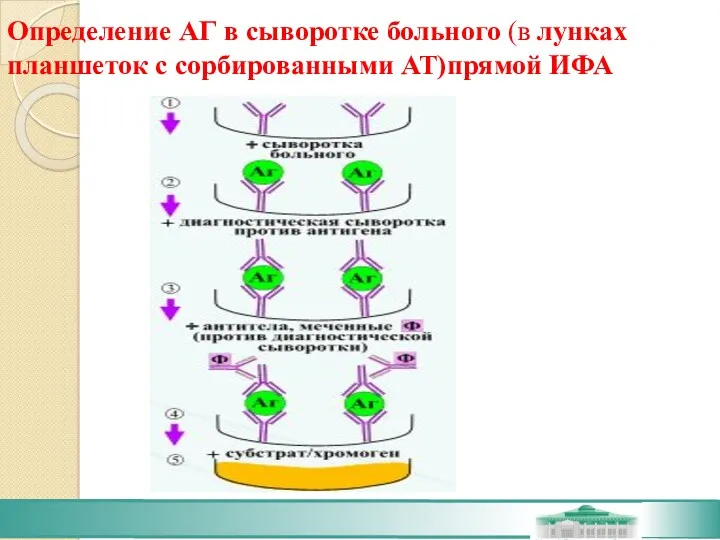
- 41. Определение АГ в сыворотке больного (в лунках планшеток с сорбированными АТ)прямой ИФА
- 42. Иммуноферментный анализ- это: Чувствительность, позволяющая выявлять концентрации до 0,05нг/мл; Возможность использовать минимальные объемы исследуемого материала; Стабильность
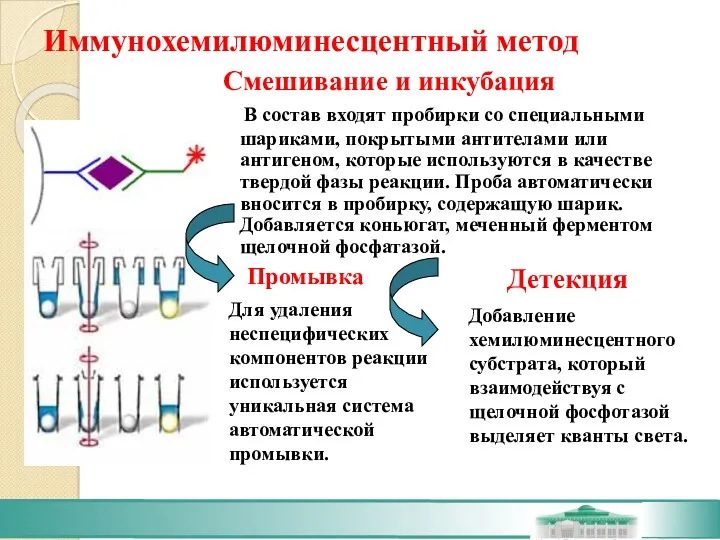
- 43. Иммунохемилюминесцентный метод
- 44. Аналитическая чувствительность- (ТТГ третьей генерации - 0,002 IU/ml. ПСА третьей генерации - 0,003 ng/ml.); Производительность -
- 45. Иммунохемилюминесцентный метод В состав входят пробирки со специальными шариками, покрытыми антителами или антигеном, которые используются в
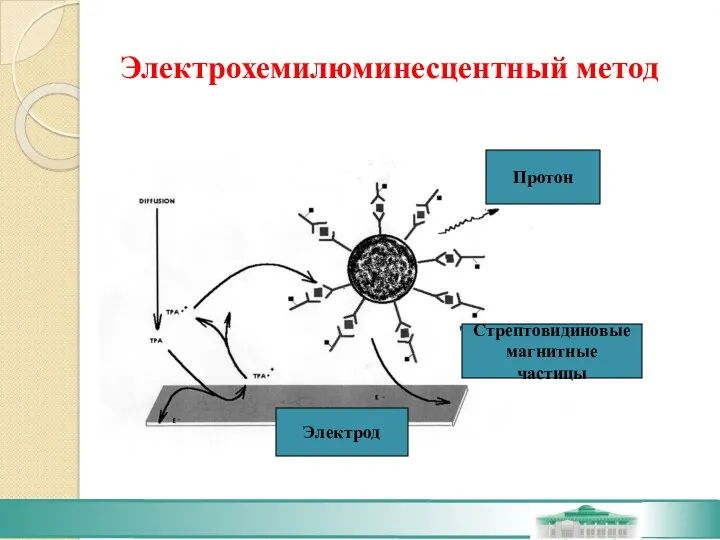
- 46. Электрохемилюминесцентный метод
- 47. Электрохемилюминесцентный метод Метод основан на детекции эмиссии света, возникшей под воздействием электрического поля. Метка - рутениевый
- 48. Электрохемилюминесцентный метод 1-я инкубация. Проба + биотинилированное МА+ второе МА, помеченное рутениевым комплеком реагируют собразованием "сэндвич"-комплекса.
- 49. Электрохемилюминесцентный метод Высокая стабильность рутениевой метки (ферменты не используются, что значительно повышает стабильность реакции); Быстрота и
- 50. Электрохемилюминесцентный метод Стрептовидиновые магнитные частицы Электрод Протон
- 51. Электрохемилюминесцентный метод Короткое время инкубации. (9-18 минут). Аналитическая чувствительность- (ТТГ - 0,005 IU/ml., ПСА - 0,005
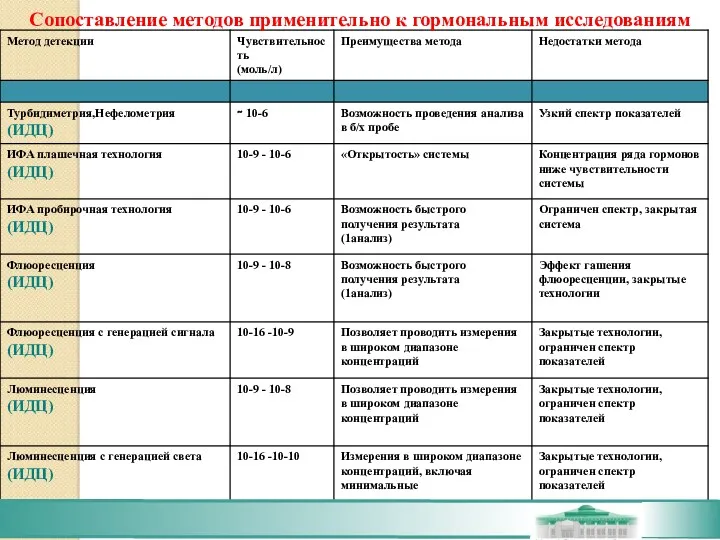
- 52. Сопоставление методов применительно к гормональным исследованиям
- 53. Группы методов лабораторной диагностики Прямые выявляют инфекционный агент Непрямые (косвенные) выявляют ответ организма на инфекционный агент
- 54. Непрямые методы Все серологические реакции – РСК, РТГА, РПГА, ИФА и т.д. Несомненные плюсы ответ появится
- 55. Прямые методы Микроскопия ИФА на антигены ПЦР Культуральный метод Особенности прямых методов Врач должен знать стадии
- 56. Выбор среди прямых методов лаб.диагностики Световая микроскопия Бак.посев ПЦР ИФА Ряд микроорганизмов не визуализируется; Схожесть морфотипов;
- 57. Тем не менее: Ни один метод не является абсолютом, исключающим все остальные Лучше всего комбинировать прямые
- 58. Хроматографические методы исследования Аффинная ЖХВД; Тонкослойная хроматография Техника ТСХ. Приготовление пластинок. Нанесение препаратов. «Проявление» пластинок, обнаружение
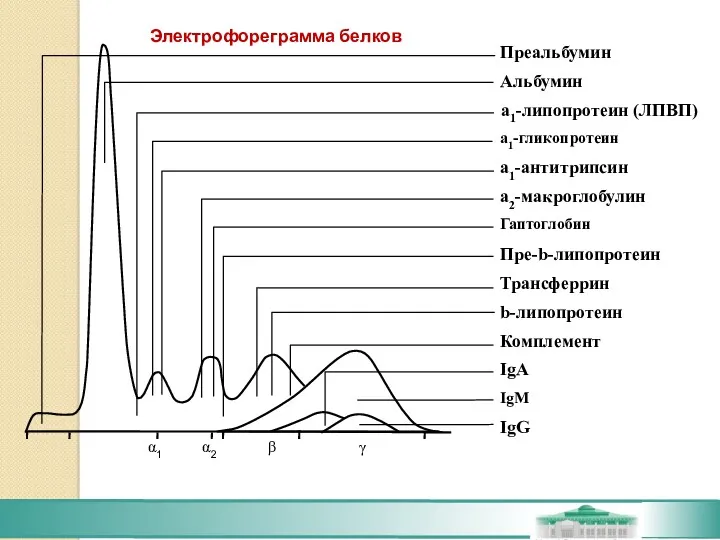
- 59. Электрофореграмма белков
- 60. Система капиллярного электрофореза CAPILLARYS 2 (SEBIA)» Инновационная технология разделения и анализа белковых фракций сыворотки крови, мочи
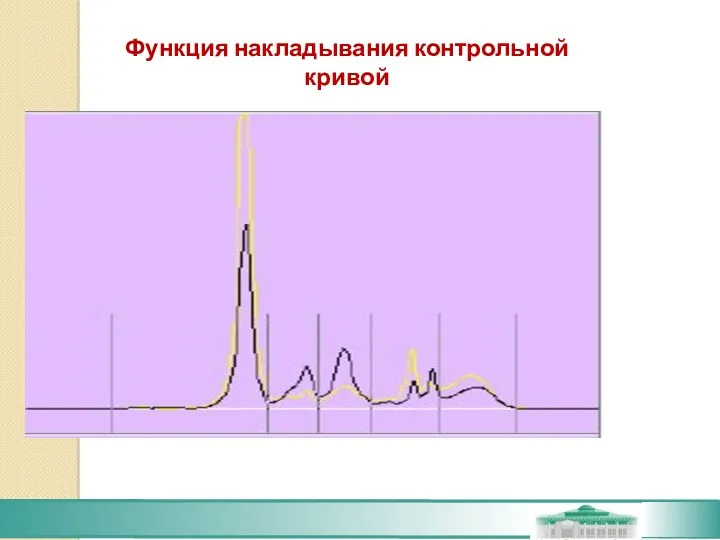
- 61. Функция накладывания контрольной кривой
- 62. Экспресс-диагностика Иммуноблотинг; Диагностические наборы для клинической химии; Латекс-тесты для качественного и полуколичественного анализа; Иммунохроматографические тесты на
- 63. Преимущества экспресс-методов Анализ без доставки в КДЛ; Получения результатов через 2-20 мин.; Отсутствие дорогостоящих приборов при
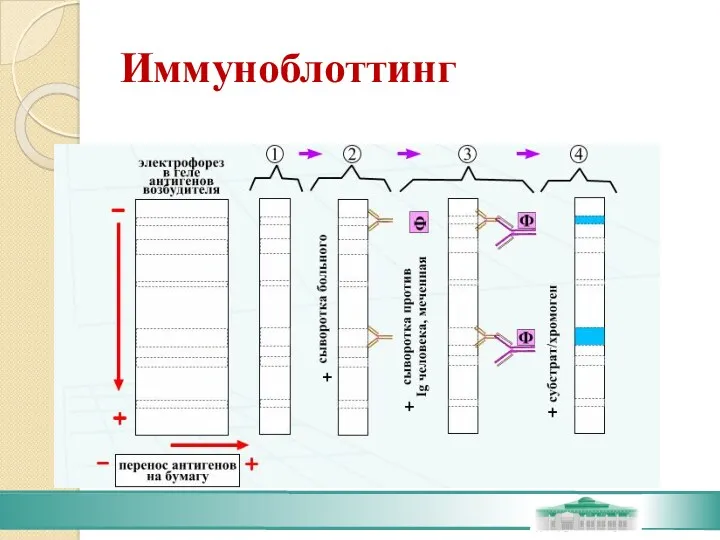
- 64. Иммуноблоттинг Иммуноблоттинг (син. вестернблоттинг) - высокочувствительный метод выявления белков, основанный на сочетании электрофореза и ИФА или
- 65. Иммуноблоттинг
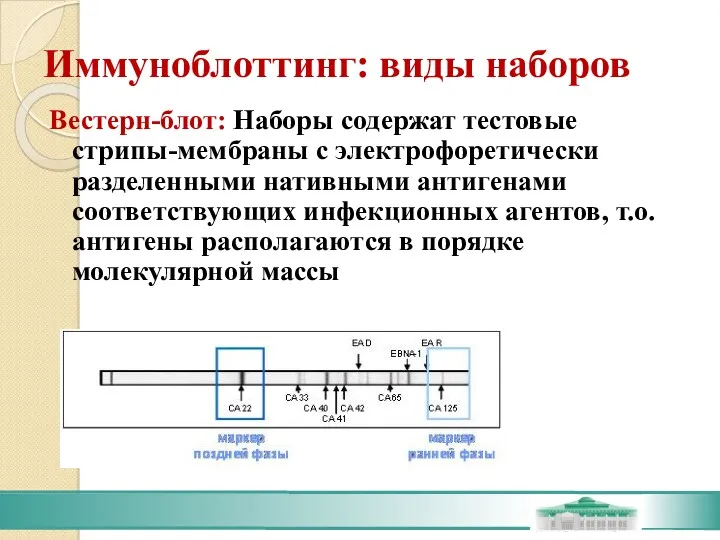
- 66. Иммуноблоттинг: виды наборов Вестерн-блот: Наборы содержат тестовые стрипы-мембраны с электрофоретически разделенными нативными антигенами соответствующих инфекционных агентов,
- 67. Иммуноблоттинг: виды наборов Лайн-блот: на тестовые стрип-мембраны нанесены только клинически значимые антигены (нативные, синтетические или рекомбинантные)
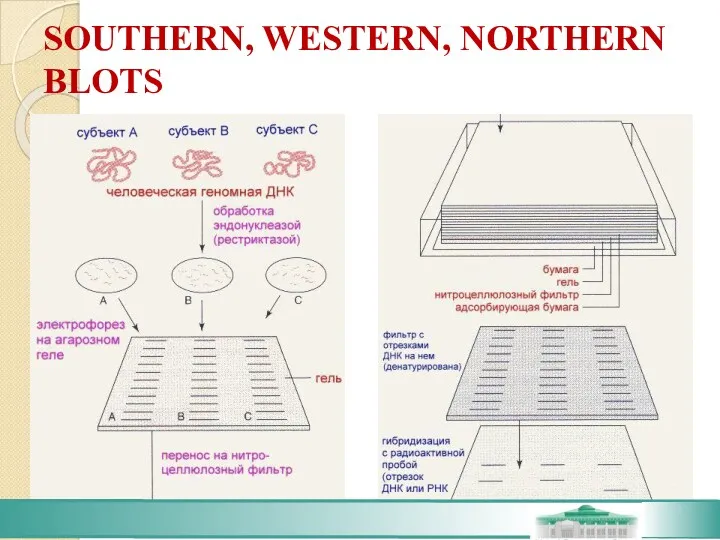
- 68. SOUTHERN BLOT - Процедура была разработана E. M. Southern и в основе ее лежит перенос отрезков
- 69. SOUTHERN, WESTERN, NORTHERN BLOTS
- 70. SOUTHERN, WESTERN, NORTHERN BLOTS На практике это используется для сравнения геномов отдельных лиц с целью выявления
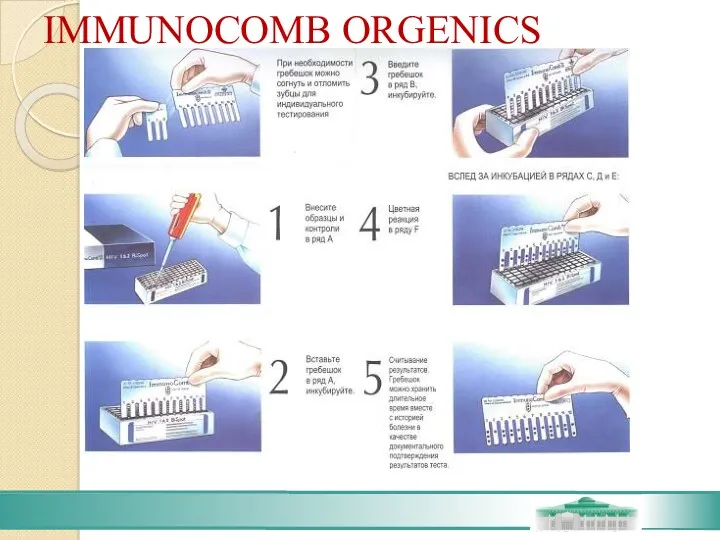
- 71. IMMUNOCOMB ORGENICS Оригинальная модификация твёрдофазного иммуноферментного анализа на гребенках, реализованная в наборах Иммунокомб, не требует использования
- 72. IMMUNOCOMB ORGENICS Зубцы пластикового гребня сенсибилизированы соответствующими антигенами или антителами. Ячейки ванночек заполнены готовыми растворами конъюгата,
- 73. IMMUNOCOMB ORGENICS
- 74. Скрининг-тесты для диагностики ревматоидных заболеваний; Для выявления инфекционных заболеваний (кандидоз, инфекционный мононуклеоз, токсоплазмоз, сифилис); Фертильность и
- 75. Реакция агглютинации Ревматоидный фактор «RF Direct Latex» Изготовитель - VEDA.LAB – Франция РФ латекс-реагент – является
- 76. Иммунохроматографические тесты Диагностика гепатитов,половых инфекций, гриппа А и Б, инфекций ЖКТ, туберкулеза, малярии, прочих инфекций, в
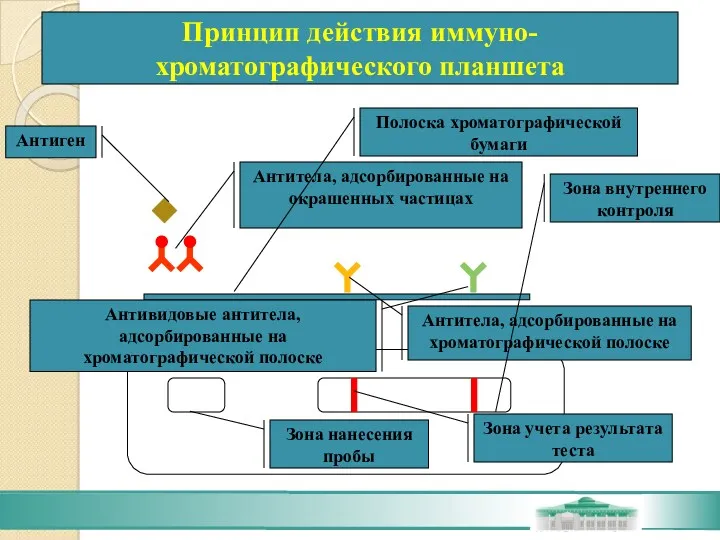
- 77. Иммунохроматография В реакции используют антитела к искомому антигену, адсорбированные на микрочастицах (окрашенный латекс или частицы коллоидного
- 78. Антитела, адсорбированные на окрашенных частицах Антитела, адсорбированные на хроматографической полоске Антивидовые антитела, адсорбированные на хроматографической полоске
- 79. Тест-полоски для анализа мочи Диагностика декомпенсированной стадии СД, сопровождающегося кетоацидозом и осложненные ренопатией; Диагностика нефрологических заболеваний;
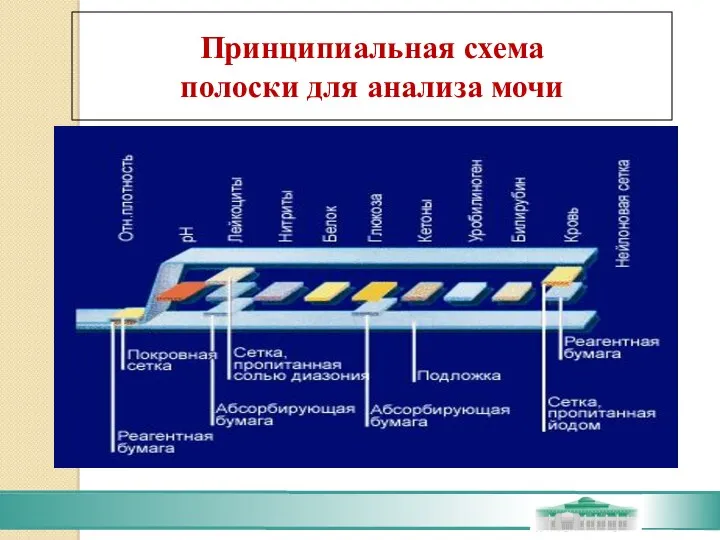
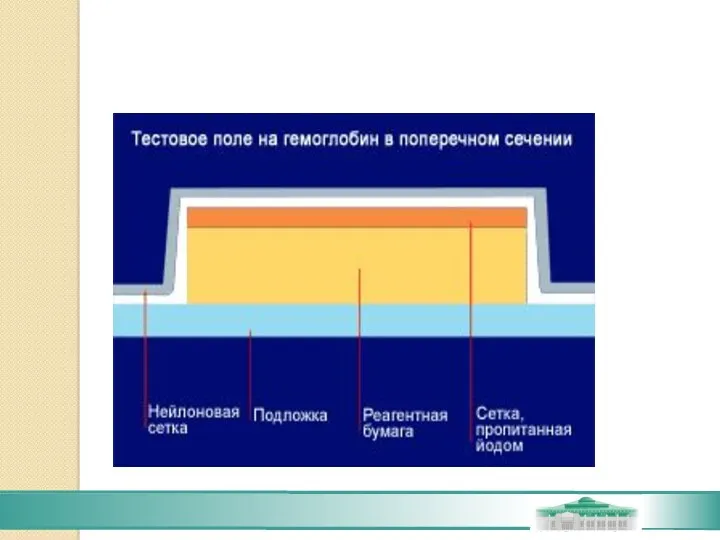
- 80. Тестовые поля представляют собой бумагу, пропитанную стандартным количеством необходимых для реакции компонентов, которые предварительно были стабилизированы
- 81. Принципиальная схема полоски для анализа мочи
- 84. Скачать презентацию





























































 Семейство лилейные, отдел цветковые или покрытосеменные
Семейство лилейные, отдел цветковые или покрытосеменные Комнатные растения (часть 2)
Комнатные растения (часть 2) Цитологические основы наследственности
Цитологические основы наследственности What is the engine of our body machine
What is the engine of our body machine Птицы
Птицы У Чёрного моря
У Чёрного моря Вредители питомников и молодняков. (Лекция 5)
Вредители питомников и молодняков. (Лекция 5) Ткани растений
Ткани растений Изучение биоритмов человека – их влияние на жизнедеятельность
Изучение биоритмов человека – их влияние на жизнедеятельность Кормовая и сахарная свёкла
Кормовая и сахарная свёкла Сана және өзіндік сана
Сана және өзіндік сана Растительный и животный мир Республики Удмуртия
Растительный и животный мир Республики Удмуртия Интересные растения
Интересные растения Жасуша ядросы
Жасуша ядросы Бидай. Бидайдың зиянкестері
Бидай. Бидайдың зиянкестері Значение бактерий в природе и жизни человека
Значение бактерий в природе и жизни человека Устройство речевого аппарата
Устройство речевого аппарата Цитоскелет растительной клетки
Цитоскелет растительной клетки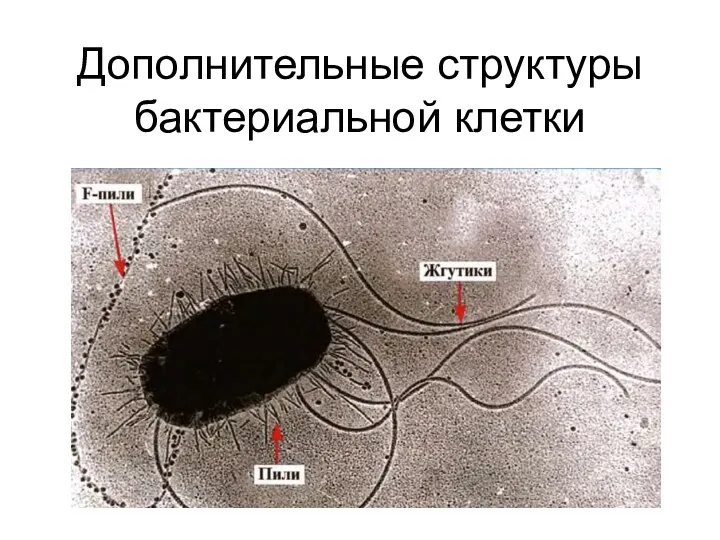 Дополнительные структуры бактериальной клетки
Дополнительные структуры бактериальной клетки Влияние факторов внешней среды на онтогенез
Влияние факторов внешней среды на онтогенез Морфология эпителиальной ткани
Морфология эпителиальной ткани Продолговатый мозг. Черепно-мозговые нервы (IX - XII)
Продолговатый мозг. Черепно-мозговые нервы (IX - XII) Сүт және сүт өнідерінің тағамдық биологиялық құндылығы мен қауіпсіздігі
Сүт және сүт өнідерінің тағамдық биологиялық құндылығы мен қауіпсіздігі Индивидуальное развитие цветковых растений
Индивидуальное развитие цветковых растений Генная инженерия: новые возможности и проблемы
Генная инженерия: новые возможности и проблемы Клонирование
Клонирование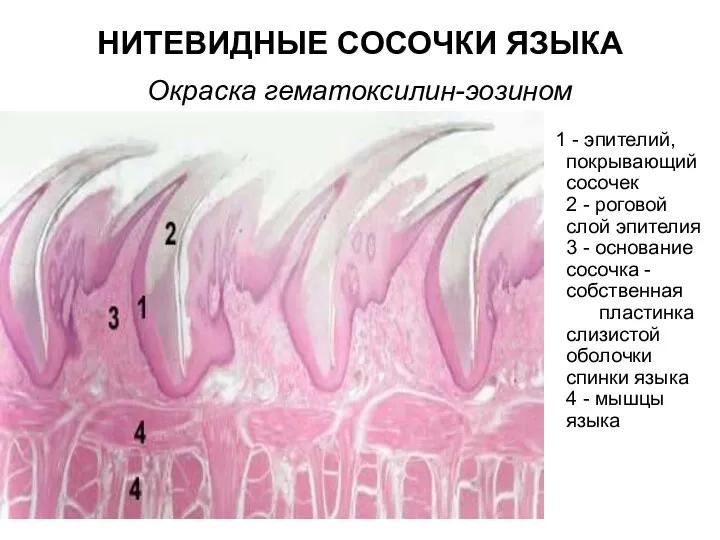 Нитевидные сосочки языка. Окраска гематоксилин-эозином
Нитевидные сосочки языка. Окраска гематоксилин-эозином Птицы Челябинской области
Птицы Челябинской области