Содержание
- 2. Индуцированные плюрипотентные стволовые (ИПС) клетки
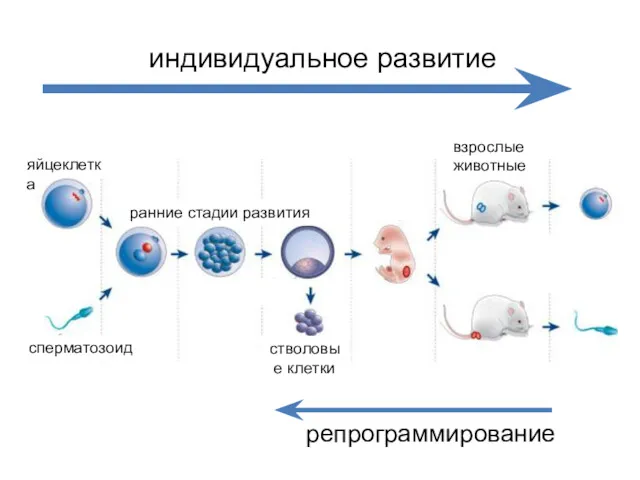
- 3. яйцеклетка сперматозоид ранние стадии развития стволовые клетки взрослые животные индивидуальное развитие репрограммирование
- 4. for the discovery that mature cells can be reprogrammed to become pluripotent за открытие возможности превращения
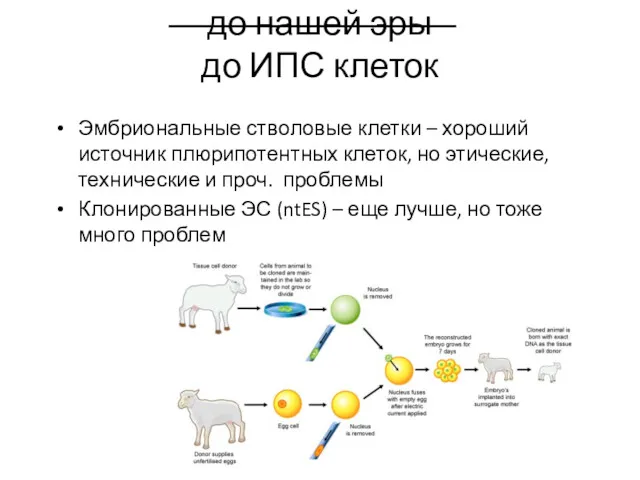
- 5. до нашей эры до ИПС клеток Эмбриональные стволовые клетки – хороший источник плюрипотентных клеток, но этические,
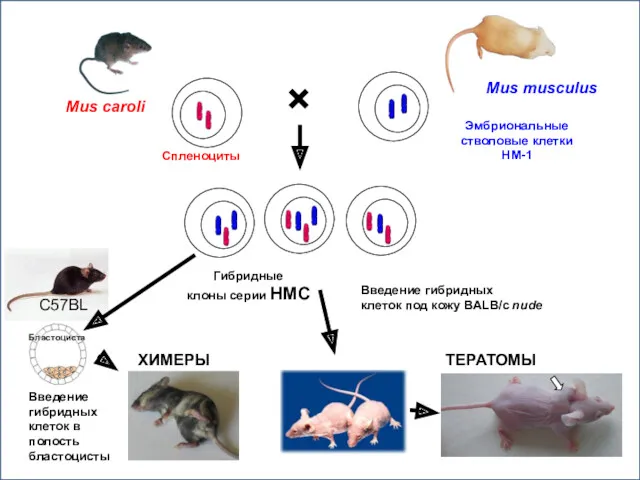
- 6. Эмбриональные стволовые клетки HM-1 Спленоциты × Гибридные клоны серии НМС Бластоциста С57BL Введение гибридных клеток под
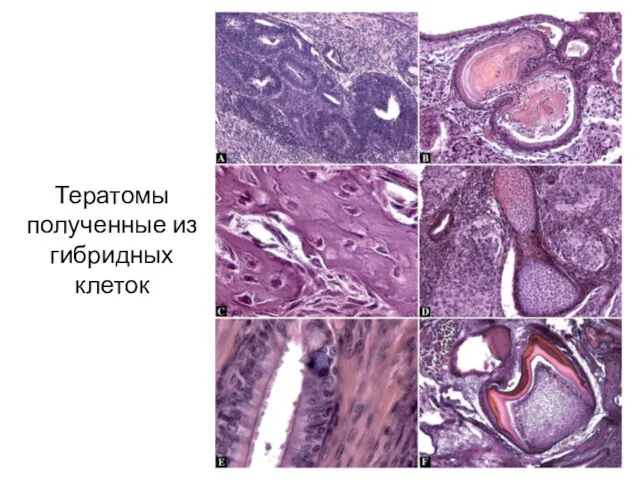
- 7. Тератомы полученные из гибридных клеток
- 8. Чем соматические клетки взрослого организма отличаются от эмбриональных стволовых клеток? Соматические клетки Выполняют определенные функции в
- 9. Чем соматические клетки взрослого организма отличаются от эмбриональных стволовых клеток? На самом деле, единственное ключевое отличие
- 10. Первая страница статьи Шиньи Яманаки в которой была показана принципиальная возможность индукции плюрипотентности в соматических клетках
- 11. Если цель получить стволовые клетки из соматических, какие факторы нужно добавить? Транскрипционные факторы специфичные для эмбриональных
- 12. Важная деталь! Для введения трансгенов в работе Яманаки использовали ретровирусные векторы. Ретровирусные векторы обеспечивают стабильную экспрессию
- 13. Virus vs. retrovirus
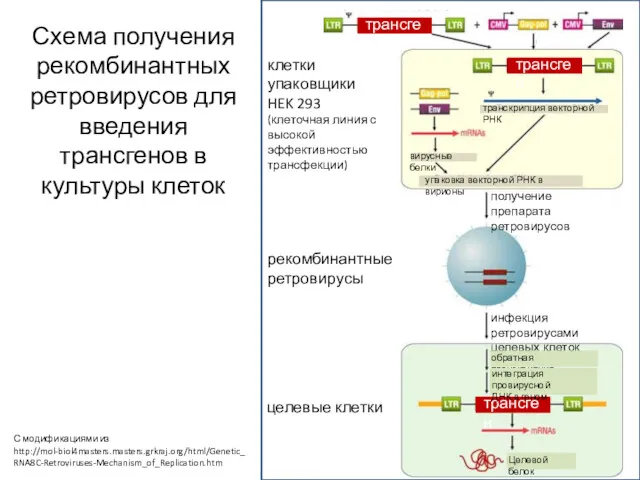
- 14. рекомбинантные ретровирусы Схема получения рекомбинантных ретровирусов для введения трансгенов в культуры клеток С модификациями из http://mol-biol4masters.masters.grkraj.org/html/Genetic_RNA8C-Retroviruses-Mechanism_of_Replication.htm
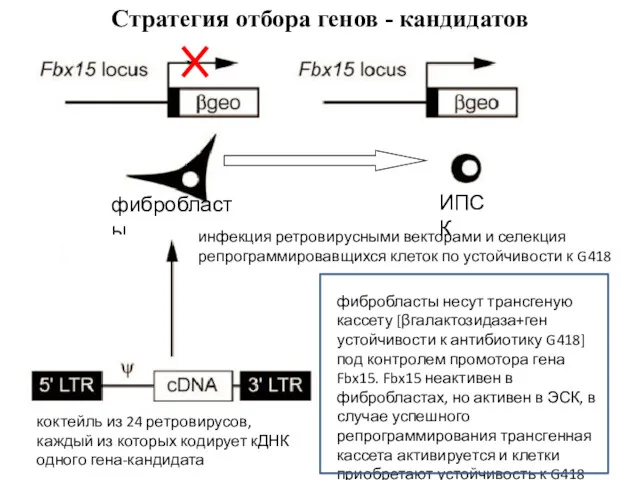
- 15. фибробласты ИПСК Стратегия отбора генов - кандидатов фибробласты несут трансгеную кассету [βгалактозидаза+ген устойчивости к антибиотику G418]
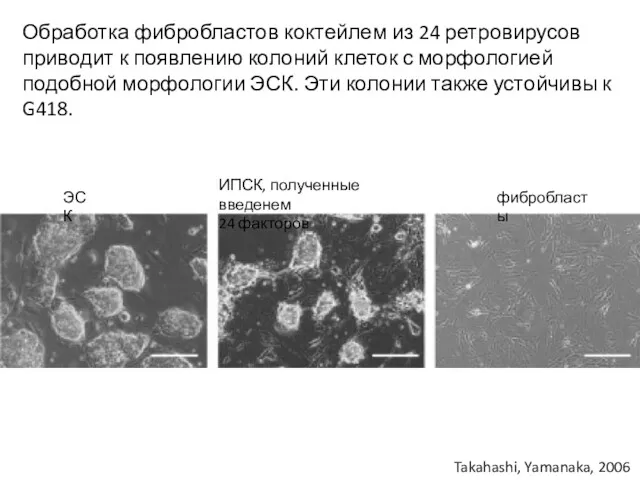
- 16. ЭСК ИПСК, полученные введенем 24 факторов фибробласты Обработка фибробластов коктейлем из 24 ретровирусов приводит к появлению
- 17. Takahashi, Yamanaka, 2006 с модификациями
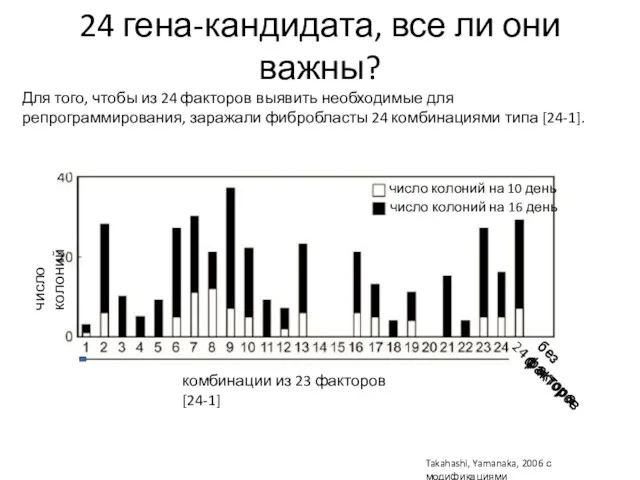
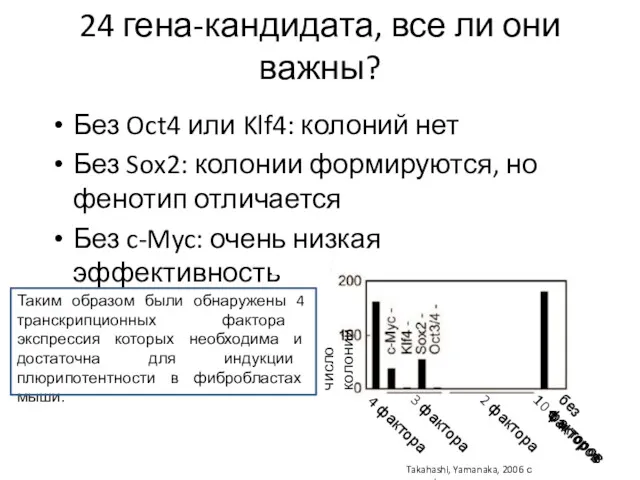
- 18. Без Oct4 или Klf4: колоний нет Без Sox2: колонии формируются, но фенотип отличается Без c-Myc: очень
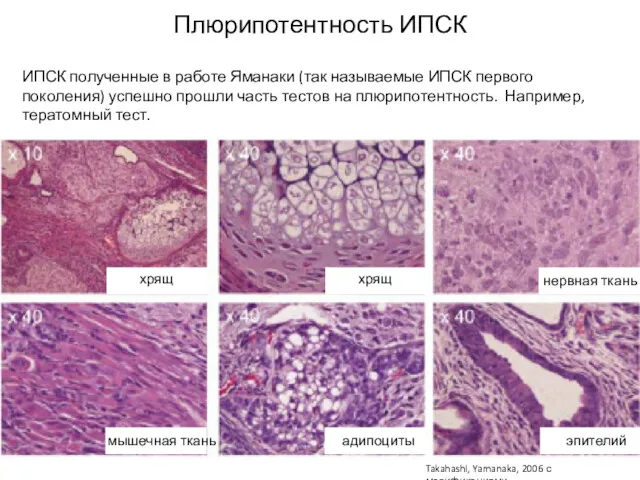
- 19. Плюрипотентность ИПСК ИПСК полученные в работе Яманаки (так называемые ИПСК первого поколения) успешно прошли часть тестов
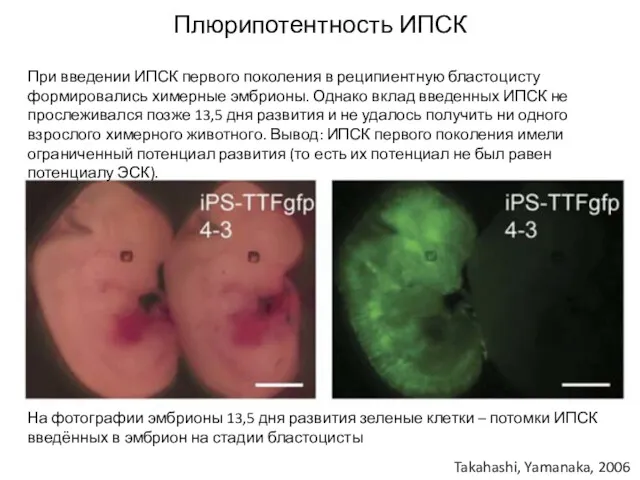
- 20. Плюрипотентность ИПСК Takahashi, Yamanaka, 2006 При введении ИПСК первого поколения в реципиентную бластоцисту формировались химерные эмбрионы.
- 21. Спустя 11 месяцев вышла статья в Nature подтвердившая результаты работы Яманаки. Второе поколение ИПСК.
- 22. второе поколение ИПС клеток основное отличие – Nanog- или Oct4-активируемый ген устойчивости для селекции репрограммированных клеток
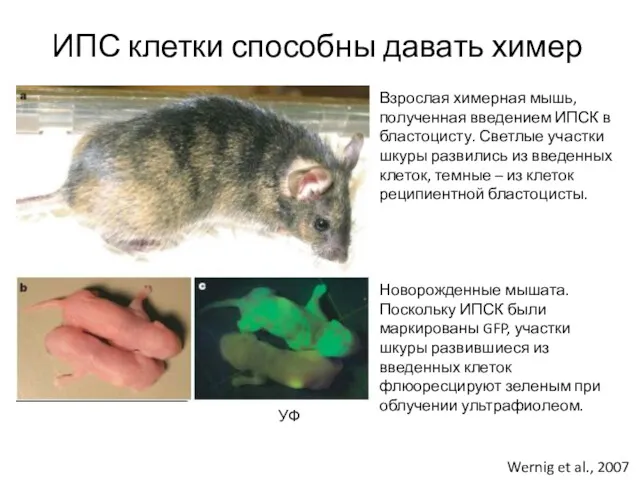
- 23. ИПС клетки способны давать химер Wernig et al., 2007 Взрослая химерная мышь, полученная введением ИПСК в
- 24. Мышата полученные из ИПС клеток Okita et al., 2007 У химерных животных ИПСК способны дифференцироваться в
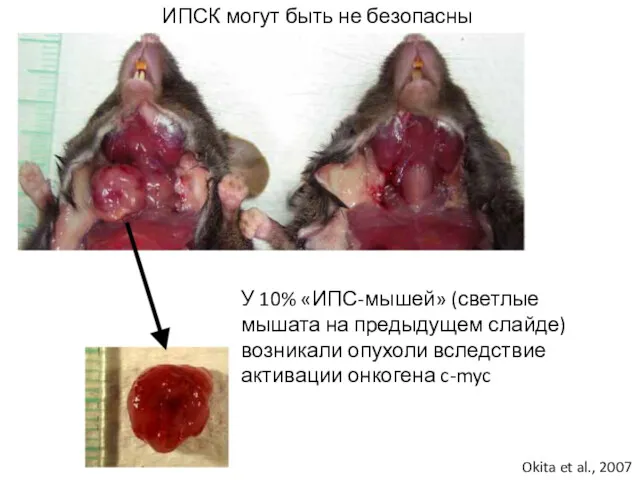
- 25. У 10% «ИПС-мышей» (светлые мышата на предыдущем слайде) возникали опухоли вследствие активации онкогена c-myc Okita et
- 26. Around the same time (Dec 2007)
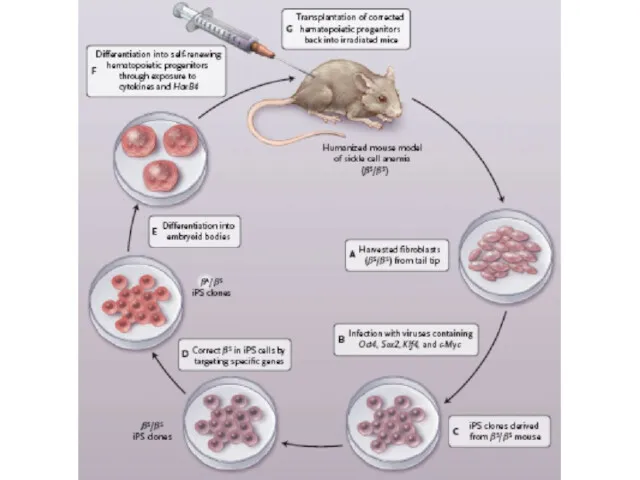
- 28. Та же технология, что и для ИПС клеток мыши Удалось получить ИПС клетки из фибробластов взрослого
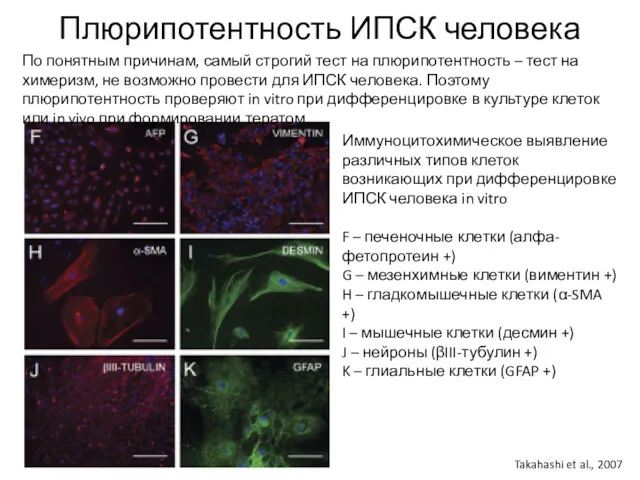
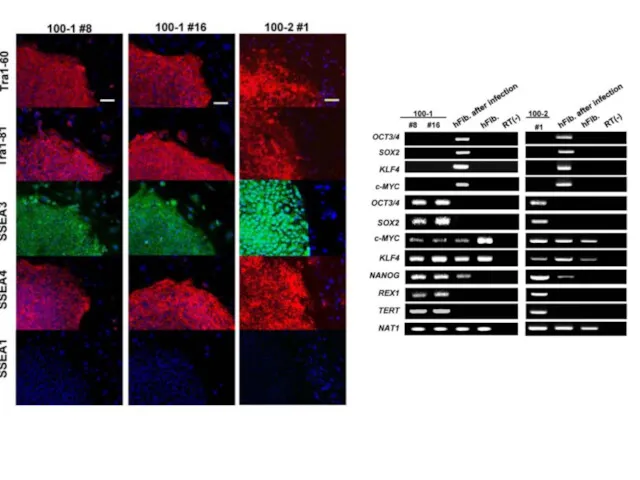
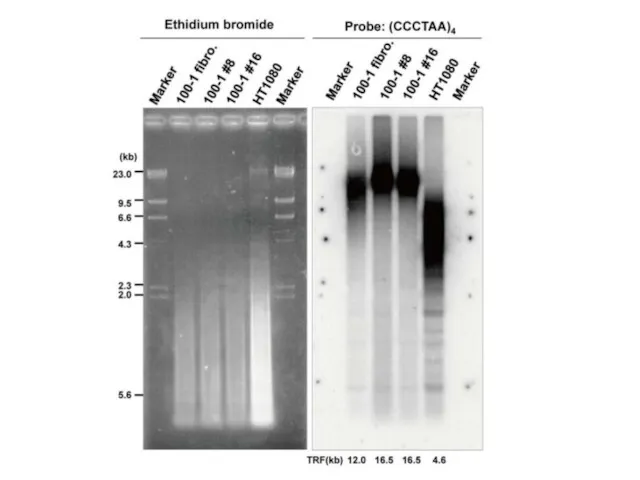
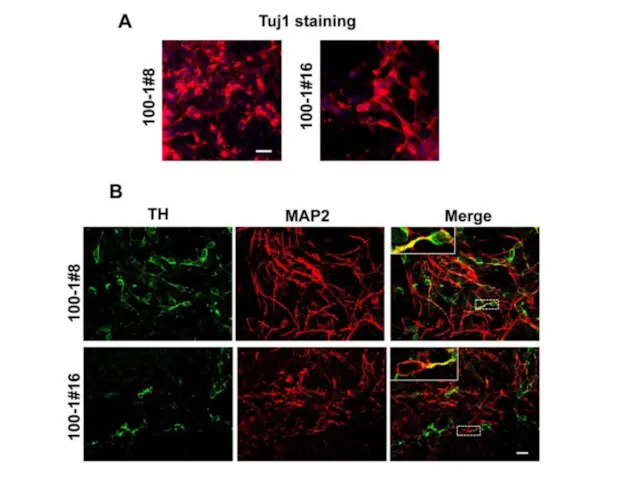
- 29. Плюрипотентность ИПСК человека По понятным причинам, самый строгий тест на плюрипотентность – тест на химеризм, не
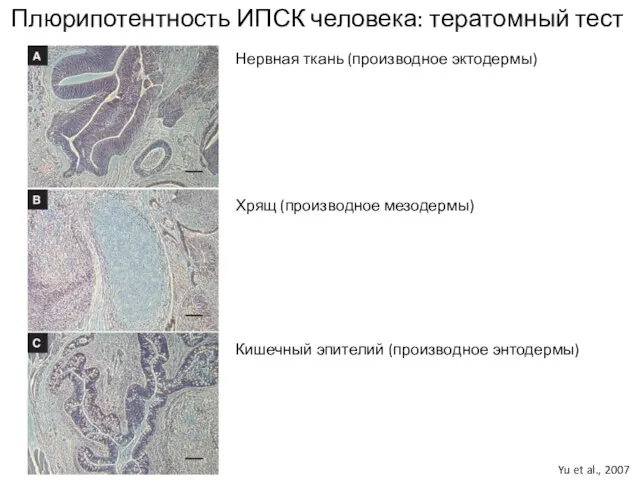
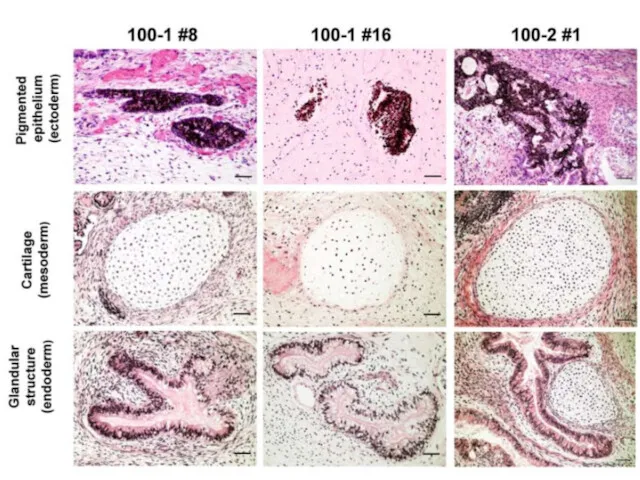
- 30. Yu et al., 2007 Плюрипотентность ИПСК человека: тератомный тест Нервная ткань (производное эктодермы) Хрящ (производное мезодермы)
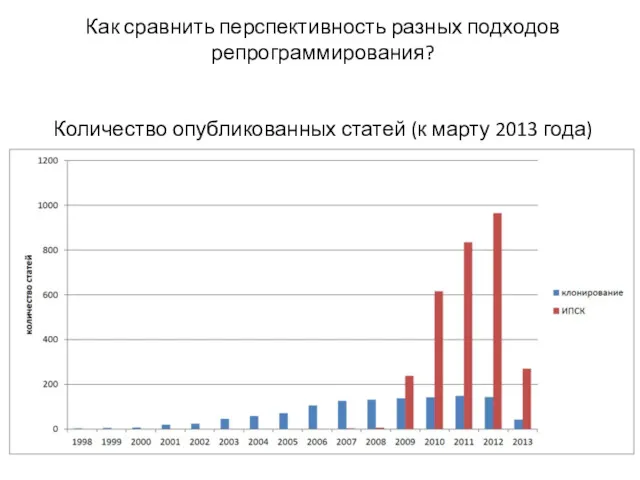
- 36. Как сравнить перспективность разных подходов репрограммирования? Количество опубликованных статей (к марту 2013 года)
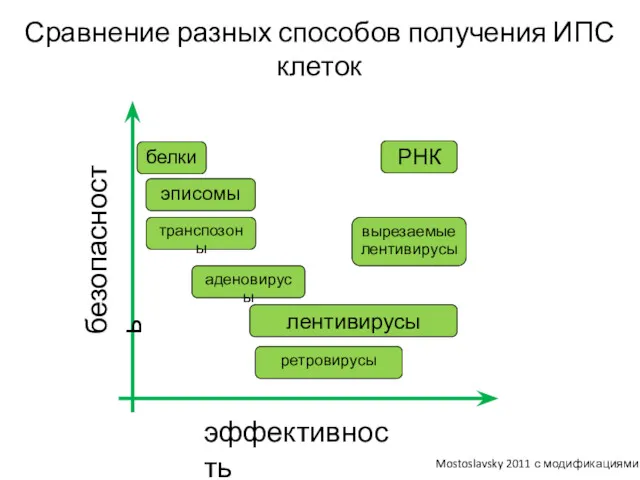
- 37. Таким образом, получение ИПСК очень перспективный подход репрограммирования генома, однако, имеет ряд серьезных недостатков применение ретровирусов
- 38. Сравнение разных способов получения ИПС клеток Mostoslavsky 2011 с модификациями
- 39. Получение ИПСК – процесс медленный и не эффективный Репрограммирование в системе гибридных клеток занимает примерно 1-2
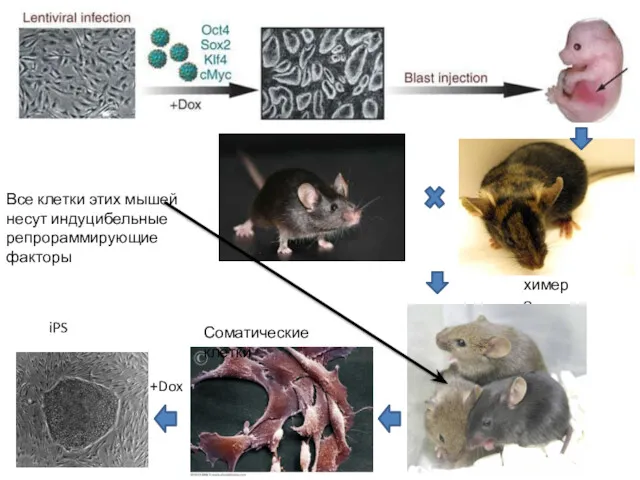
- 40. химера Все клетки этих мышей несут индуцибельные репрораммирующие факторы iPS Соматические клетки +Dox
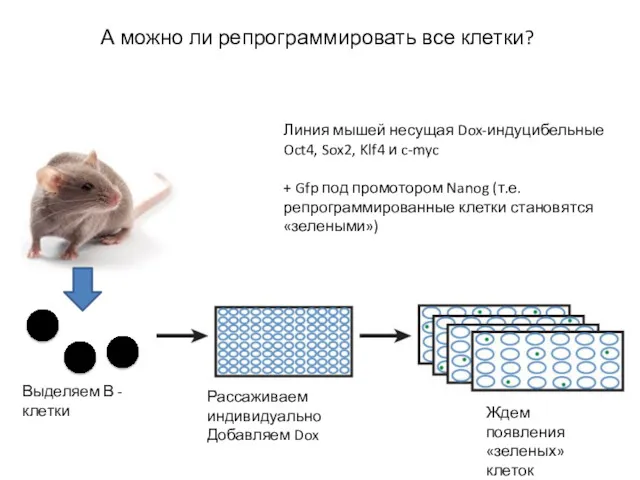
- 41. А можно ли репрограммировать все клетки? Линия мышей несущая Dox-индуцибельные Oct4, Sox2, Klf4 и c-myc +
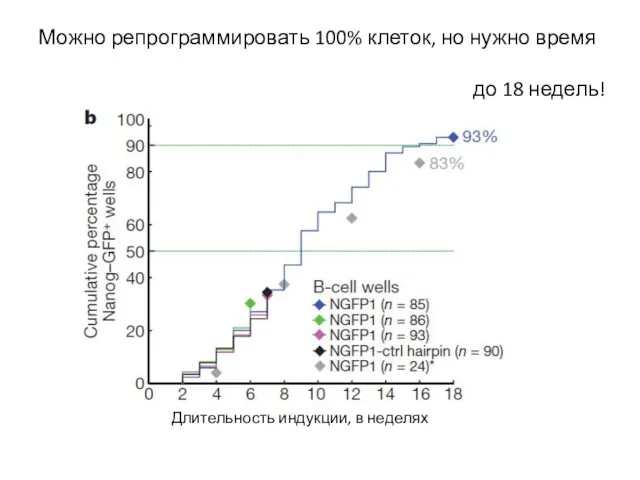
- 42. Можно репрограммировать 100% клеток, но нужно время до 18 недель! Длительность индукции, в неделях
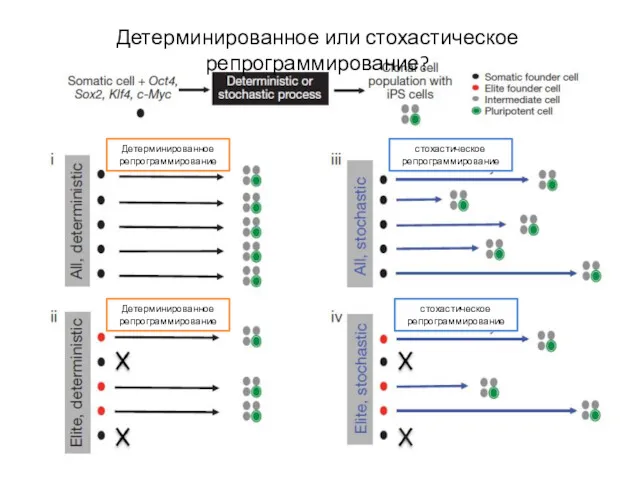
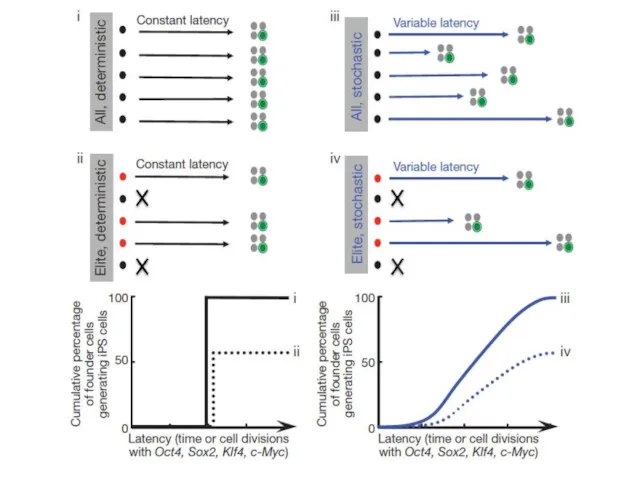
- 43. Детерминированное или стохастическое репрограммирование? Детерминированное репрограммирование Детерминированное репрограммирование стохастическое репрограммирование стохастическое репрограммирование
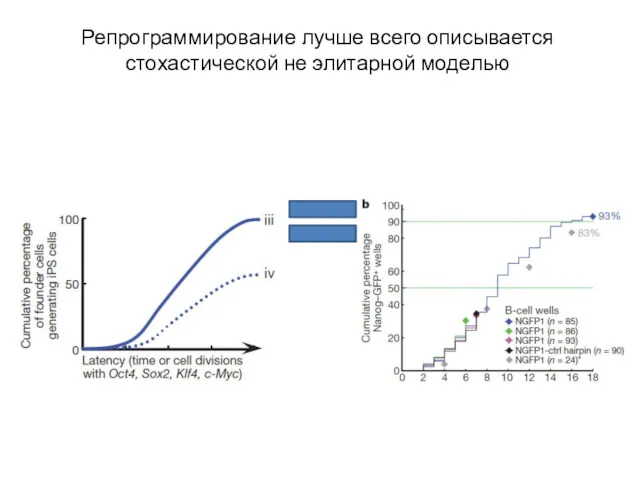
- 45. Репрограммирование лучше всего описывается стохастической не элитарной моделью
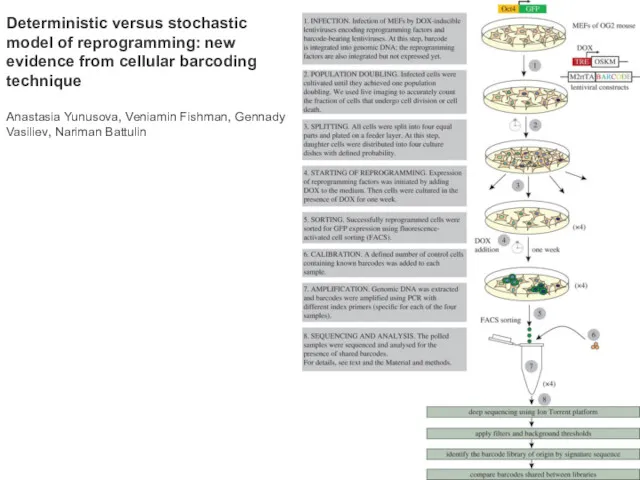
- 46. Deterministic versus stochastic model of reprogramming: new evidence from cellular barcoding technique Anastasia Yunusova, Veniamin Fishman,
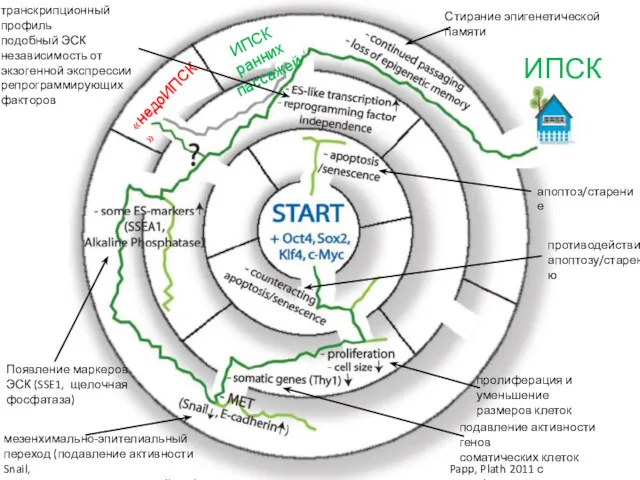
- 47. Papp, Plath 2011 с модификациями ИПСК апоптоз/старение противодействие апоптозу/старению пролиферация и уменьшение размеров клеток подавление активности
- 48. Первые этапы репрограммирования В первые 1-2 дня: Укорачивается клеточный цикл (фибробласты делятся раз в 22 часа,
- 49. Первые этапы репрограммирования Через 4-8 дней: Некоторые из быстро делящихся маленьких клеток формируют плотные колонии. Этот
- 50. Поздние этапы репрограммирования В небольшой доле клеток добравшихся до этого этапа: появляются поверхностные антигены, свойственные ЭС
- 51. Поздние этапы репрограммирования В небольшой доле клеток добравшихся до этого этапа: закрепляются свойства, характерные для ЭС
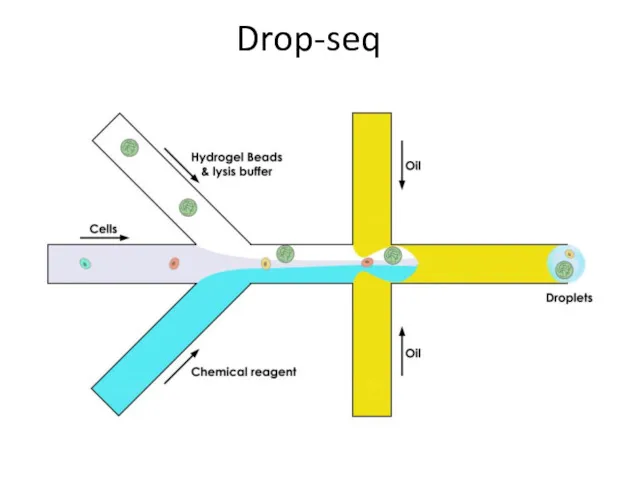
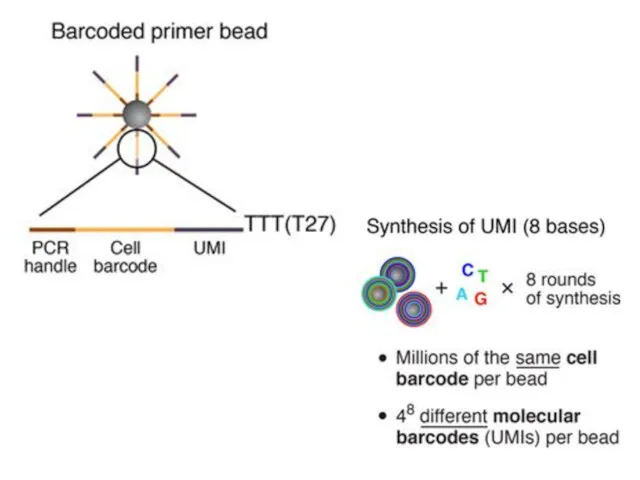
- 52. Drop-seq
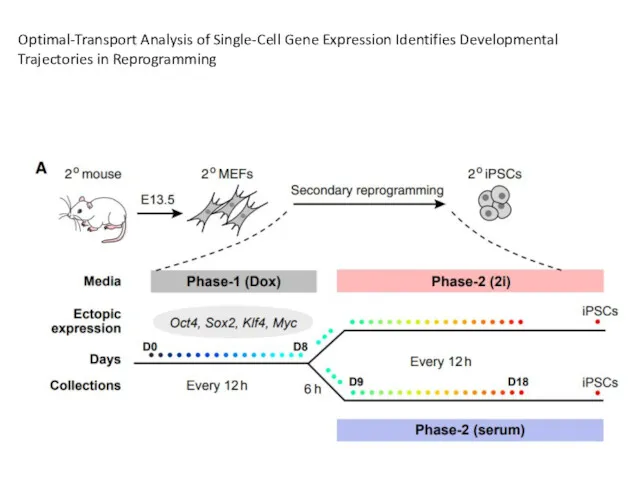
- 56. Optimal-Transport Analysis of Single-Cell Gene Expression Identifies Developmental Trajectories in Reprogramming
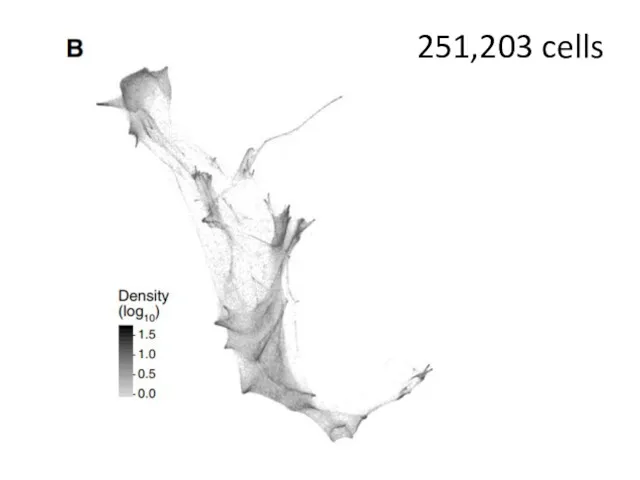
- 57. 251,203 cells
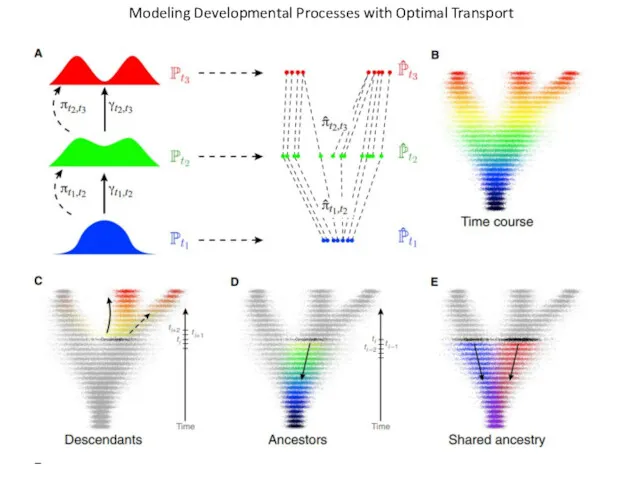
- 58. Modeling Developmental Processes with Optimal Transport
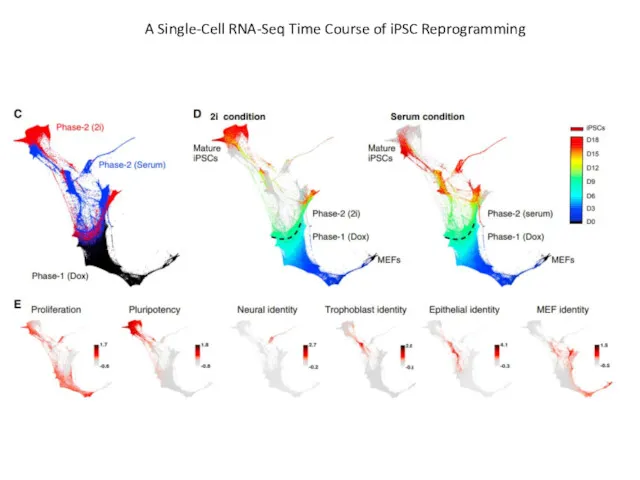
- 59. A Single-Cell RNA-Seq Time Course of iPSC Reprogramming
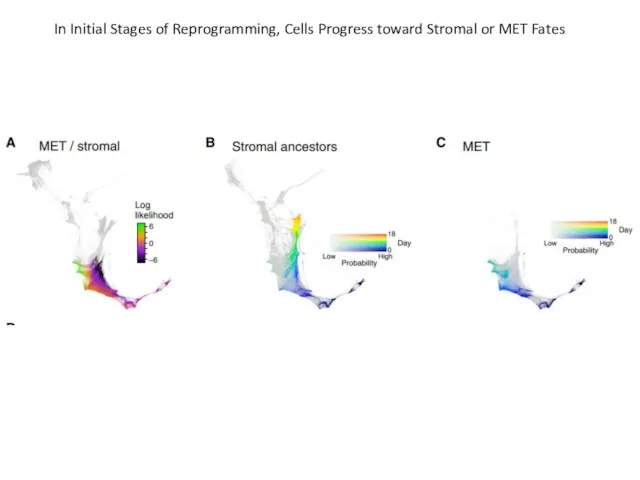
- 60. In Initial Stages of Reprogramming, Cells Progress toward Stromal or MET Fates
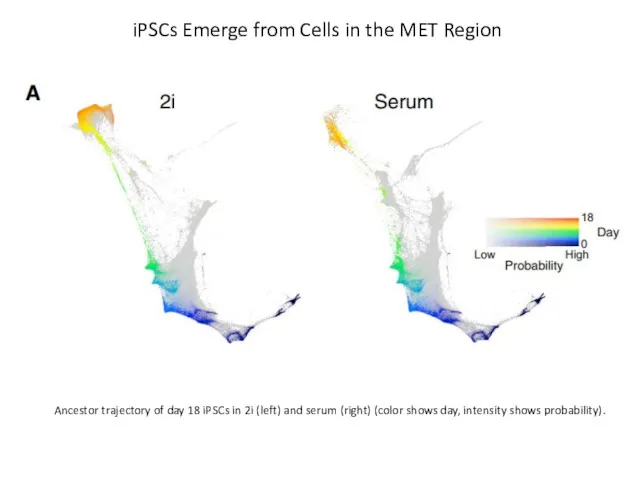
- 61. iPSCs Emerge from Cells in the MET Region Ancestor trajectory of day 18 iPSCs in 2i
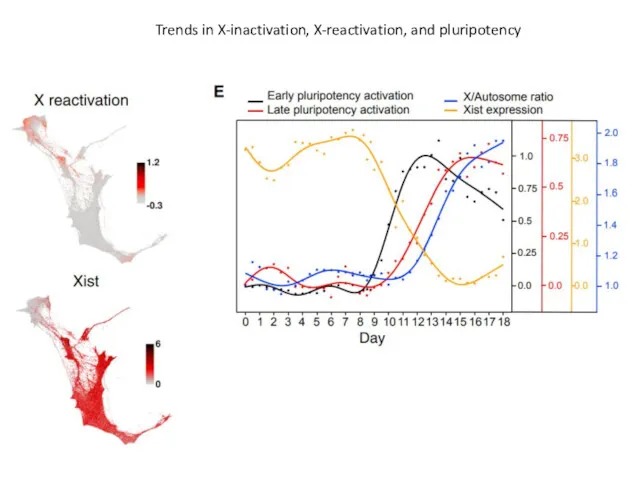
- 62. Trends in X-inactivation, X-reactivation, and pluripotency
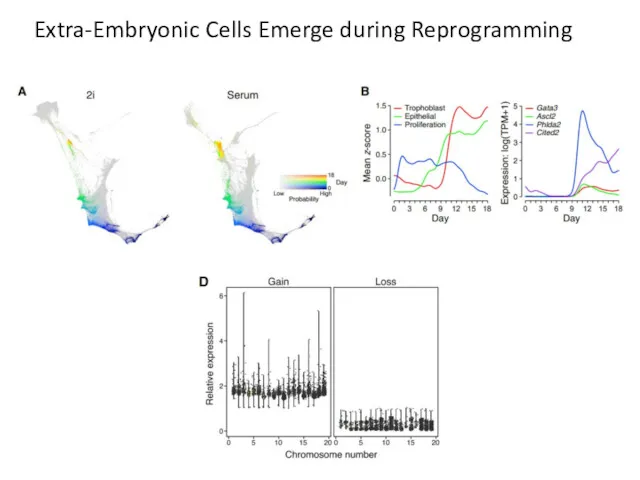
- 63. Extra-Embryonic Cells Emerge during Reprogramming
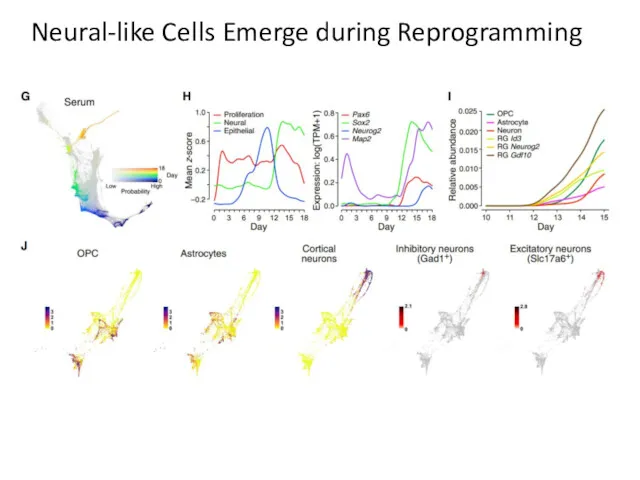
- 64. Neural-like Cells Emerge during Reprogramming
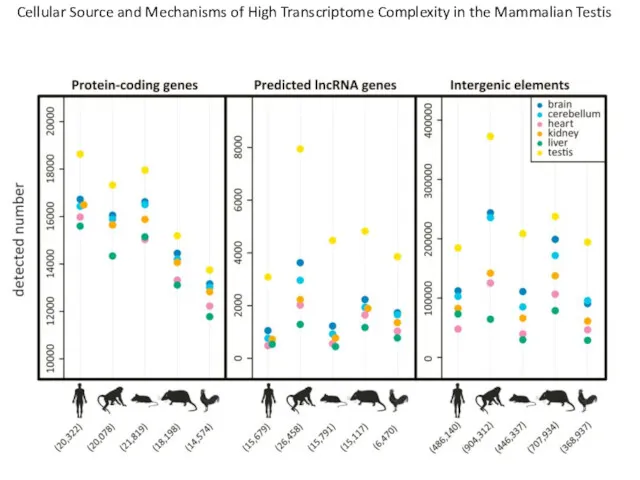
- 65. Cellular Source and Mechanisms of High Transcriptome Complexity in the Mammalian Testis
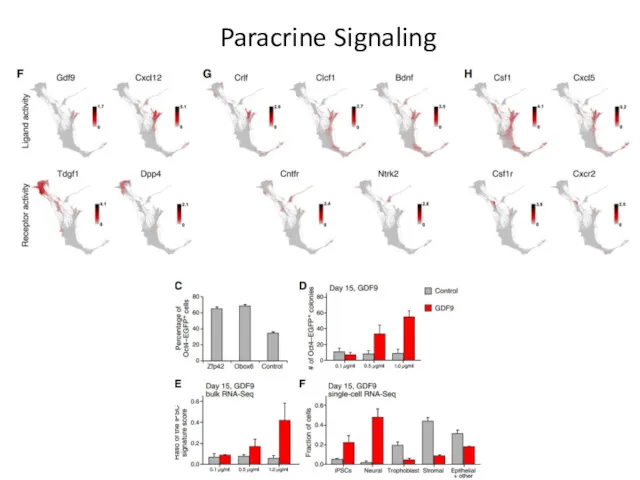
- 66. Paracrine Signaling
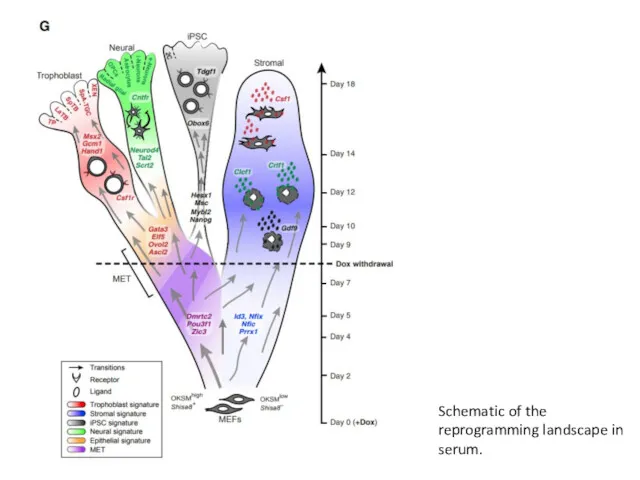
- 67. Schematic of the reprogramming landscape in serum.
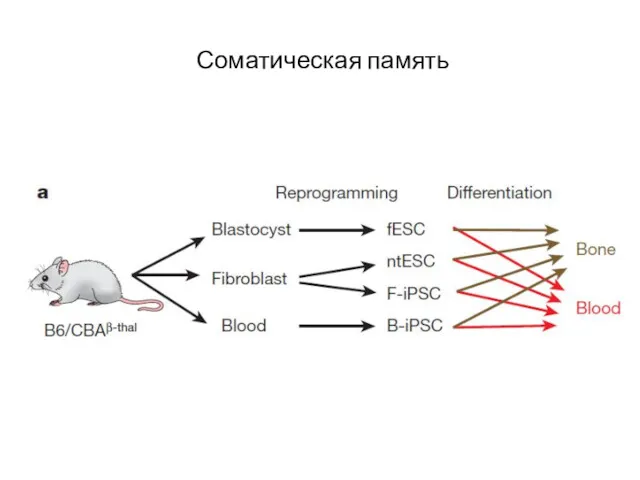
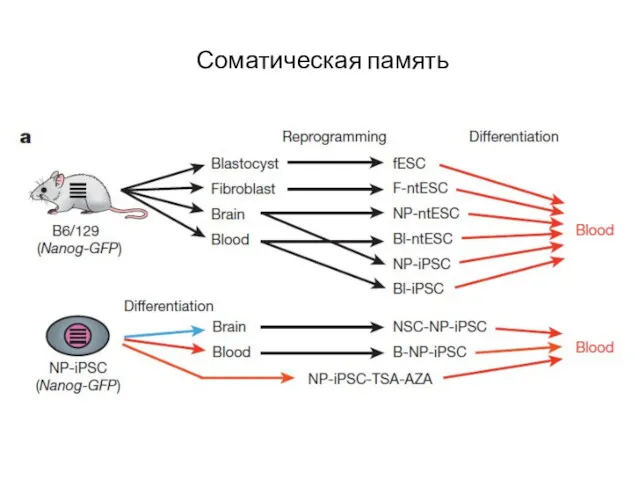
- 68. Соматическая память
- 69. Соматическая память
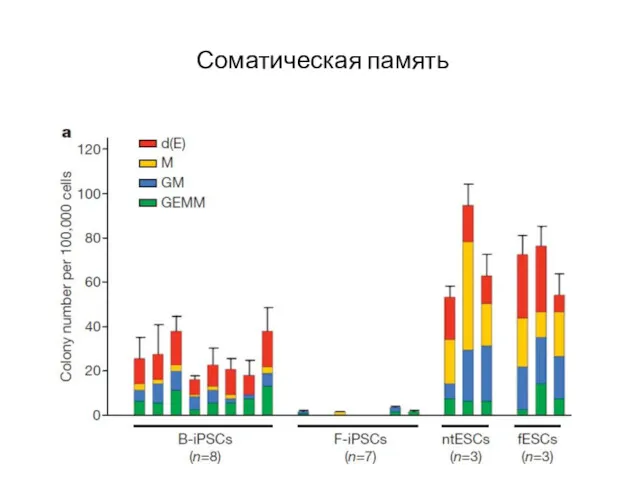
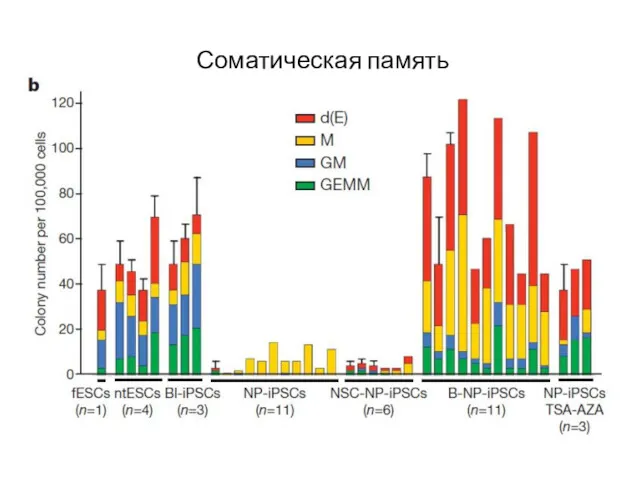
- 71. Соматическая память
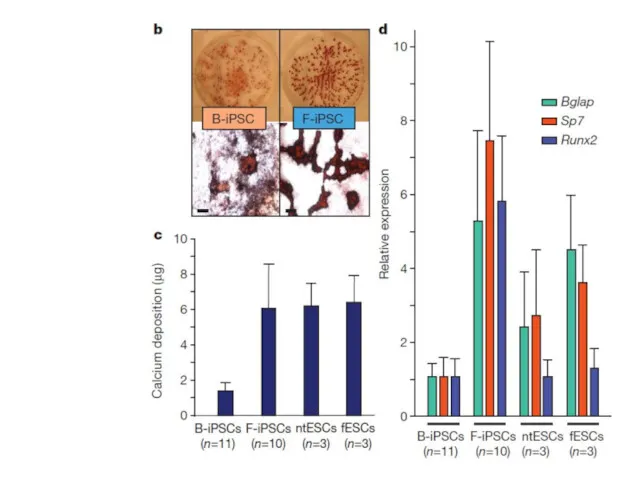
- 72. Соматическая память
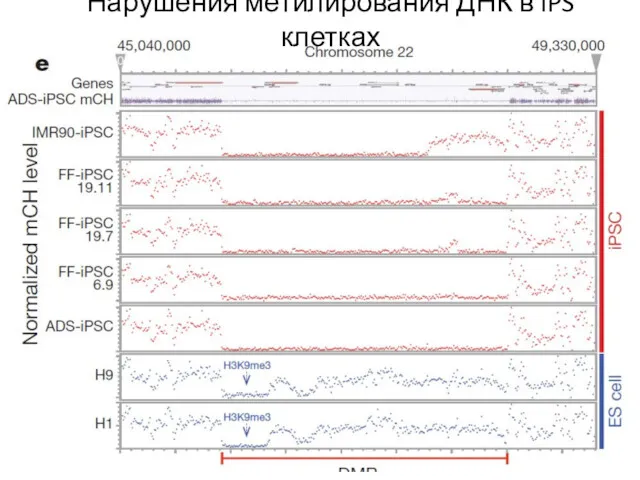
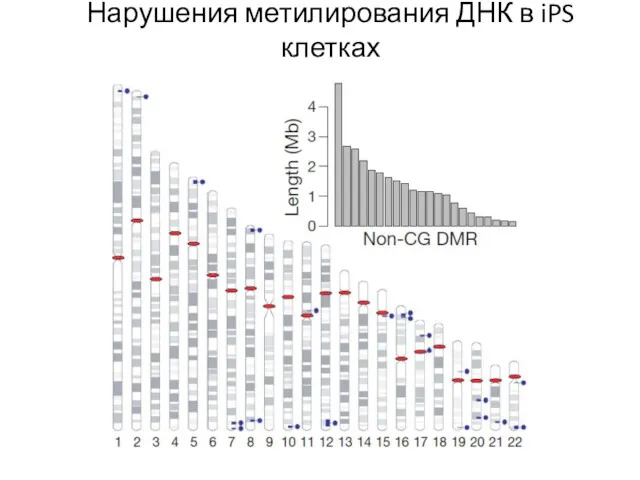
- 73. Нарушения метилирования ДНК в iPS клетках
- 74. Нарушения метилирования ДНК в iPS клетках
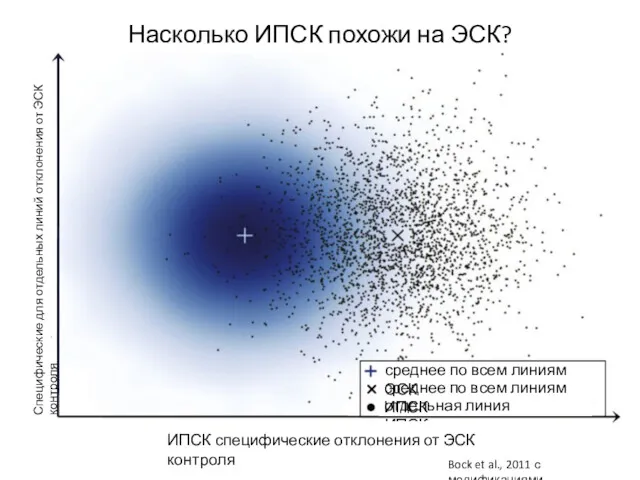
- 75. Насколько ИПСК похожи на ЭСК?
- 77. Скачать презентацию





















 Ископаемые люди современного типа
Ископаемые люди современного типа Лошади. Породы лошадей
Лошади. Породы лошадей Акселерация как социальная и гигиеническая проблема
Акселерация как социальная и гигиеническая проблема Болезни хвои и листьев. (Лекция 10)
Болезни хвои и листьев. (Лекция 10) Воспроизведение на организменном уровне. Индивидуальное развитие организма - онтогенез
Воспроизведение на организменном уровне. Индивидуальное развитие организма - онтогенез Будова скелета людини
Будова скелета людини Чем живое отличается от неживго
Чем живое отличается от неживго Фенотипическая структура популяции
Фенотипическая структура популяции Особенности движения крови в разных отделах сосудистого русла
Особенности движения крови в разных отделах сосудистого русла Органы дыхания. Эволюция
Органы дыхания. Эволюция Пчёлы
Пчёлы Многообразие млекопитающих
Многообразие млекопитающих Системогенез и теория функциональных систем
Системогенез и теория функциональных систем ДНҚ-ның метилденуі
ДНҚ-ның метилденуі Внешнее строение и разнообразие листьев
Внешнее строение и разнообразие листьев Презентация без названия
Презентация без названия WWF = World Wide Fund for Nature
WWF = World Wide Fund for Nature Биохимическое исследование печени
Биохимическое исследование печени Презентация для открытого урока на тему пищеварительная система
Презентация для открытого урока на тему пищеварительная система Секвенирование НК. Секвенирование по Сэнгеру. Занятие 7
Секвенирование НК. Секвенирование по Сэнгеру. Занятие 7 Открытый урок по биологии Первая помощь при кровотечениях
Открытый урок по биологии Первая помощь при кровотечениях Физиологические основы восприятия
Физиологические основы восприятия Психофизиология эмоций. Возникновение и протекание эмоций. Виды эмоций
Психофизиология эмоций. Возникновение и протекание эмоций. Виды эмоций Презентация к уроку биологии Борьба за существование
Презентация к уроку биологии Борьба за существование Пресмыкающиеся, или рептилии
Пресмыкающиеся, или рептилии Общая характеристика конструктивного и энергетического метаболизма прокариот. Культивирование микроорганизмов
Общая характеристика конструктивного и энергетического метаболизма прокариот. Культивирование микроорганизмов Обрезка декоративных кустарников
Обрезка декоративных кустарников Способы передвижения животных. Движение растений
Способы передвижения животных. Движение растений