Содержание
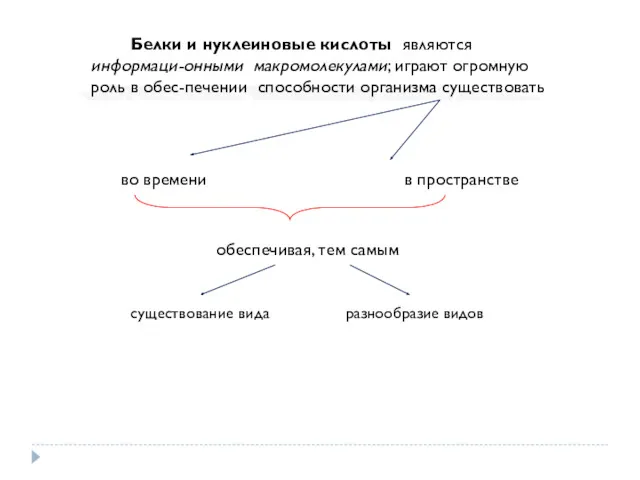
- 2. Белки и нуклеиновые кислоты являются информаци-онными макромолекулами; играют огромную роль в обес-печении способности организма существовать во
- 3. Белки и нуклеиновые кислоты Белки и нуклеиновые кислоты – это органические ве-щества - биополимеры, высокомолекулярные соединения
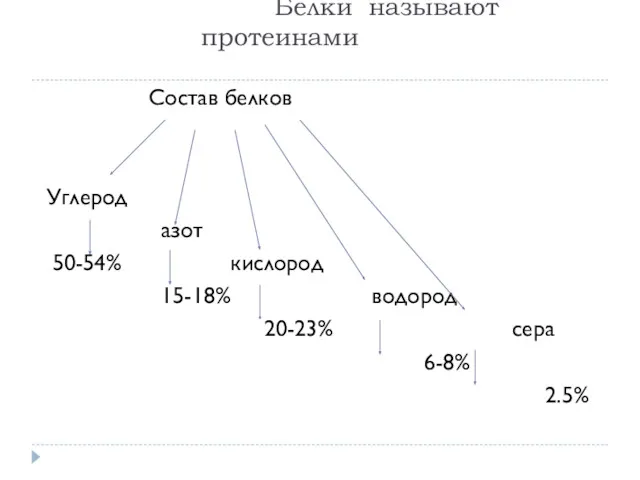
- 4. Белки называют протеинами Состав белков Углерод азот 50-54% кислород 15-18% водород 20-23% сера 6-8% 2.5%
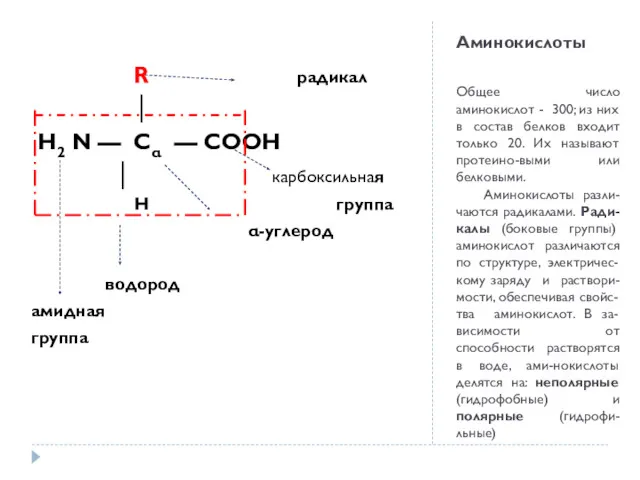
- 5. Аминокислоты Общее число аминокислот - 300; из них в состав белков входит только 20. Их называют
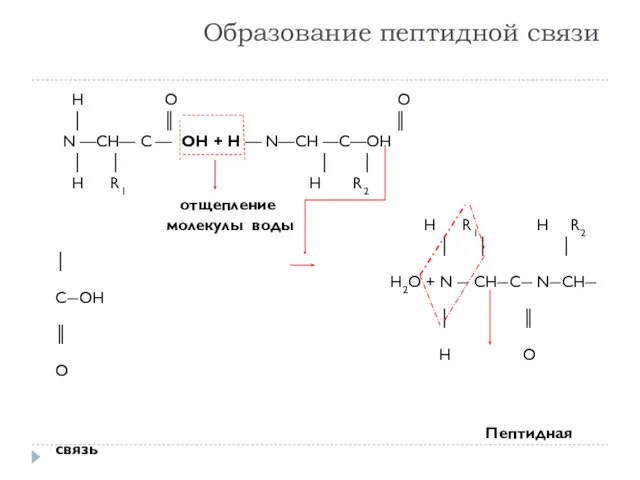
- 6. Образование пептидной связи Н О O │ ║ ║ N —CH— C — OH + H
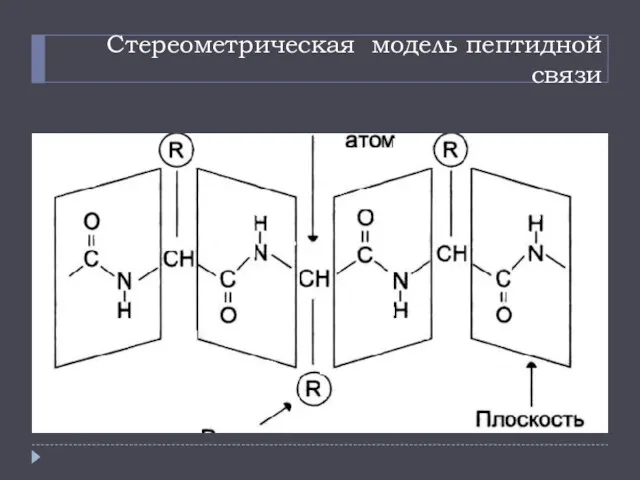
- 7. Пептидная связь характеризуется следующими свойствами: 1. 4 атома пептидной связи лежат в одной плоскости (рис.7а); 2.
- 8. Пептидная связь характеризуется следующими свойствами: 1. 4 атома пептидной связи лежат в одной плоскости (рис.7а); 2.
- 9. Стереометрическая модель пептидной связи
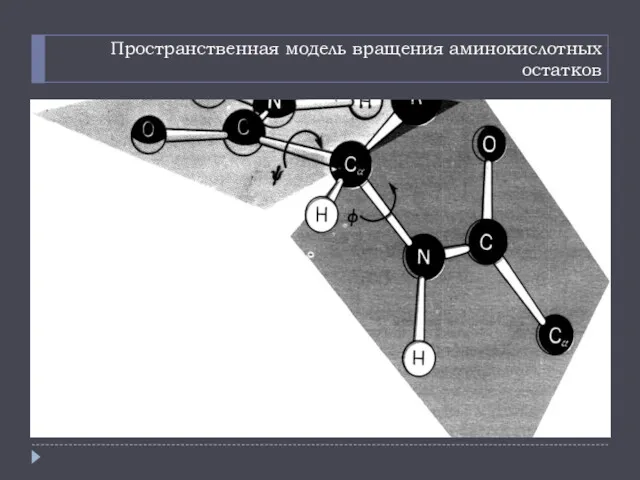
- 10. Пространственная модель вращения аминокислотных остатков
- 11. Пептиды Соединения, в которых аминокислоты соединены пептидными связями, называется пептидами: олигопептиды (содержат до 10 аминокислот), полипептиды
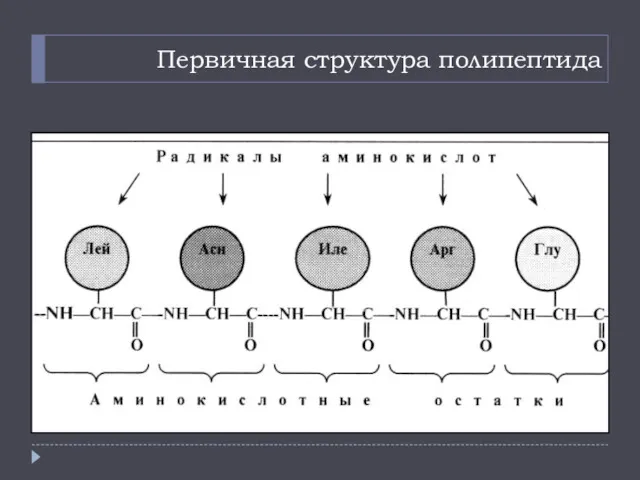
- 12. Первичная структура полипептида
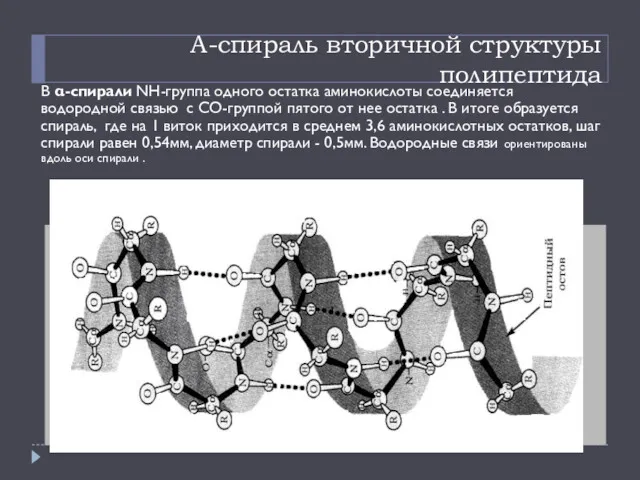
- 13. Α-спираль вторичной структуры полипептида В α-спирали NH-группа одного остатка аминокислоты соединяется водородной связью с СО-группой пятого
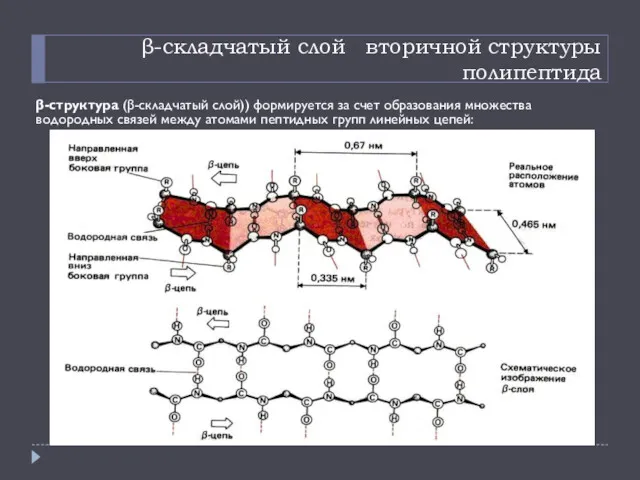
- 14. β-складчатый слой вторичной структуры полипептида β-структура (β-складчатый слой)) формируется за счет образования множества водородных связей между
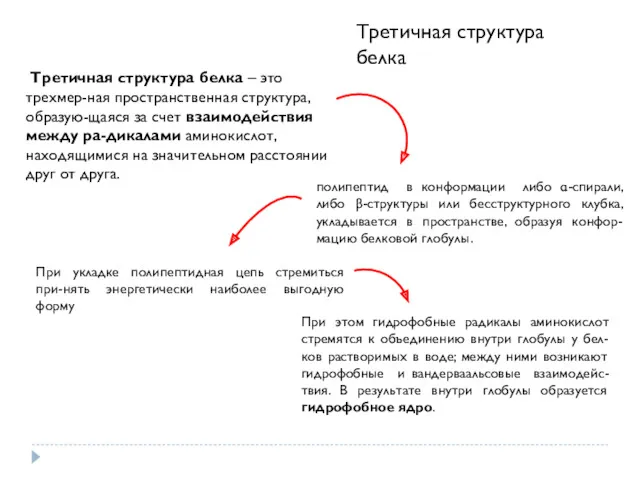
- 15. Третичная структура белка Третичная структура белка – это трехмерная прост -ранственная структура, образующаяся за счет взаимо-
- 16. Третичная структура белка – это трехмер-ная пространственная структура, образую-щаяся за счет взаимодействия между ра-дикалами аминокислот, находящимися
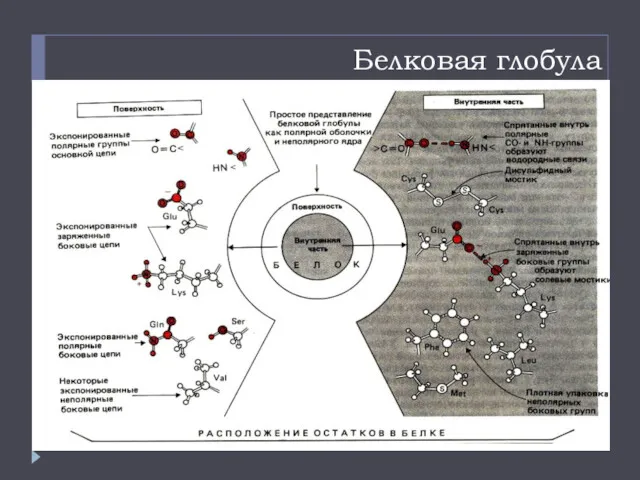
- 18. Белковая глобула
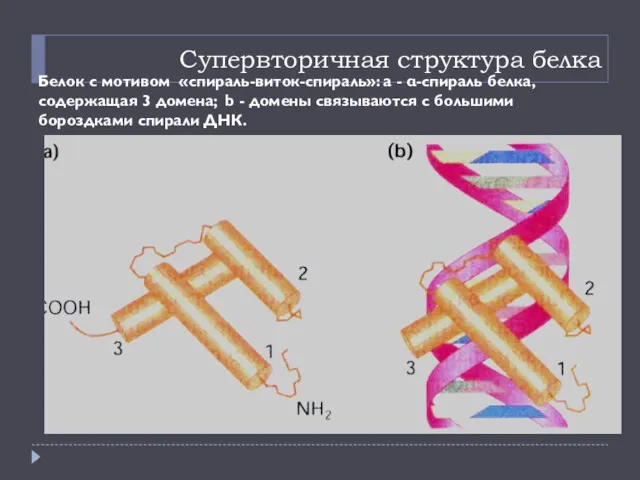
- 19. Супервторичная структура белка Белок с мотивом «спираль-виток-спираль»: а - α-спираль белка, содержащая 3 домена; b -
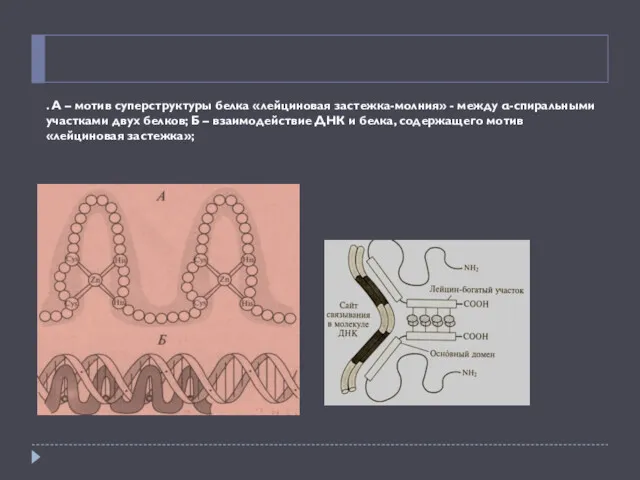
- 20. . А – мотив суперструктуры белка «лейциновая застежка-молния» - между α-спиральными участками двух белков; Б –
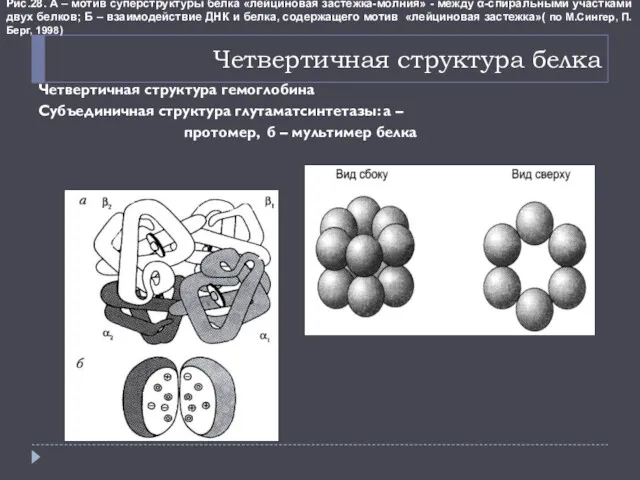
- 21. Четвертичная структура белка Четвертичная структура гемоглобина Субъединичная структура глутаматсинтетазы: а – протомер, б – мультимер белка
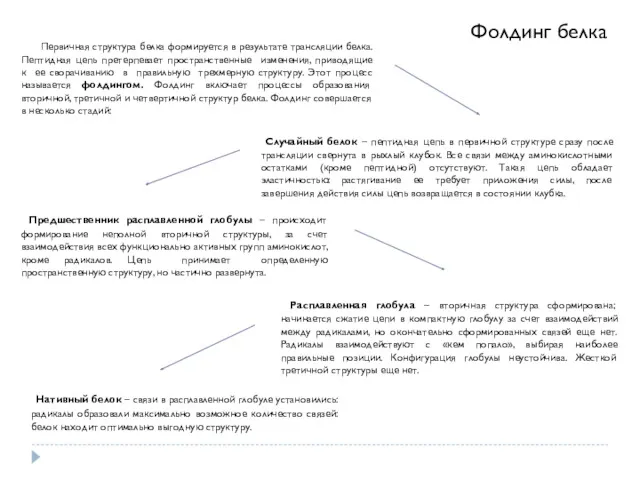
- 22. Фолдинг белка Первичная структура белка формируется в результате трансляции белка. Пептидная цепь претерпевает пространственные изменения, приводящие
- 23. Первичная структура белка формируется в результате трансляции белка. Пептидная цепь претерпевает пространственные изменения, приводящие к ее
- 24. Классификация белков Белки можно классифицировать: по форме (глобулярные и фибриллярные), по молекулярной массе (низко-, высокомолекулярные и
- 25. Некоторые сложные белки
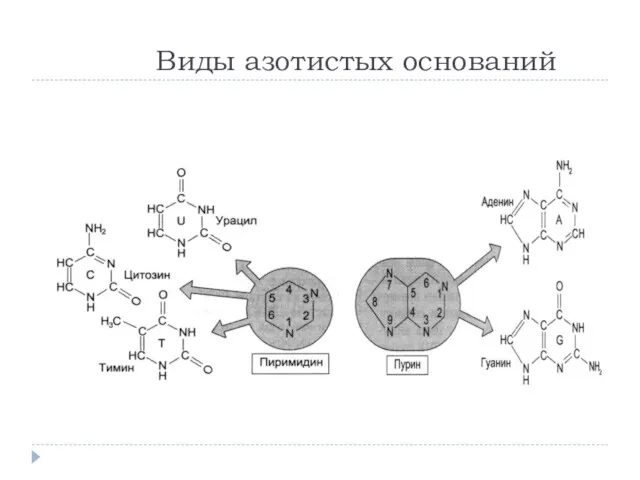
- 26. Виды азотистых оснований
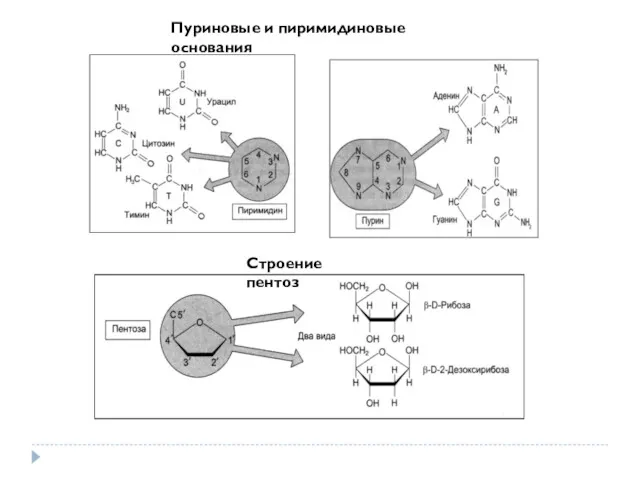
- 27. Пуриновые и пиримидиновые основания Строение пентоз
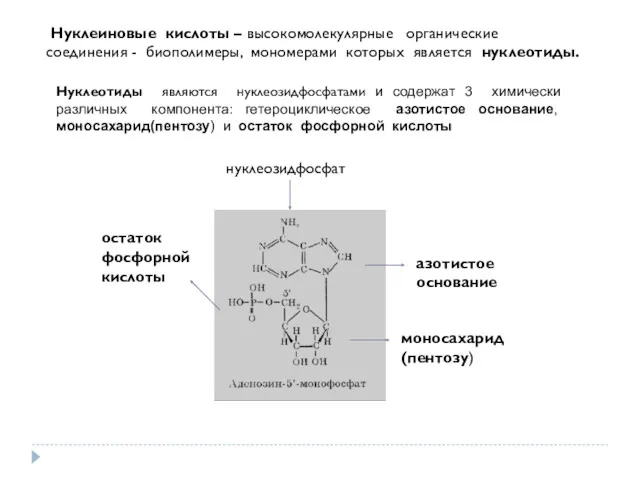
- 28. Нуклеиновые кислоты – высокомолекулярные органические соединения - биополимеры, мономерами которых является нуклеотиды. Нуклеотиды являются нуклеозидфосфатами и
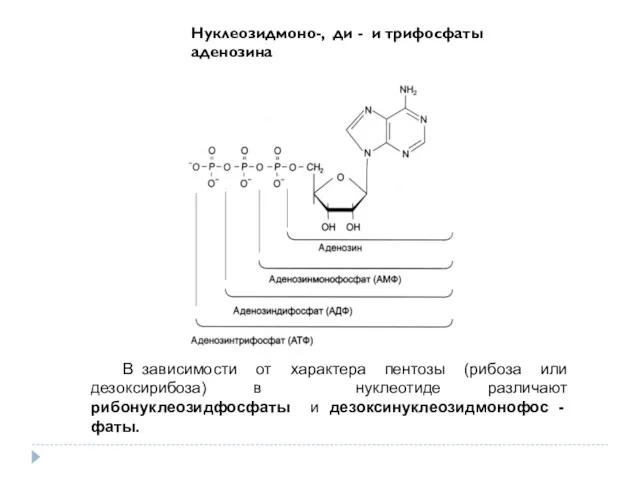
- 29. В зависимости от характера пентозы (рибоза или дезоксирибоза) в нуклеотиде различают рибонуклеозидфосфаты и дезоксинуклеозидмонофос - фаты.
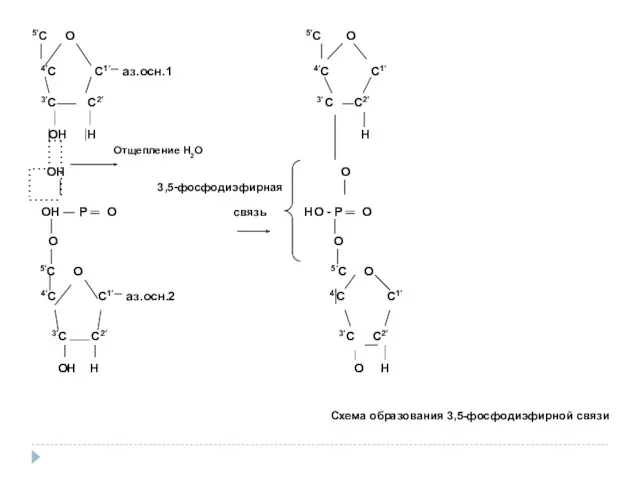
- 30. 5′С О 5′С О │ 4′С С1′― аз.осн.1 4′С С1′ 3′С С2′ 3′С С2′ │ ОН
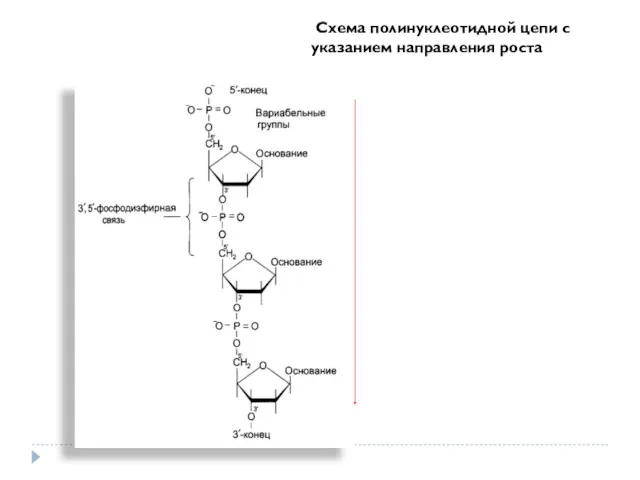
- 31. Схема полинуклеотидной цепи с указанием направления роста
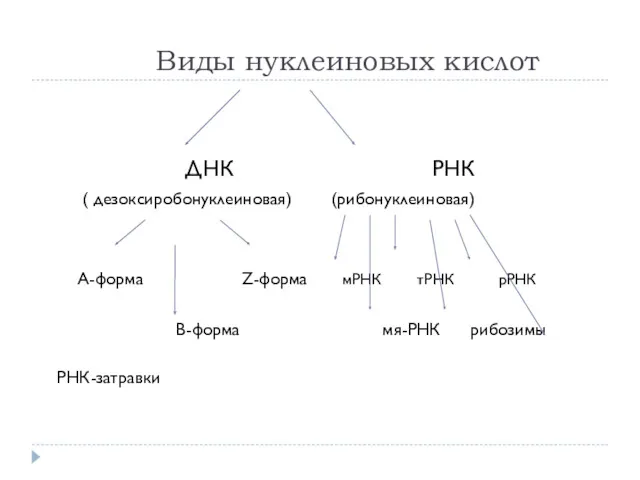
- 32. Виды нуклеиновых кислот ДНК РНК ( дезоксиробонуклеиновая) (рибонуклеиновая) А-форма Z-форма мРНК тРНК рРНК В-форма мя-РНК рибозимы
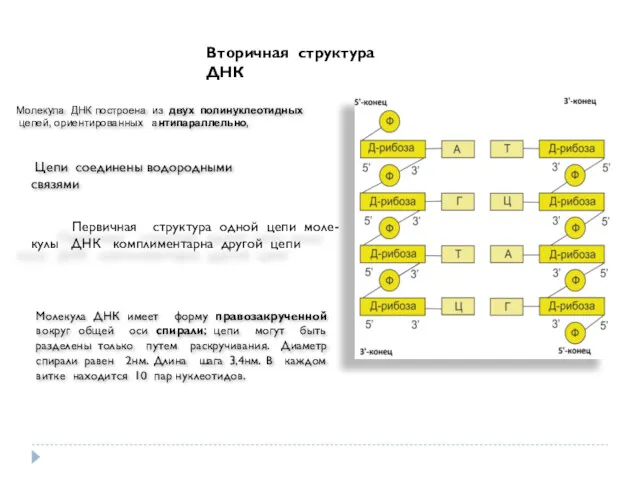
- 33. Вторичная структура ДНК Молекула ДНК построена из двух полинуклеотидных цепей, ориентированных антипараллельно, Цепи соединены водородными связями
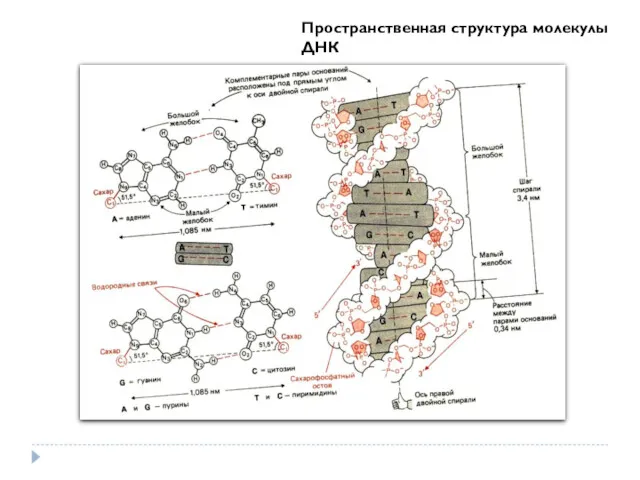
- 34. Пространственная структура молекулы ДНК
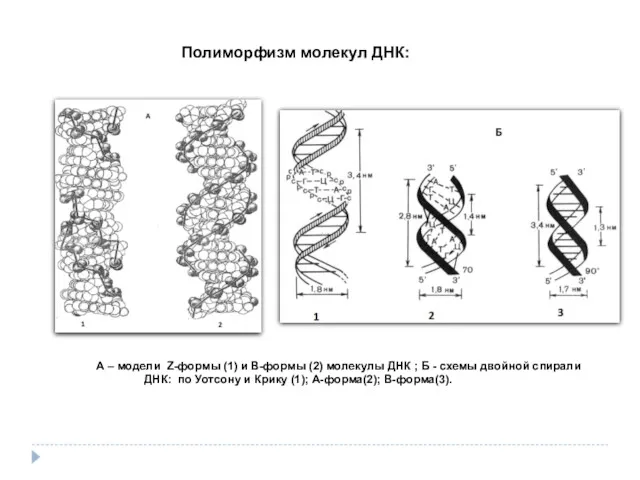
- 35. А – модели Z-формы (1) и В-формы (2) молекулы ДНК ; Б - схемы двойной спирали
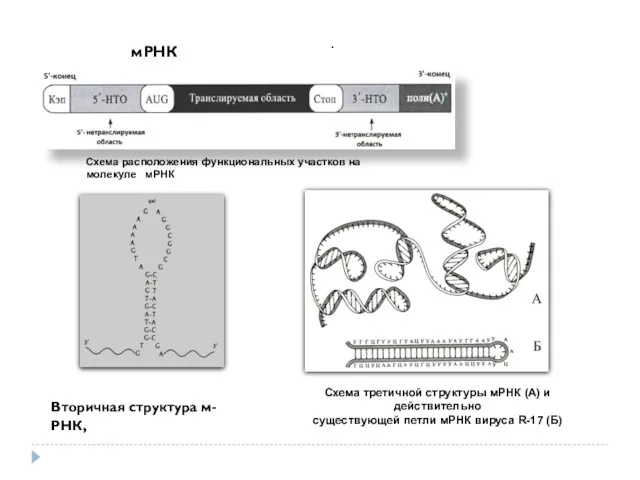
- 36. . Схема расположения функциональных участков на молекуле мРНК Вторичная структура м-РНК, Схема третичной структуры мРНК (А)
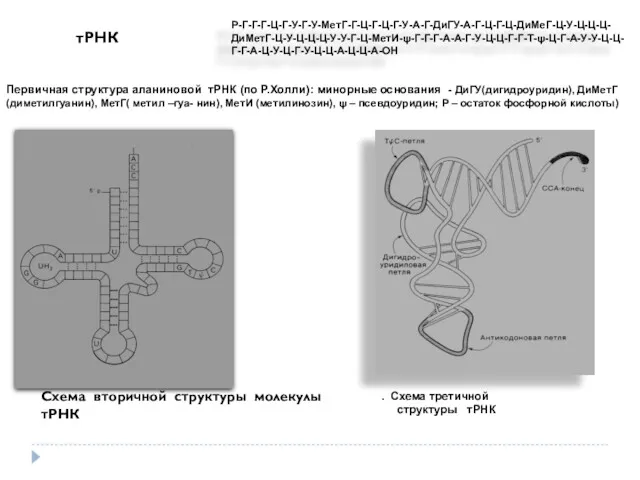
- 37. Р-Г-Г-Г-Ц-Г-У-Г-У-МетГ-Г-Ц-Г-Ц-Г-У-А-Г-ДиГУ-А-Г-Ц-Г-Ц-ДиМеГ-Ц-У-Ц-Ц-Ц- ДиМетГ-Ц-У-Ц-Ц-Ц-У-У-Г-Ц-МетИ-ψ-Г-Г-Г-А-А-Г-У-Ц-Ц-Г-Г-Т-ψ-Ц-Г-А-У-У-Ц-Ц- Г-Г-А-Ц-У-Ц-Г-У-Ц-Ц-А-Ц-Ц-А-ОН Первичная структура аланиновой тРНК (по Р.Холли): минорные основания - ДиГУ(дигидроуридин), ДиМетГ (диметилгуанин), МетГ(
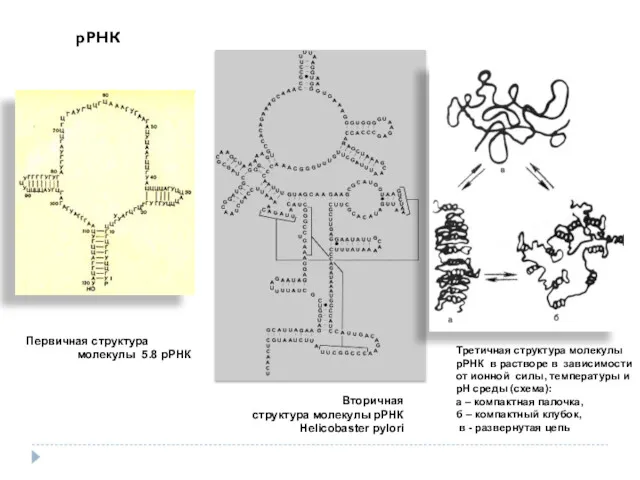
- 38. Первичная структура молекулы 5.8 рРНК Вторичная структура молекулы рРНК Helicobaster pylori Третичная структура молекулы рРНК в
- 40. Скачать презентацию








 Репликация. Основы
Репликация. Основы Насекомые – вредители сада
Насекомые – вредители сада Птахи, які користуються знаряддями праці
Птахи, які користуються знаряддями праці Растения-хищники
Растения-хищники Этические проблемы использования животных
Этические проблемы использования животных Генная инженерия
Генная инженерия Мышцы шеи
Мышцы шеи Будова, властивості, характеристика, класифікація вірусів
Будова, властивості, характеристика, класифікація вірусів Головной мозг - строение
Головной мозг - строение Хвостатые земноводные
Хвостатые земноводные Возврат органики в почву. Грядка Бублика
Возврат органики в почву. Грядка Бублика Растениеводство. Классификация севооборотов и их основные звенья
Растениеводство. Классификация севооборотов и их основные звенья Органы и системы органов
Органы и системы органов Строение и развитие органов дыхательной системы
Строение и развитие органов дыхательной системы Биотехнология в животноводстве
Биотехнология в животноводстве Экологиялық факторлар
Экологиялық факторлар Уход за морской свинкой
Уход за морской свинкой Влияние сроков посева на рост и развитие сеянцев сосны и ели с закрытой корневой системой
Влияние сроков посева на рост и развитие сеянцев сосны и ели с закрытой корневой системой Растения-хищники
Растения-хищники Физика и анатомия музыки
Физика и анатомия музыки Мейоз
Мейоз Насекомые. Отгадайте загадки
Насекомые. Отгадайте загадки Биология кошек
Биология кошек Презентация по теме: Особенности высшей нервной деятельности человека.
Презентация по теме: Особенности высшей нервной деятельности человека. Хищные животные Хабаровского края
Хищные животные Хабаровского края разновидности тестового контроля
разновидности тестового контроля Внешнее строение листа. Урок биологии в 6 классе
Внешнее строение листа. Урок биологии в 6 классе Разнообразие растительного мира. Семейство Норичниковые
Разнообразие растительного мира. Семейство Норичниковые