Содержание
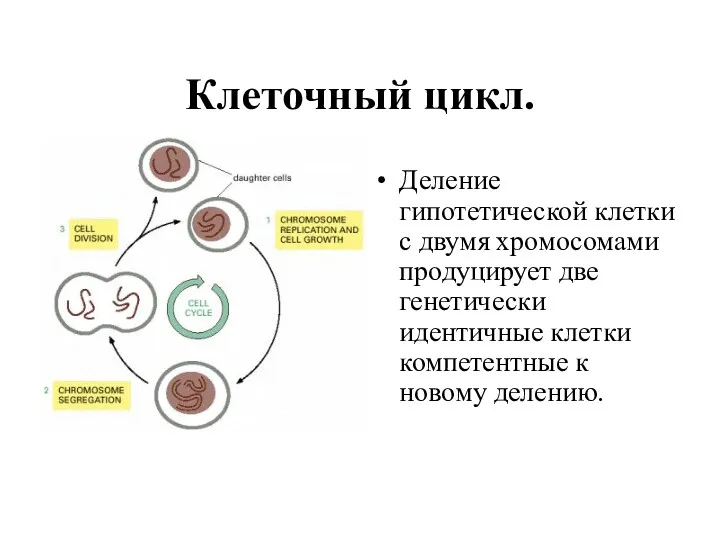
- 2. Клеточный цикл. Деление гипотетической клетки с двумя хромосомами продуцирует две генетически идентичные клетки компетентные к новому
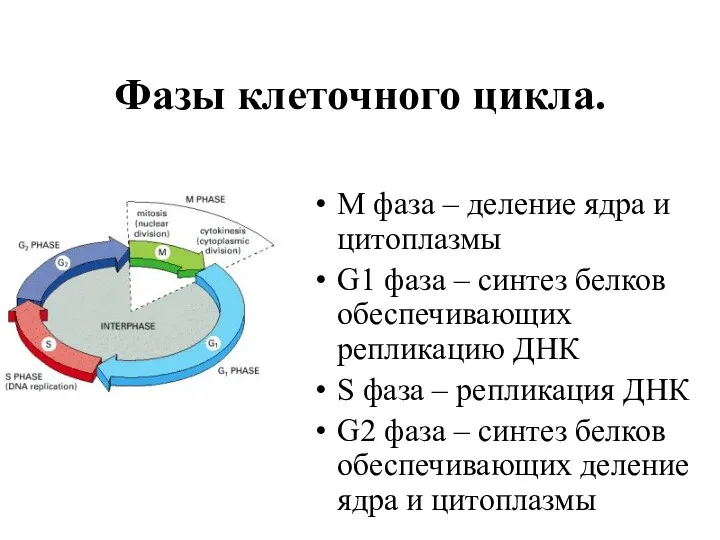
- 3. Фазы клеточного цикла. М фаза – деление ядра и цитоплазмы G1 фаза – синтез белков обеспечивающих
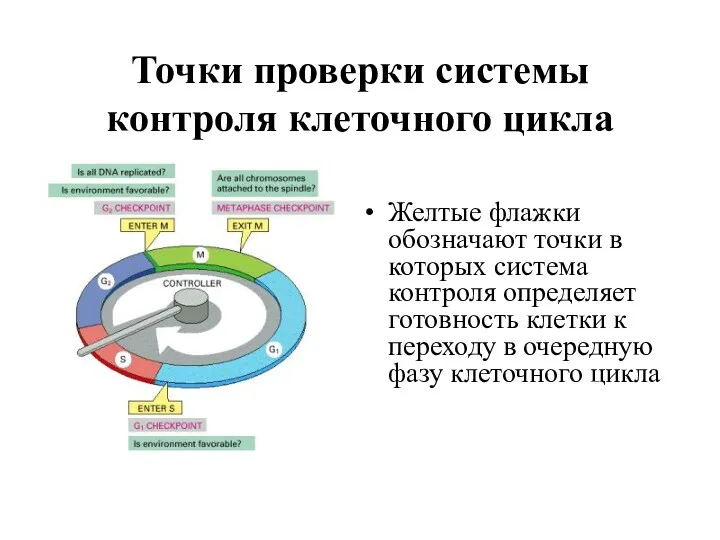
- 4. Точки проверки системы контроля клеточного цикла Желтые флажки обозначают точки в которых система контроля определяет готовность
- 5. Циклины и фазы клеточного цикла. Имеется четыре класса циклинов. Функция каждого из них связана с образованием
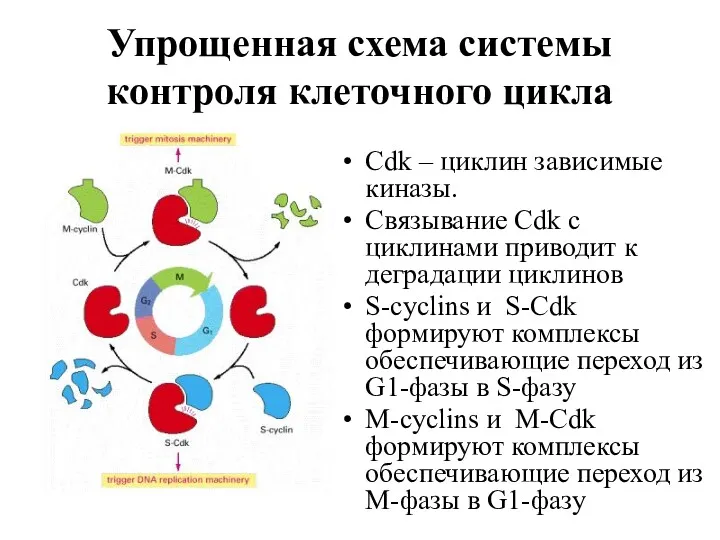
- 6. Упрощенная схема системы контроля клеточного цикла Cdk – циклин зависимые киназы. Связывание Cdk с циклинами приводит
- 7. Двухкомпонентная система контроля клеточного цикла. Связывание циклина и Cdk активирует протеинкиназу к обеспечению прохождения специфических событий
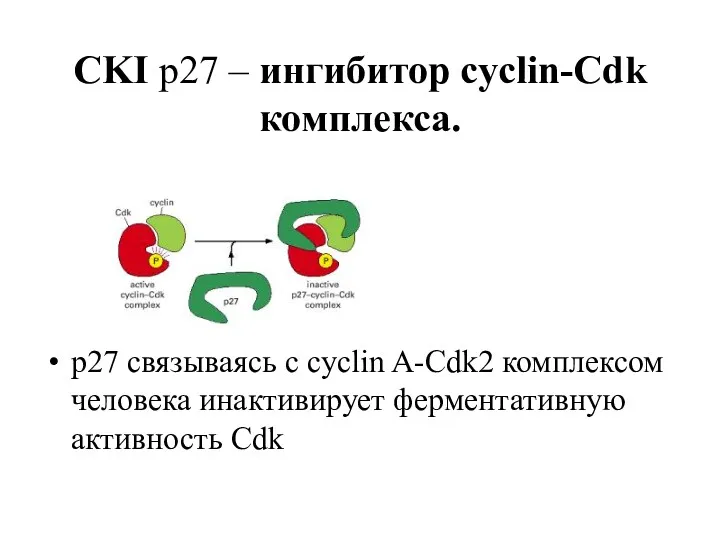
- 8. CKI p27 – ингибитор cyclin-Cdk комплекса. p27 связываясь с cyclin A-Cdk2 комплексом человека инактивирует ферментативную активность
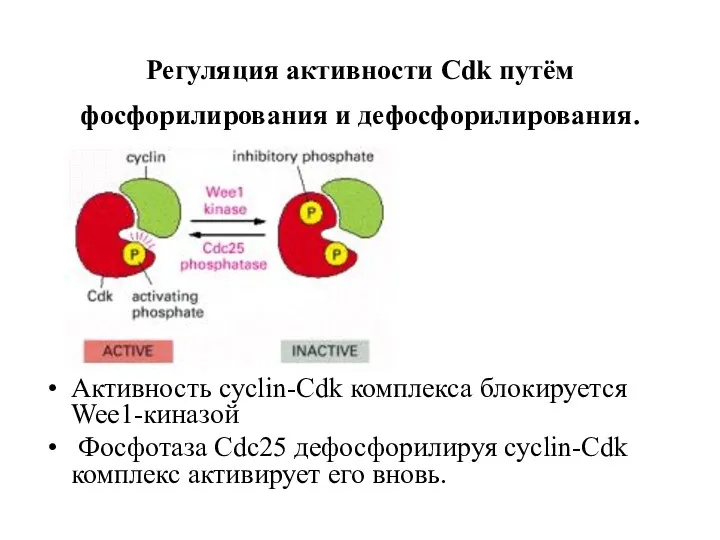
- 9. Регуляция активности Cdk путём фосфорилирования и дефосфорилирования. Активность cyclin-Cdk комплекса блокируется Wee1-киназой Фосфотаза Cdc25 дефосфорилируя cyclin-Cdk
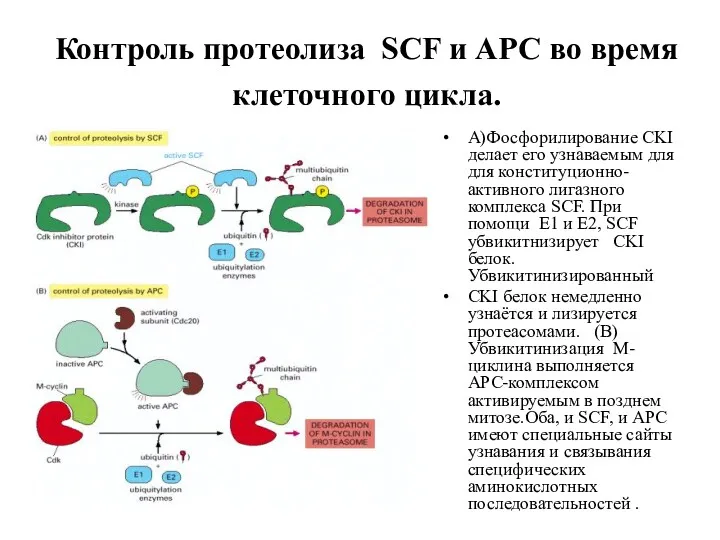
- 10. Контроль протеолиза SCF и APC во время клеточного цикла. A)Фосфорилирование CKI делает его узнаваемым для для
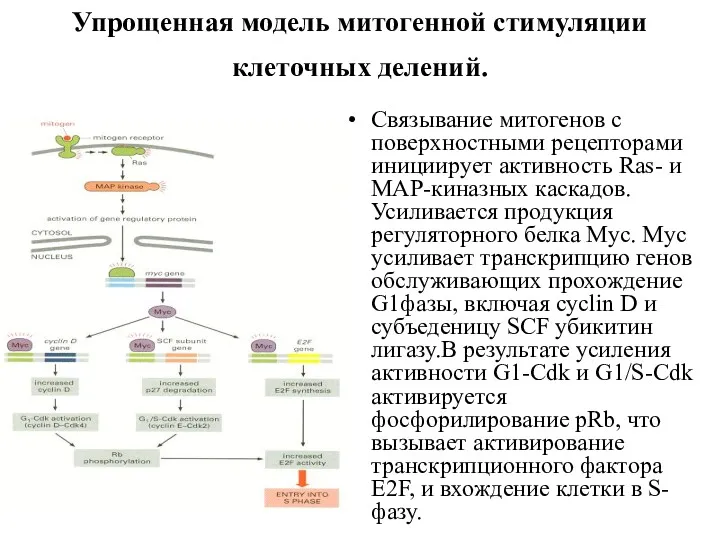
- 11. Упрощенная модель митогенной стимуляции клеточных делений. Связывание митогенов с поверхностными рецепторами инициирует активность Ras- и MAP-киназных
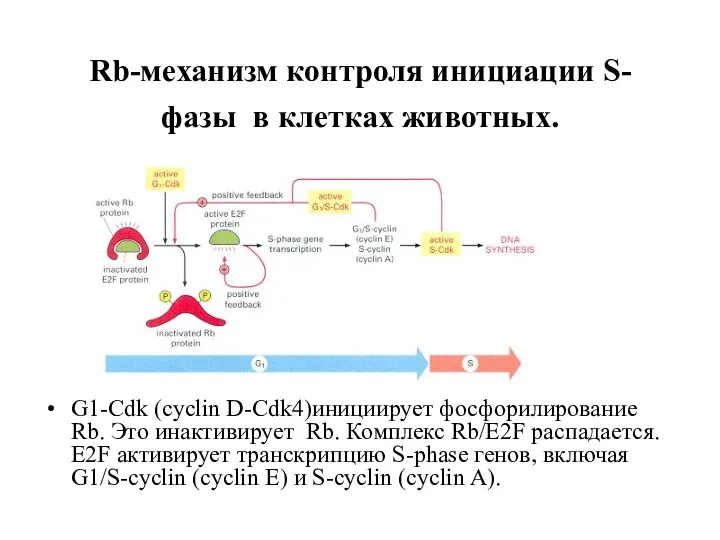
- 12. Rb-механизм контроля инициации S-фазы в клетках животных. G1-Cdk (cyclin D-Cdk4)инициирует фосфорилирование Rb. Это инактивирует Rb. Комплекс
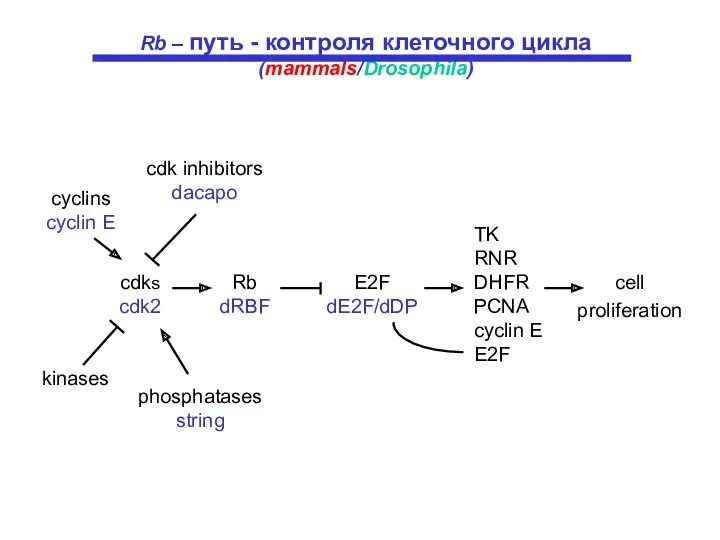
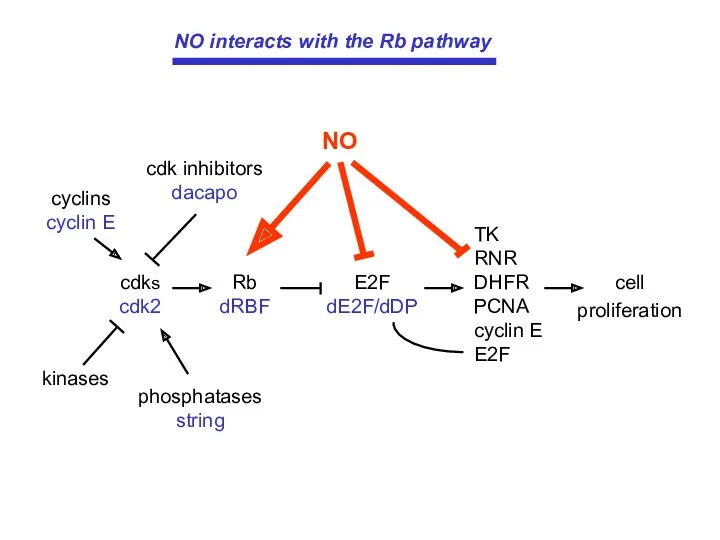
- 13. cell proliferation TK RNR DHFR PCNA cyclin E E2F phosphatases string kinases cdks cdk2 Rb dRBF
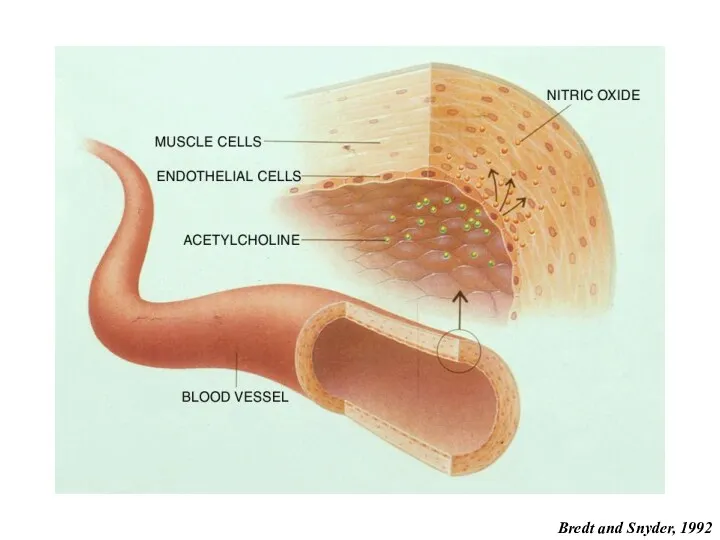
- 14. Bredt and Snyder, 1992
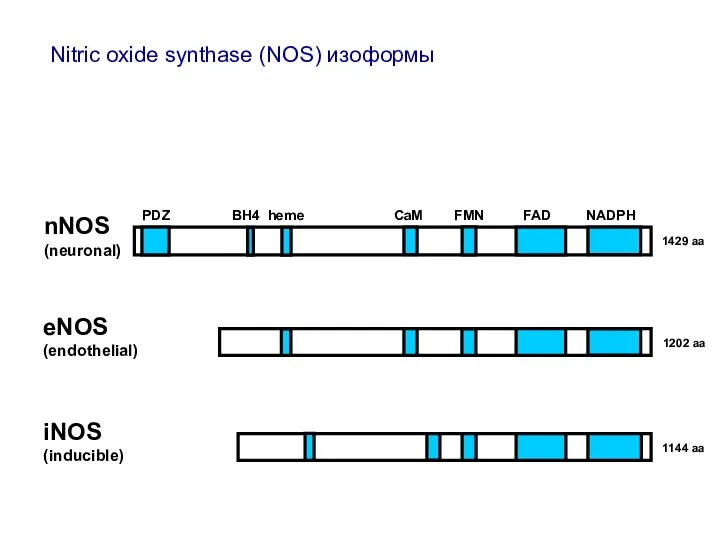
- 15. 1429 aa 1202 aa 1144 aa nNOS (neuronal) eNOS (endothelial) iNOS (inducible) PDZ BH4 heme CaM
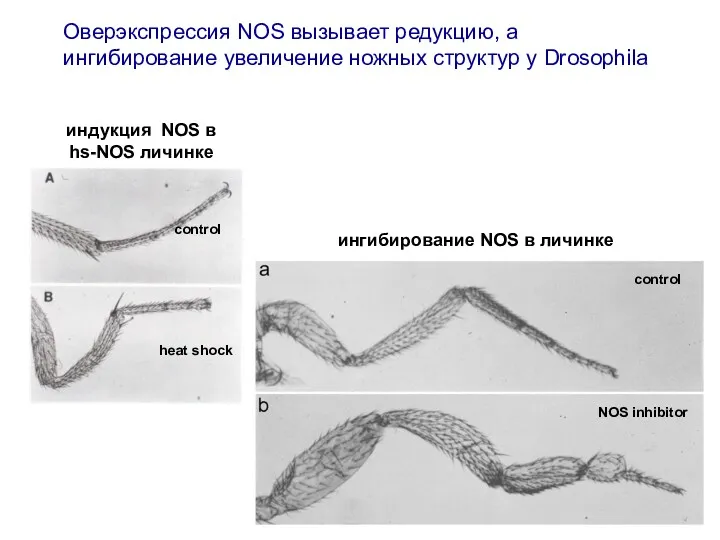
- 16. Оверэкспрессия NOS вызывает редукцию, а ингибирование увеличение ножных структур у Drosophila control heat shock NOS inhibitor
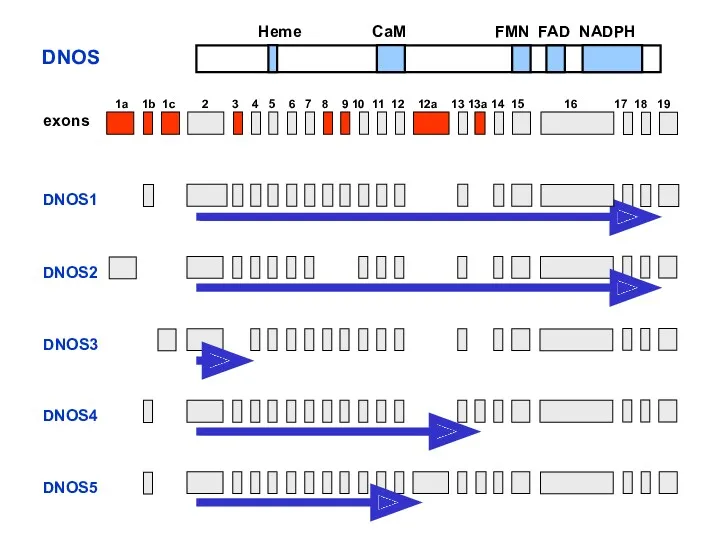
- 17. DNOS1 DNOS2 DNOS3 DNOS4 DNOS5 1a 1b 1c 2 3 4 5 6 7 8 9
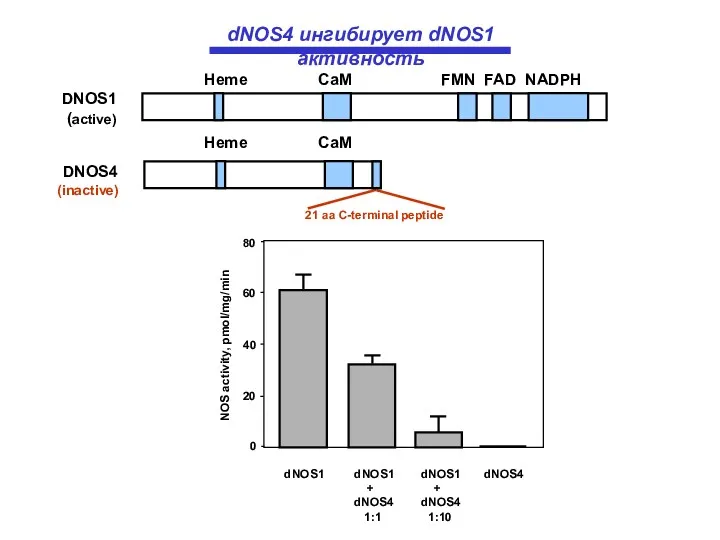
- 18. NOS activity, pmol/mg/min 0 20 40 60 80 dNOS1 dNOS1 dNOS1 dNOS4 + + dNOS4 dNOS4
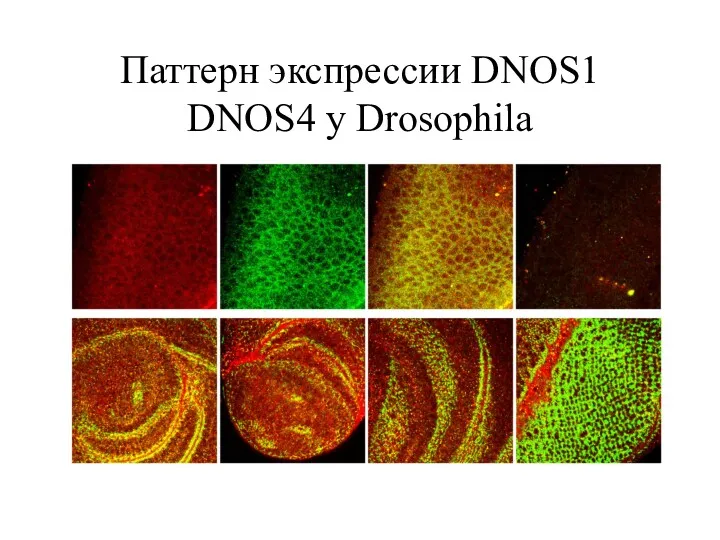
- 19. Паттерн экспрессии DNOS1 DNOS4 у Drosophila
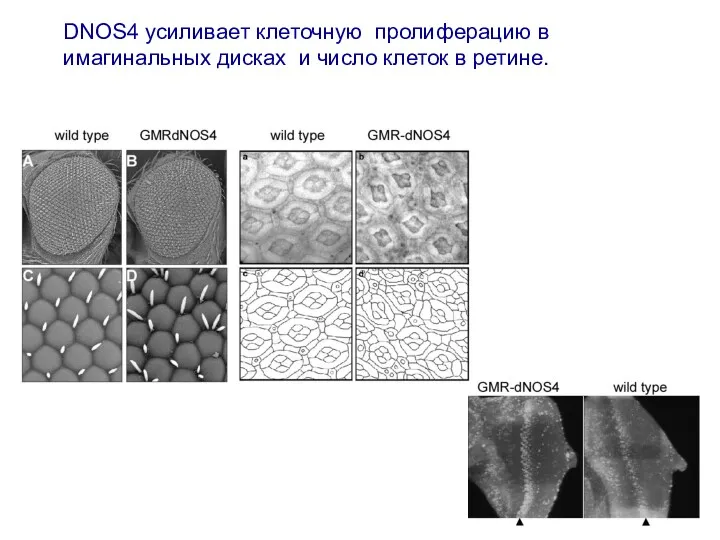
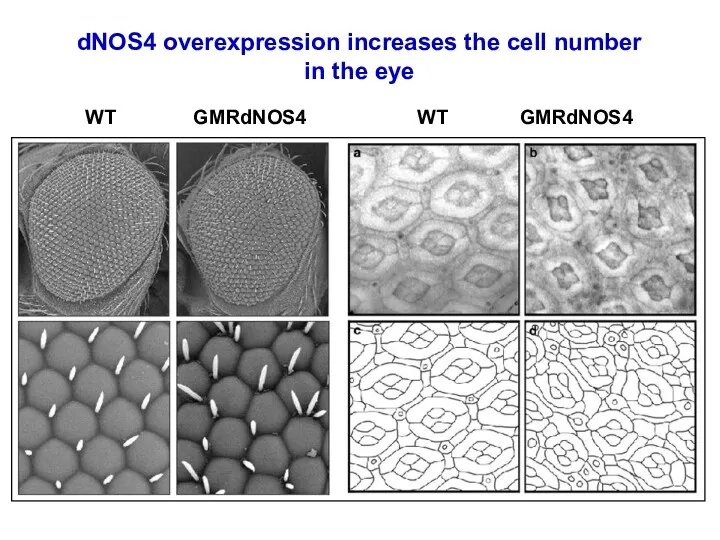
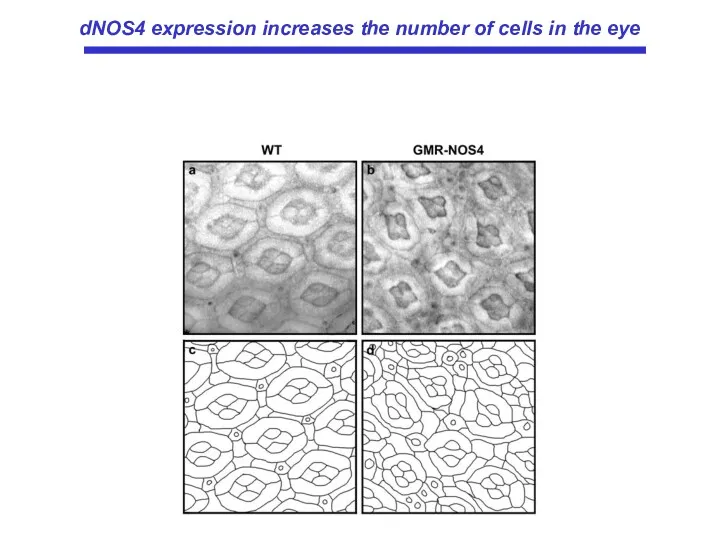
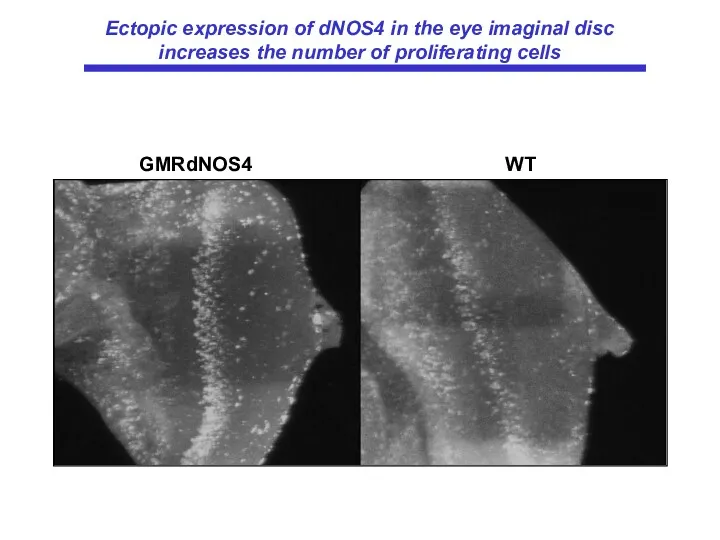
- 20. DNOS4 усиливает клеточную пролиферацию в имагинальных дисках и число клеток в ретине.
- 21. GMR-RBF4 GMR-RBF4 + + GMRdNOS4 GMRdNOS4 dNOS4 спасает RBF4 фенотип
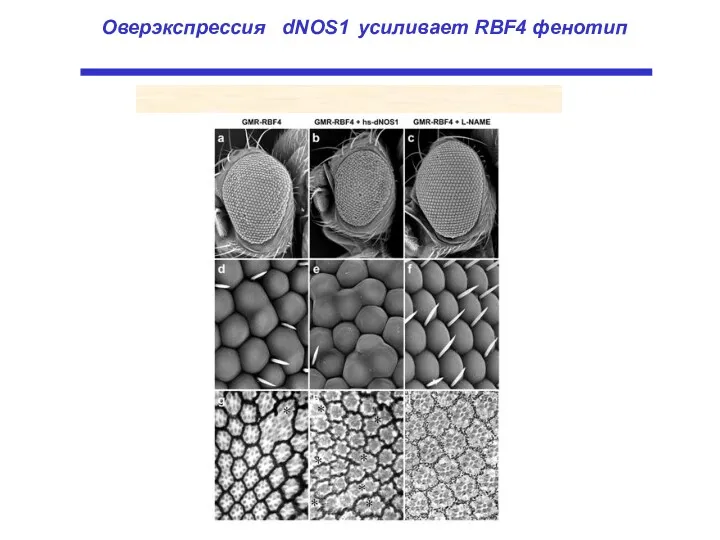
- 22. Оверэкспрессия dNOS1 усиливает RBF4 фенотип
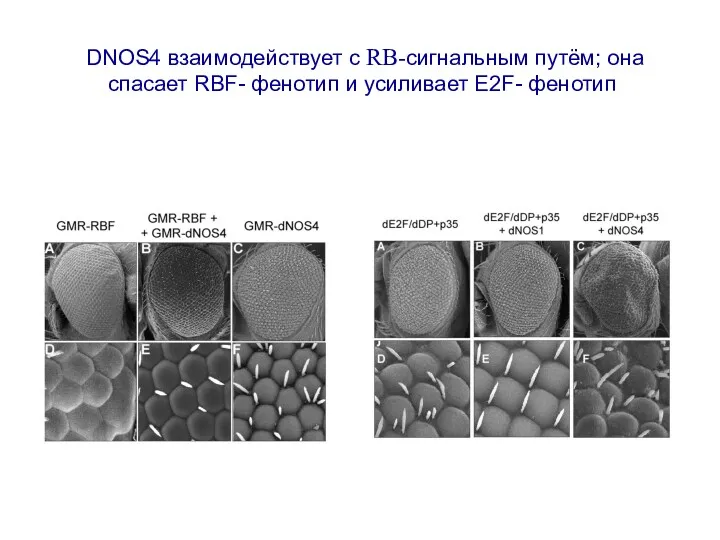
- 23. DNOS4 взаимодействует с RB-сигнальным путём; она спасает RBF- фенотип и усиливает E2F- фенотип
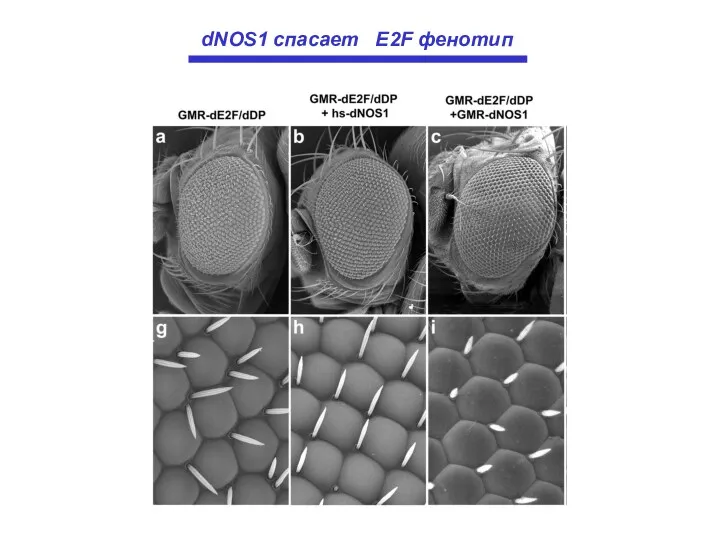
- 24. dNOS1 спасает E2F фенотип
- 25. cell proliferation TK RNR DHFR PCNA cyclin E E2F phosphatases string kinases cdks cdk2 Rb dRBF
- 26. Примеры фенотипических изменений мутациями генов определяющих планарную полярность клеток у дрозофилы и мыши. Дикий тип показан
- 27. Фенотипическое проявление нарушений планарной полярности у мутантов Stbm/Vang – генов. .Часть крыла Drosophila дикого типа (A)
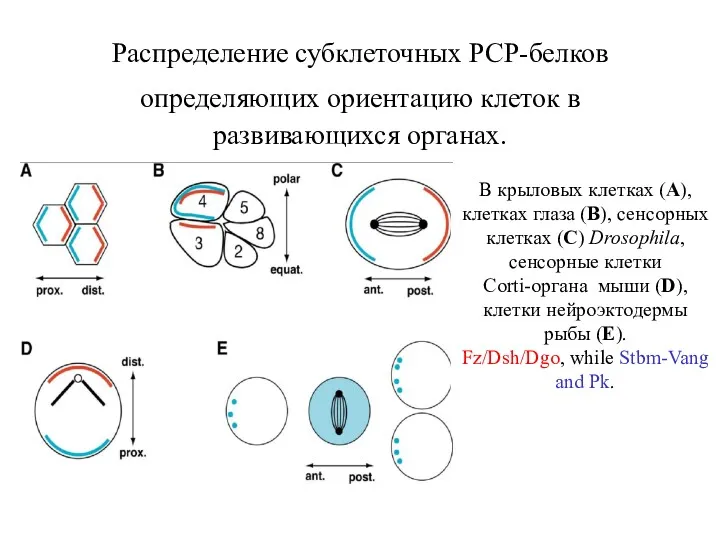
- 28. Распределение субклеточных РСР-белков определяющих ориентацию клеток в развивающихся органах. В крыловых клетках (A), клетках глаза (B),
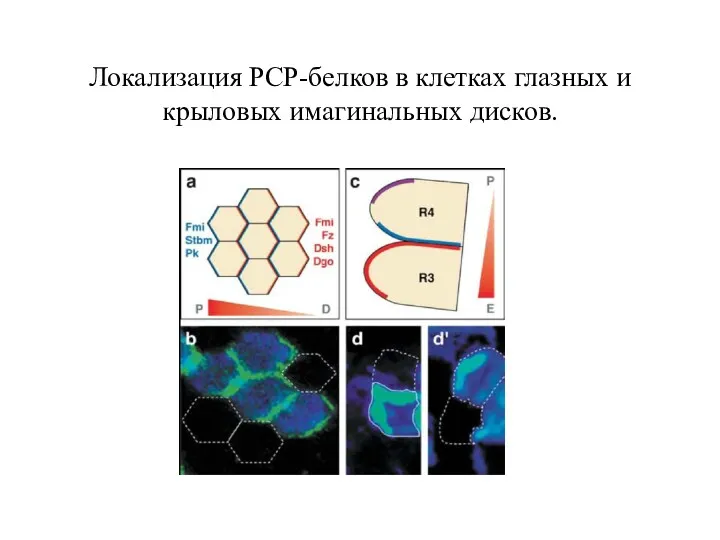
- 29. Локализация РСР-белков в клетках глазных и крыловых имагинальных дисков.
- 30. Нарушение полярности фоторецепторов
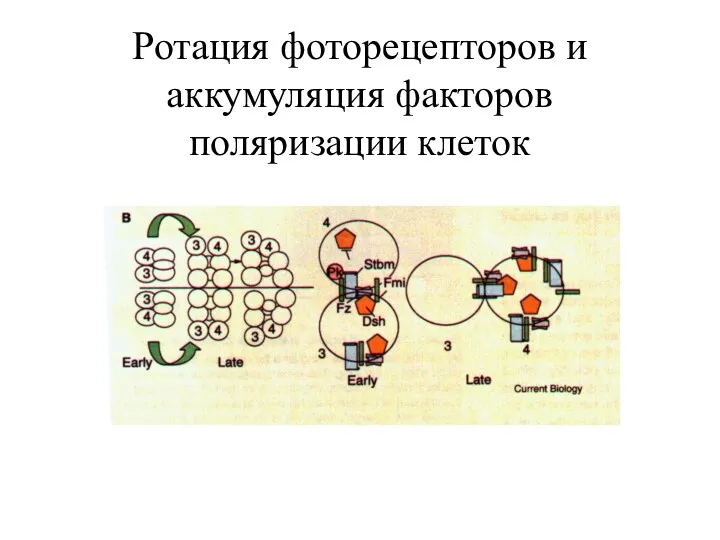
- 31. Ротация фоторецепторов и аккумуляция факторов поляризации клеток
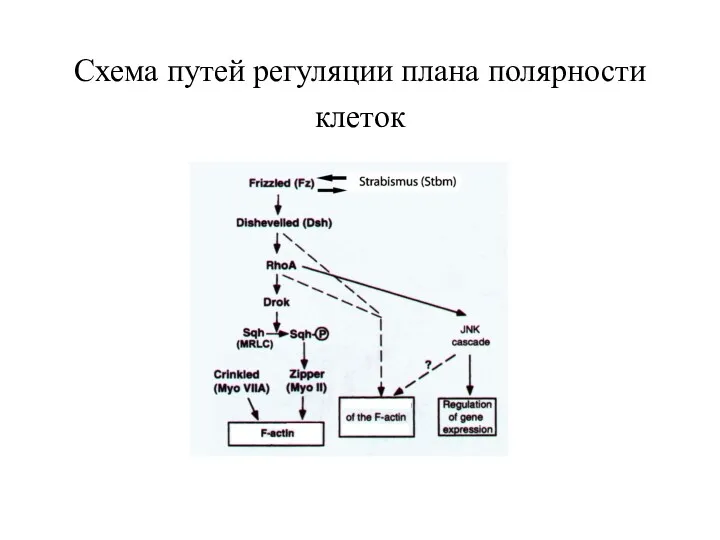
- 32. Схема путей регуляции плана полярности клеток
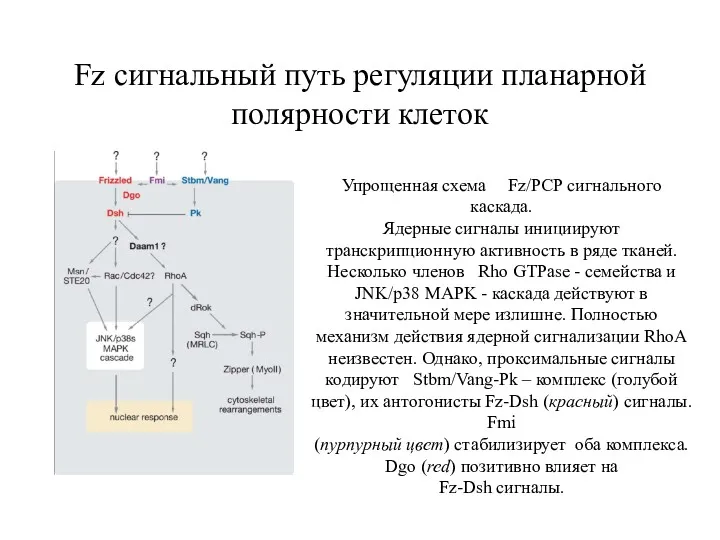
- 33. Fz сигнальный путь регуляции планарной полярности клеток Упрощенная схема Fz/PCP сигнального каскада. Ядерные сигналы инициируют транскрипционную
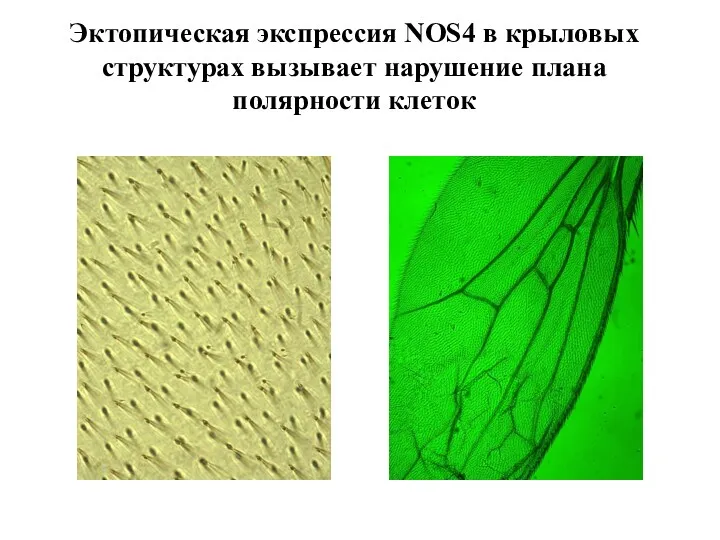
- 34. Эктопическая экспрессия NOS4 в крыловых структурах вызывает нарушение плана полярности клеток
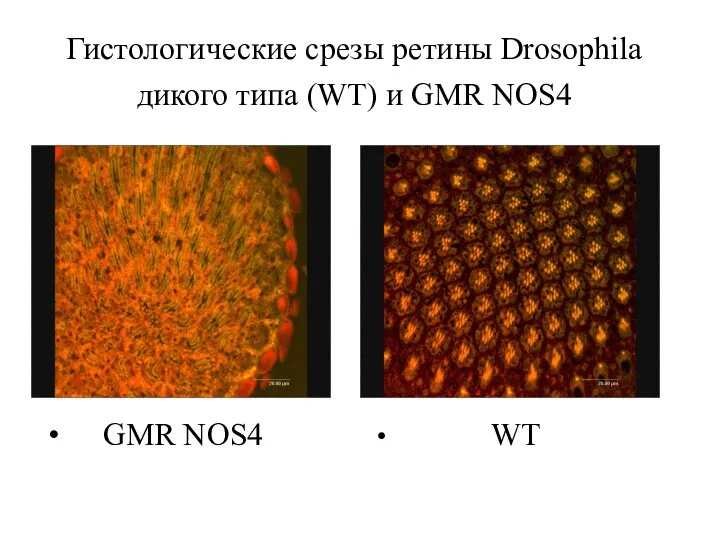
- 35. Гистологические срезы ретины Drosophila дикого типа (WT) и GMR NOS4 GMR NOS4 WT
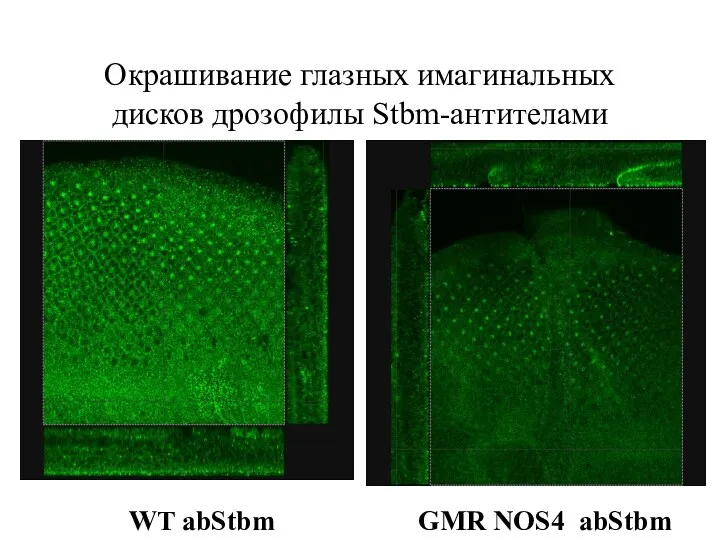
- 36. Окрашивание глазных имагинальных дисков дрозофилы Stbm-антителами GMR NOS4 abStbm WT abStbm
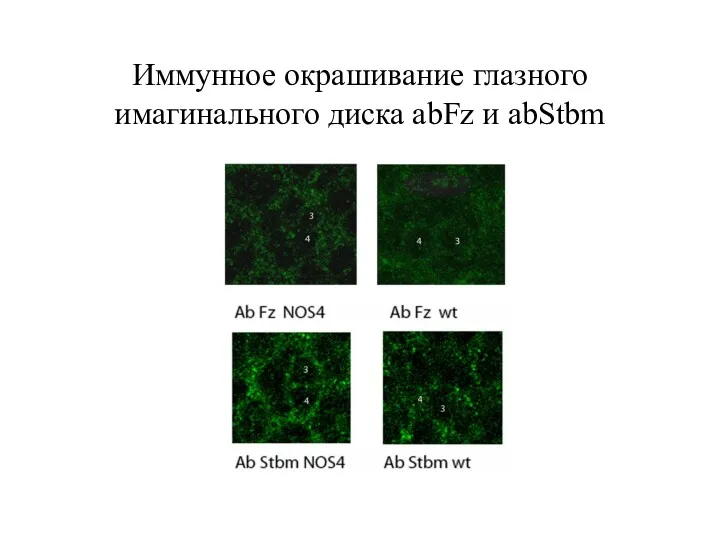
- 37. Иммунное окрашивание глазного имагинального диска abFz и abStbm
- 38. Стуктуры аристы на разных стадиях куколки (22ч., 32 ч., 44ч.) и имаго WT и DLL GAL4;
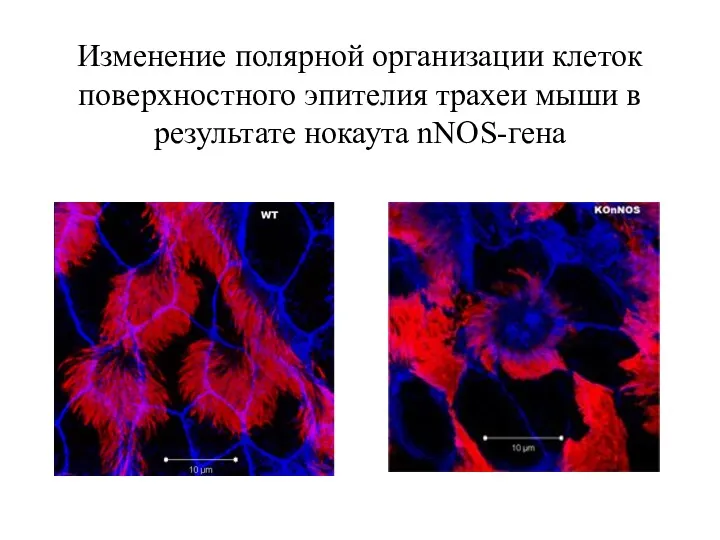
- 39. Изменение полярной организации клеток поверхностного эпителия трахеи мыши в результате нокаута nNOS-гена
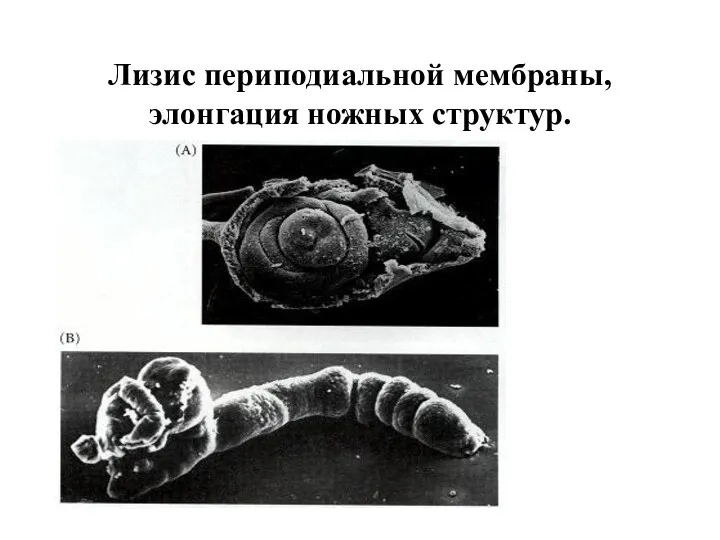
- 40. Лизис периподиальной мембраны, элонгация ножных структур.
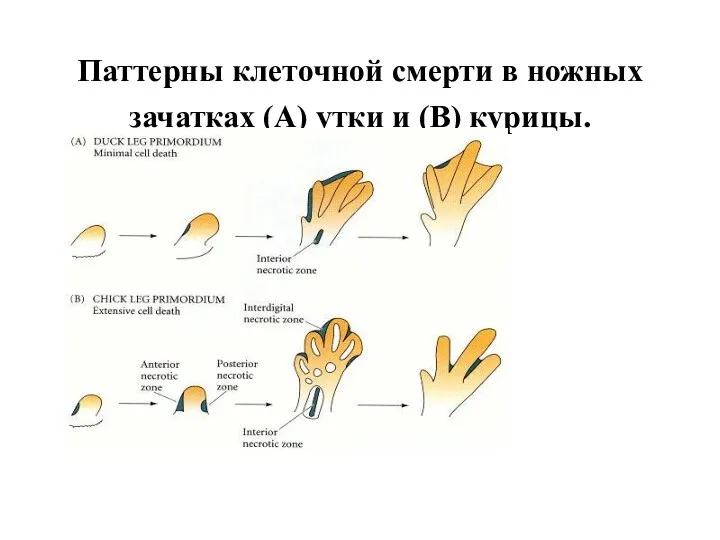
- 41. Паттерны клеточной смерти в ножных зачатках (A) утки и (B) курицы.
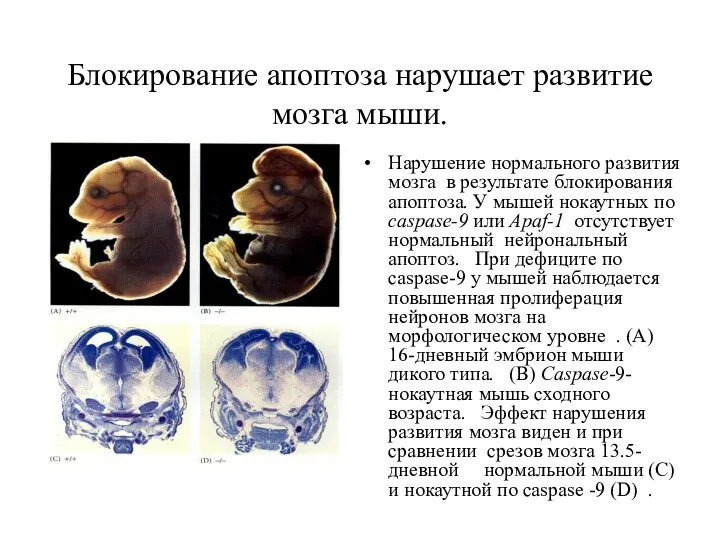
- 42. Блокирование апоптоза нарушает развитие мозга мыши. Нарушение нормального развития мозга в результате блокирования апоптоза. У мышей
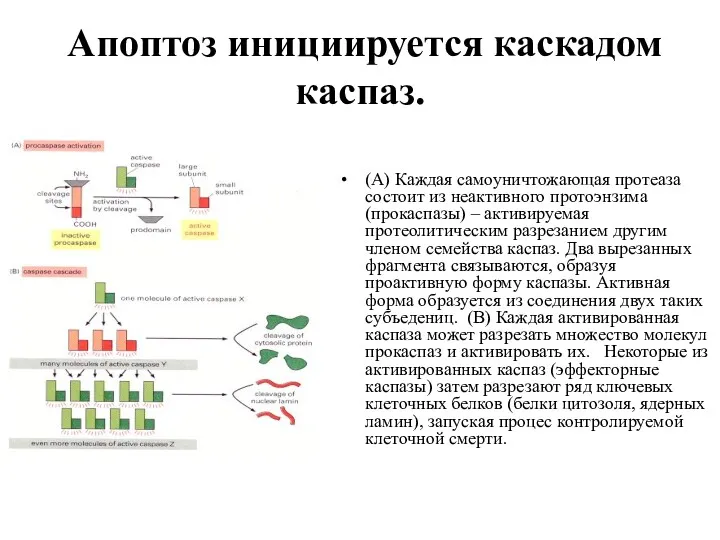
- 43. Апоптоз инициируется каскадом каспаз. (A) Каждая самоуничтожающая протеаза состоит из неактивного протоэнзима (прокаспазы) – активируемая протеолитическим
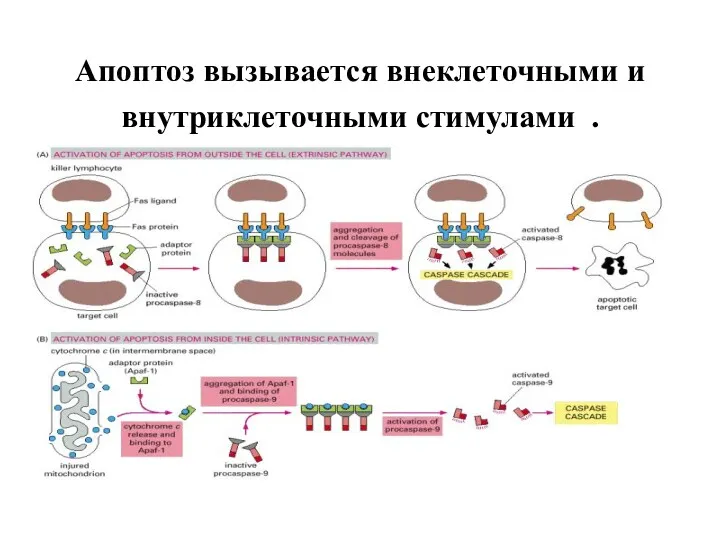
- 44. Апоптоз вызывается внеклеточными и внутриклеточными стимулами .
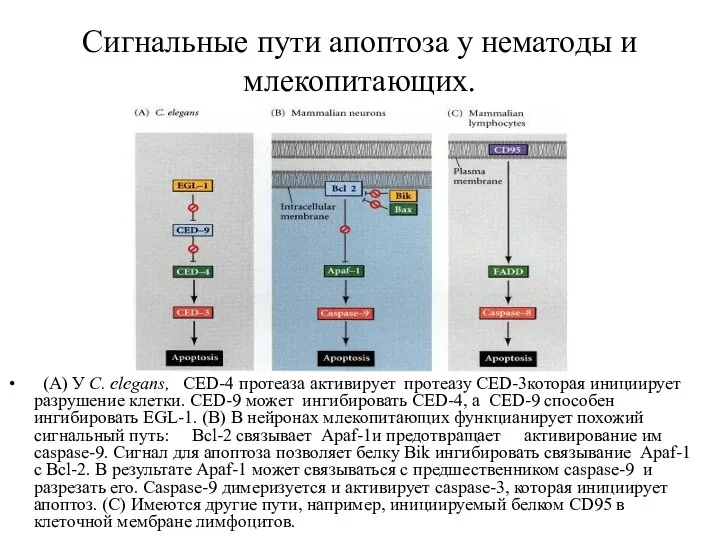
- 45. Сигнальные пути апоптоза у нематоды и млекопитающих. (A) У C. elegans, CED-4 протеаза активирует протеазу CED-3которая
- 46. Взаимодействие генов в ответ на воздействие внешней среды является важнейшим фактором индивидуального и исторического развития
- 47. Иллюстрация к «теории канализации развития», на примере шара скатывающегося по поверхности горного рельефа
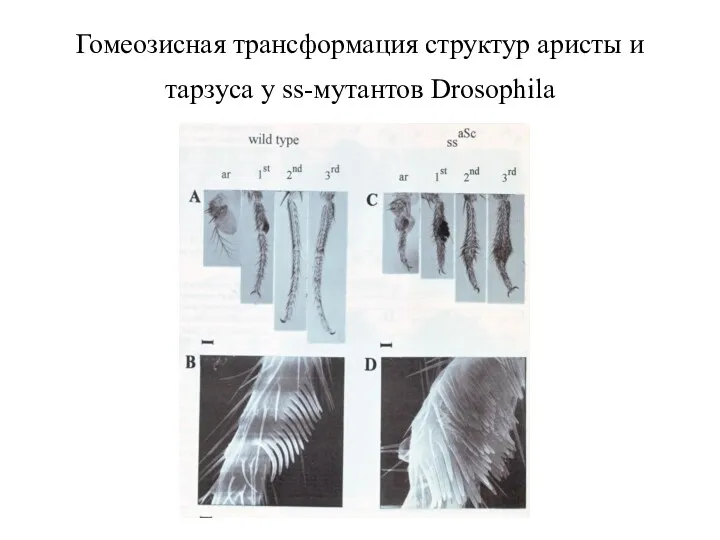
- 48. Гомеозисная трансформация структур аристы и тарзуса у ss-мутантов Drosophila
- 49. Мутации spineless-aristapedia нарушают: морфогенез конечностей; нейрогенез; дендритное ветвление; митоз и характеризуются температурной чувствительностью
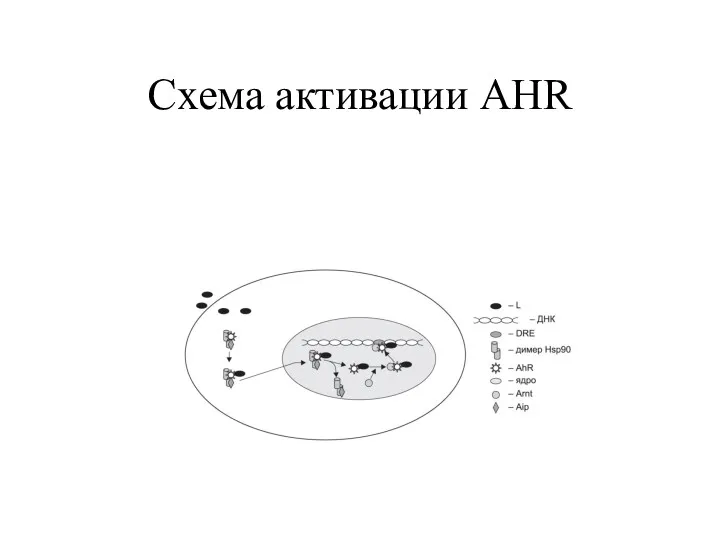
- 50. Схема активации AHR
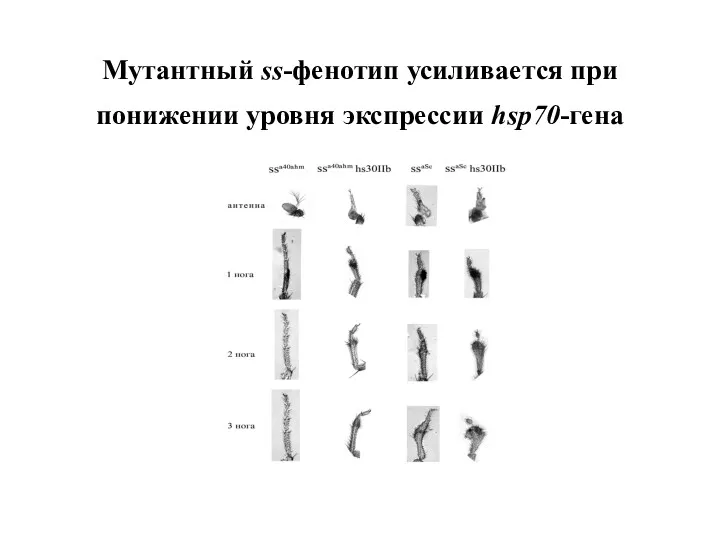
- 51. Мутантный ss-фенотип усиливается при понижении уровня экспрессии hsp70-гена
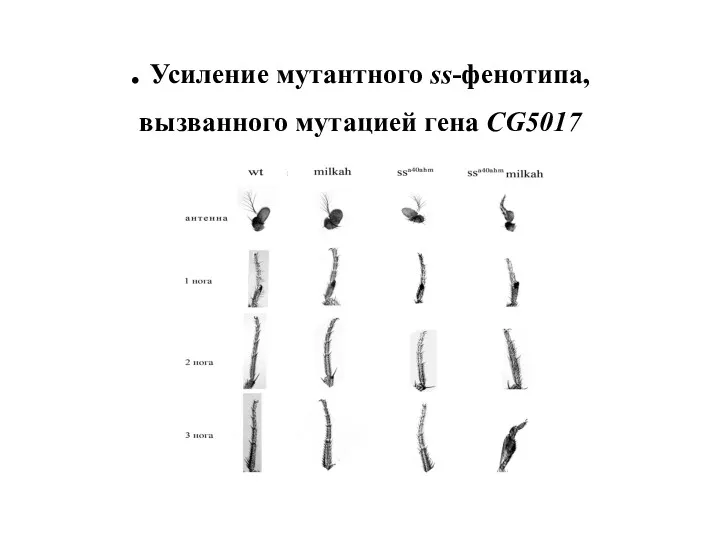
- 52. . Усиление мутантного ss-фенотипа, вызванного мутацией гена СG5017
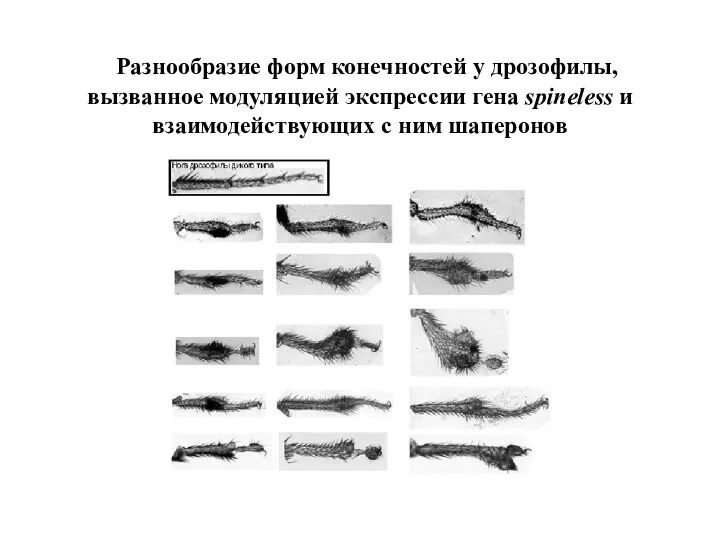
- 53. Разнообразие форм конечностей у дрозофилы, вызванное модуляцией экспрессии гена spineless и взаимодействующих с ним шаперонов
- 54. Разнообразие форм конечностей внутри класса насекомых
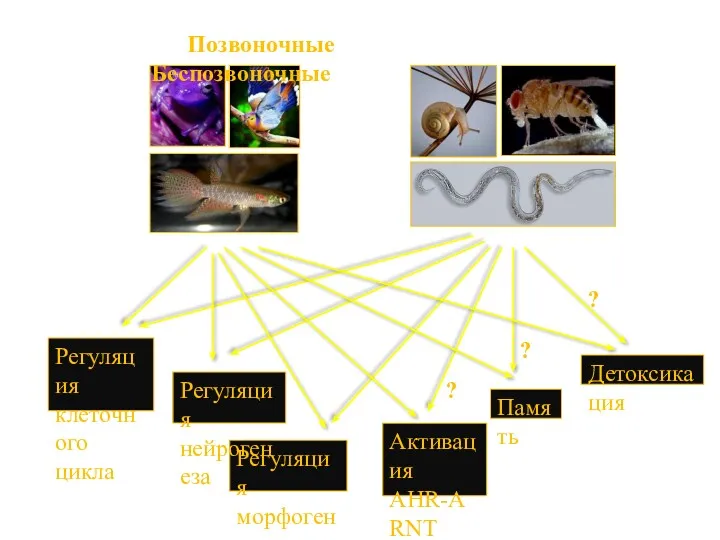
- 55. Позвоночные Беспозвоночные Регуляция морфогенеза Регуляция клеточного цикла Детоксикация Регуляция нейрогенеза Активация AHR-ARNT диоксином Память ? ?
- 57. WT GMRdNOS4 WT GMRdNOS4 dNOS4 overexpression increases the cell number in the eye
- 58. One copy of GMR-dNOS4 transgene combined with dNOS1 deficient allele causes an overproliferative eye phenotype GMR-dNOS4
- 59. dNOS4 expression increases the number of cells in the eye
- 60. GMRdNOS4 WT Ectopic expression of dNOS4 in the eye imaginal disc increases the number of proliferating
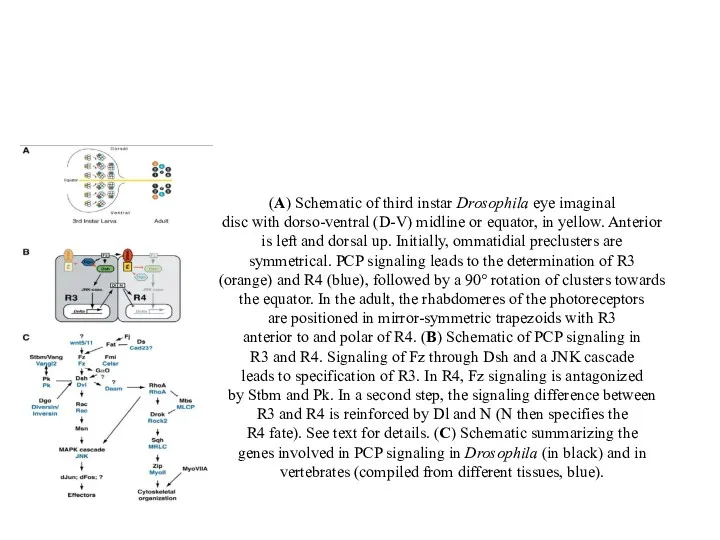
- 61. (A) Schematic of third instar Drosophila eye imaginal disc with dorso-ventral (D-V) midline or equator, in
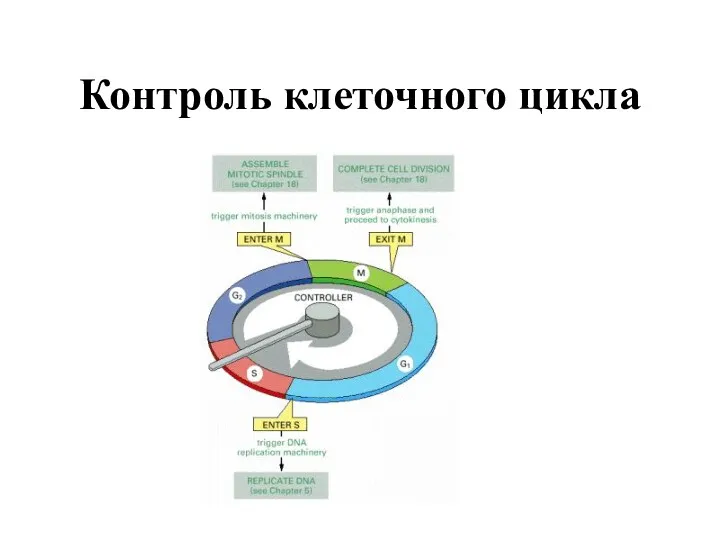
- 62. Контроль клеточного цикла
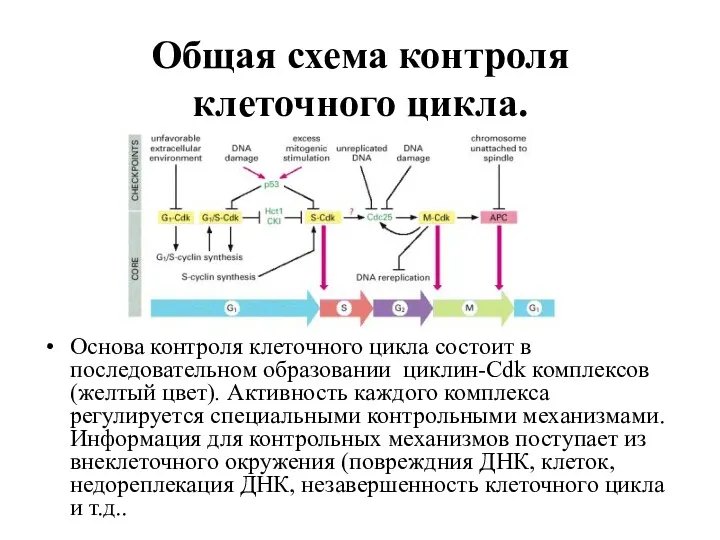
- 63. Общая схема контроля клеточного цикла. Основа контроля клеточного цикла состоит в последовательном образовании циклин-Cdk комплексов(желтый цвет).
- 64. (A) Во время клеточных циклов в раннем эмбриогенезе, активность убикинитизирующего комплекса Cdc20-APC повышается к концу метафазы,
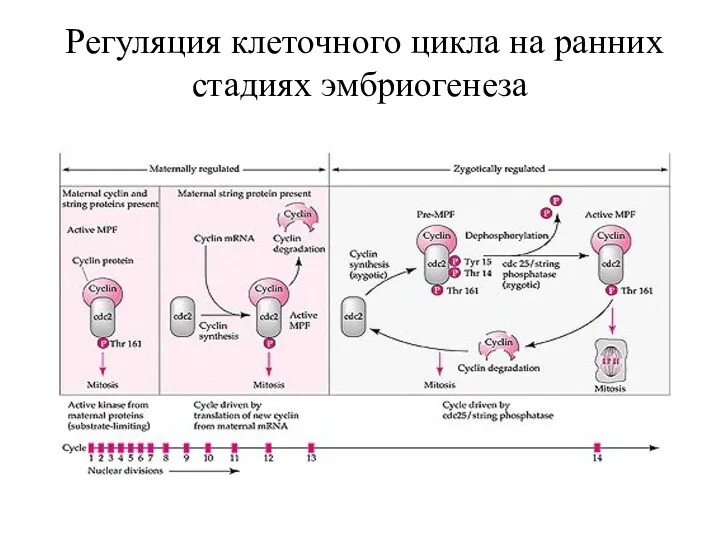
- 65. Регуляция клеточного цикла на ранних стадиях эмбриогенеза
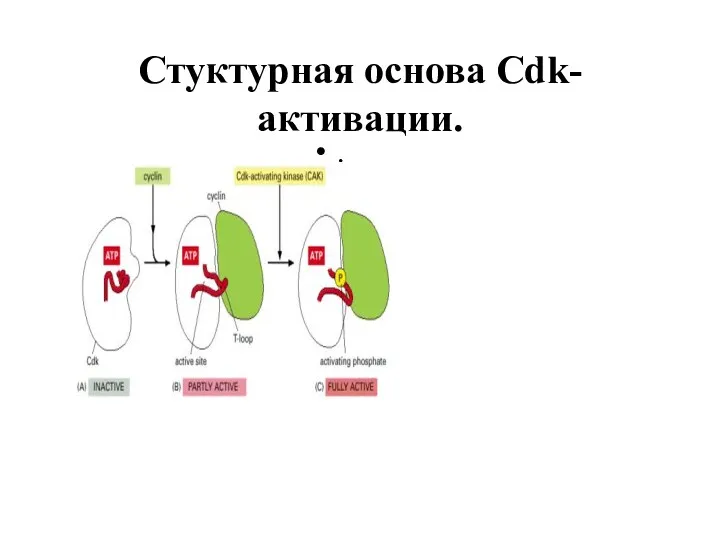
- 66. Стуктурная основа Cdk-активации. .
- 68. Скачать презентацию














 Тварини та їхні особливості. Жираф - найвища тварина на Землі
Тварини та їхні особливості. Жираф - найвища тварина на Землі Презентация к уроку биологии 7 класс
Презентация к уроку биологии 7 класс Обмен веществ и энергии. Терморегуляция. Лекция
Обмен веществ и энергии. Терморегуляция. Лекция Особенности физиологии человека в условиях высокого и низкого давления
Особенности физиологии человека в условиях высокого и низкого давления Мимические мышцы лица
Мимические мышцы лица Положение человека в системе животного мира. Стадии антропогенеза
Положение человека в системе животного мира. Стадии антропогенеза Cerphidae. Ден
Cerphidae. Ден Зоология позвоночных. Строение основных типов беспозвоночных
Зоология позвоночных. Строение основных типов беспозвоночных Красноухая черепаха
Красноухая черепаха Основи механізованої технології виробництва культур. Лекция №7
Основи механізованої технології виробництва культур. Лекция №7 Органы выделения
Органы выделения Природные зоны
Природные зоны Мезозойская эра
Мезозойская эра Физиология гладких мышц. (Лекция 7)
Физиология гладких мышц. (Лекция 7) Презентация Открытия в области биотехнологии
Презентация Открытия в области биотехнологии Уразовский Заказник
Уразовский Заказник Презентация по теме Основные типы экологических взаимодействий
Презентация по теме Основные типы экологических взаимодействий Презентация Загрязнение воздуха
Презентация Загрязнение воздуха Факторы влияющие на качество молока. Лекция 4
Факторы влияющие на качество молока. Лекция 4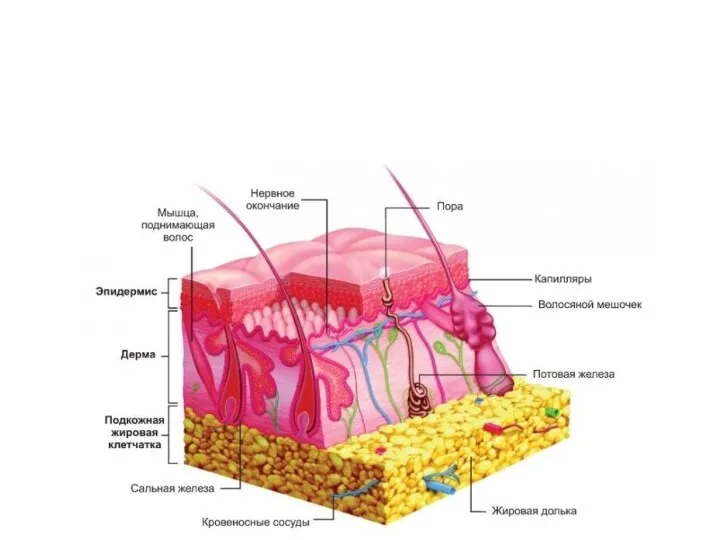 Строение и функции кожи. Наружный слой - эпидермис
Строение и функции кожи. Наружный слой - эпидермис Царство прокариоты, подцарство бактерии
Царство прокариоты, подцарство бактерии Общее представление о биотестировании и биоиндикации
Общее представление о биотестировании и биоиндикации Кольчатые черви
Кольчатые черви Ящерицы
Ящерицы Квітка - вкорочений видозмінений пагін - орган насіннєвого розмноження
Квітка - вкорочений видозмінений пагін - орган насіннєвого розмноження Белки
Белки Внешнее строение рыб. Надкласс рыбы
Внешнее строение рыб. Надкласс рыбы Происхождение современного человека. (Тема 3)
Происхождение современного человека. (Тема 3)