Содержание
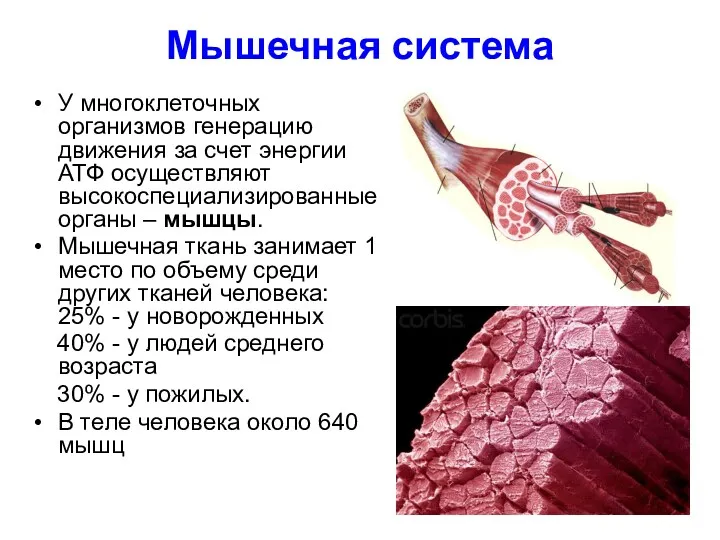
- 2. Мышечная система У многоклеточных организмов генерацию движения за счет энергии АТФ осуществляют высокоспециализированные органы – мышцы.
- 3. Функции мышц Скелетные мышцы построены из поперечнополосатой мышечной ткани и поэтому способны к произвольным сокращениям. Обеспечивают
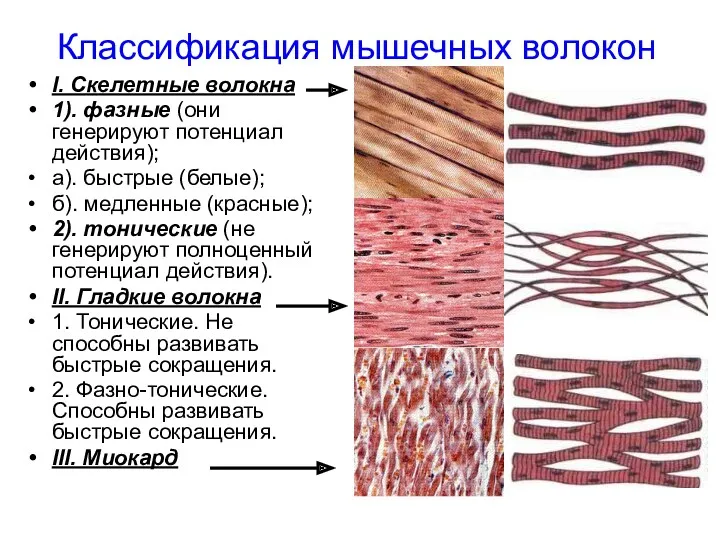
- 4. I. Скелетные волокна 1). фазные (они генерируют потенциал действия); а). быстрые (белые); б). медленные (красные); 2).
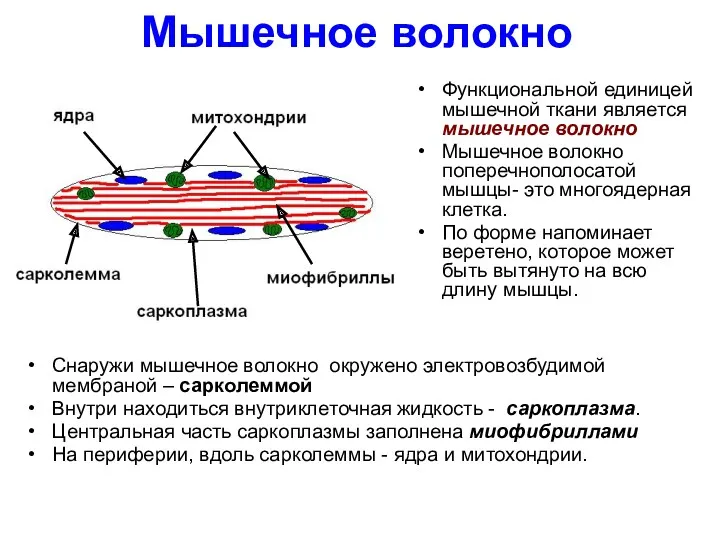
- 5. Мышечное волокно Функциональной единицей мышечной ткани является мышечное волокно Мышечное волокно поперечнополосатой мышцы- это многоядерная клетка.
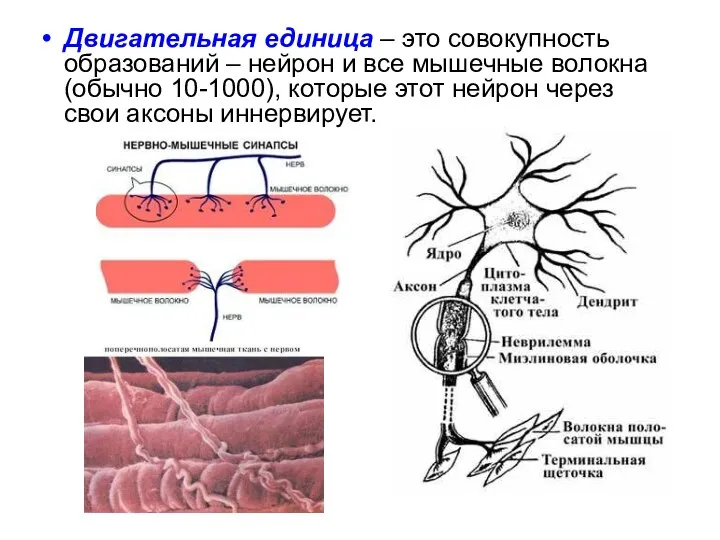
- 6. Двигательная единица – это совокупность образований – нейрон и все мышечные волокна (обычно 10-1000), которые этот
- 7. ХИМИЧЕСКИЙ СОСТАВ МЫШЕЧНОЙ ТКАНИ Вода............................................72—80 Сухой остаток …........................20—28 В том числе: Белки...........................................16,5—20,9 Гликоген......................................0,3—3,0 Фосфатиды.................................0,4—1,0 Холестерин.................................0,06—0,2 Креатин
- 8. 1. Сократительные (миофибриллярные) белки миозин 55% актин 25% тропомиозин (во всех мышцах) тропонины Т, I и
- 9. Углеводы мышечной ткани Гликоген: 0,3-3,0% ГАГ моносахариды глюкоза, фруктоза Липиды мышечной ткани Фосфолипиды (в миокарде больше)
- 10. ОСОБЕННОСТИ ОБМЕНА ВЕЩЕСТВ В МЫШЕЧНОЙ ТКАНИ Обмен белков и аминокислот Мышцы характеризуются высоким обменом белков и
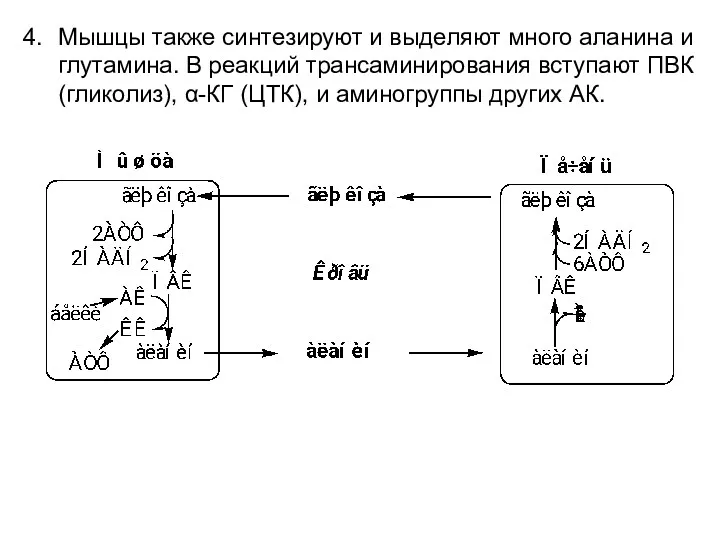
- 11. Мышцы также синтезируют и выделяют много аланина и глутамина. В реакций трансаминирования вступают ПВК (гликолиз), α-КГ
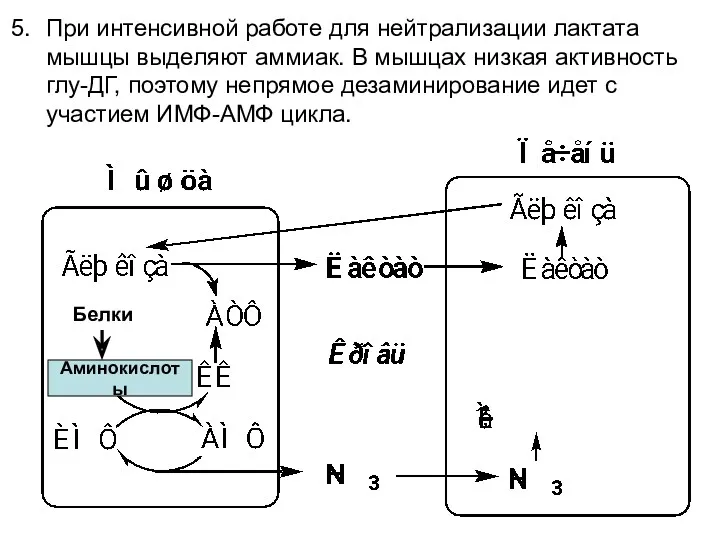
- 12. Аминокислоты Белки При интенсивной работе для нейтрализации лактата мышцы выделяют аммиак. В мышцах низкая активность глу-ДГ,
- 13. Липидный обмен преобладает катаболизм липидов. Жирные кислоты, кетоновые тела в аэробных условиях окисляются в мышцах для
- 14. Углеводный обмен преобладает катаболизм углеводов. глюкоза окисляется в аэробных или анаэробных условиях для синтеза АТФ. Из
- 15. Энергетический обмен Энергетический обмен в состоянии покоя очень низкий, при интенсивной физической нагрузке значительно возрастает. В
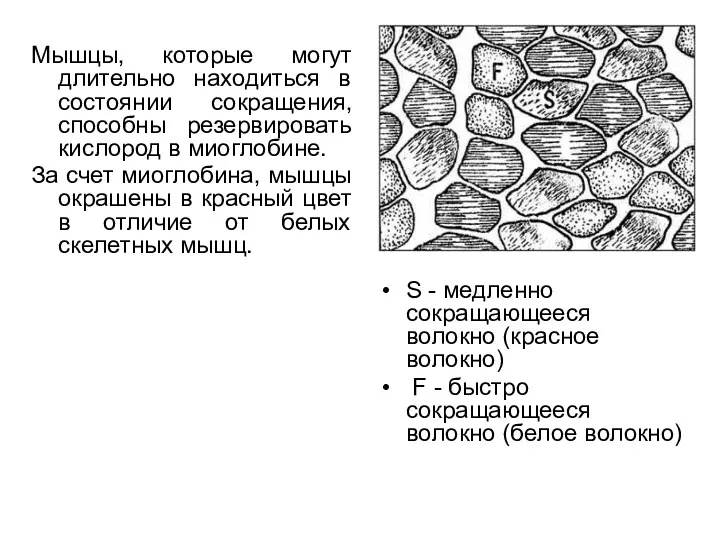
- 16. Мышцы, которые могут длительно находиться в состоянии сокращения, способны резервировать кислород в миоглобине. За счет миоглобина,
- 17. Основной потребитель АТФ - процесс мышечного сокращения. Запасы АТФ быстро истощаются. Источники АТФ: 1) классический путь
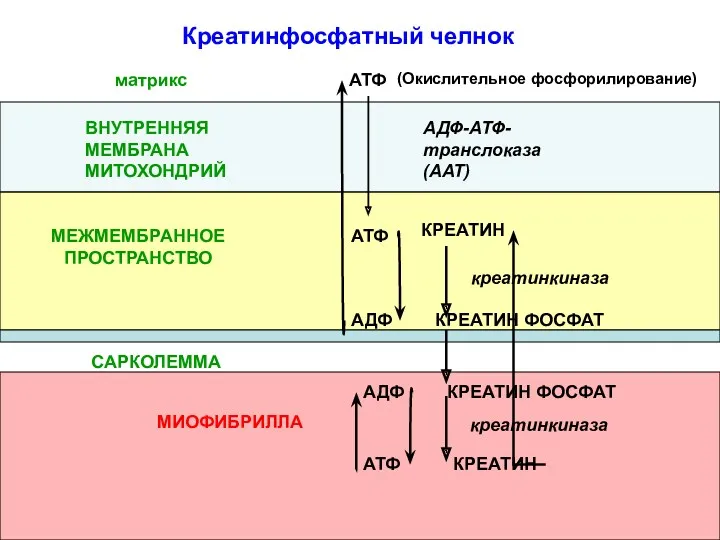
- 18. (Окислительное фосфорилирование) АТФ АДФ-АТФ-транслоказа(ААТ) ВНУТРЕННЯЯ МЕМБРАНА МИТОХОНДРИЙ КРЕАТИН КРЕАТИН ФОСФАТ АТФ АДФ САРКОЛЕММА МИОФИБРИЛЛА КРЕАТИН ФОСФАТ
- 19. Креатинфосфатный челнок предотвращает быстрое истощение запасов АТФ в мышце за счет: запаса макроэргических связей в креатинфосфате
- 20. Характеристика быстрых и медленных скелетных мышц
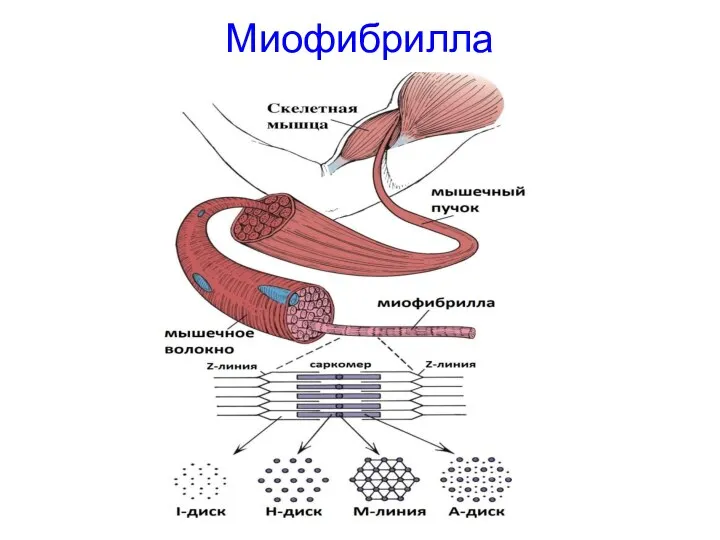
- 21. Миофибрилла
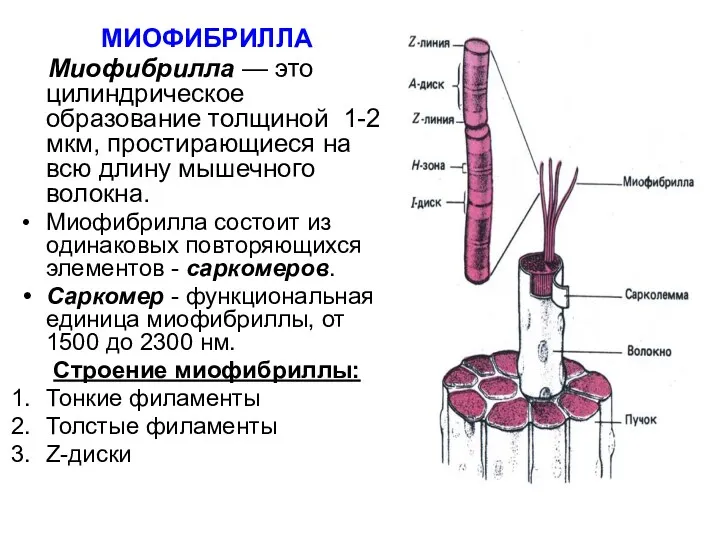
- 22. МИОФИБРИЛЛА Миофибрилла — это цилиндрическое образование толщиной 1-2 мкм, простирающиеся на всю длину мышечного волокна. Миофибрилла
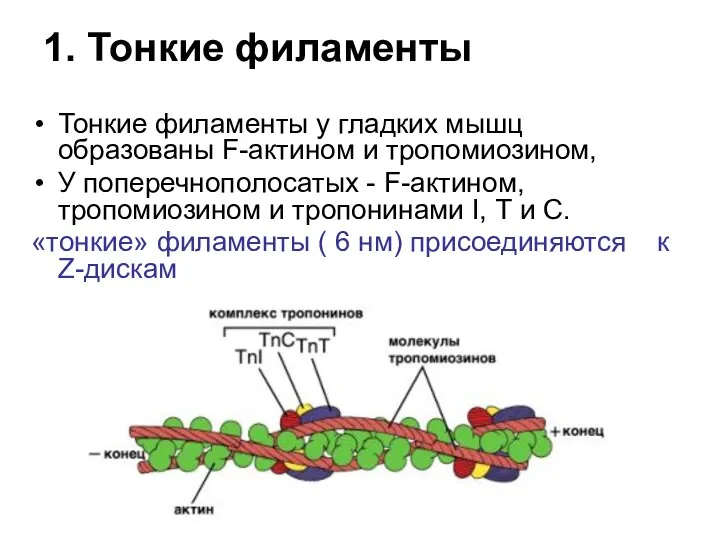
- 23. 1. Тонкие филаменты Тонкие филаменты у гладких мышц образованы F-актином и тропомиозином, У поперечнополосатых - F-актином,
- 24. Актин G-актин - мономерный (глобулярный) белок с массой 43кДа. F-актин. При физиологической величине рН и в
- 25. Тропомиозин - есть во всех мышцах: белок, состоящий из а и р цепей, располагается в щели
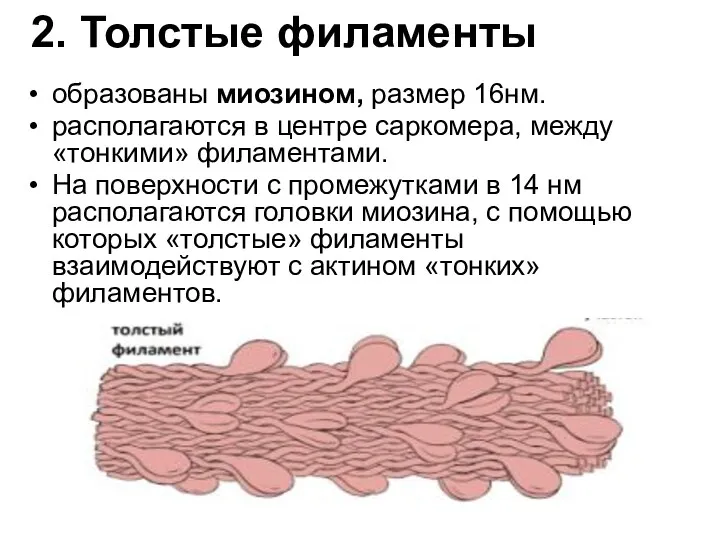
- 26. 2. Толстые филаменты образованы миозином, размер 16нм. располагаются в центре саркомера, между «тонкими» филаментами. На поверхности
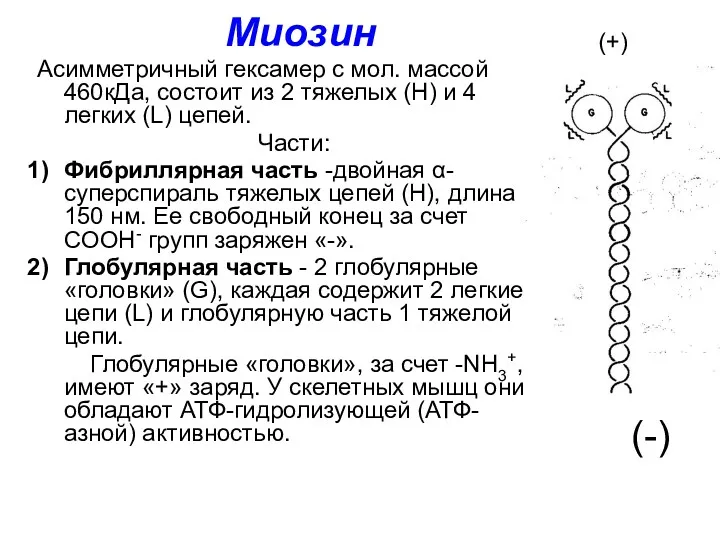
- 27. Миозин Асимметричный гексамер с мол. массой 460кДа, состоит из 2 тяжелых (Н) и 4 легких (L)
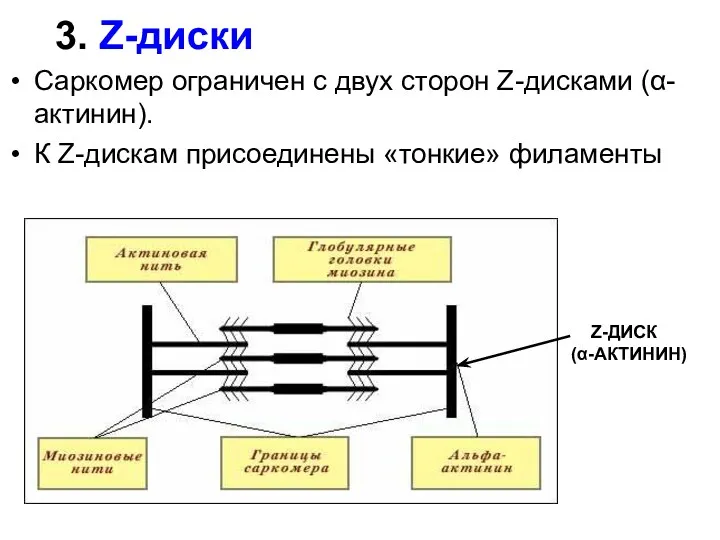
- 28. 3. Z-диски Саркомер ограничен с двух сторон Z-дисками (α-актинин). К Z-дискам присоединены «тонкие» филаменты Z-ДИСК (α-АКТИНИН)
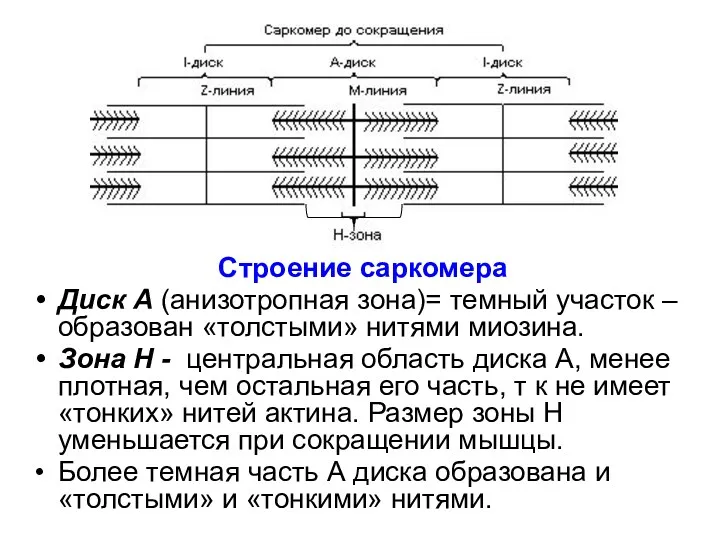
- 29. Строение саркомера Диск А (анизотропная зона)= темный участок –образован «толстыми» нитями миозина. Зона Н - центральная
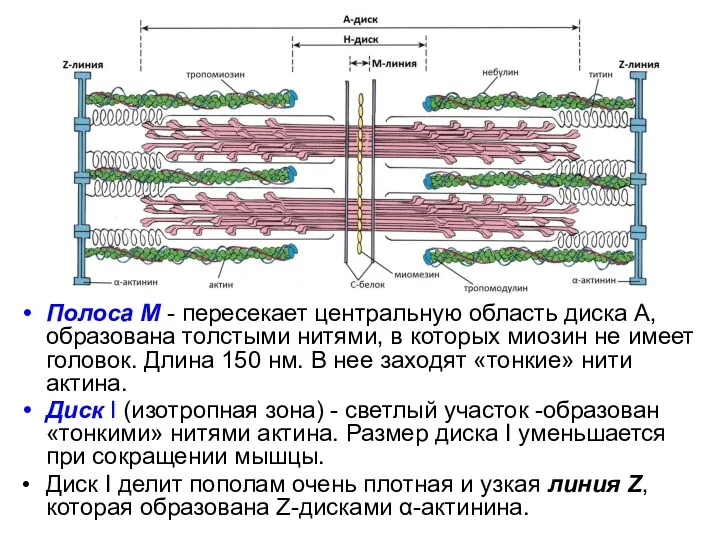
- 30. Полоса М - пересекает центральную область диска А, образована толстыми нитями, в которых миозин не имеет
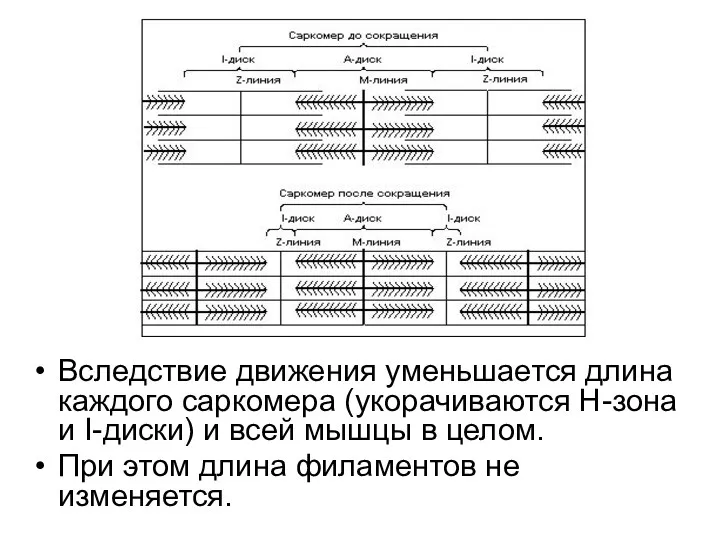
- 31. Вследствие движения уменьшается длина каждого саркомера (укорачиваются Н-зона и I-диски) и всей мышцы в целом. При
- 32. В скелетной мышечной ткани саркомеры миофибрилл располагаются параллельно. За счет этого на срезах скелетные мышцы выглядят
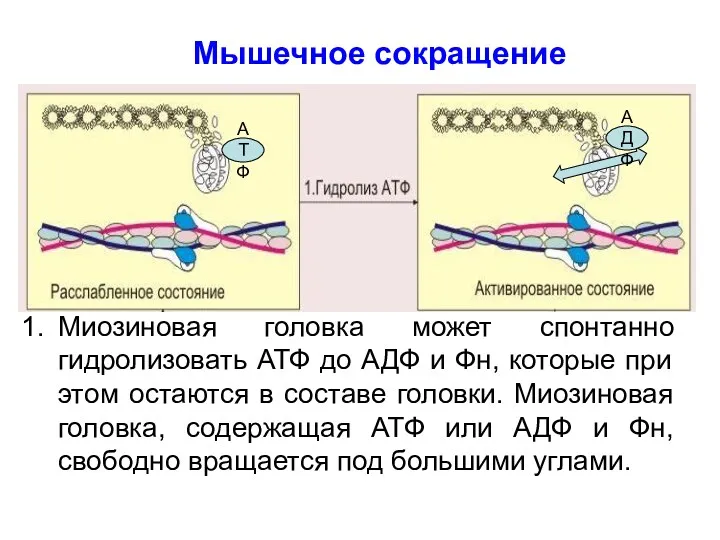
- 33. Миозиновая головка может спонтанно гидролизовать АТФ до АДФ и Фн, которые при этом остаются в составе
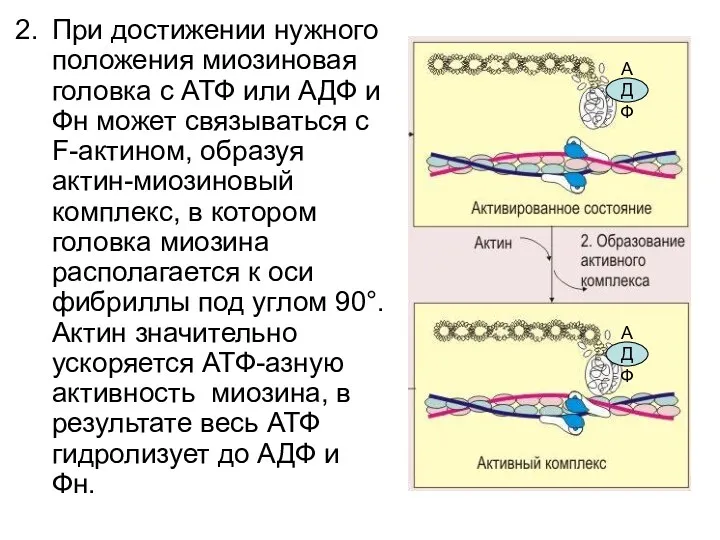
- 34. При достижении нужного положения миозиновая головка с АТФ или АДФ и Фн может связываться с F-актином,
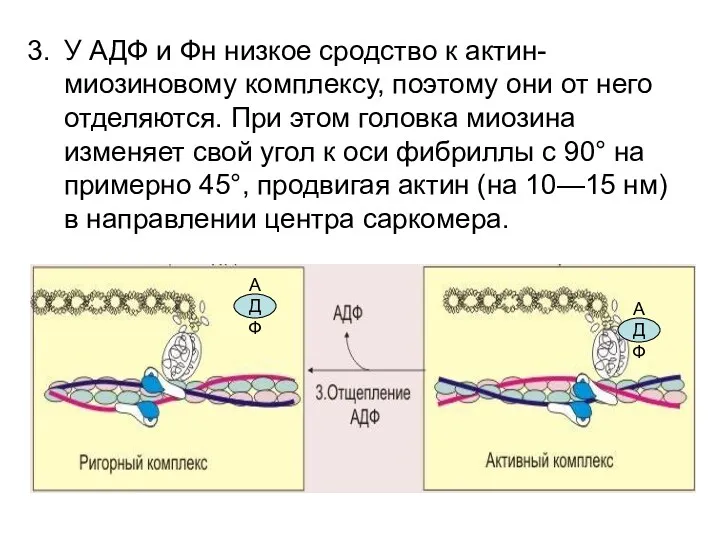
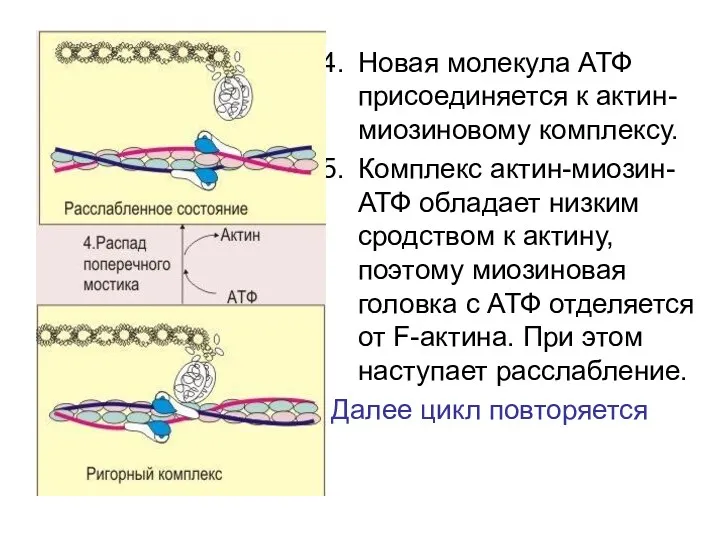
- 35. У АДФ и Фн низкое сродство к актин-миозиновому комплексу, поэтому они от него отделяются. При этом
- 36. Новая молекула АТФ присоединяется к актин-миозиновому комплексу. Комплекс актин-миозин-АТФ обладает низким сродством к актину, поэтому миозиновая
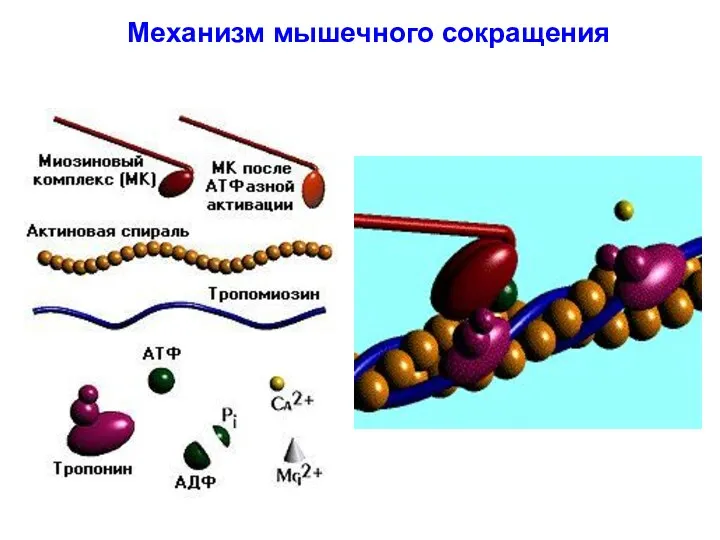
- 37. Механизм мышечного сокращения
- 38. Регуляция сокращения и расслабления мышц Любое мышечное сокращение опосредуется Са2+. Кальциевые насосы постоянно перекачивают Са2+ из
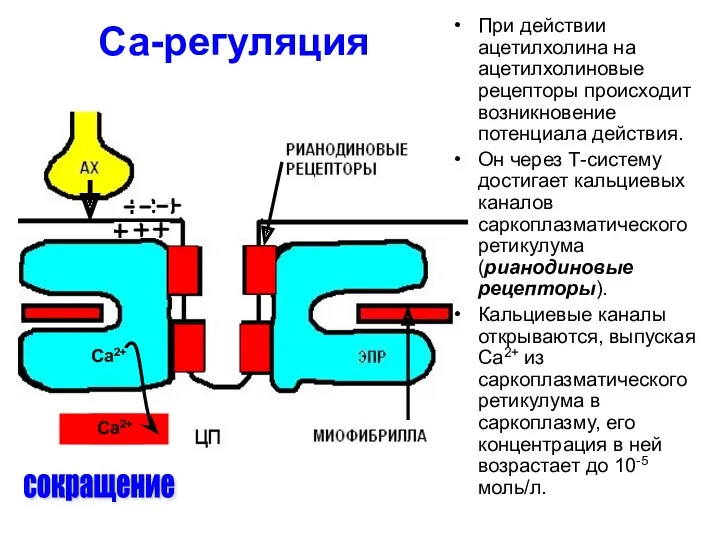
- 39. Са-регуляция сокращение При действии ацетилхолина на ацетилхолиновые рецепторы происходит возникновение потенциала действия. Он через Т-систему достигает
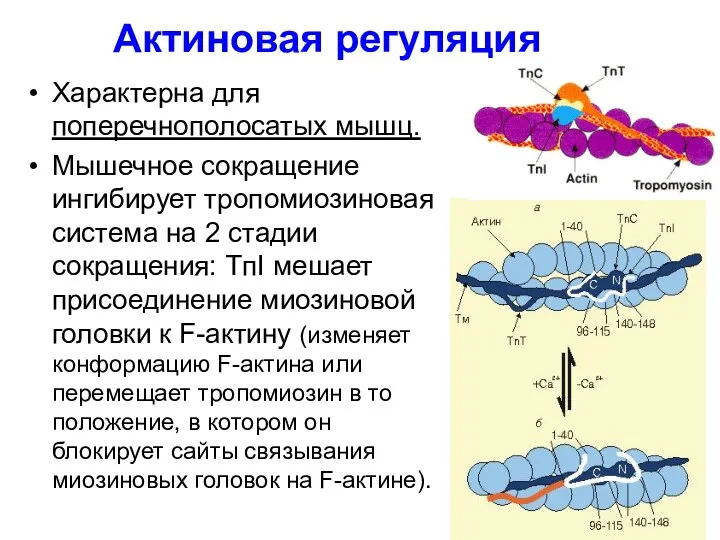
- 40. Актиновая регуляция Характерна для поперечнополосатых мышц. Мышечное сокращение ингибирует тропомиозиновая система на 2 стадии сокращения: TпI
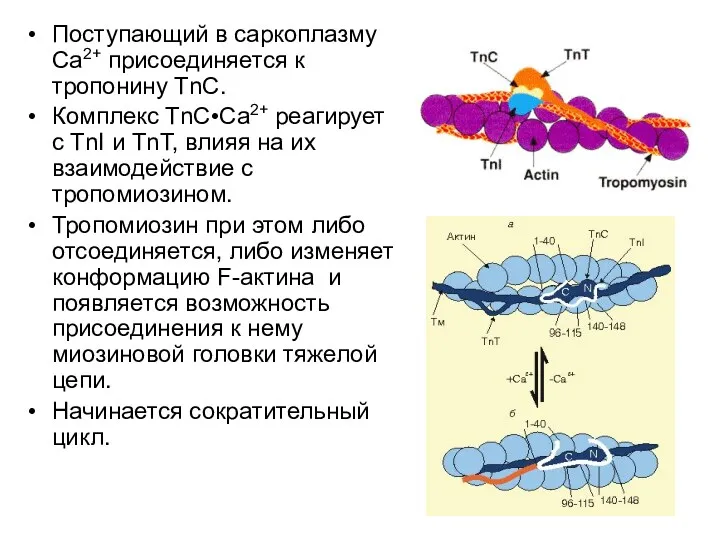
- 41. Поступающий в саркоплазму Са2+ присоединяется к тропонину ТnС. Комплекс ТnС•Са2+ реагирует с TnI и ТnТ, влияя
- 42. Расслабление происходит, когда: 1) При перекачке Са2+ в ЭПР его содержание в саркоплазме падает ниже 10-7
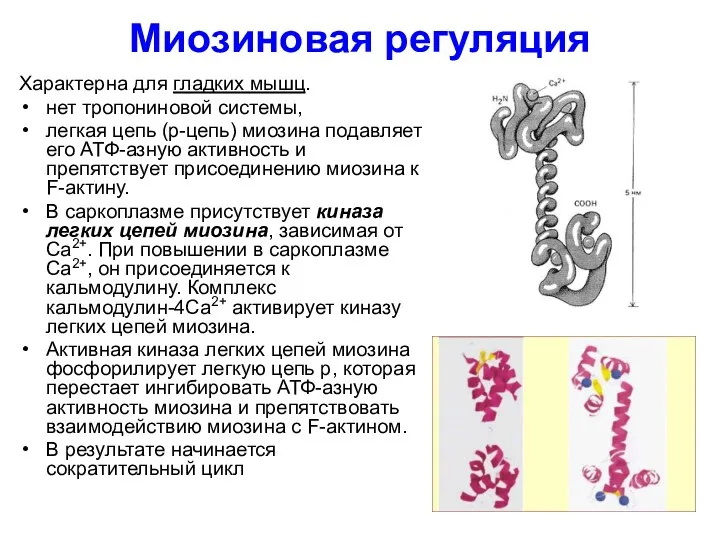
- 43. Миозиновая регуляция Характерна для гладких мышц. нет тропониновой системы, легкая цепь (р-цепь) миозина подавляет его АТФ-азную
- 44. Расслабление гладких мышц происходит, когда: 1) содержание ионов Са2+ в саркоплазме падает ниже 10-7 моль/л 2)
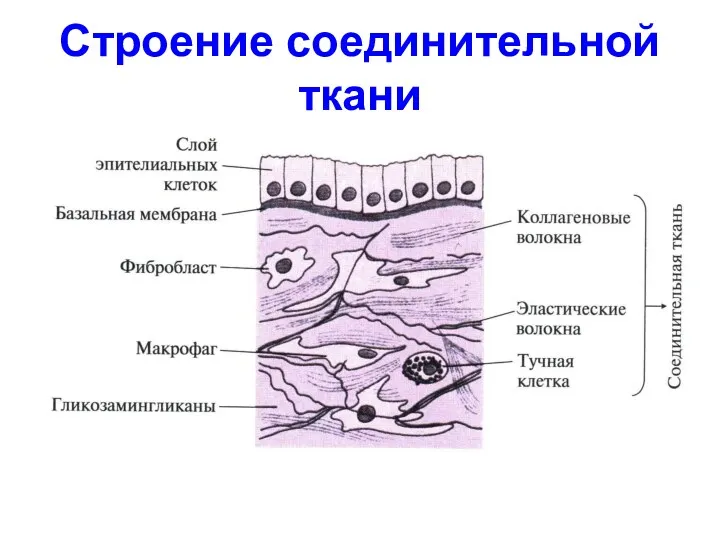
- 45. Строение соединительной ткани
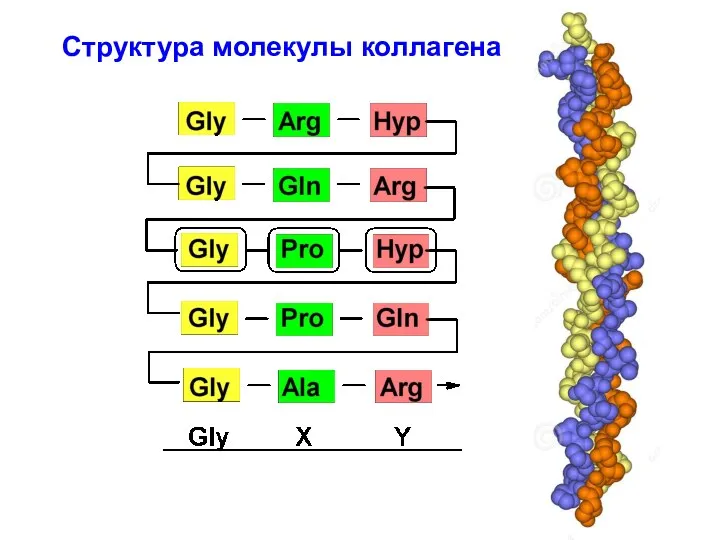
- 46. Структура молекулы коллагена
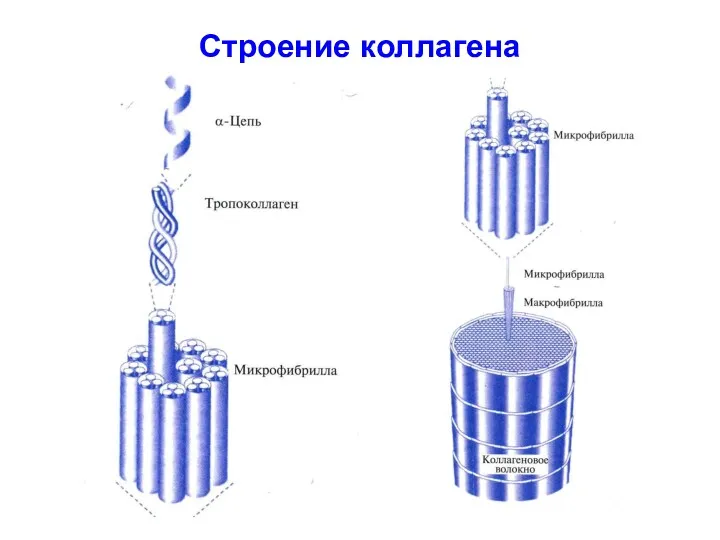
- 47. Строение коллагена
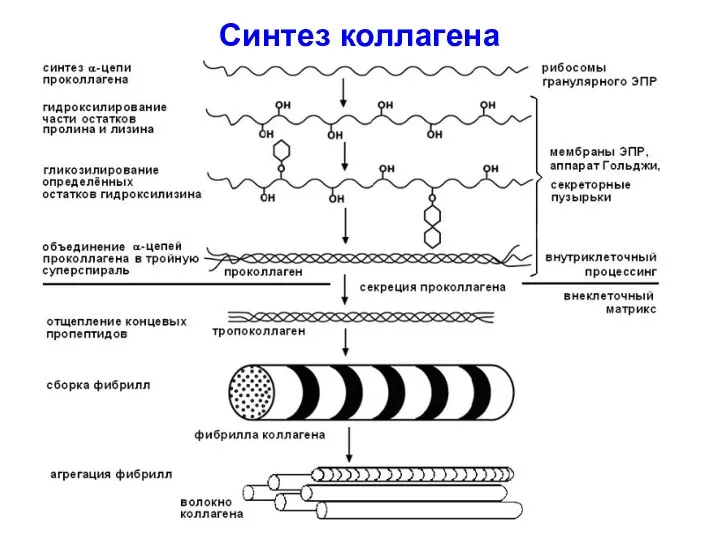
- 48. Синтез коллагена
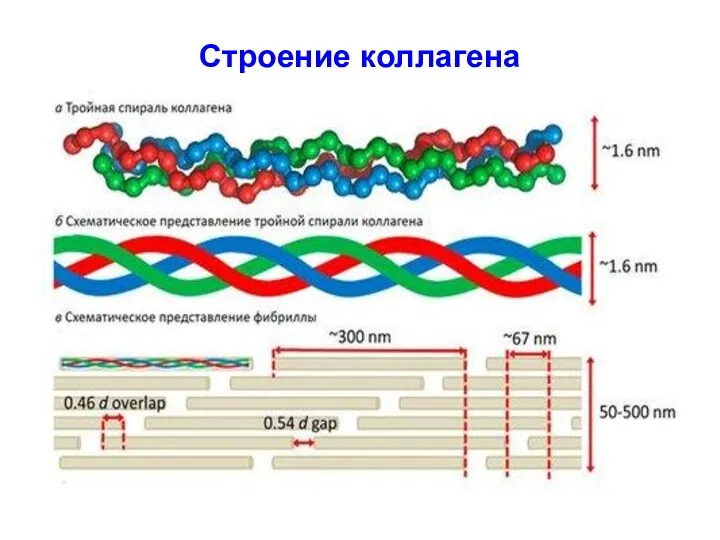
- 49. Строение коллагена
- 50. Гидролиз коллагена
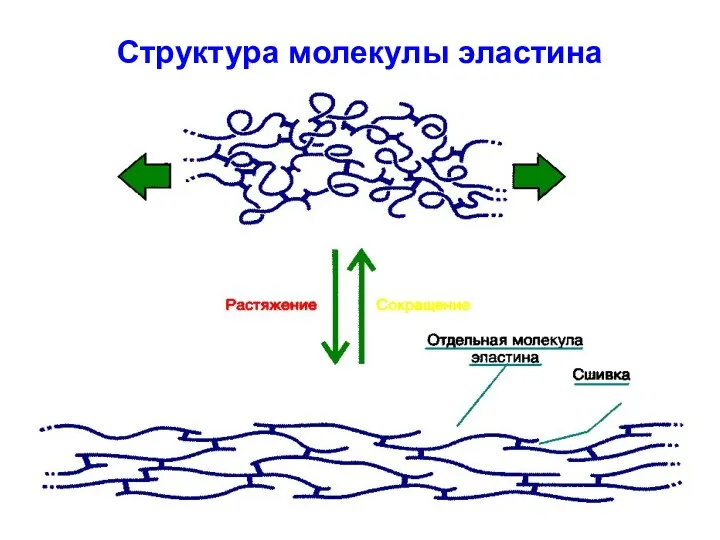
- 51. Структура молекулы эластина
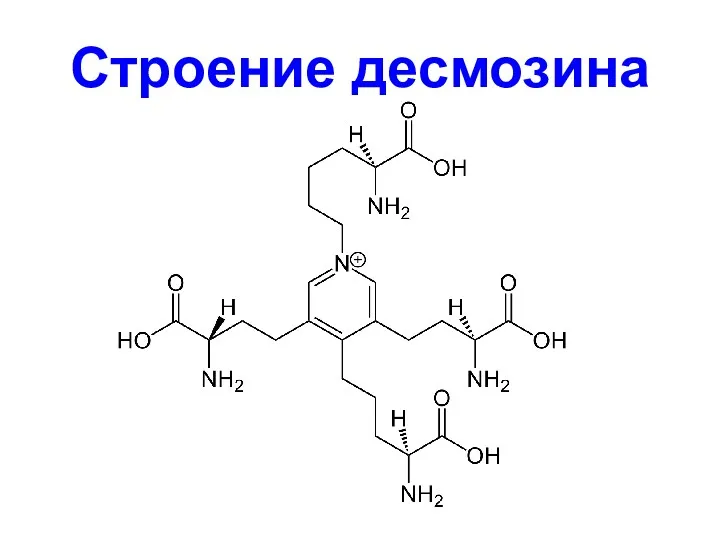
- 52. Строение десмозина
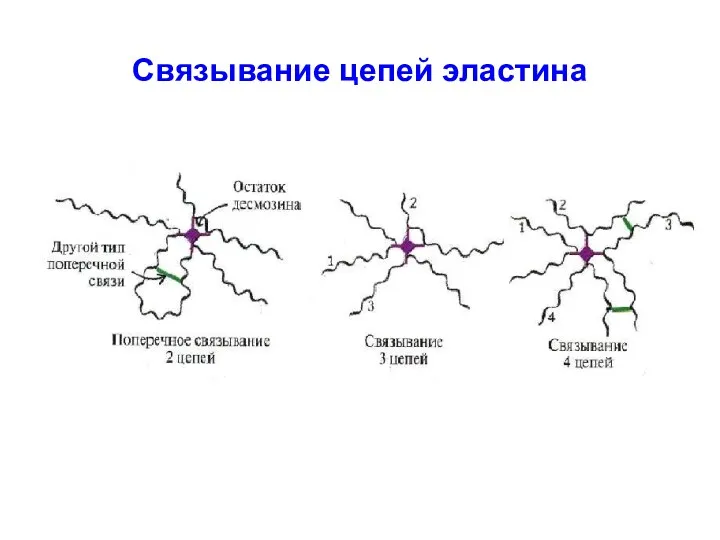
- 53. Связывание цепей эластина
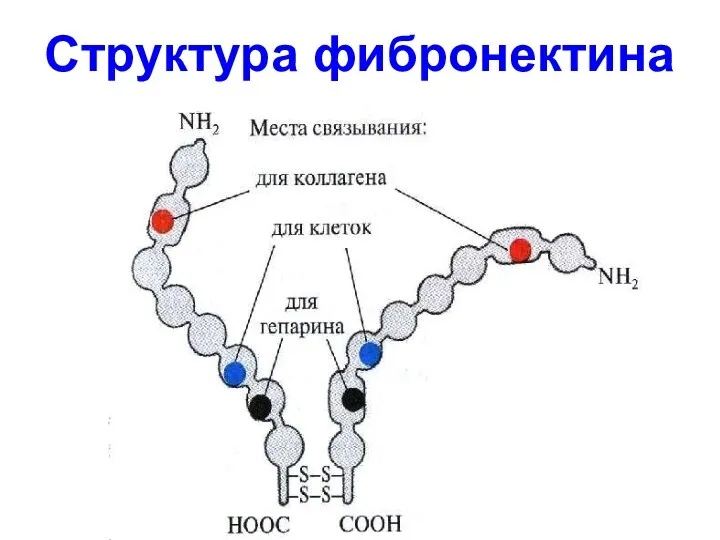
- 54. Структура фибронектина
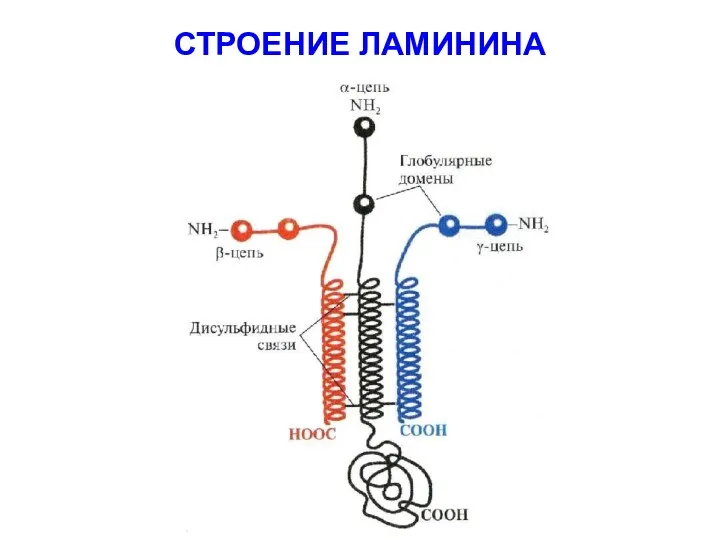
- 55. СТРОЕНИЕ ЛАМИНИНА
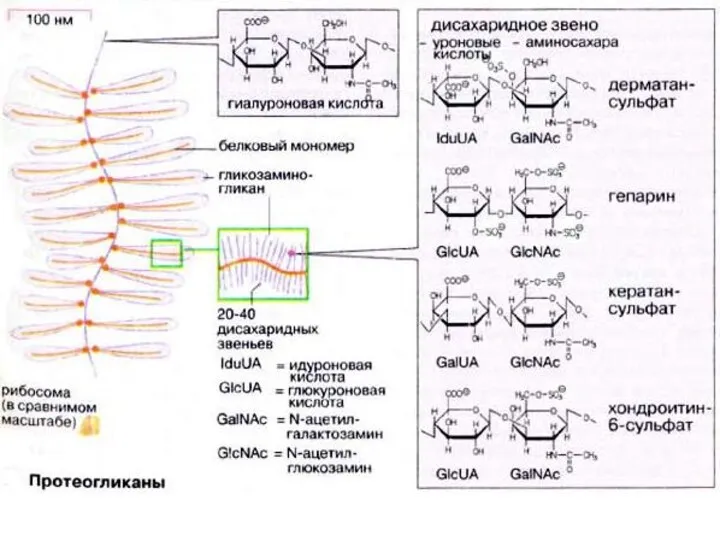
- 56. Гликозоаминогликаны Молекулы гликозаминогликанов состоят из повторяющихся звеньев, которые построены из остатков уроновых кислотМолекулы гликозаминогликанов состоят из
- 57. Гликозаминогликаны подразделяются на семь основных типов гиалуроновые кислоты хондроитин-4-сульфат хондроитин-6-сульфат дерматансульфат гепарин гепарансульфат
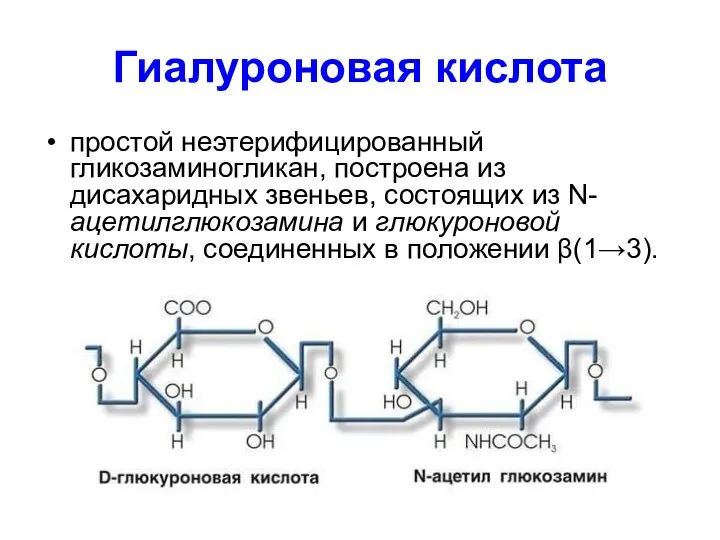
- 58. Гиалуроновая кислота простой неэтерифицированный гликозаминогликан, построена из дисахаридных звеньев, состоящих из N-ацетилглюкозамина и глюкуроновой кислоты, соединенных
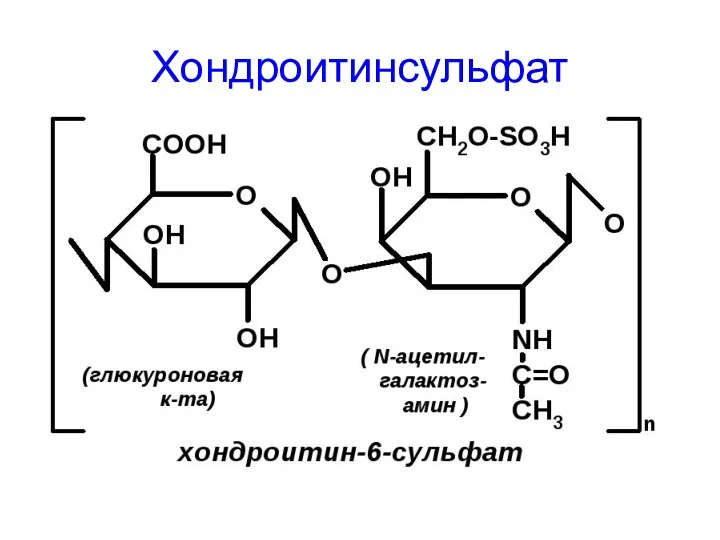
- 59. Хондроитинсульфат
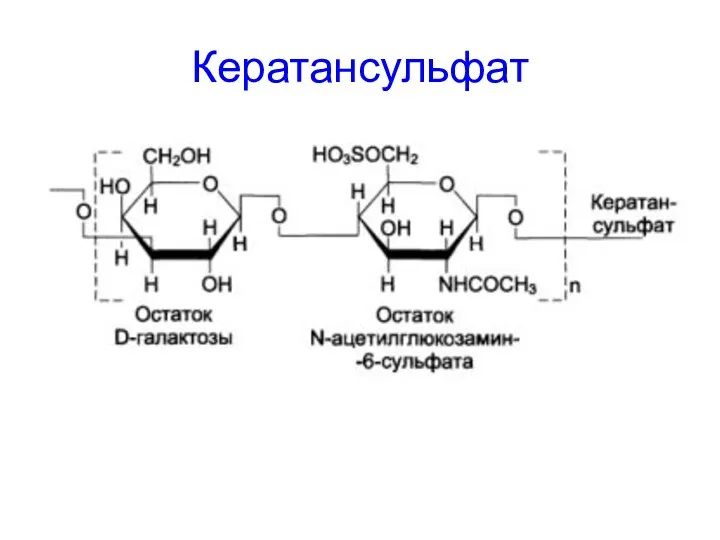
- 60. Кератансульфат
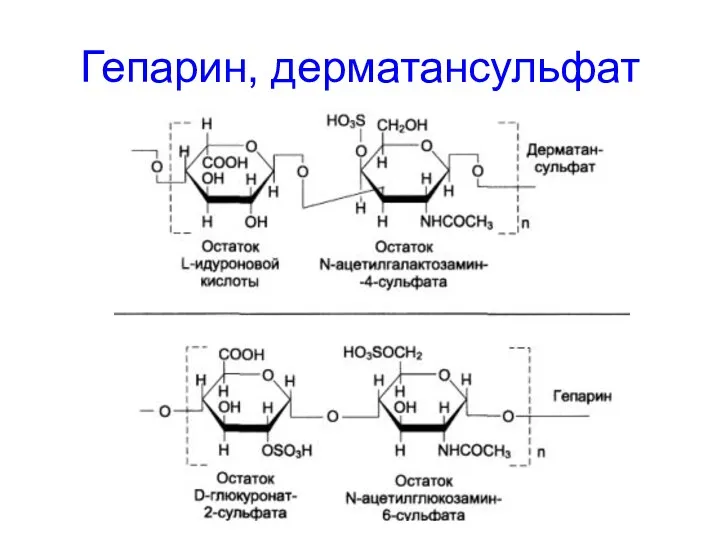
- 61. Гепарин, дерматансульфат
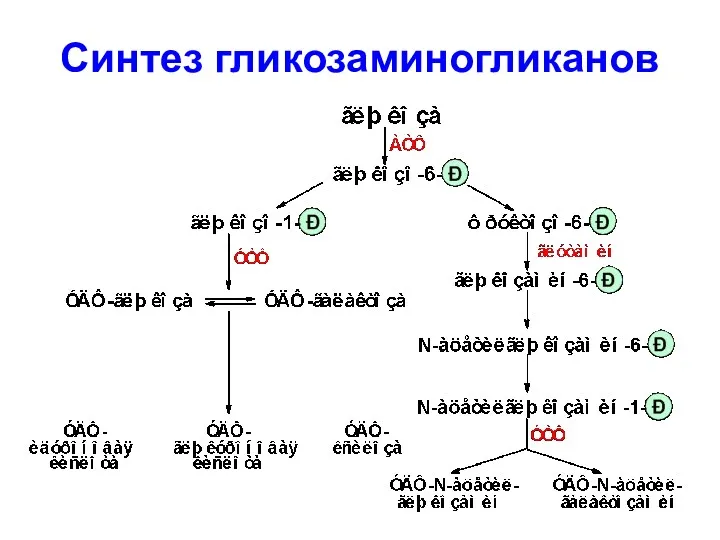
- 62. Синтез гликозаминогликанов
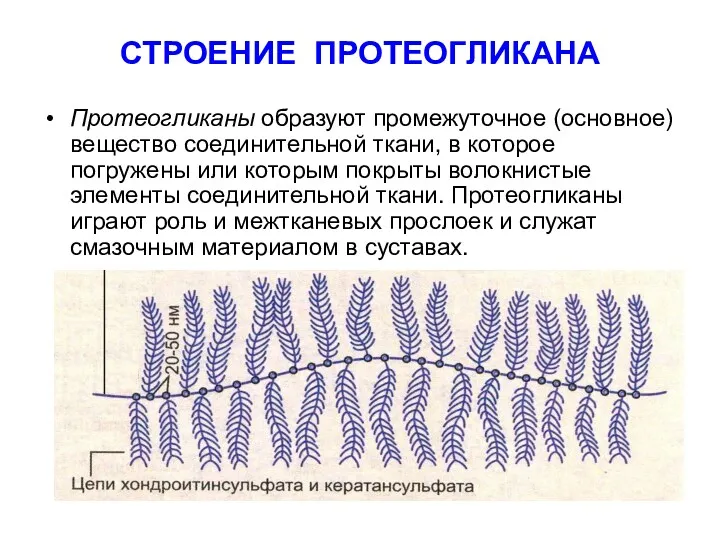
- 63. СТРОЕНИЕ ПРОТЕОГЛИКАНА Протеогликаны образуют промежуточное (основное) вещество соединительной ткани, в которое погружены или которым покрыты волокнистые
- 65. Биохимические показатели крови и мочи, отражающие функциональное состояние мышечной ткани Аминотрансферазы -диагностика патологии печени и миокарда.
- 66. Тропонин Т -маркер инфаркта миокарда в острой и подострой фазе. Миоглобин -маркер деструктивных изменений в мышечной
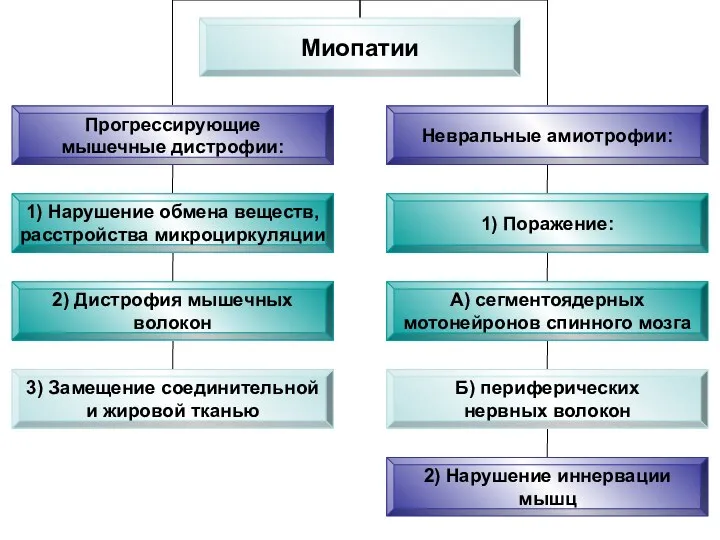
- 67. Миопатии (греч. mys, myos мышца + pathos страдание, болезнь) - нервно-мышечные заболевания, характеризующиеся развитием первичного дистрофического
- 69. БИОХИМИЧЕСКИЕ ИЗМЕНЕНИЯ В МЫШЦАХ ПРИ ПАТОЛОГИИ: снижение содержания миофибриллярных белков возрастание концентрации белков стромы и некоторых
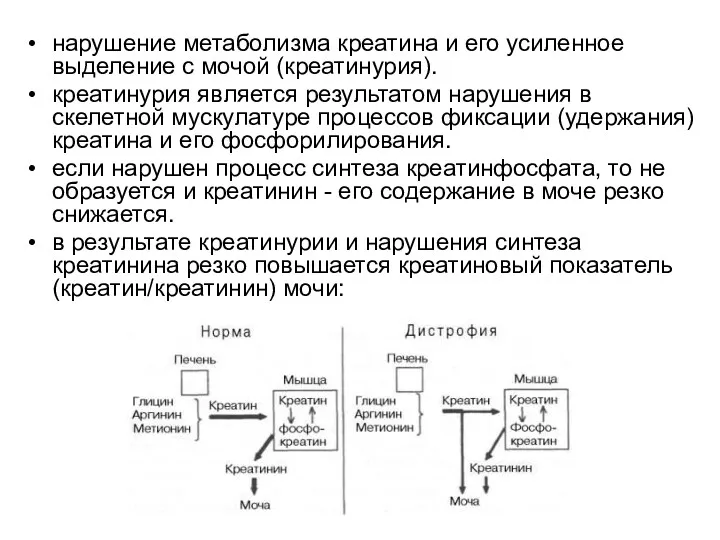
- 70. нарушение метаболизма креатина и его усиленное выделение с мочой (креатинурия). креатинурия является результатом нарушения в скелетной
- 71. Изменение активности ферментов в мышцах: уменьшается активность ферментов, локализованных в саркоплазме изменяется активность ферментов, связанных с
- 73. Скачать презентацию

























 Личинки животных
Личинки животных Ч.Дарвиннің. Жердегі тіршіліктің эволюциясы теориясының негізгі қағидалары,эволюцияның синтетикалық теориясы
Ч.Дарвиннің. Жердегі тіршіліктің эволюциясы теориясының негізгі қағидалары,эволюцияның синтетикалық теориясы Для нимфальной стадии клеща
Для нимфальной стадии клеща Физиология и биохимия микроорганизмов
Физиология и биохимия микроорганизмов Нервная система. Спинной мозг. Рефлектроная дуга
Нервная система. Спинной мозг. Рефлектроная дуга Выделение. Мочевыделительная система
Выделение. Мочевыделительная система Болезни овощей и фруктов
Болезни овощей и фруктов Надтип Amera. Тип Моллюски, или мягкотелые MOLLUSCA
Надтип Amera. Тип Моллюски, или мягкотелые MOLLUSCA Сон-трава или прострел раскрытый
Сон-трава или прострел раскрытый Передвижение веществ в организме растения
Передвижение веществ в организме растения Развитие тутового шелкопряда
Развитие тутового шелкопряда Царство Растения
Царство Растения Теория существования прокариот
Теория существования прокариот Как появился человек на Земле
Как появился человек на Земле Травы и цветы полей и лугов
Травы и цветы полей и лугов Класс двудольные. Класс однодольные. 6 класс
Класс двудольные. Класс однодольные. 6 класс Условия полноценного развития системы кровообращения
Условия полноценного развития системы кровообращения Железы внутренней и смешанной секреции
Железы внутренней и смешанной секреции Влияние музыки на растения
Влияние музыки на растения Тип Моллюски
Тип Моллюски Закономерности изменчивости
Закономерности изменчивости Кровеносная система
Кровеносная система Polymers and amino acids
Polymers and amino acids Пауки и паутина. Рисование паутины пауков
Пауки и паутина. Рисование паутины пауков Питание китов
Питание китов Презентация по биологии 8 класс темы Внутренняя среда организма
Презентация по биологии 8 класс темы Внутренняя среда организма Генетика пола. Наследование,сцепленное с полом
Генетика пола. Наследование,сцепленное с полом Системна радіобіологія: від молекули до організму. Системна радіобіологія: від організму до популяції
Системна радіобіологія: від молекули до організму. Системна радіобіологія: від організму до популяції