Содержание
- 2. Механизмы репарации Репарация – Процесс, позволяющий живым организмам восстанавливать повреждения, возникающие в ДНК. Оказывается возможной благодаря
- 3. Историческая справка 1927 – H. Muller: рентгеновские лучи индуцируют мутации 1928 – F. Gates: УФ излучение
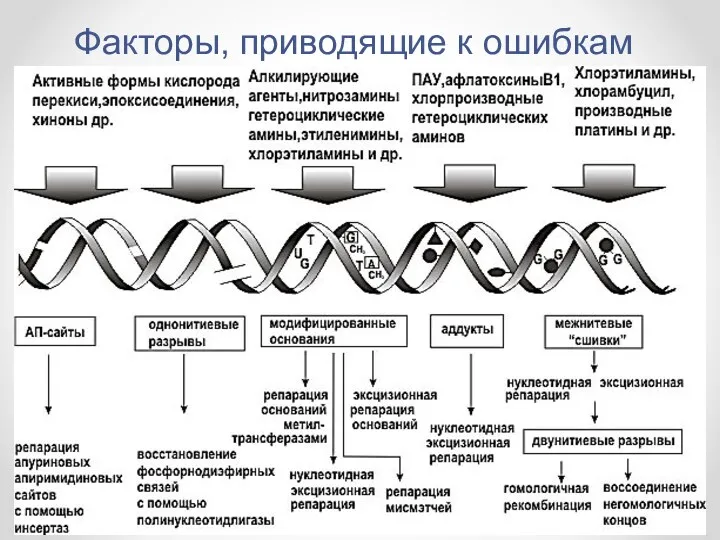
- 4. Факторы, приводящие к ошибкам
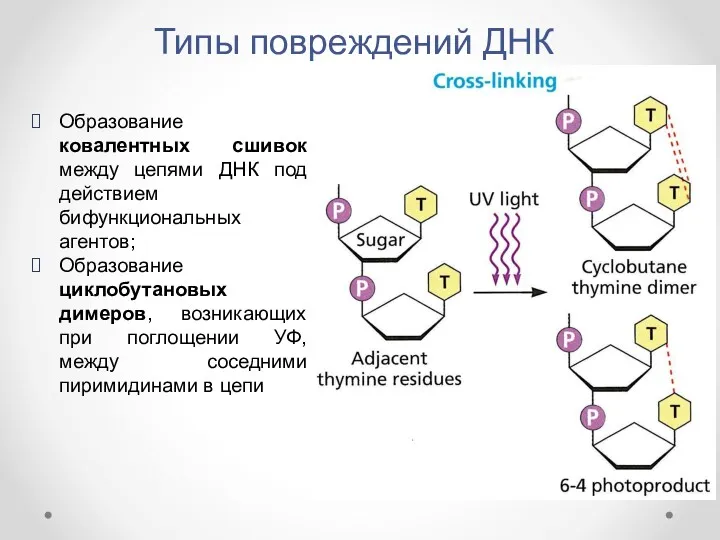
- 5. Типы повреждений ДНК Образование ковалентных сшивок между цепями ДНК под действием бифункциональных агентов; Образование циклобутановых димеров,
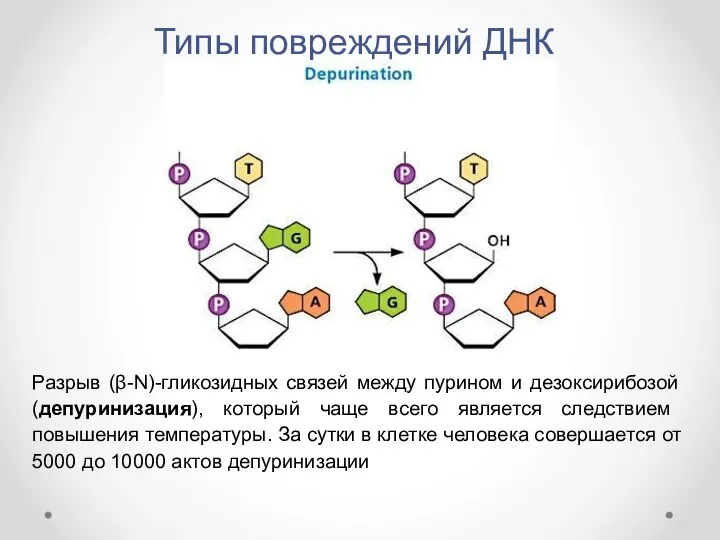
- 6. Типы повреждений ДНК Разрыв (β-N)-гликозидных связей между пурином и дезоксирибозой (депуринизация), который чаще всего является следствием
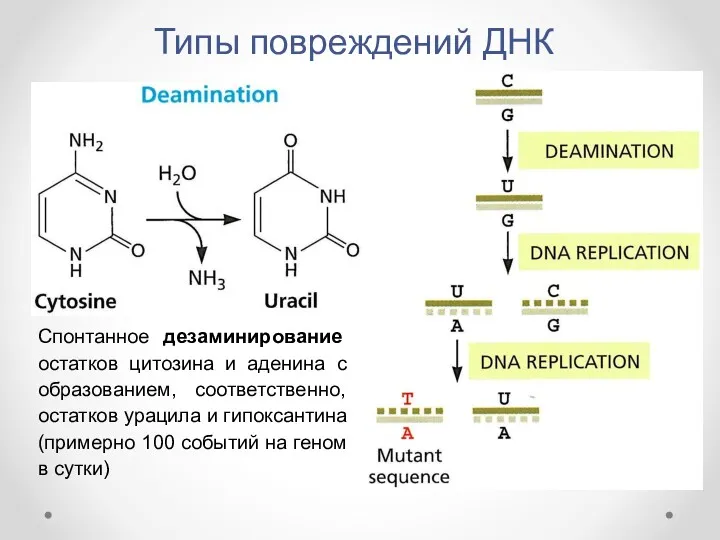
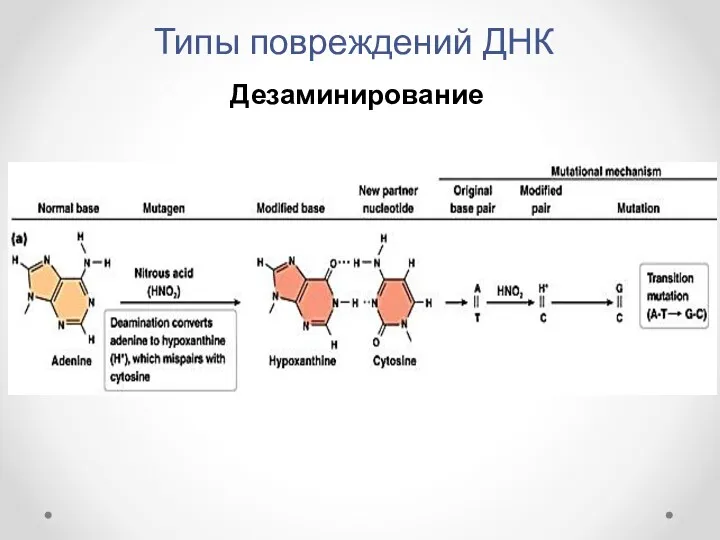
- 7. Типы повреждений ДНК Спонтанное дезаминирование остатков цитозина и аденина с образованием, соответственно, остатков урацила и гипоксантина
- 8. Типы повреждений ДНК Дезаминирование
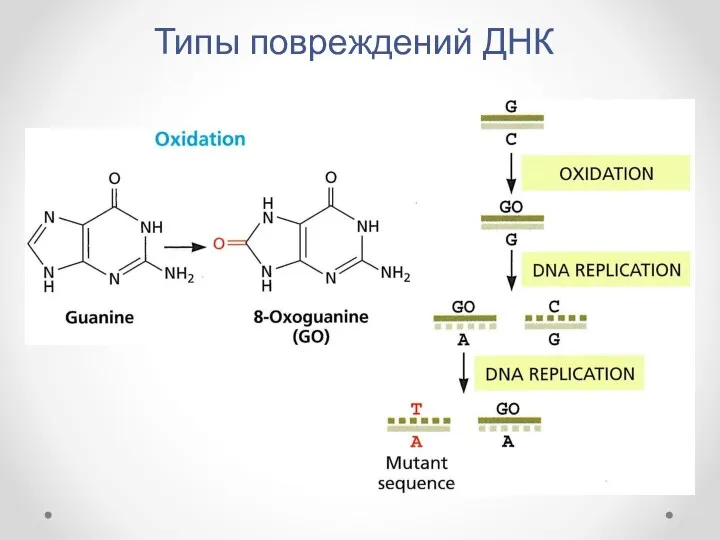
- 9. Типы повреждений ДНК
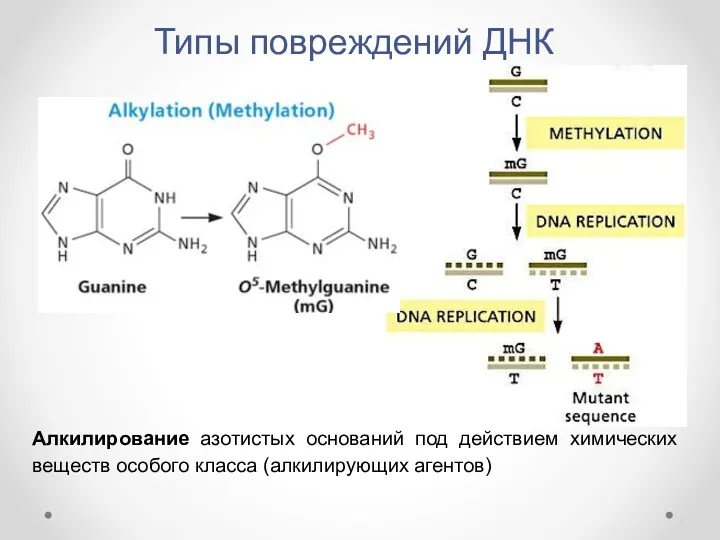
- 10. Типы повреждений ДНК Алкилирование азотистых оснований под действием химических веществ особого класса (алкилирующих агентов)
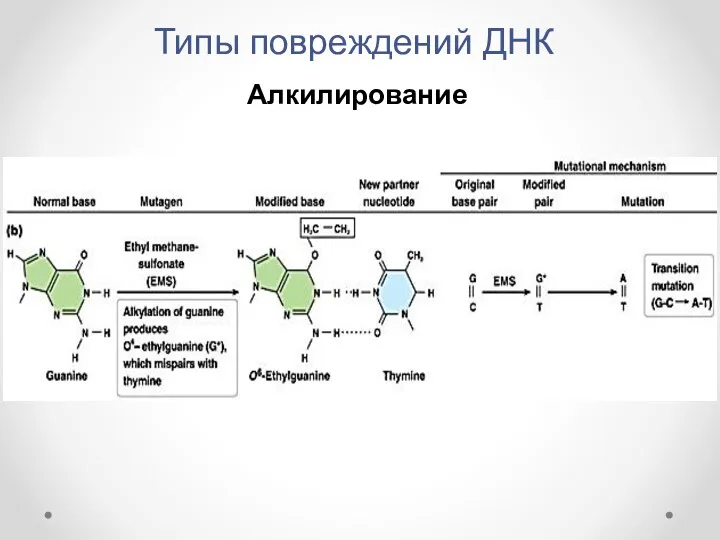
- 11. Типы повреждений ДНК Алкилирование
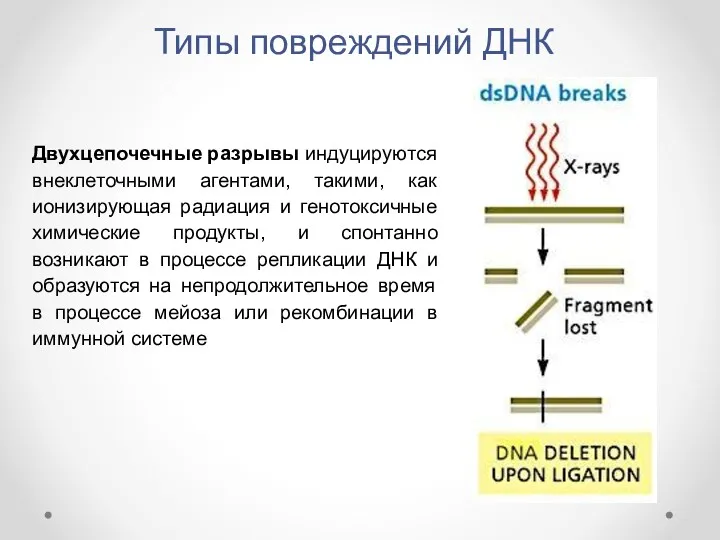
- 12. Типы повреждений ДНК Двухцепочечные разрывы индуцируются внеклеточными агентами, такими, как ионизирующая радиация и генотоксичные химические продукты,
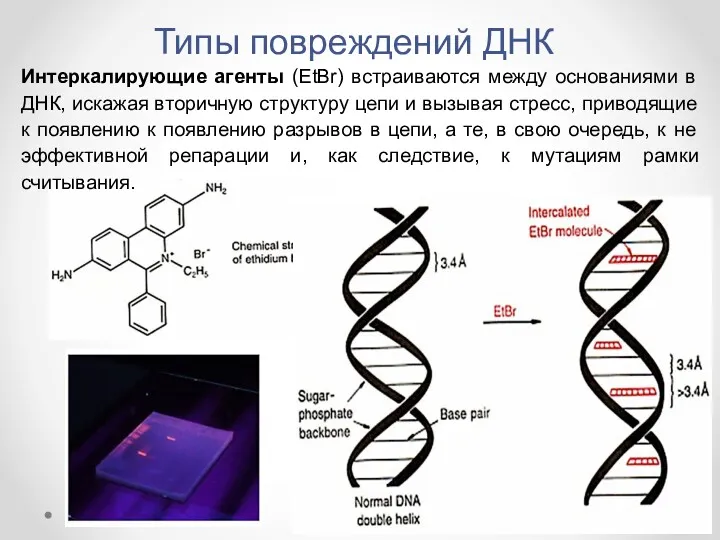
- 13. Интеркалирующие агенты (EtBr) встраиваются между основаниями в ДНК, искажая вторичную структуру цепи и вызывая стресс, приводящие
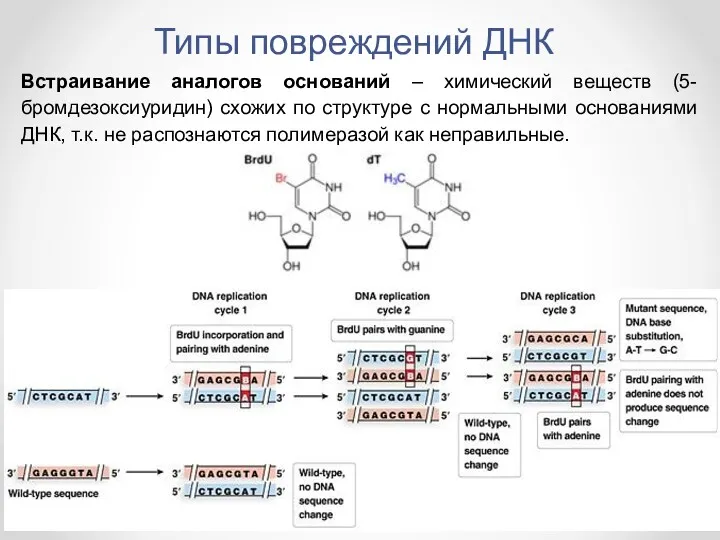
- 14. Встраивание аналогов оснований – химический веществ (5-бромдезоксиуридин) схожих по структуре с нормальными основаниями ДНК, т.к. не
- 15. Пути и механизмы репарации
- 16. Пути и механизмы репарации Желтым отмечены классические пути репарации, приводящие к восстановлению структуры ДНК с ошибками
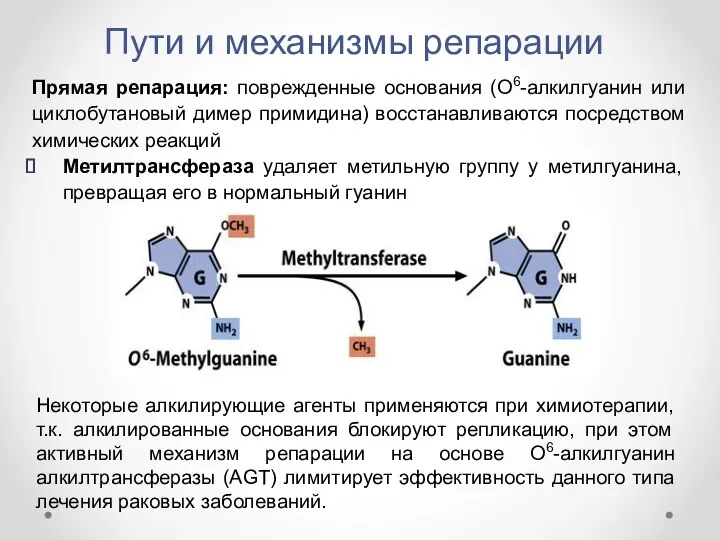
- 17. Пути и механизмы репарации Прямая репарация: поврежденные основания (О6-алкилгуанин или циклобутановый димер примидина) восстанавливаются посредством химических
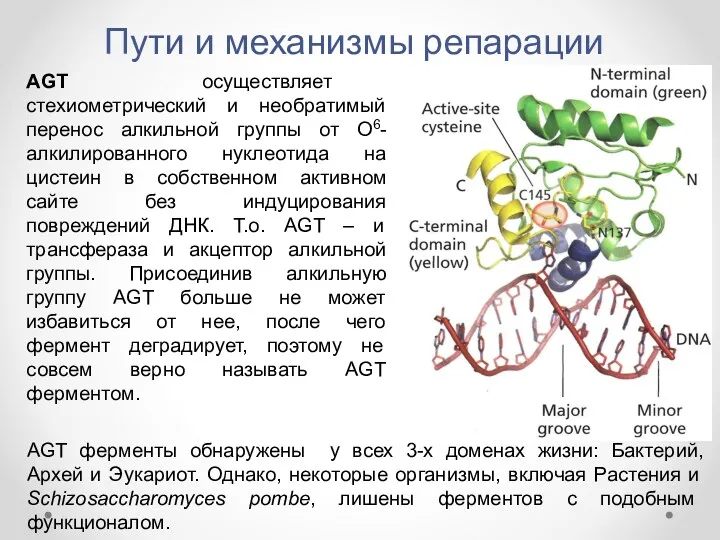
- 18. Пути и механизмы репарации AGT осуществляет стехиометрический и необратимый перенос алкильной группы от О6-алкилированного нуклеотида на
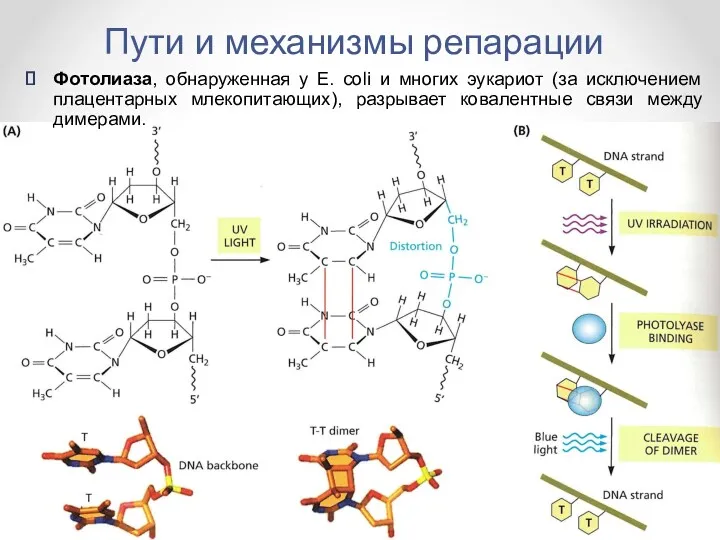
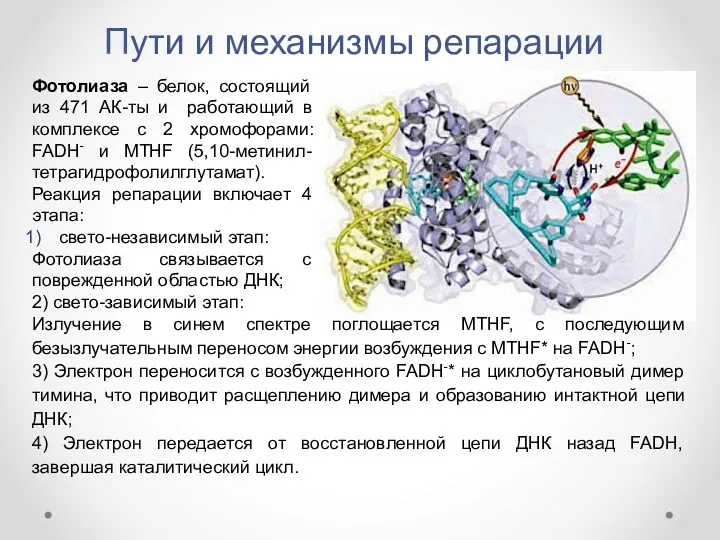
- 19. Пути и механизмы репарации Фотолиаза, обнаруженная у E. coli и многих эукариот (за исключением плацентарных млекопитающих),
- 20. Пути и механизмы репарации Излучение в синем спектре поглощается MTHF, с последующим безызлучательным переносом энергии возбуждения
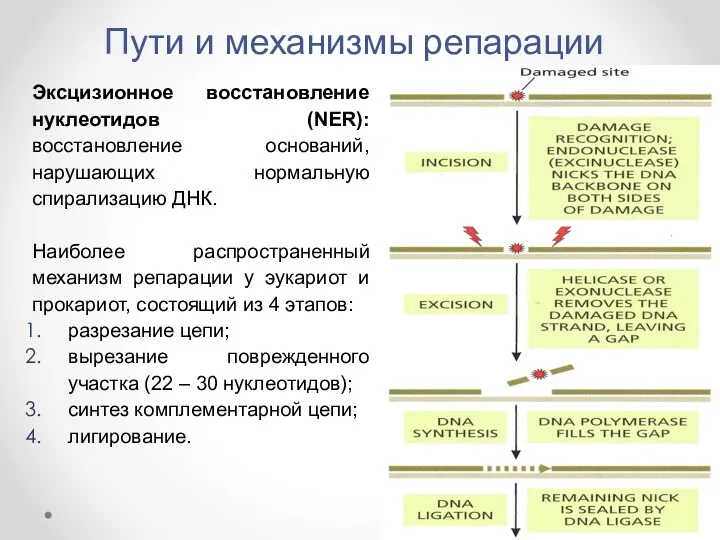
- 21. Пути и механизмы репарации Эксцизионное восстановление нуклеотидов (NER): восстановление оснований, нарушающих нормальную спирализацию ДНК. Наиболее распространенный
- 22. Пути и механизмы репарации NER может осуществляться двумя путями. В первом случае происходит гидролиз фосфодиэфирной связи
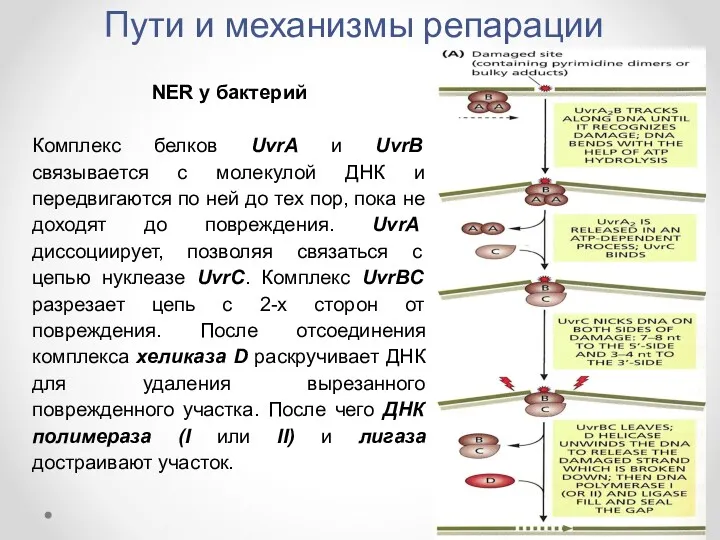
- 23. Пути и механизмы репарации NER у бактерий Комплекс белков UvrA и UvrB связывается с молекулой ДНК
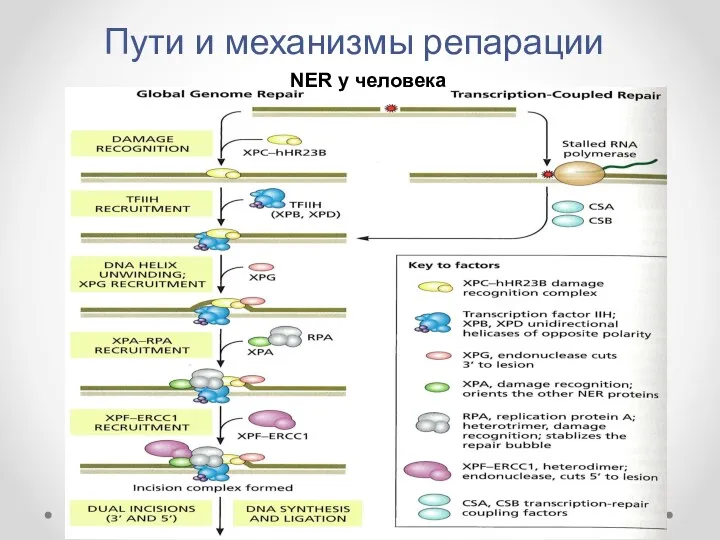
- 24. Пути и механизмы репарации NER у эукариот: Global genome repair (GGR) Transcription-coupled repair (TCR). Направлены на
- 25. Пути и механизмы репарации NER у эукариот: Global genome repair (GGR) Transcription-coupled repair (TCR). Наличие повреждений
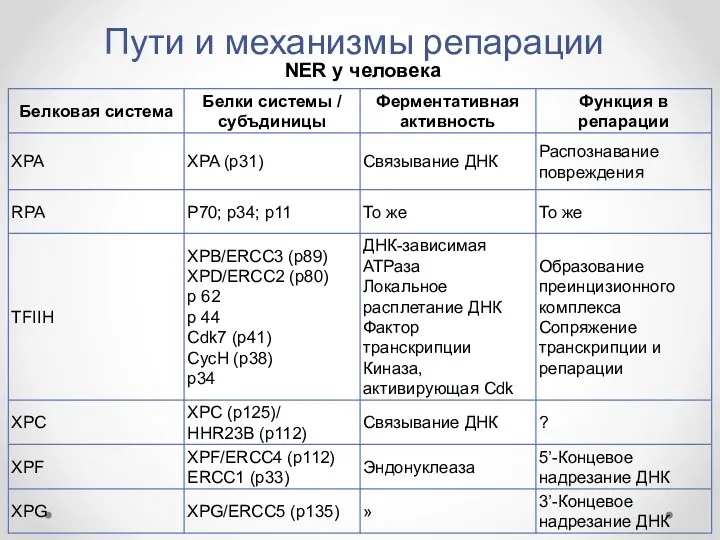
- 26. Пути и механизмы репарации NER у человека на примере пигментной ксеродермы (XP). Анализ различных клеточных линий
- 27. Пути и механизмы репарации NER у человека
- 28. Пути и механизмы репарации NER у человека
- 29. Пути и механизмы репарации NER у человека
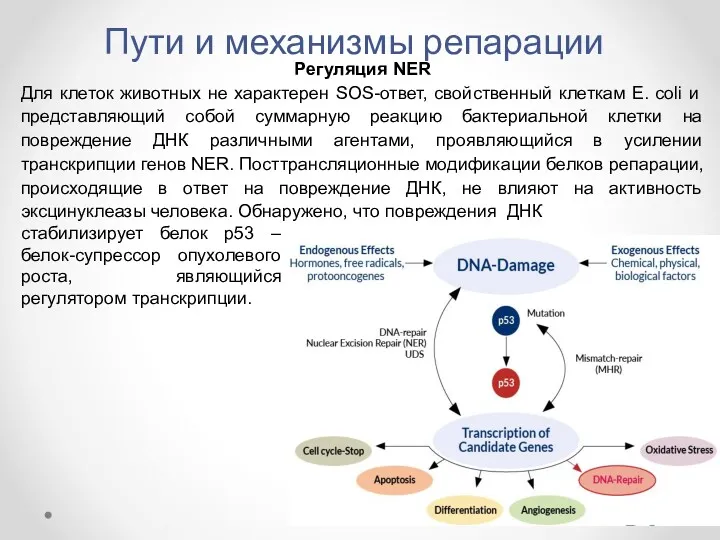
- 30. Пути и механизмы репарации Регуляция NER Для клеток животных не характерен SOS-ответ, свойственный клеткам E. coli
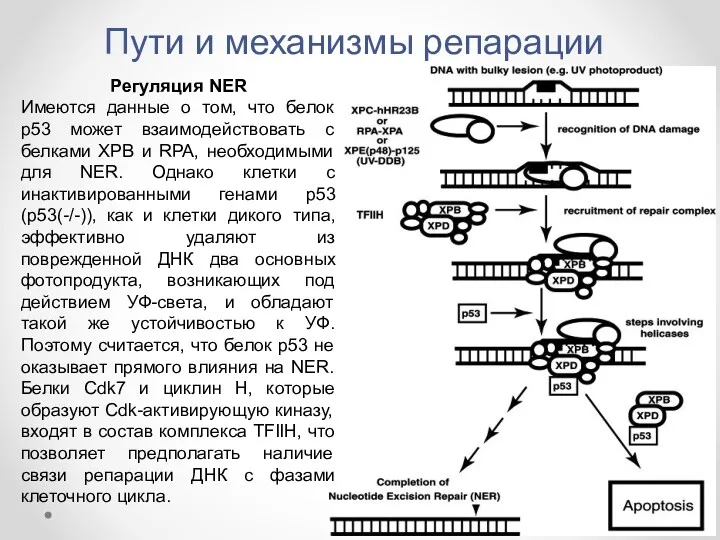
- 31. Пути и механизмы репарации Регуляция NER Имеются данные о том, что белок р53 может взаимодействовать с
- 32. Пути и механизмы репарации Эксцизионное восстановление оснований (NEB): удаление поврежденных оснований в следствие химических изменений оснований:
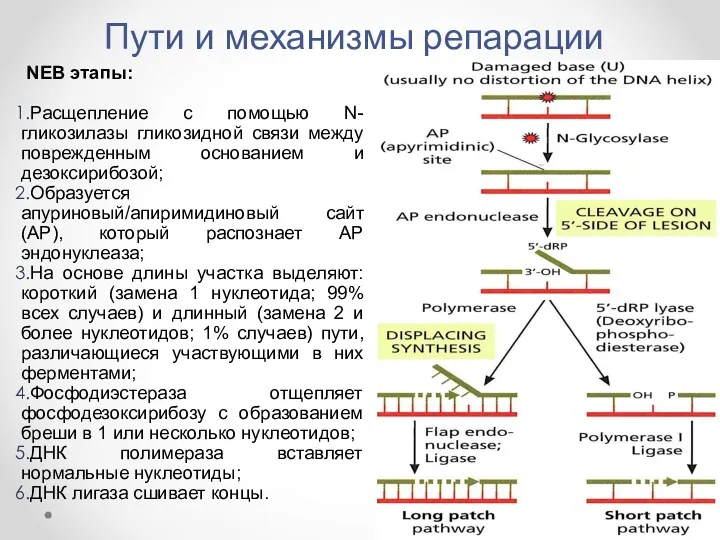
- 33. Пути и механизмы репарации NEB этапы: Расщепление с помощью N-гликозилазы гликозидной связи между поврежденным основанием и
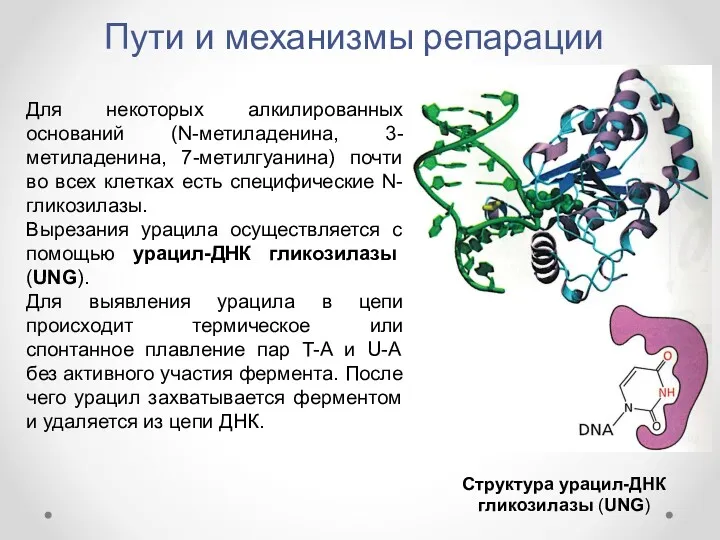
- 34. Пути и механизмы репарации Для некоторых алкилированных оснований (N-метиладенина, 3-метиладенина, 7-метилгуанина) почти во всех клетках есть
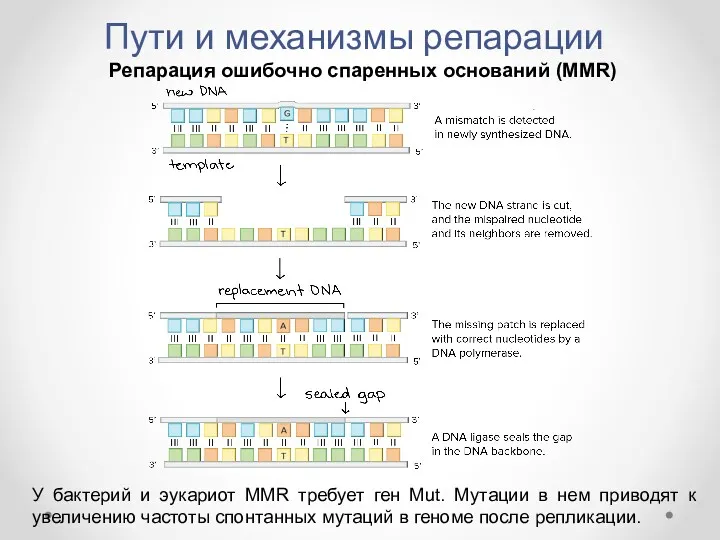
- 35. Пути и механизмы репарации Репарация ошибочно спаренных оснований (MMR) У бактерий и эукариот MMR требует ген
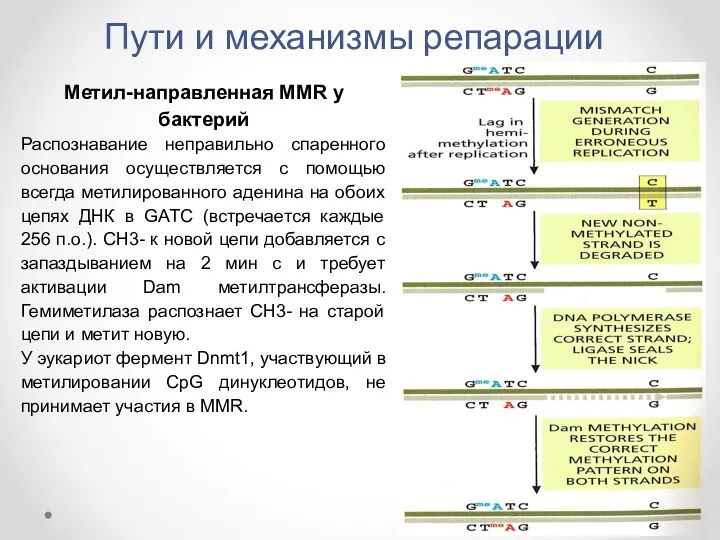
- 36. Пути и механизмы репарации Метил-направленная MMR у бактерий Распознавание неправильно спаренного основания осуществляется с помощью всегда
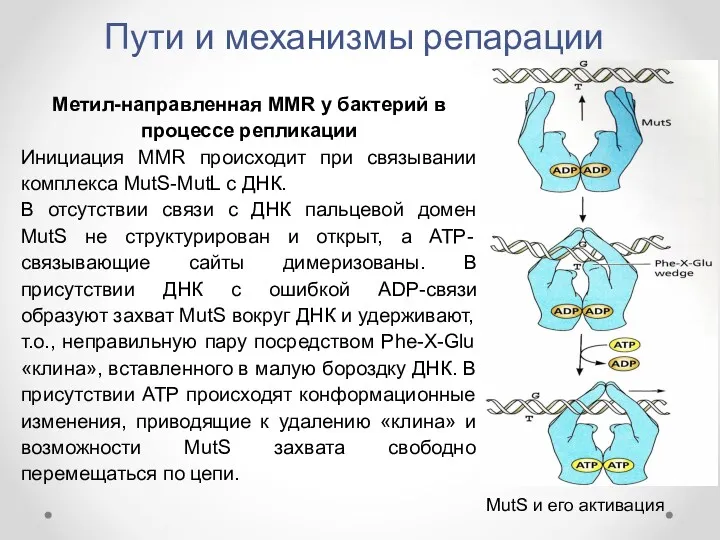
- 37. Пути и механизмы репарации Метил-направленная MMR у бактерий в процессе репликации Инициация MMR происходит при связывании
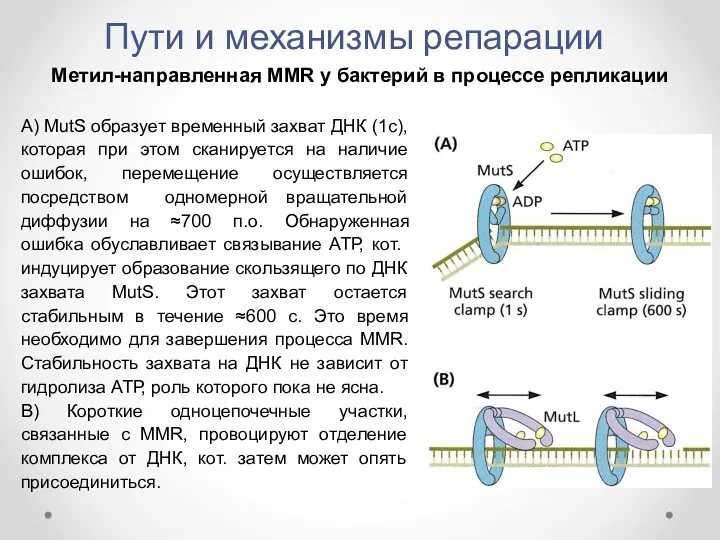
- 38. Пути и механизмы репарации Метил-направленная MMR у бактерий в процессе репликации А) MutS образует временный захват
- 39. Пути и механизмы репарации Метил-направленная MMR у бактерий в процессе репликации Инициация MMR происходит при связывании
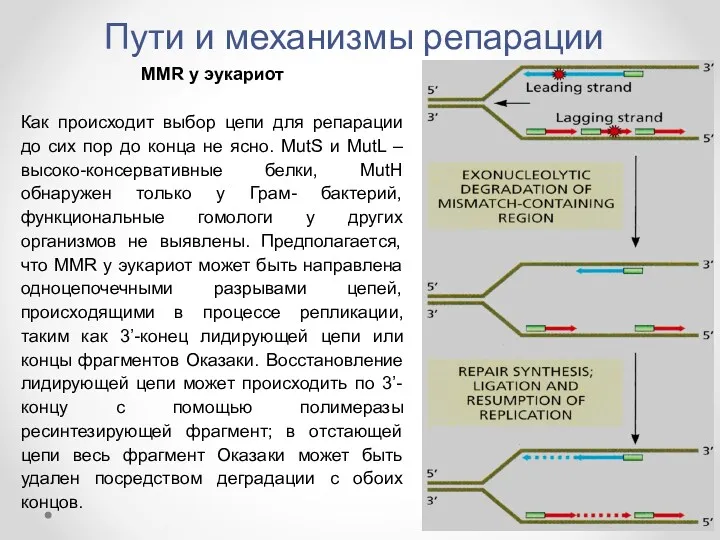
- 40. Пути и механизмы репарации MMR у эукариот Как происходит выбор цепи для репарации до сих пор
- 41. Пути и механизмы репарации MMR у эукариот Репарация инициируется при связывании неправильного основания с комплексами MutS
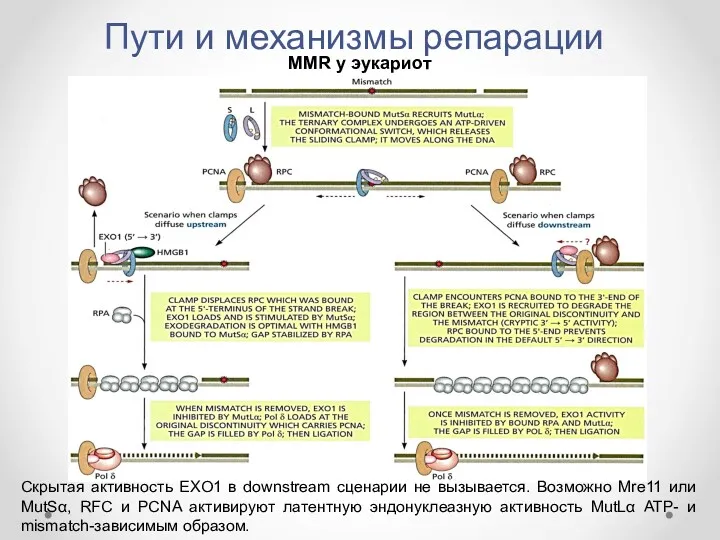
- 42. Пути и механизмы репарации MMR у эукариот Скрытая активность EXO1 в downstream сценарии не вызывается. Возможно
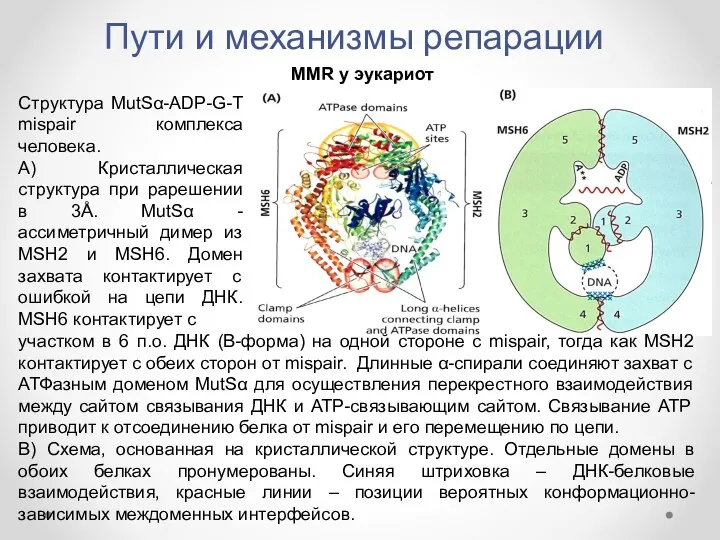
- 43. Пути и механизмы репарации MMR у эукариот Структура MutSα-ADP-G-T mispair комплекса человека. А) Кристаллическая структура при
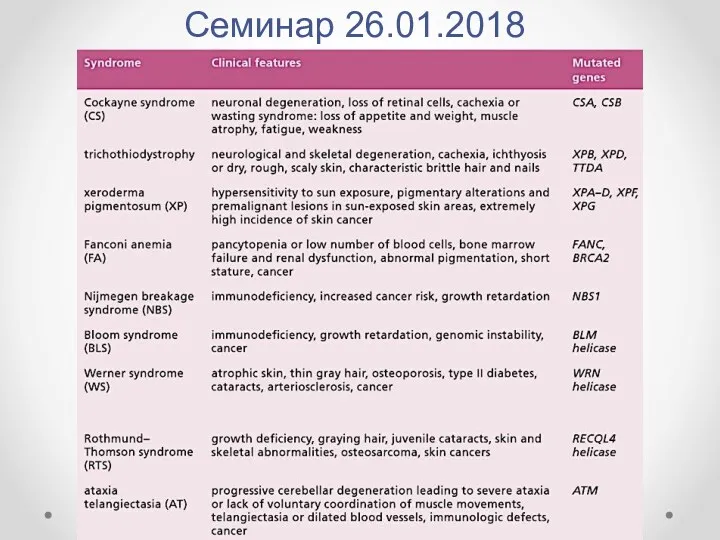
- 44. Семинар 26.01.2018
- 45. Спасибо за внимание!
- 47. Скачать презентацию













 Презентация к уроку на тему Видоизменение побегов в 6 классе
Презентация к уроку на тему Видоизменение побегов в 6 классе Презентация по биологии Гуморальная регуляция для 8 класса
Презентация по биологии Гуморальная регуляция для 8 класса Химический состав клетки
Химический состав клетки Статистические закономерности модификационной изменчивости
Статистические закономерности модификационной изменчивости Exotic animals
Exotic animals Виды корней и типы корневых систем
Виды корней и типы корневых систем Царство животные
Царство животные Презентация к уроку биологии Царство: грибы 6 класс Часть 1 Диск
Презентация к уроку биологии Царство: грибы 6 класс Часть 1 Диск Разнообразие растительного мира
Разнообразие растительного мира Редактирование генома
Редактирование генома Физиология дыхания. Газовый состав крови
Физиология дыхания. Газовый состав крови Органические вещества клетки. Углеводы. Часть 1. 10 класс
Органические вещества клетки. Углеводы. Часть 1. 10 класс Строение белков
Строение белков Безопасные ягоды и грибы
Безопасные ягоды и грибы Паразитические высшие растения
Паразитические высшие растения Екологічна ніша як наслідок адаптацій організмів певного виду до існування в екосистемі
Екологічна ніша як наслідок адаптацій організмів певного виду до існування в екосистемі Экологический урок: Культура обращения с отходами, раздельный сбор отходов в 2014 году
Экологический урок: Культура обращения с отходами, раздельный сбор отходов в 2014 году Кровь. Кроветворение (подготовка к контрольной работе)
Кровь. Кроветворение (подготовка к контрольной работе) Роль биологии в жизнедеятельности человека
Роль биологии в жизнедеятельности человека Всероссийский конкурс Мой лучший урок
Всероссийский конкурс Мой лучший урок Метаболизм
Метаболизм Принципы анатомического строения и функционирования анализаторов. Антиноцицептивная система. Стресс, его механизмы
Принципы анатомического строения и функционирования анализаторов. Антиноцицептивная система. Стресс, его механизмы Бесполое и половое размножение (10 класс)
Бесполое и половое размножение (10 класс) Лимфа жүйесінің құрылысы
Лимфа жүйесінің құрылысы Представители бактерий в Архангельской области
Представители бактерий в Архангельской области Прокариоты и эукариоты. Сравнение строения
Прокариоты и эукариоты. Сравнение строения Тип Кольчатые черви
Тип Кольчатые черви Многообразие грибов. Значение грибов в природе и жизни человека
Многообразие грибов. Значение грибов в природе и жизни человека